Evaluar la utilidad del aporte de concentrado de médula ósea rico en células troncales mesenquimales (MSC) como tratamiento de la necrosis avascular de cabeza femoral (NAV) para evitar o retrasar la artroplastia total de cadera (ATC).
Material y métodosEstudio clínico unicéntrico, prospectivo, no controlado, de pacientes con diagnóstico de NAV. Evaluación de parámetros demográficos, Harris Hip Score (HHS), pruebas de imagen (radiografía y RMN); estadificación mediante escala de Arlet-Ficat. Seguimiento a 1, 6, 12 y 24 meses. Aspirado de médula ósea de cresta ilíaca, concentrado con sistema Harvest SmartPReP 2, e infusión en zona de necrosis mediante forages.
ResultadosVeintidós caderas en 17 pacientes fueron reclutados entre los años 2006-2012, seguimiento mínimo 2 años. Extracción media de 119,5ml de aspirado, implantándose 15,25ml de concentrado de MSC. Durante los primeros 2 años de la infusión 5 caderas (24,7%) precisaron ATC, sin diferencias en estadio de Ficat basal, y 4 (80%) de ellas presentaban afectación de cabeza femoral igual o superior al 30%. En las 17 caderas restantes, se observó a los 2 años de la infusión un aumento significativo del HHS (14,27) (p=0,026) y disminución del dolor (0,98) en la EVA (p=0,089). Nuestros resultados sugieren que la infusión de concentrado de médula ósea rico en MSC asociado a descompresión quirúrgica del núcleo mejora significativamente la funcionalidad de la cadera (HHS) y evita la ATC en el 75,3% de los pacientes con NAV tratados durante los primeros 2 años.
To assess the efficacy of implanting concentrated bone marrow rich in mesenchymal stem cells (MSC) for the treatment of femoral head avascular necrosis (AVN) to prevent or delay total hip replacement (THR).
Material and methodsA single-centre, prospective, non-controlled clinical study was conducted on patients with a diagnosis of AVN. The parameters assessed were, patient demographics, Harris Hip Score (HHS), imaging test (X-ray and NMR), and staging using the Arlet-Ficat scale. The patients were followed up for 1, 6, 12 and 24 months. The bone marrow was aspirated from the iliac crest, concentrated with the Harvest SmartPReP 2 system, and infused into the necrotic area by means of core decompression.
ResultsA total of 22 hips in 17 patients were recruited between the years 2006 to 2012, with a minimum follow-up of 2 years. A mean of 119.5mL of aspirate was extracted, with 15.25ml of MSC being implanted. During the first 2 years of the infusion, 5 hips (24.7%) required THR, with no differences in the baseline Arlet-Ficat stage, and 4 of these (80%) had femoral head involvement equal to or higher than 30%. A significant increase of 14.27 (P=.026) in the HHS and a 0.98 (P=.089) decrease in the VAS was observed two years after the infusion in the remaining 17 hips. The results suggest that the infusion of concentrated bone marrow rich in MSC, combined with surgical decompression of the nucleus, improves hip function (HHS), and avoids THR in 75.3% of patients with AVN treated during the first 2 years.
La necrosis avascular de la cabeza femoral (NAV) es una enfermedad debida a un déficit de aporte sanguíneo al hueso. Su pico de incidencia entre la tercera y cuarta década de la vida, la alta demanda funcional que presentan estos pacientes y la evolución natural de la enfermedad hacia el colapso de la cabeza femoral plantea un reto a la hora de decidir el tratamiento óptimo para estos pacientes. Existen múltiples opciones terapéuticas antes del colapso, algunas de ellas de eficacia controvertida. El tratamiento conservador mediante reposo y descarga de la articulación es efectivo en el 22,7% de los casos, y el 66% de estos pacientes necesitarán una artroplastia total de cadera (ATC) a medio plazo1, representado esta indicación entre el 5 y el 12% del total de las artroplastias de cadera realizadas al año en Estados Unidos2. La descompresión quirúrgica del núcleo3 mediante la realización de forages sigue siendo el método más empleado4, aunque solamente parece eficaz cuando está afectado menos del 30% del volumen de la cabeza femoral3. Otros tratamientos como los injertos óseos vascularizados o las osteotomías femorales presentan resultados muy irregulares y son técnicas complejas que pueden dificultar posibles intervenciones posteriores5–7. Recientemente algunos autores optan por el tratamiento con aporte de concentrado de células troncales mesenquimales (MSC del inglés mesenchymal stem cells)8–13 infundiendo el concentrado obtenido a partir de un aspirado de médula ósea (MO) en la zona de la necrosis a través de un forage. Esta técnica es poco agresiva y está siendo utilizada en la clínica en la última década con resultados esperanzadores no solo en el tratamiento de la necrosis avascular del fémur sino también en los casos de seudoartrosis de la diáfisis de huesos largos9.
El objetivo de nuestro trabajo fue evaluar la evolución clínica y la necesidad de ATC en pacientes con NAV en fase de precolapso durante los primeros 2 años después del implante de MO autógena.
Material y métodosDiseño del estudioEstudio clínico prospectivo, no controlado, abierto, de 22 caderas en 17 pacientes adultos consecutivos que acudieron a la consulta de Cirugía Ortopédica y Traumatología de nuestro hospital entre noviembre de 2006 y enero de 2012, con el diagnóstico de NAV. El estudio fue aprobado por el Comité Ético y de Investigación de nuestro hospital y los pacientes dieron su consentimiento informado a participar en el estudio.
Se excluyeron los pacientes con NAV y edad superior a 70 años, colapso radiológico de la cabeza femoral, tratamiento previo con citostáticos, alcoholismo activo, lesiones dérmicas en extremidades inferiores, radiación previa afectando a pelvis, infección activa, anemia (Hb<10 g/dl), leucopenia (leucocitos<4.000/mm3) o procesos tumorales activos.
Parámetros analizados y calendario de evaluaciónSe realizó una evaluación preoperatoria mediante historia clínica: datos demográficos y generales, datos de la enfermedad (uni o bilateral, causa y factores de riesgo), escala visual analógica del dolor (EVA), Harris Hip Score (HSS); pruebas de imagen: radiografía anteroposterior y axial de cadera, resonancia magnética (cuantificando el volumen de la lesión en porcentaje y estadificación mediante la escala para la valoración de la NAV de Arlet-Ficat2).
Al alta hospitalaria los pacientes deambularon en descarga con bastones ingleses durante 2 semanas, autorizándose carga parcial posteriormente según tolerancia. Se realizó un seguimiento en consultas externas a 1, 6, 12 y 24 meses después del procedimiento. En cada visita se realizó una valoración radiográfica y clínica (EVA, HSS) hasta completar los 24 meses o la realización de una artroplastia.
Se definió como fracaso del tratamiento la evolución hacia el colapso con necesidad de realización de ATC. La indicación de esta última fue ausencia de mejoría clínica y la existencia de colapso radiológico superior o igual al 30% en la radiografía simple durante las visitas de seguimiento.
Obtención e implante de concentrado de médula ósea autógenoSe procedió, en quirófano bajo condiciones de asepsia y generalmente bajo anestesia epidural, al aspirado de MO mediante punción de la cresta ilíaca ipsilateral inmediatamente posterior a la espina iliaca anterosuperior, con un trocar canulado de 1,5mm de diámetro interno con orificios laterales9,13. Dicho trocar se insertó a través de la cortical hasta llegar a hueso esponjoso, donde se comenzó la aspiración. Para prevenir la hemodilución, la dirección y profundidad de la aguja se variaban cada 2ml de aspirado14. En cada paciente se realizaron entre 2 y 3 perforaciones separadas 2cm entre sí, y se fue girando el trocar en cada aspirado.
El aspirado se inyectó en un recipiente estéril, al que se añadió una dilución de suero salino fisiológico al 0,9% y heparina en una concentración de 455 unidades/ml, añadiendo 3ml de esta dilución a cada 60ml de aspirado de MO. La concentración final resultante fue de 22,7 unidades de heparina por mililitro de aspirado de MO.
Para obtener el concentrado de células madre se utilizó el sistema Harvest SmartPReP 2®(Harvest Technologies Corp.). Dicho sistema centrifuga las bolsas del aspirado durante 15min y en un proceso automático obtiene una separación del plasma y las capas celulares, facilitando la obtención de la suspensión de células mononucleadas. El extracto resultante de células mononucleadas es el que será reinfundido en la zona de necrosis ósea.
En la intervención quirúrgica se extrajo una media de 119,5ml (±31,87; 60-180) de MO. Por cada 60ml de aspirado de MO se obtienen alrededor de 10ml de concentrado, que contiene una media de 376×106 células mononucleadas, 16×106 células CD34+ (células madre hematopoyéticas) y 3.000 unidades formadoras de colonias por mililitro7.
Posteriormente y bajo control fluoroscópico se procedió, mediante técnica percutánea, a realizar un forage con una broca de 5mm llegando hasta el centro de la zona de necrosis ósea en la cabeza del fémur. A través del trocar perforado se infunde a un ritmo lento y constante una media de 15,25ml (±4,86) de concentrado de MO con la técnica estandarizada por otros autores11.
Se produjo una complicación quirúrgica menor, definida como hematoma en el punto de extracción en cresta iliaca.
Análisis estadísticoSe realizó un análisis estadístico con el programa SPSS 18.0 expresando los datos en: media aritmética (±desviación estándar; rango). El contraste de hipótesis se llevó a cabo mediante pruebas no paramétricas usando la prueba de los rangos con signo de Wilcoxon y la prueba de la T de Student para datos independientes.
ResultadosDurante el periodo de estudio se reclutaron 22 caderas en 17 pacientes, 14 varones y 3 mujeres, La edad media de los pacientes fue de 37,5 años (±9,5; valores extremos 25-59). Doce pacientes presentaban NAV unilateral y los otros 5 NAV bilateral (4 varones y una mujer). La NAV afectaba al lado derecho en 11 casos y al izquierdo en los otros 11 casos. La causa de la NAV fue traumática en 6 caderas, corticodependiente en otros 4 e idiopática en las 12 caderas restantes.
Antes de la infusión del concentrado de MO, la valoración del dolor mediante la EVA fue de 5,61 (±1,65; 1-9), y la puntuación del HSS de 60,23 (±18,8; 28-100). Dos caderas estaban en estadio i de la escala de Arlet-Ficat, 14 caderas en estadio ii y 6 en estadio iii, con una media de 2,18 (±0,6). El porcentaje medio de cabeza femoral afectado, medido mediante resonancia magnética, fue de 26,07% (±14,57; 10-60).
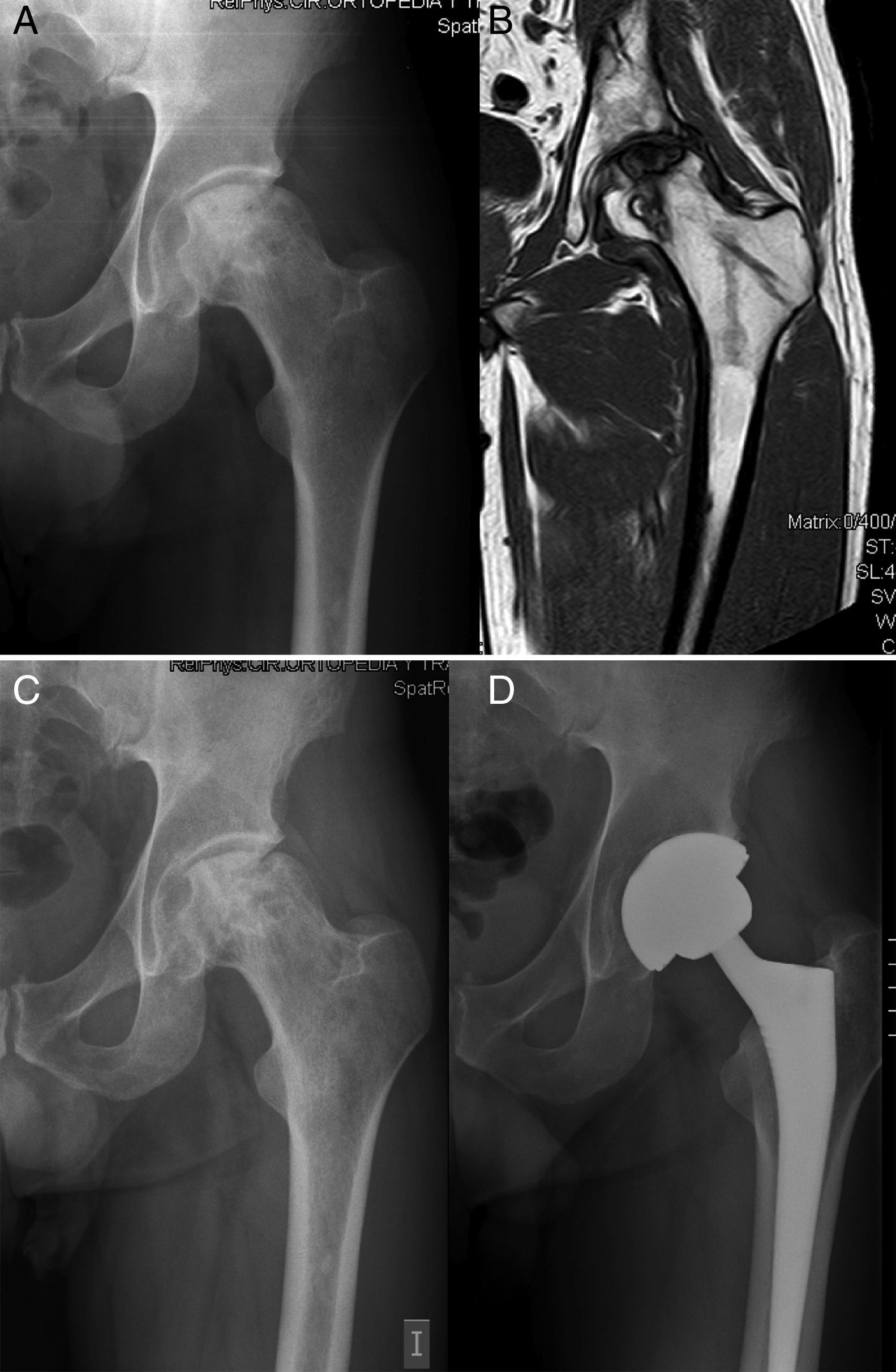
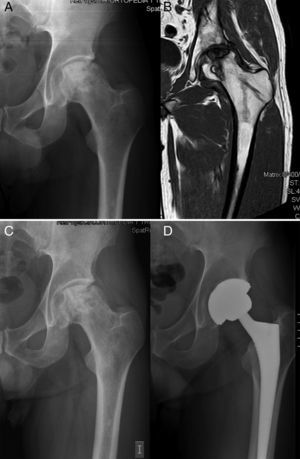
Durante los primeros 2 años del implante se indicó artroplastia de cadera en 5 (24,7%) de las 22 caderas tras un tiempo medio de 17,2 meses después de la infusión de concentrado de MO. El estadio basal de Arlet-Ficat en estos casos fue estadio i en un caso, estadio ii en 2 casos y estadio iii en otros 2. En total se realizaron 3 artroplastias en las 16 caderas en estadios i y ii (18,75%) (fig. 1) y 2 en las 6 caderas en estadio iii (33,3%) (p=0,9256). En las 17 caderas que no precisaron artroplastia, la valoración de la EVA mejoró desde un valor basal de 5,61 (±1,65) a 4,09 (±2,16); 4,66 (±2,26); 4,55 (±2,81) y 4,64 (±2,81) a 1, 6, 12 y 24 meses, respectivamente. La disminución media de EVA a los 24 meses respecto a la basal fue de 0,98 puntos (p=0,089).
En estas 17 caderas la valoración del HHS también mejoró significativamente desde basal de 60,23 (±18,8) a 70,81 (±13,98); 70,04 (±18,31); 75,61 (±19,73) y 74,5 (±20,57) a 1, 6, 12 y 24 meses, respectivamente. El aumento medio del HHS a los 24 meses respecto a la basal fue de 14,27 puntos (p=0,026).
DiscusiónEl éxito de los diferentes tratamientos en la NAV está directamente relacionado con el grado de la enfermedad5,9, y diversos trabajos indican cuál es la mejor técnica a emplear según el estadio de la osteonecrosis5,10,13. La descompresión mediante perforaciones es la técnica más común en la fase de precolapso, y el aporte de BMP o MSC mejora los resultados disminuyendo la necesidad del reemplazo articular4. Las MSC del adulto tienen el potencial de diferenciarse a tendón, músculo, grasa, hueso, tejido cicatricial, etc.; y la capacidad de estas células para generar osteoblastos ha sido bien definida en vitro y en vivo, capacidad que se ve favorecida en presencia de factores osteogénicos, como la proteína morfogenética ósea (BMPs), factor de crecimiento de fibroblastos, la dexametasona y el factor de crecimiento insulin-like13,15,16. La NAV es por lo tanto una indicación idónea para este tratamiento si tenemos en cuenta que a partir de los 25 años disminuye el número de osteoprogenitores en la cabeza femoral9 y que este descenso es más acusado en casos de necrosis8. Sin embargo, el éxito del tratamiento mediante esta técnica parece estar directamente relacionado con el número de MSC implantadas, aunque no hay artículos que establezcan la cifra ideal5,9. En un estudio sobre consolidación de seudoartrosis, Hernigou et al. establecieron que el éxito ocurría en aquellos casos en que se habían implantado más de 30×103 osteoprogenitores en total9.
El número de células presentes en la MO de cada paciente es variable y está disminuido en determinadas situaciones (abuso de alcohol, fumadores y tratamiento con esteroides)5,9,10,17,18. El potencial osteogénico de una muestra de MO está correlacionado directamente con la concentración celular de esta13,15,16, y dado que el número de MSC presentes en el aspirado es pequeño (1×105 células mononucleadas) se han creado sistemas que aumentan la concentración celular, que generan mediante separación por centrifugación una concentración de células nucleadas 5 veces mayor que el aspirado original. No existe actualmente un consenso en la literatura acerca del número de células madre necesario para tratar la necrosis avascular, pero los trabajos más recientes han establecido una media de 25×103 células por cadera como límite mínimo para ser clínicamente eficaz8,9. En nuestros pacientes se infundió una media de 15ml por paciente, que según los datos publicados7 corresponden a una media de 45×103 células.
El grado de la enfermedad es el otro factor determinante a la hora de decidir la actitud terapéutica, beneficiándose más aquellos pacientes que aún no han presentado un colapso de la cabeza femoral (grados i-ii de Ficat). Sin embargo, la clasificación de Ficat es descriptiva de la lesión y no tiene en cuenta los aspectos cuantitativos de la misma: el porcentaje de cabeza femoral afectado.
Aún así, el porcentaje de progresión hacia el colapso en esta enfermedad dejada a su evolución natural sería del 67% a los 5 años de media en estadios i–ii19. Tras la inyección de MSC Gangji el al., el único estudio, hasta el momento, prospectivo y controlado publicado sobre este tratamiento encuentra que a 2 años de seguimiento medio solo el 10% de las NAV tratadas con aporte de concentrado de MO autógeno alcanzaron el estadio iii frente al 62,5% en el grupo control. Si nos centramos en la necesidad de realizar una ATC, Wang en un reciente estudio sobre 59 pacientes tratados con este método lo cifra en el 12,9% a un seguimiento de 27,6 meses20. Nosotros tenemos que lamentar el doble de prótesis implantadas en un plazo medio ligeramente superior (24,7% en 31 meses de seguimiento), sin embargo son menos de la mitad de lo esperado si se deja a su evolución natural. Esto podría deberse a que, a diferencia de los 2 artículos previamente mencionados, utilizamos una clasificación poco adaptada a la severidad de la necrosis. Según Saito et al., la evolución de la enfermedad depende fundamentalmente de la extensión de la lesión, viendo que cuando era menor del 50% solo progresaban el 9%, mientras que cuando era mayor lo hacía el 73% a 5 años7. Cuatro de las 5 caderas (80%) que necesitaron la realización de artroplastia presentaban una afectación de la cabeza femoral igual o superior al 30% (2 en estadio ii y 2 en estadio iii). La utilización en la práctica clínica de otras clasificaciones que valoren no solo el grado de colapso sino la superficie de cabeza femoral afectada, como la Clasificación Internacional de Osteonecrosis (ARCO) y la modificación de Pensilvania6 que nos aporta una información descriptiva y cuantitativa de la lesión, puede ayudar a sentar las bases de la indicación terapéutica con células mesenquimales estromales de MO y disminuir los fracasos.
Nuestros resultados sugieren que el aporte de MSC de MO asociado a la descompresión quirúrgica del núcleo en pacientes con NAV mejora significativamente la funcionalidad de la cadera medida mediante HHS y evita la ATC en el 75,3% de los pacientes tratados mediante esta técnica durante los primeros 2 años. Es un tratamiento reproducible y de fácil implantación en la práctica clínica diaria, con mínimas complicaciones y que ayuda a disminuir la morbilidad de esta patología.
La clasificación preoperatoria de Arlet-Ficat mediante resonancia magnética no fue en nuestra experiencia útil para discriminar la extensión de la lesión y sentar una correcta indicación y pronóstico que mejore los resultados del tratamiento con MSC.
La principal limitación del estudio es la falta de un grupo control aleatorizado, por lo que no se pueden extraer conclusiones con un nivel de evidencia alto sobre la utilidad del implante de concentrado de MO respecto a su no utilización y tratamiento con descarga de los pacientes. Otra limitación parcial del estudio es la corta duración del periodo de seguimiento. Los resultados presentados en este trabajo son los datos preliminares a los 24 meses de un estudio en marcha, en el cual continuamos el seguimiento de estos pacientes durante un periodo de tiempo más prolongado.
Nivel de evidenciaNivel de evidencia ii.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.