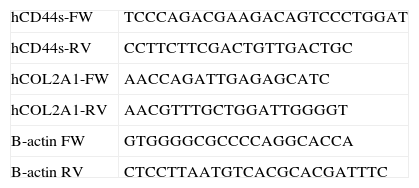Evaluar in vitro los efectos del ácido hialurónico (AH) en células madre mesenquimales derivadas de tejido adiposo (ASC) ante su posible uso combinado en el tratamiento de la artrosis de rodilla.
Material y métodoLas ASC fueron cultivadas en presencia o ausencia de AH, realizando estudios de proliferación (ensayo con WST8) y viabilidad celular (Alamar Blue® y Trypan Blue), posible diferenciación condrogénica de las células (expresión de colágeno tipo 2) por RT-PCR, así como el estudio de la expresión del receptor de AH (CD44) por citometría de flujo y RT-QPCR, y factores pro- y antiinflamatorios (IL-6, TGFß, IL-10) por RT-QPCR.
ResultadosEl número de ASC aumentó significativamente tras 7 días con AH (158±39%, p<0,05). Así mismo, la viabilidad de las ASC tratadas con AH a uno, 3, 5 y 7 días fue similar a la de las células control, considerándose que el tratamiento con AH no resultaba tóxico. No se observaron cambios en la expresión de CD44 tras el tratamiento con AH ni tampoco la inducción a la diferenciación condrogénica. La expresión de TGFß no se modificó con el tratamiento con AH; sin embargo, las ASC cultivadas con AH mostraron un incremento de 2 veces en la expresión de IL-10 y una reducción sobre el valor basal de 4 veces en la expresión de IL-6.
ConclusionesEl AH favorece la proliferación de las ASC en cultivo, no presentando toxicidad celular, e induciendo un perfil antiinflamatorio en estas células. Consideramos al AH un vehículo adecuado para la administración intraarticular de células madre mesenquimales.
To evaluate the in vitro effects of hyaluronic acid (HA) on adipose-derived stem cells (ASC) in order to consider the possibility of their combined used in the treatment of knee arthrosis.
Material and methodsThe ASC cells were grown both in the presence and absence of AH, and several studies were carried out: proliferation (WST8) and cell viability studies (Alamar Blue® and Trypan Blue), possible chondrogenic differentiation (collagen type 2 expression) by RT-PCR, AH receptor expression (CD44) by flow cytometry and RT-QPCR, and expression of inflammatory and anti-inflammatory factors (IL-6, TGFß, IL-10) by RT-QPCR.
ResultsThe number of ASC significantly increased after 7 days with HA (158±39%, p <0.05). Additionally, the cell viability of the ASC treated with HA after 1, 3, 5 and 7 days was similar to that of the control cells, being considered non-toxic. There were no changes observed in the expression of CD44 and chondrogenic differentiation. TGFß expression was not modified after AH treatment, but there was a 4-fold decrease in IL-6 expression and IL-10 expression increased up to 2-fold compared to control cells.
ConclusionsHyaluronic acid favours ASC proliferation without causing cellular toxicity, and inducing an anti-inflammatory profile in these cells. Hyaluronic acid appears to be a suitable vehicle for the intra-articular administration of mesenchymal stem cells.
Actualmente, la medicina regenerativa se presenta como una de las más prometedoras alternativas en el tratamiento de enfermedades osteoarticulares. En concreto, el uso de células combinadas con estructuras tridimensionales y moléculas bioactivas ofrece resultados prometedores en la regeneración tisular en lesiones condrales. Entre los diferentes tipos de células madre mesenquimales (MSC), aquellas derivadas de tejido adiposo (ASC) han demostrado gran utilidad en la regeneración tisular debido a su potencial condrogénico y osteogénico que, junto con su relativa facilidad de obtención y aislamiento, las convierte en excelentes candidatas para ser empleadas en estudios de regeneración en cirugía ortopédica y traumatología1.
Uno de los problemas con el que se enfrenta la terapia celular es el vehículo a utilizar para el aporte de las células al tejido lesionado. El ácido hialurónico (AH) es un elemento fundamental de la matriz extracelular y se encuentra en la mayoría de los tejidos y fluidos orgánicos, como el cartílago hialino y el líquido sinovial. Se trata de un polímero biodegradable de alto peso molecular que actúa como andamiaje, además de presentar importantes funciones biológicas como la regulación de la adhesión, movilidad, diferenciación y proliferación celular. Estas características, junto a su escasa inmunogenicidad, lo convierten en un biomaterial muy prometedor para su uso en ingeniería de tejidos2. Geles de AH, así como sustratos derivados del mismo, han sido testados para su utilización como estructuras de soporte para el cultivo de condrocitos y la producción de tejido cartilaginoso3. Estudios recientes en experimentación animal han valorado la posibilidad de la utilización de células mesenquimales pluripotenciales procedentes de médula ósea junto a sustratos bifásicos de AH y fosfato tricálcico para la reparación de defectos osteocondrales con resultados alentadores4. Por otra parte, estudios recientes destacan la importancia de la interacción entre el AH y las células madre mesenquimales (MSC) en su efecto terapéutico, así como la producción de AH por parte de las propias MSC como parte fundamental de su mecanismo de actuación5. Finalmente, destacar que el AH ha demostrado un efecto diferenciador hacia la línea condrogénica de las MSC superior a otros productos utilizados como soporte para el cultivo de las mismas6.
La artrosis es una de las patologías osteoarticulares más prevalentes y extendidas con un gran impacto negativo, no solo en cuanto a la afectación de la calidad de vida de los pacientes, sino también por el gran coste económico que implica para las instituciones sanitarias7. La artrosis afecta al cartílago articular y, a través de reacciones inmunológicas e inflamatorias, se produce de forma gradual una lesión progresiva que lleva finalmente a la pérdida de la función articular8. A pesar de que diversas articulaciones pueden verse afectadas por esta enfermedad, la rodilla es de las articulaciones más comúnmente implicadas. En España, se ha estimado que el 10% de la población presenta síntomas relacionados con artrosis de rodilla9.
Teniendo todos estos aspectos en cuenta, el objetivo de este trabajo ha sido la evaluación in vitro de la proliferación, viabilidad y posible diferenciación condrogénica de las células ASC en presencia de AH, así como el estudio de la expresión del receptor de AH (CD44), factores pro- y antiinflamatorios en estas células que pudieran verse alterados en presencia del polisacárido, con el objetivo de valorar el potencial del AH como vehículo para la administración intraarticular de ASC.
Material y métodoLas células ASC fueron obtenidas de Inbiobank (San Sebastián, España) y procedían de una mujer joven sana; fueron cultivadas rutinariamente en medio DMEM con 1g/lD-glucosa (Gibco®-Life Technologies, Grand Island, NY, EE. UU.), antibióticos (100U/ml penicilina y 100μg/ml estreptomicina) y suplementado con 10% de suero fetal bovino cualificado (MSC Qualified Fetal Bovine Serum, FBS, Gibco®-Life Technologies), cambiando el medio cada 3-4 días. El mantenimiento de las células se llevó a cabo en frascos de 75 o 150cm2 (Corning, Corning, NY, EE. UU.) y se procedió a su pase antes de alcanzar la confluencia mediante tripsinización (TrypLE Express, Gibco®-Life Technologies). Las ASC se caracterizaron según los criterios de la Sociedad Internacional de Terapia Celular10,11: formación de colonias de tipo fibroblastoide, inmunofenotipo por citometría de flujo (CD73+, CD90+, CD105+, CD11b-, CD45-, HLADR-), y diferenciación osteoblástica y adipogénica (datos no mostrados).
Se llevaron a cabo diversos experimentos para evaluar la actividad del AH (Adant®, 10mg/ml, Tedec-Meiji Farma, Alcalá de Henares, España) sobre la proliferación y viabilidad celular, así como su efecto en la expresión del receptor de AH, CD44, del colágeno tipo 2, y de citoquinas pro- y antiinflamatorias en las ASC.
En el estudio de proliferación celular, las ASC se sembraron en placas de 96 pocillos a una concentración de 2×103cel/pocillo; a las 24h se indujo la quiescencia mediante privación de suero (1%) y fueron tratadas con diferentes dosis de AH (0,1, 0,3, y 1mg/ml) durante 7 días, cambiando el medio a los 4 días. Pasado este tiempo, se evaluó el número de células mediante un ensayo colorimétrico que evalúa el formazán producido durante 3h a 37°C a partir de una sal de tetrazolio (CCK-8, Sigma, Barcelona, España) midiendo la absorbancia a 450nm en un espectrofotómetro de microplacas (Epoch, Biotek Instruments, Winooski, VT, EE. UU.).
En el estudio de viabilidad celular, las ASC se sembraron en placas de 48 pocillos a una concentración de 2×103cel/pocillo. Las células se trataron a una concentración de 5mg/ml de AH en medio suplementado con suero durante uno, 3, 5 y 7 días. A estos tiempos, se evaluó la cantidad de células viables mediante incubación con AlamarBlue® (AbD Serotec, Oxford, RU) durante 2,5h a 37°C, midiendo la señal de fluorescencia emitida (long. onda excitación: 530nm; long. onda emisión: 590nm) en un espectrofotómetro multimodal (Synergy 4 Hybrid, Biotek Instruments, Winooski, VT, EE. UU.). Una vez realizado este ensayo, se procedió a un recuento de las células viables con un hemocitómetro Neubauer mediante tripsinización y tinción con Trypan Blue.
La expresión del receptor de AH, CD44, en ASC en presencia y ausencia del AH se evaluó mediante citometría de flujo y transcripción inversa-reacción en cadena de polimerasa (RT-PCR). Para citometría de flujo se llevó a cabo la siembra de células en placas de 100mm de diámetro (6×103/cm2), cultivándolas durante 7 días en medio con suero±1mg/ml AH. Pasado este tiempo, las células se despegaron de la placa de cultivo con TrypLE-Express para ser resuspendidas posteriormente en solución salina tamponada con fosfato (PBS) a 106cel/100μl; e incubadas a temperatura ambiente durante 30min con 5μl anticuerpo anti-CD44-PE (clon MEM-263, Novus Biologicals, Cambridge, RU). La cuantificación de la fluorescencia de las células se realizó en un citómetro de flujo Navios (Beckman Coulter, Brea, CA, EE. UU.). Para RT-PCR o QPCR, tras el tratamiento de las células±1mg/ml AH durante 7 días, se procedió a la extracción de RNA total con reactivo TRIzol® (Ambion-Life Technologies, Carlsbad, CA, EE. UU.), según las instrucciones del fabricante, seguido de tratamiento con DNasa (Turbo DNA free, Ambion-Life Technologies) para eliminar la posible contaminación de DNA genómico; el DNA complementario se sintetizó a partir de 1μg RNA total mediante reacción con transcriptasa inversa Multiscribe® (Applied Biosystems-Life Technologies, Foster City, CA, EE. UU.) y oligo (dT)16.
Para PCR estándar, se utilizó un termociclador (Mastercycler, Eppendorf, Hamburgo, Alemania) con un volumen de reacción de 20μl, conteniendo 1,5mM MgCl2, 0,5μM oligonucleótidos (0,3μM para ß-Actina), 1u Taq DNA Polymerase (Biotools, Madrid, España), amplificando el cDNA con 35 ciclos de 30” a 95°C, 30” a 55-60°C, 30” a 72°C. Los fragmentos de DNA se visualizaron en geles de 1,7% agarosa en tampón TBE 0,5x conteniendo RealSafe 1x (Durviz, Valencia, España), con un fotodocumentador digital (Alliance 2.7, UVItec, Cambridge, RU). Para PCR cuantitativa, se usó un termociclador CFX96 Touch (BioRad, Hercules, CA, EE. UU.), con un volumen de reacción de 20μl, con Quantimix Easy kit (Biotools) conteniendo 0,3μM oligonucleótidos, y SYBR Green 0,5x (Invitrogen-Life Technologies,Grand Island, NY, EE.UU.). El cDNA se amplificó durante 40 ciclos de 30” a 95°C, 30” a 60-65°C, 30” a 72°C, y 2” a 80°C donde se detectaba la fluorescencia. Para el cálculo de la expresión de los diferentes mRNA se utilizó el método de 2−ΔΔCt. Los oligonucleótidos para CD44, COL2A1 y ß-Actina específicos de las secuencias humanas se detallan en la tabla 1. Los oligonucleótidos para TGFß, IL-10 e IL-6 están descritos previamente12. Los datos se expresan como media±DE. El análisis estadístico de los resultados se llevó a cabo mediante los tests ANOVA y T de Student con el programa Prism 5 (GraphPad, La Jolla, CA, EE. UU.), considerando estadísticamente significativo un valor de p<0,05.
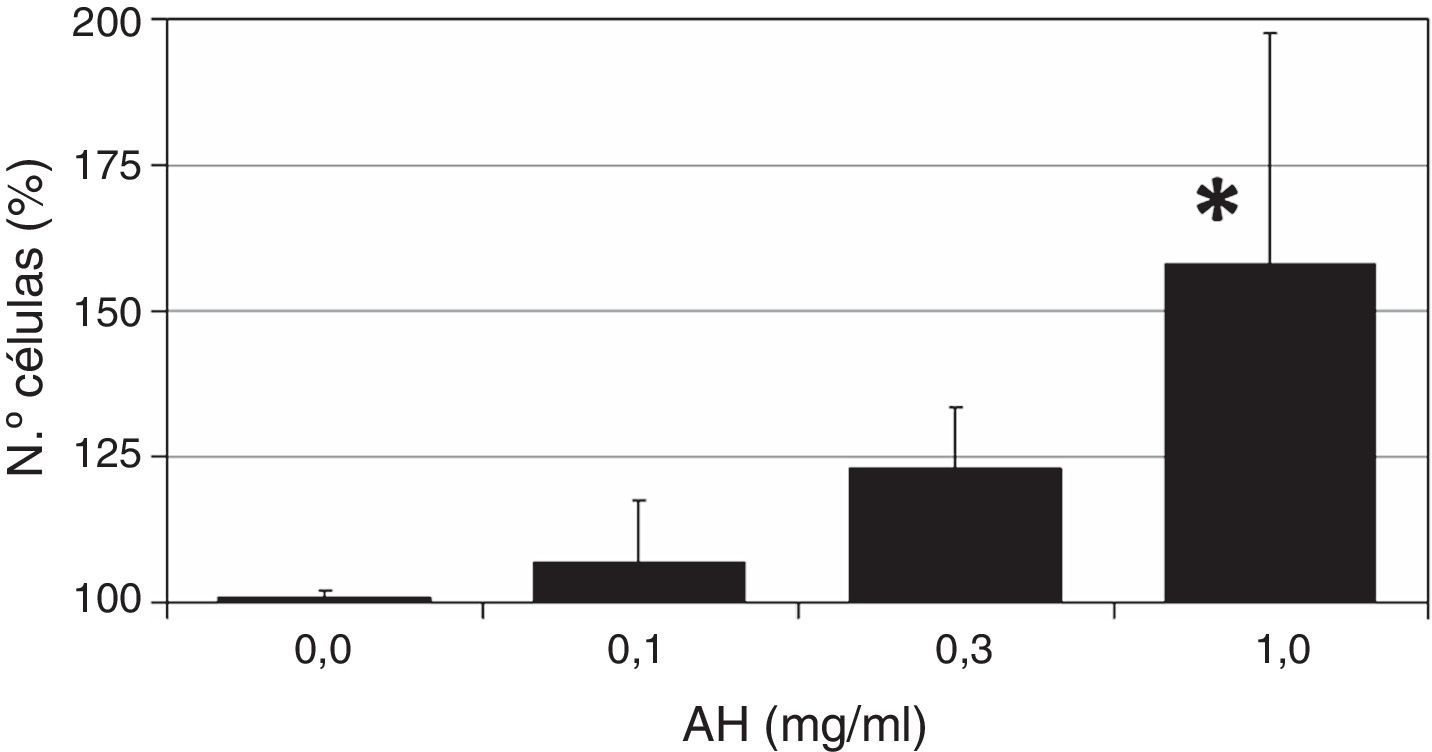
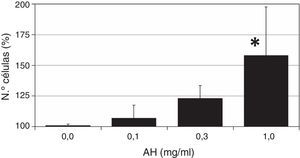
ResultadosLas células ASC se trataron con diferentes dosis de AH para valorar el efecto del polisacárido sobre la proliferación celular. Los resultados de este ensayo colorimétrico quedan recogidos en la figura 1. Como se puede observar, la administración de AH a células quiescentes (en 1% FBS) da lugar a un incremento del número de células tras 7 días de tratamiento, con un efecto dependiente de la dosis, observándose un efecto máximo a la mayor concentración de AH utilizada (1mg/ml), siendo este efecto estadísticamente significativo respecto al crecimiento de las células control (158%±39, p<0,05).
Efecto de diferentes dosis de AH sobre la proliferación de las células ASC. Células quiescentes (con 1% FBS) se incubaron con distintas dosis de HA durante 7 días tras los cuales se determinó el número de células por un ensayo colorimétrico de formación de formazán. Los valores son media±DE de 4 experimentos independientes por triplicado. *p<0,05.
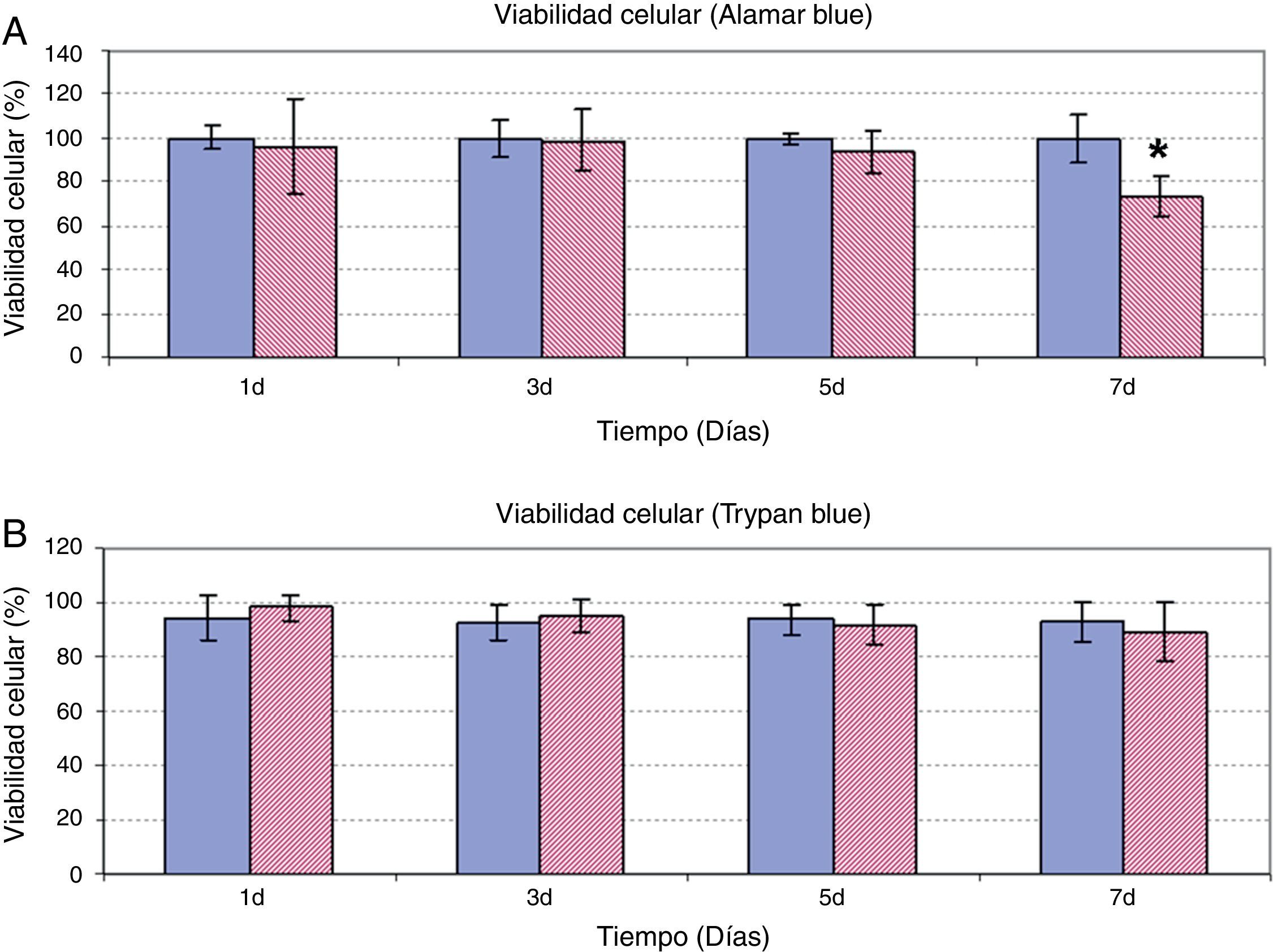
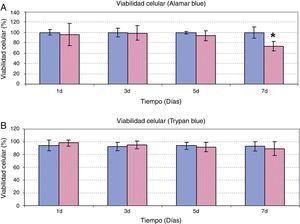
Además de evaluar el efecto del AH sobre la proliferación celular, se estudió la posible alteración de la viabilidad celular cuando las ASC eran tratadas a una dosis de 5mg/ml durante 7 días. Como se observa en la figura 2, tanto los resultados de la determinación de la viabilidad celular mediante Alamar Blue® (fig. 2A) como de exclusión de Trypan Blue (fig. 2B) fueron coincidentes. En los días 1, 3 y 5 de tratamiento, se observó una viabilidad de las ASC tratadas con AH similar a la viabilidad de las células control, con valores comprendidos entre 80-100% en ambos experimentos. Únicamente tras 7 días de incubación de las ASC con AH se observa un descenso significativo de la viabilidad respecto a las células control en el experimento de cuantificación mediante Alamar Blue®. Sin embargo, a pesar de las diferencias respecto al control, el valor de viabilidad obtenido a ese tiempo fue de 73%±9.
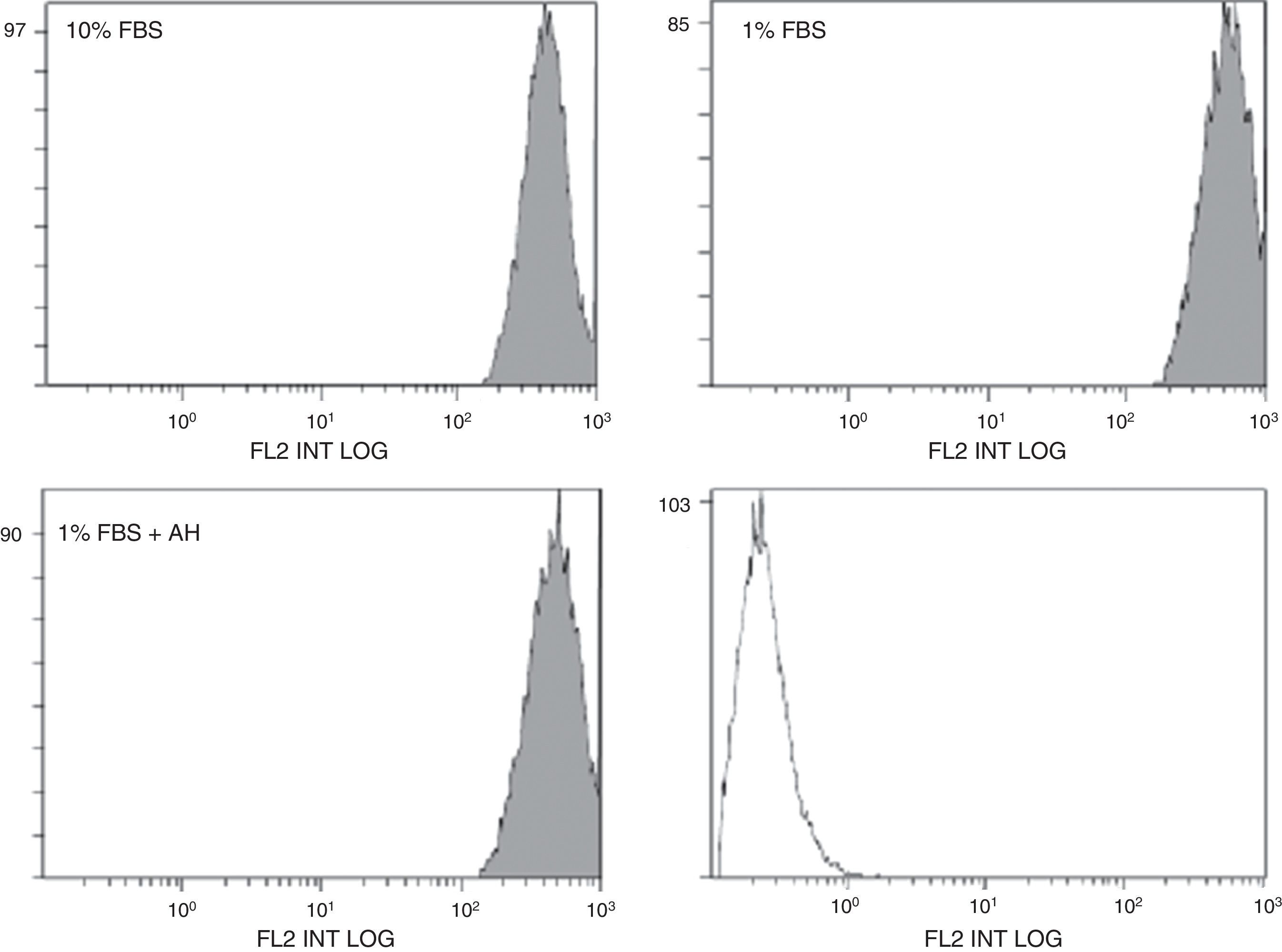
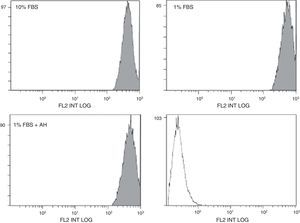
Los efectos del AH están mediados por su receptor de membrana, CD44. El efecto estimulador del AH sobre la proliferación de las ASC puede estar mediado por cambios en la expresión de CD44. La posible modificación de la expresión de CD44 en las células ASC en presencia de AH se evaluó mediante citometría de flujo (expresión de proteína, figura 3) y RT-QPCR (expresión de mRNA, tabla 2). En el caso de la citometría de flujo, parece que existe un ligero desplazamiento hacia la derecha de la señal de fluorescencia en el caso de las células quiescentes (tratadas con 1% de FBS) respecto a las tratadas con 10% FBS (fig. 3). Este aumento de la expresión de la proteína CD44 en la membrana celular se vio confirmado por los resultados obtenidos mediante RT-QPCR, donde la expresión de mRNA de CD44 fue mayor también en el caso de las células tratadas con 1% de FBS respecto a las tratadas con 10% FBS (tabla 2). Sin embargo, el tratamiento con AH en células quiescentes no pareció afectar de manera significativa la expresión de este receptor ni a nivel protéico ni de su mRNA puesto que no se encontraron diferencias significativas por ninguna de las 2 técnicas respecto a su control (1% FBS).
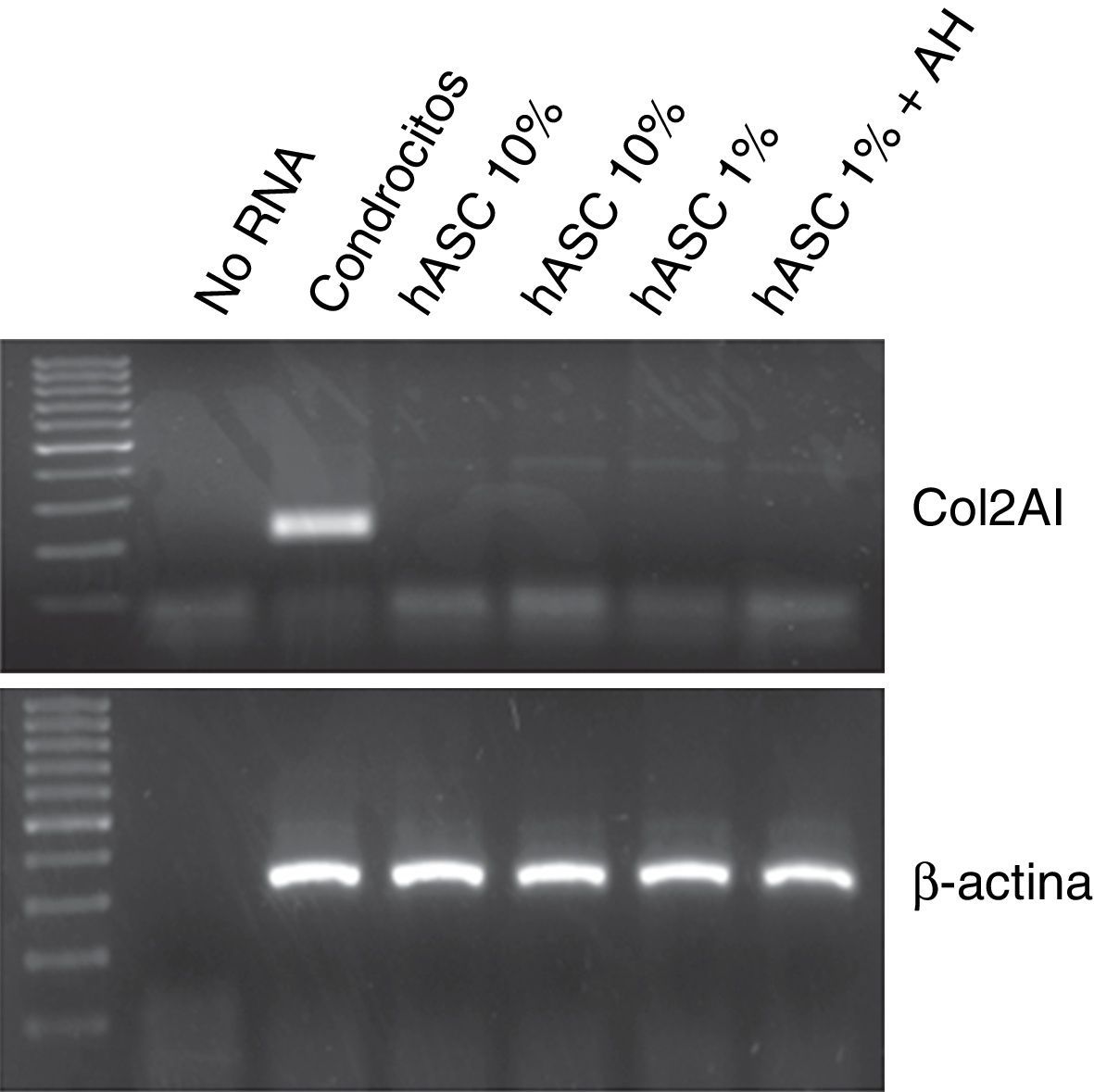
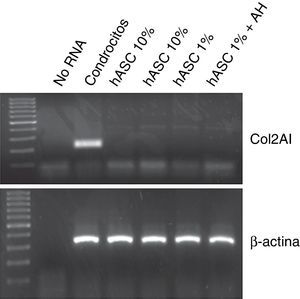
Con el objetivo de analizar la posible diferenciación condrogénica de las células ASC tras el tratamiento con 1mg/ml de AH, se evaluó la expresión de mRNA para colágeno tipo 2 mediante RT-PCR. Como se puede observar en la figura 4, en ninguna de las condiciones en las que se cultivaron las ASC, en proliferación con 10% FBS, o en quiescencia con 1%FBS±AH durante 7 días se pudo detectar mRNA para colágeno tipo 2, a diferencia de condrocitos humanos usados como control positivo.
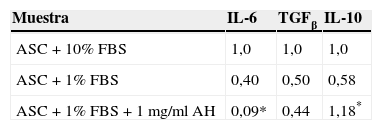
Finalmente, se evaluó mediante RT-QPCR la expresión de mRNA para IL-6, TGFβ e IL-10. Los datos obtenidos de este ensayo se recogen en la tabla 3. En el caso de TGFβ no se observaron diferencias significativas entre las células tratadas con AH y las células control. Sin embargo, el tratamiento de las ASC con 1mg/ml AH condujo a la disminución de la expresión de la citoquina proinflamatoria IL-6 con un resultado hasta 4 veces menor que la expresión en las células control, mientras que aumentó en 2 veces la expresión de la citoquina antiinflamatoria IL-10 respecto a su control.
DiscusiónLa artrosis se encuentra entre las patologías del aparato locomotor más frecuentes asociadas a un deterioro en la función física y calidad de vida relacionada con la salud, afectando a diferentes grupos de edad y la mayoría de ellos en etapas productivas. La búsqueda de tratamientos más efectivos que los actuales es una de las prioridades en la investigación dentro del campo de la traumatología. Una de las alternativas más atractivas y esperanzadoras para mejorar el tratamiento actual la ofrece la ingeniería tisular, concretamente la administración de células madre mesenquimales embebidas en hidrogeles que proporcionen un soporte adecuado para la supervivencia de las células in vivo. Este trabajo pretende estudiar el comportamiento y supervivencia de las células humanas mesenquimales derivadas de tejido adiposo in vitro en presencia de diversas dosis de AH, habitualmente empleado como tratamiento de la artrosis de rodilla, con el objetivo de valorar la posible administración de ASC vehiculizadas en AH.
El AH ha sido empleado desde hace muchos años como biomaterial, cumpliendo con los conceptos de biocompatibilidad y biodegradabilidad generalmente exigibles a este tipo de materiales, y es, de hecho, uno de los compuestos más empleados en el diseño de estructuras tridimensionales para ingeniería de tejidos2,13. Sin embargo, existen muy escasos datos en la literatura acerca de su efecto in vitro sobre las células madre mesenquimales y únicamente hemos encontrado un trabajo reciente que presenta algunos datos a este respecto. Ding et al. valoraron el efecto sobre la proliferación celular de las ASC procedentes de la grasa de Hoffa por el ensayo XTT (Roche, Mannheim, Alemania) y concluyen que a concentraciones de entre el 25-75% el AH no afecta la proliferación de dichas células. En este trabajo no se realizaron estudios de viabilidad celular, aunque sí se comprobó un aumento en la diferenciación celular de la ASC en presencia de AH tras 2 semanas de cultivo14. En nuestro estudio, hemos caracterizado parámetros como la proliferación y toxicidad celular, así como otros factores que pueden afectar a la diferenciación celular y la utilidad antiinflamatoria de este biomaterial aplicado a este tipo celular concreto.
Los resultados de viabilidad y proliferación demuestran que el AH es biocompatible con las células ASC, permitiendo un crecimiento gradual de las células con una tendencia dosis-dependiente. Además hemos demostrado que las células ASC presentan elevados valores de viabilidad celular en cultivo con AH. De hecho, los valores de viabilidad obtenidos en nuestro estudio son muy similares a los obtenidos por otros investigadores que también emplearon hidrogeles de AH y MSC para su aplicación en regeneración ósea15.
CD44 es un receptor celular implicado en la mediación de diversos procesos celulares como morfogénesis, inflamación o metástasis entre otros, y se expresa en la superficie de muchos tipos celulares, incluyendo las ASC. Este receptor interacciona de forma muy activa con el AH y se ha considerado como receptor principal del AH en la mayoría de tipos celulares. Mediante estudios de citometría de flujo y RT-QPCR hemos podido comprobar cómo el patrón de expresión de este receptor no se ve afectado por el tratamiento con AH a una dosis de AH de 1mg/ml, por lo que las células mantienen la expresión de CD44 en su membrana superficial en las mismas condiciones que las células control. La única diferencia significativa que se pudo apreciar en nuestro estudio se observó como consecuencia de la privación de suero del medio de cultivo, al pasar de un 10% de FBS a un 1% de FBS, aumentando así la expresión de CD44. Sin embargo, el tratamiento realizado con AH se llevó a cabo empleando un 1% FBS, por lo que se puede considerar que no existen diferencias frente a su verdadero control, y que el tratamiento con el polisacárido no afecta a la expresión de dicho receptor en la superficie de las ASC, hecho que apoyaría la no diferenciación de las ASC en las condiciones estudiadas.
Una de las ventajas que presentan las células mesenquimales para la ingeniería de tejidos aplicada al campo de regeneración condral frente al uso de condrocitos es precisamente su capacidad para mantener su estado indiferenciado a pesar del cultivo in vitro. Durante el cultivo celular in vitro de condrocitos se producen cambios en las células que luego les impiden rediferenciarse. Sin embargo, tanto las MSC como las ASC, se mantienen indiferenciadas durante el cultivo in vitro, conservando así todas sus características para su implantación posterior in vivo11. Por este motivo quisimos comprobar el grado de diferenciación celular de las ASC cultivadas mediante la cuantificación de la expresión de colágeno tipo 2. El colágeno tipo 2 es un marcador que se emplea habitualmente como indicador de la diferenciación de este tipo de células mesenquimales hacia un fenotipo celular condrogénico16. Tanto el tratamiento con AH así como el propio subcultivo de células in vitro no causaron la diferenciación fenotípica de las ASC, lo que confirma el mantenimiento de una de las propiedades más atractivas de estas células. Como se ha comentado anteriormente, los estudios realizados por Ding et al. sí demostraron un efecto prodiferenciador del AH en cultivos de ASC14, si bien las condiciones de cultivo no fueron las mismas, y de especial importancia fue el tiempo en el que se mantuvieron las células en cultivo: 14 días, frente a los 7 días de nuestro estudio.
Las ASC, además de presentar el potencial de diferenciación y la capacidad de auto-renovación propios de las MSC, secretan diversas citoquinas y factores de crecimiento implicados en procesos de reparación tisular, con propiedades antiinflamatorias, antiapoptóticas e inmunomoduladoras. Numerosos estudios señalan a la acción paracrina de estos factores solubles como responsable de los efectos beneficiosos de la terapia celular con MSC, en lugar de atribuirlos a su capacidad de diferenciación17. Por ello, quisimos comprobar el efecto del AH sobre la capacidad de secreción de citoquinas de las ASC respecto a las células control mediante la determinación de los niveles de IL6, IL10 y TGFβ. La IL-6 actúa como factor proinflamatorio, especialmente en la artrosis de rodilla18, mientras que la IL10 y el TGFβ se consideran factores antiinflamatorios19. En nuestro estudio se pudo comprobar cómo el papel antiinflamatorio queda completamente demostrado mediante un aumento muy significativo en la producción de IL10, mientras que se produce una disminución considerable en la expresión de IL6 por parte de las ASC tratadas con AH durante 7 días.
Por todo ello, y teniendo en cuenta los resultados de los ensayos que hemos realizado, podemos afirmar la biocompatibilidad del AH y las ASC, así como el potencial antiinflamatorio de su administración conjunta. Estos esperanzadores resultados permiten considerar al AH un vehículo ideal para la administración intraarticular de células madre mesenquimales procedentes de tejido adiposo.
Nivel de evidenciaNivel de evidencia IV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido llevado a cabo gracias a la financiación de la beca Hyalgan de la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT) 2012. Fernando de Miguel disfruta de un contrato de Investigador Miguel Servet II (CPII13/00006) del Instituto de Salud Carlos III.