Las manifestaciones oculares de la artritis reumatoide son manifestaciones graves que requieren manejo agresivo. En el presente reporte presentamos un caso de queratitis asociada a derretimiento corneal desencadenado por suspensión abrupta de su medicación reumatológica y cirugía no ocular, que respondió de forma favorable al manejo con metilprednisolona y ciclofosfamida.
Ocular signs of rheumatoid arthritis are severe extra-articular manifestations, which usually require aggressive management. In this report, A case is presented here of patient with peripheral ulcerative keratitis associated with corneal melt syndrome triggered by abrupt suspension of antirheumatic medication and non-ocular surgery. They symptoms responded favourably to methylprednisolone and cyclophosphamide.
La artritis reumatoide (AR) tiende a ser considerada una enfermedad predominantemente articular. No obstante, el proceso autoinmune es en sí un proceso multisistémico con una amplia gama de manifestaciones ajenas al tejido sinovial que se denominan manifestaciones extraarticulares1. Dentro de este grupo de manifestaciones, las oculares son particularmente importantes, no solo por las consecuencias que tienen para la calidad de vida de las personas sino por las implicaciones de la historia natural de la enfermedad2. En el presente reporte de caso presentamos un caso de complicaciones oculares de la AR con su tratamiento.
Información del pacientePaciente mestizo de 65 años, con antecedente personal de AR desde hace 20 años diagnosticada según criterios de 19873, en su momento el paciente debutó con un cuadro de poliartritis simétrica, con patrón de dolor inflamatorio asociado a un factor reumatoide positivo en altos títulos, para lo cual venía en tratamiento con cloroquina base 150mg/día y leflunomida 20mg/día. Con este tratamiento el paciente se encontraba en remisión clínica sin articulaciones inflamadas y dolorosas, no obstante, con deformidades articulares establecidas (caput ulnae, ráfaga cubital, pulgar en Z y deformidad en cuello de cisne). Como antecedente personal relevante, el paciente padecía enfermedad coronaria por lo que 3 años antes presentó un infarto agudo de miocardio, siendo llevado a coronariografía con implantación de 3 stents medicados. Un año antes del ingreso por síntomas secos oculares el paciente consulta con oftalmología y se documentan síntomas secos oculares sin síndrome de Sjögren sobreagregado, recibiendo manejo tópico con hialuronato de sodio al 0,4%, ácido poliacrílico y ciclosporina al 0,1% con control parcial de los síntomas.
El cuadro clínico se inicia un mes previo al ingreso del paciente en el servicio de urgencias cuando con motivo de la realización de una cirugía de corrección de un hallux valgus bilateral, se ordenó la suspensión de todos los medicamentos para el control de su artritis reumatoide. Quince días posteriores a la realización de la cirugía, el paciente presentó ojo rojo bilateral, acompañado de dolor ocular y fotofobia; estos síntomas empeoran hasta tornarse incapacitantes, asociándose a disminución de la agudeza visual y secreción purulenta, motivo por el cual el paciente decide consultar.
Examen físicoAl examen físico el paciente se encontraba estable hemodinámicamente, sin alteraciones en el examen físico general, salvo las alteraciones en el sistema osteomuscular que consistían en anquilosis en codos y rodillas, así como deformidades establecidas descritas previamente en manos y pies, sin evidenciar la presencia de sinovitis o dolor. Al examen ocular se observaba inyección conjuntival y oculalgia a la palpación, especialmente izquierda. El fondo de ojo no fue realizable por la intensa fotofobia que presentaba el paciente.
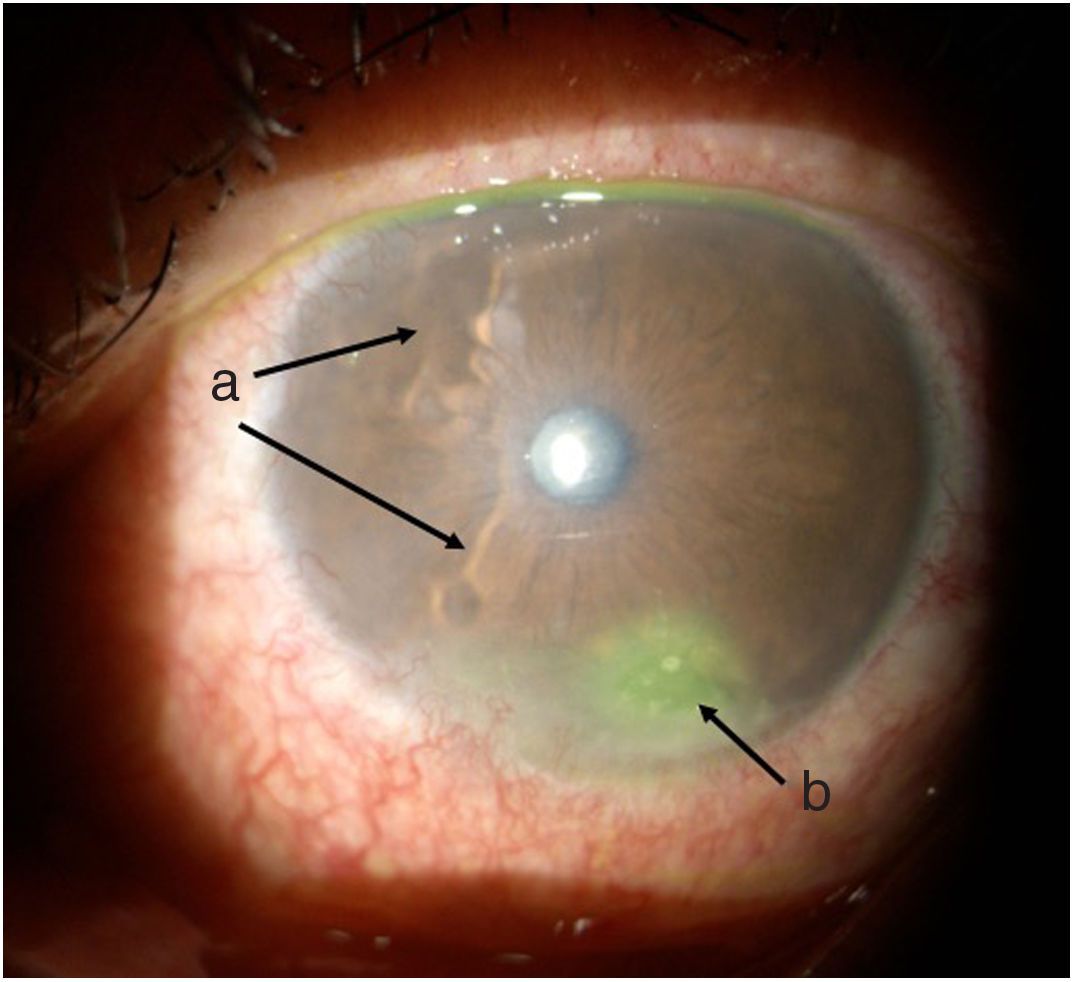
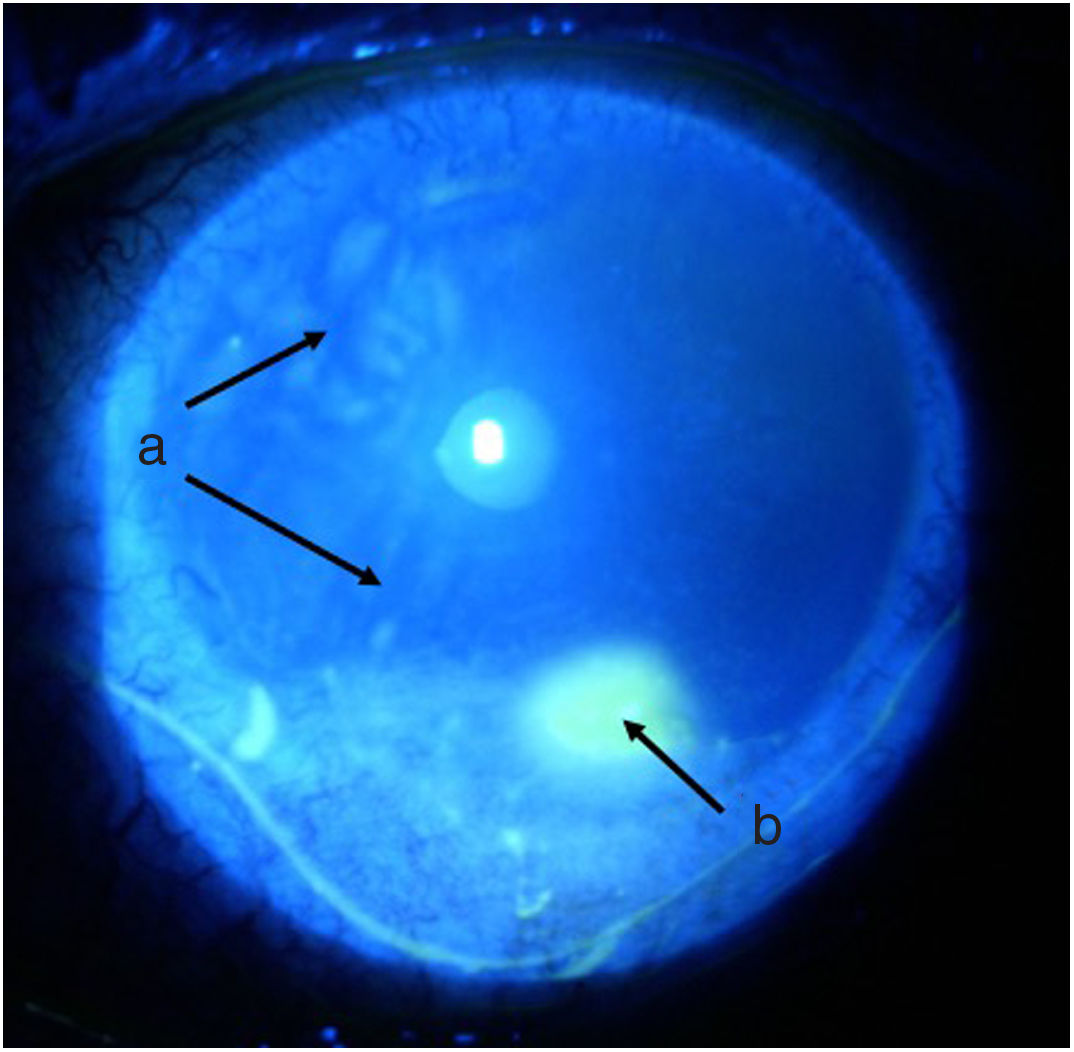
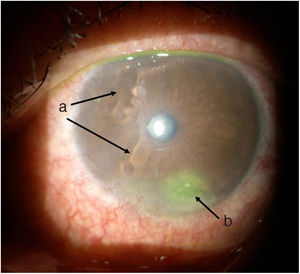
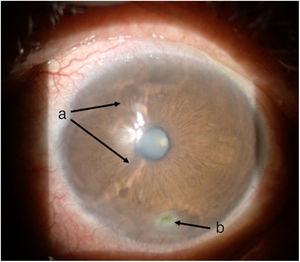
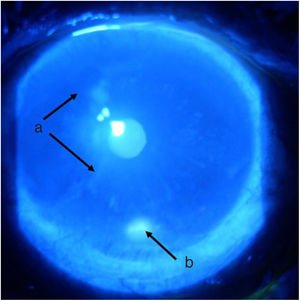
Línea del tiempoAnte esta situación, Medicina General inició tratamiento con moxifloxacina oftálmica una gota cada 12 h e hidrocortisona de 30mg cada 12 h. El paciente es evaluado 2 h después por el Servicio de Reumatología que, ante la sospecha de derretimiento corneal, solicitó evaluación urgente por oftalmología para confirmar diagnóstico y descartar procesos infecciosos concomitantes que contraindicaran el manejo inmunosupresor agresivo. Oftalmología evalúa al paciente 4 h después y encuentra una agudeza visual en ojo derecho de 20/100 (estenopeico: 20/50) y en ojo izquierdo: 20/80 (estenopeico: 20/50). Adicionalmente, se realizó biomicroscopía con lámpara de hendidura e instilación de fluoresceína, y se encontró en ojo derecho leve tinción corneal punteada sin otros hallazgos en segmento anterior ni posterior, compatibles con ojo seco moderado. Los hallazgos más relevantes se encontraban en el ojo izquierdo (figs. 1 y 2), donde se observó hiperemia conjuntival moderada, tinción corneal generalizada con úlcera corneal inferior de 2 x 3mm, además con lesiones en sacabocado en periferia corneal, desde las 6 a las 12 del reloj compatibles con derretimiento corneal.
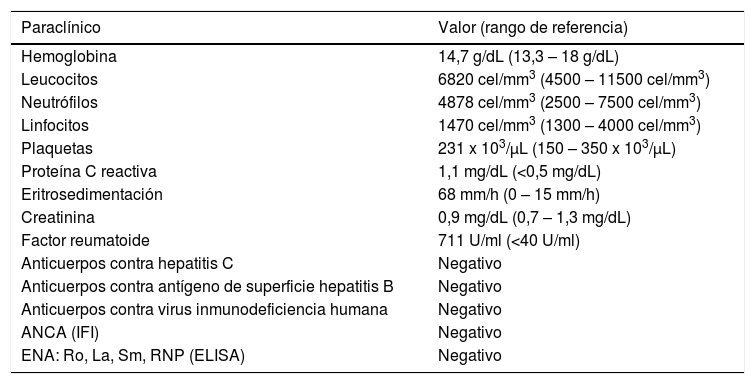
Se practicaron paraclínicos, los cuales descartaron causas infecciosas y se confirmaba la positividad alta del factor reumatoide, así como no elevación de reactantes de fase aguda (tabla 1).
Paraclínicos relevantes
| Paraclínico | Valor (rango de referencia) |
|---|---|
| Hemoglobina | 14,7 g/dL (13,3 – 18 g/dL) |
| Leucocitos | 6820 cel/mm3 (4500 – 11500 cel/mm3) |
| Neutrófilos | 4878 cel/mm3 (2500 – 7500 cel/mm3) |
| Linfocitos | 1470 cel/mm3 (1300 – 4000 cel/mm3) |
| Plaquetas | 231 x 103/μL (150 – 350 x 103/μL) |
| Proteína C reactiva | 1,1 mg/dL (<0,5 mg/dL) |
| Eritrosedimentación | 68 mm/h (0 – 15 mm/h) |
| Creatinina | 0,9 mg/dL (0,7 – 1,3 mg/dL) |
| Factor reumatoide | 711 U/ml (<40 U/ml) |
| Anticuerpos contra hepatitis C | Negativo |
| Anticuerpos contra antígeno de superficie hepatitis B | Negativo |
| Anticuerpos contra virus inmunodeficiencia humana | Negativo |
| ANCA (IFI) | Negativo |
| ENA: Ro, La, Sm, RNP (ELISA) | Negativo |
ELISA: ensayo por inmunoadsorción ligado a enzimas (siglas en inglés); IFI: inmunofluorescencia indirecta.
Con esta información, previa desparasitación, se inició inmunosupresión con metilprednislona 500mg IV día durante 3 días y ciclofosfamida 750mg IV dosis única aplicada al día siguiente del ingreso del paciente. El tratamiento tópico instaurado continuó sin cambios y después de la aplicación de los pulsos de metilprednisolona se continuó con prednisolona 50mg día.
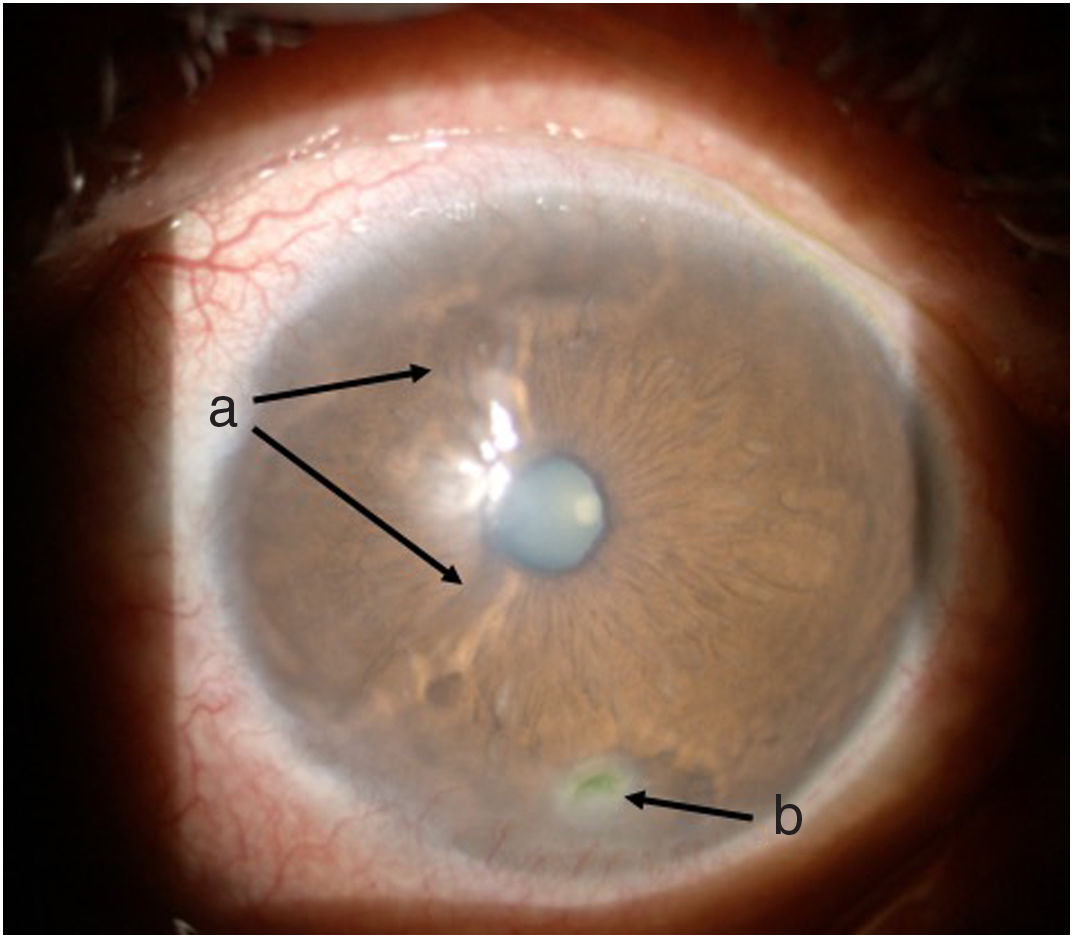
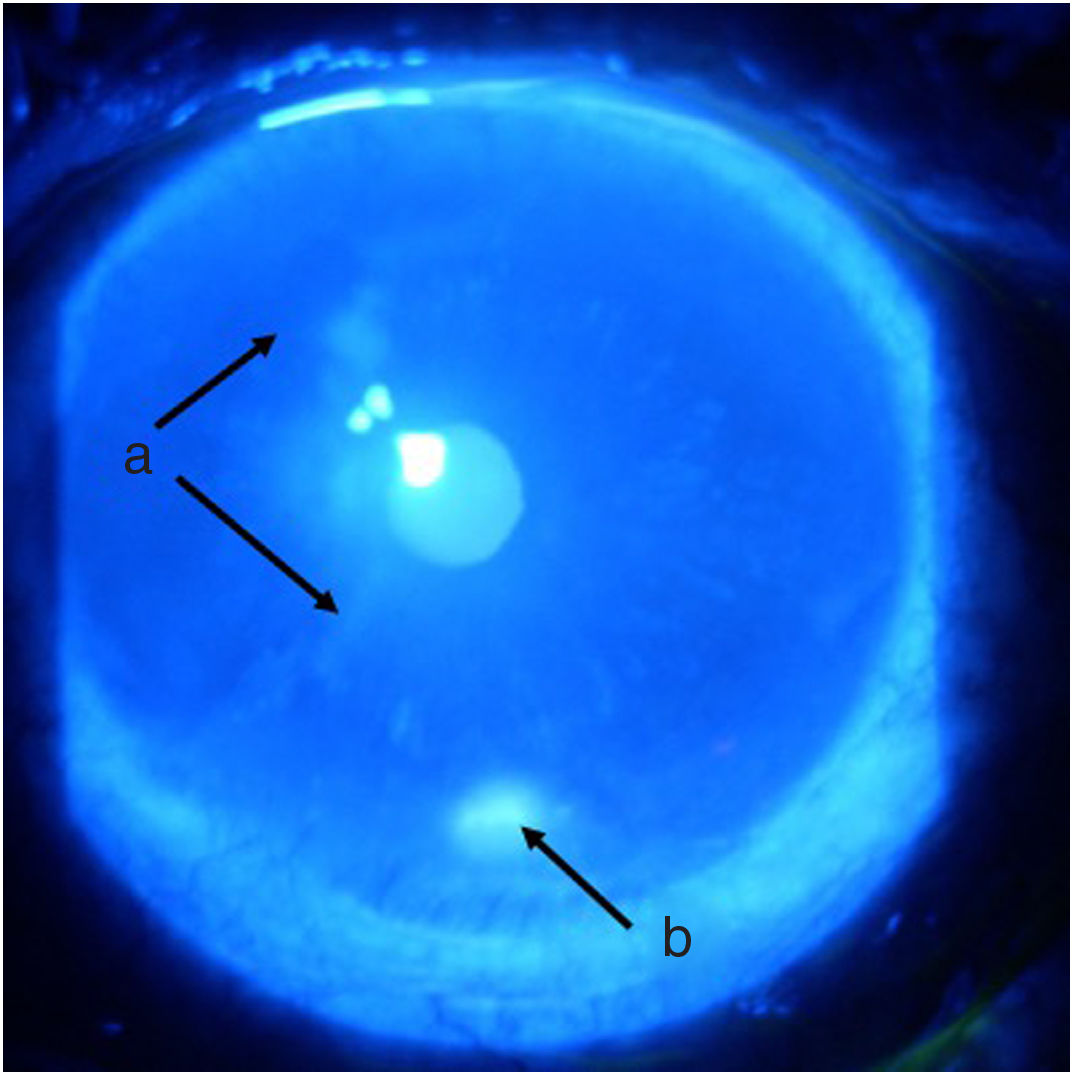
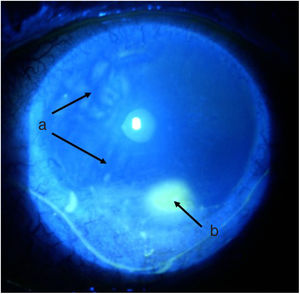
Seguimiento y desenlacesA las 48 h de iniciado el tratamiento, el paciente presentaba una mejoría sintomatológica importante. Una semana después es reevaluado por oftalmología, quienes encuentran una mejoría marcada de los signos y síntomas oculares (figs. 3 y 4), con disminución del área de la úlcera y mejoría de la superficie corneal, siendo dado de alta continuando la dosis de prednisolona y con orden para aplicación de una nueva dosis de ciclofosfamida como parte de un plan de aplicación de este medicamento mensualmente durante 6 meses.
El presente caso nos muestra una complicación ocular rara de la AR con derretimiento corneano. Para entender el porqué de esta complicación es importante recordar las características de la córnea como estructura compleja cuya principal función es permitir el paso de la luz a la retina. Para cumplir este propósito esta debe carecer de estructuras vasculares pues estas no solo obstruyen el paso de la luz, sino que en caso de inflamación permiten el paso de elementos celulares lo que llevaría a una catástrofe desde el punto de vista funcional4; es por este motivo que se privilegia la inmunidad humoral a nivel ocular constituyéndose en un «santuario inmunológico»5.
A pesar de verse como una estructura homogénea, el limbo esclerocorneal posee ciertas particularidades que lo hacen susceptible al depósito de complejos inmunes: la cercanía de la red vascular escleral y epiescleral, la presencia de células de Langerhans y de altos niveles de inmunoglobulina M y C1 favorece la formación de complejos inmunes y la activación de la vía clásica del complemento, respectivamente6. Esto es relevante si tenemos en cuenta que un proceso similar está relacionado con el desarrollo de ciertas complicaciones como la vasculitis reumatoide, lo que explicaría la relación entre vasculitis reumatoide y derretimiento corneano7. Una vez se depositan los complejos inmunes esto activa la vía clásica del sistema del complemento, lo cual resulta en quimiotaxis de células inflamatorias, en particular neutrófilos y macrófagos, los cuales liberan colagenasas y proteasas, así como una disminución en los inhibidores de estas lo que genera un desbalance que destruye el estroma corneal8,9. Adicionalmente, las citoquinas proinflamatorias como IL1 estimulan a los queratocitos a producir metaloproteinasas de matriz que aceleran el proceso de destrucción, dando como resultado la formación de úlceras periféricas y, en estadios avanzados, el adelgazamiento progresivo de los bordes corneales hasta la perforación, fenómeno conocido bajo el término de derretimiento corneal y al proceso que lleva a este fenómeno conocido como queratitis ulcerativa periférica (QUP). Finalmente, en algunos estudios se ha observado una alta presencia de anticuerpos contra antígenos corneales (91%)10, no obstante, hoy en día se consideran estos como un epifenómeno posterior al proceso inflamatorio inicial y no tienen un papel importante en su fisiopatología11.
Existen múltiples causas para la QUP que pueden dividirse, grosso modo, en locales o sistémicas (tabla 2). El propósito de este artículo es revisar su asociación con AR, no obstante, y dadas las implicaciones que pueden tener en estos pacientes, es prudente siempre descartar otras causas, en especial procesos infecciosos. Dentro de las causas no infecciosas de origen sistémico, la AR es la afección más frecuente, encontrándose en el 34% de los afectados, seguida de cerca en frecuencia por la poliangeítis con granulomatosis12. Las otras enfermedades que se asocian con QUP se enumeran en la tabla 2.
Causas de adelgazamiento corneal inflamatorio
| Queratitis ulcerativa periférica | |||
|---|---|---|---|
| Grupo de enfermedades inflamatorias destructivas corneales que resultan en adelgazamiento de la córnea periférica por pérdida de células epiteliales y queratólisis13.Aproximadamente el 50% de los pacientes con QUP tienen asociada una enfermedad sistémica, en su mayoría enfermedades del colágeno vascular | |||
| Oculares, no infecciosas:IdiopáticoRosáceaPosquirúrgico o postraumáticoPor exposiciónÚlcera de MoorenDegeneración marginal de Terrien | Ocular, infeccioso:Bacteriano: Staphylococcus, StreptococcusViral: herpes simplex y herpes zosterParasitario: AcantamoebaMicótico | Sistémico, no infeccioso14–16:Artritis reumatoideVasculitis asociadas a anticuerpos contra el citoplasma del neutrófiloPoliarteritis nudosaLupus eritematoso sistémico | Sistémico, infeccioso: RaroInfección por gonococoDisentería bacilarTuberculosisVaricela zosterHelmintiasis |
Visto desde otro punto de vista la afección ocular en AR es frecuente, ocurre aproximadamente en el 25% de los pacientes17. Su principal manifestación es la queratoconjuntivitis sicca, seguida de escleritis, epiescleritis y QUP18,19. Esta última manifestación es relativamente rara presentándose entre 1,4 y 2,5% de los pacientes19,20, con una incidencia de 3,01 casos por 1.000.000 de habitantes9, aunque su incidencia tiende a disminuir probablemente por la mejoría en el tratamiento en los últimos años.
Cuando se analizan las características de estos pacientes con complicaciones oculares de la AR, estos tienden a ser personas mayores de 60 años, con enfermedad de larga data y positividad para el factor reumatoide. Watanabe et al.15, realizaron un estudio de seguimiento a partir de 2003 (fecha en la que estuvo disponible la terapia biológica), encontrando 8 pacientes con una edad promedio de 73 años y 12 años de duración de la enfermedad. En esta serie el 100% de los pacientes tenía factor reumatoide positivo y todos los pacientes estaban al menos en baja actividad de la enfermedad por clinimetría11,20, hallazgo que es de vital importancia pues es usual esperar altos niveles de actividad de la enfermedad en pacientes con complicaciones de la AR. Si bien la QUP puede presentarse de forma espontánea11,20, generalmente existe un factor desencadenante, en especial la cirugía ocular, proceso que facilita el depósito de complejos inmunes y el inicio de un proceso vasculítico local y una respuesta intensa de linfocitos T en promedio a las 14 semanas posteriores a la intervención21. De igual manera, si bien es reportado de forma mucho más esporádica, esta también puede desencadenarse por la suspensión del tratamiento inmunosupresor20, como en el caso de nuestro paciente en el que se suspendió este de forma abrupta en el contexto de su cirugía de hallux valgus.
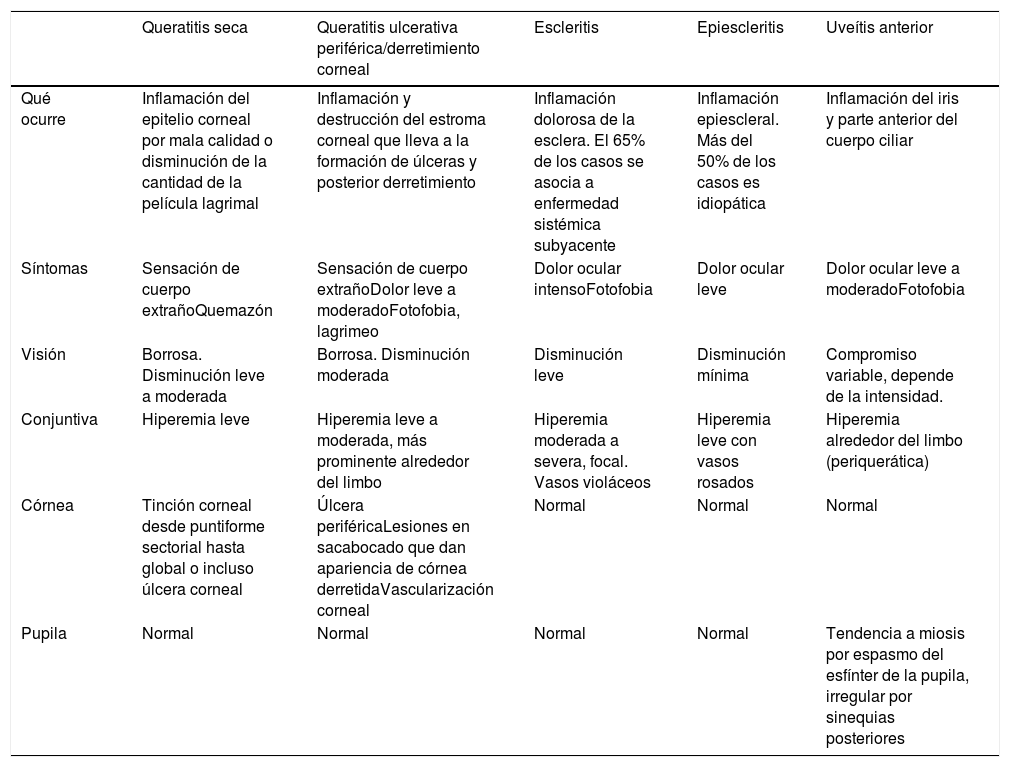
Clínicamente el derretimiento corneal se manifiesta con inyección conjuntival, dolor ocular, blefaroespasmo, fotofobia y disminución de la agudeza visual. Generalmente se observa una úlcera corneal en forma de semiluna la cual en algunos casos pueden encontrarse en la región superior pasando desapercibida en caso de no retirar el párpado durante la evaluación11. Esta inflamación se presenta en un 70% asociada a escleritis9 lo que tiende a desviar la atención del médico tratante. Es por esto por lo que todo paciente con AR y escleritis deberá ser evaluado para descartar una QUP. Desde el punto de vista oftalmológico, es importante definir si la ulceración es central o periférica, pues en el primer caso deberán sospecharse causas de tipo infeccioso o asociado a ojo seco15, no obstante, aun las ulceraciones centrales si están asociadas a AR tienen un peor pronóstico22. Adicionalmente, es importante evaluar la presencia de síntomas secos o síndrome de Sjögren pues estos aumentan de forma importante la posibilidad de QUP23. La explicación para este fenómeno no está completamente clara pero posiblemente se deba al aumento de la osmolaridad producido por la sequedad de la córnea que favorece un estado inflamatorio y la activación de las enzimas tipo matriz metaloproteinasa 4. Teniendo en cuenta la variedad de diagnósticos diferenciales de la inflamación ocular es necesario realizar un diagnóstico acertado del compromiso ocular específico, por esto en la tabla 3 se enumeran los distintos tipos de compromiso y sus principales diferencias semiológicas.
Diagnósticos diferenciales de ojo rojo en paciente con artritis reumatoide
| Queratitis seca | Queratitis ulcerativa periférica/derretimiento corneal | Escleritis | Epiescleritis | Uveítis anterior | |
|---|---|---|---|---|---|
| Qué ocurre | Inflamación del epitelio corneal por mala calidad o disminución de la cantidad de la película lagrimal | Inflamación y destrucción del estroma corneal que lleva a la formación de úlceras y posterior derretimiento | Inflamación dolorosa de la esclera. El 65% de los casos se asocia a enfermedad sistémica subyacente | Inflamación epiescleral. Más del 50% de los casos es idiopática | Inflamación del iris y parte anterior del cuerpo ciliar |
| Síntomas | Sensación de cuerpo extrañoQuemazón | Sensación de cuerpo extrañoDolor leve a moderadoFotofobia, lagrimeo | Dolor ocular intensoFotofobia | Dolor ocular leve | Dolor ocular leve a moderadoFotofobia |
| Visión | Borrosa. Disminución leve a moderada | Borrosa. Disminución moderada | Disminución leve | Disminución mínima | Compromiso variable, depende de la intensidad. |
| Conjuntiva | Hiperemia leve | Hiperemia leve a moderada, más prominente alrededor del limbo | Hiperemia moderada a severa, focal. Vasos violáceos | Hiperemia leve con vasos rosados | Hiperemia alrededor del limbo (periquerática) |
| Córnea | Tinción corneal desde puntiforme sectorial hasta global o incluso úlcera corneal | Úlcera periféricaLesiones en sacabocado que dan apariencia de córnea derretidaVascularización corneal | Normal | Normal | Normal |
| Pupila | Normal | Normal | Normal | Normal | Tendencia a miosis por espasmo del esfínter de la pupila, irregular por sinequias posteriores |
Una vez realizado el diagnóstico de QUP, el tratamiento debe ser agresivo y encaminado a evitar tanto las complicaciones locales como sistémicas, pues sin tratamiento la QUP puede desencadenar no solo en un pobre resultado visual sino en una mortalidad cercana al 30%, generalmente por el desarrollo de una vasculitis reumatoide subsecuente20. Una serie de casos realizada por Squirrell et al., en 1999, documentó los resultados visuales y sistémicos de 9 pacientes con AR y QUP, encontrando un predominio de pacientes con visión menor a 20/200 o no percepción de luz, requiriéndose en 2 pacientes cirugía de emergencia. Es por esto que el tratamiento debe ser interdisciplinario combinando las distintas herramientas disponibles.
Dentro de las distintas opciones de manejo tópico están los lubricantes locales y la ciclosporina A, la cual, al menos desde el punto de vista teórico, pudiera ser preferida por su efecto sobre los linfocitos T mediante la inhibición de producción de IL-224. Es importante mencionar que no deben utilizarse esteroides tópicos pues estos si bien suprimen la inflamación, inhiben la producción de colágeno retrasando la epitelialización y predisponiendo a infección. Finalmente, el tratamiento quirúrgico se reserva usualmente para casos refractarios o con inminencia de perforación ocular, dentro de estas opciones está la aplicación de adhesivo ocular de cianoacrilato, útil en casos de perforación inminente o en perforaciones menores a 2mm17,25. El injerto en parche para defectos intermedios14 y el trasplante de córnea para las perforaciones grandes, si bien estas son de mal pronóstico26. Aquí nuevamente es importante mencionar que no debe realizarse flap conjuntival pues la vascularización propia de la conjuntiva puede empeorar la lesión.
Adicional al manejo local, es indispensable complementar el tratamiento con terapia inmunosupresora sistémica. Esta incluye diversos medicamentos desde metotrexate y azatioprina11 pasando por ciclofosfamida y ciclosporina15, la cual es en teoría un agente ideal por los aspectos mencionados previamente. Adicionalmente la terapia biológica ha sido utilizada también en estos casos siendo los agentes mejor estudiados los bloqueadores del factor de necrosis tumoral27–30 y rituximab el cual ha demostrado su efectividad en otras manifestaciones graves de la AR pero de forma paradójica puede ocasionalmente desencadenar la QUP al alterar la relación de antígeno anticuerpo secundario a su efecto sobre las células B31.
Si bien el propósito inicial del tratamiento es permitir la cicatrización de la córnea, es importante recordar que estos pacientes tienen una alta tasa de desarrollo de vasculitis reumatoide subsecuente32, por lo que no solo la visión del individuo está en juego, siendo el uso de inmunosupresores la única intervención que modificará el patrón de mortalidad33, como lo muestran estudios que comparan cohortes históricas observando una disminución tanto de la mortalidad (28 vs. 15%) como de las complicaciones oculares como perforación ocular 34 vs. 3,4% y enucleación 10 vs. 0% 6, siendo, por lo tanto, una conducta obligada en los casos asociados a AR.
Nuestro caso es particularmente ilustrativo de varios elementos importantes, un compromiso extraarticular disociado de la actividad inflamatoria articular, la ausencia de escleritis como compromiso ocular asociado, el requerimiento de una evaluación de oftalmología para el diagnóstico adecuado y la presencia de la suspensión de tratamiento como factor desencadenante del cuadro clínico. Esta mezcla de factores hace que el clínico deba tener una alta sospecha diagnóstica no solo para preservar la visión sino por la asociación con complicaciones graves como vasculitis reumatoide.
En resumen, la QUP es una manifestación extraarticular grave de la AR que se presenta en pacientes con enfermedad establecida y no guarda relación con la actividad articular. Generalmente se presenta asociada a escleritis y es agravada por los síntomas secos oculares. Su manejo debe ser agresivo no solo para evitar la pérdida de la visión sino para evitar complicaciones sistémicas graves como la vasculitis reumatoide, para lo cual la terapia sistémica provee los mejores resultados.
ÉticaEl presente caso contó con el consentimiento y la aprobación del Comité de ética de la Clínica Universitaria Bolivariana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.