Los síntomas psicológicos y conductuales de las demencias (SPCD) aparecen con frecuencia asociados a los pacientes con demencia, agravando su estado cognitivo y conductual, que genera angustia a sus cuidadores principales. Las terapias no farmacológicas son un método para abordar los SPCD.
ObjetivoAnalizar la eficacia de una intervención terapéutico-conductual y de apoyo al cuidador familiar sobre la reducción de su sobrecarga y si dicha reducción tiene un impacto positivo sobre los SPCD del paciente con demencia.
MétodoEnsayo clínico, aleatorizado, doble ciego en una muestra de pacientes con demencia y sus cuidadores principales (CP). Los CP fueron asignados a un grupo de intervención (GI) y a un grupo control (GC). La intervención consistió en una educación cognitiva-conductual individual realizada por enfermería ambulatoria, con controles periódicos telefónicos durante 3 meses. El GC recibió la atención de práctica clínica habitual. Fue evaluada la función cognitiva: escala Mini-Mental State Exploration (MMSE) y Neuropsychiatric Inventory (NPI-10); la depresiva: escala depresión geriátrica (GDS) y sobrecarga del cuidador: escala Zarit. Los SPCD fueron recogidos según datos cuantitativos y cualitativos en la visita inicial y final.
ResultadosEdad media total de pacientes: 78,96 ± 6,64 años, y distribución por sexos, (50%) hombres. Los CP (n=28) mostraron una edad media de 58,64 ± 11,69 años, siendo la práctica totalidad (92,9%) mujeres. El GI (n=13) mostró mejor puntuación que el GC (n=15) entre visitas (inicial y 3 meses), tanto en el MMSE (p<0,001) como en la GDS (p<0,001), aunque sin cambios en la NPI-10 (p=0,419), indicando mejoría cognitiva y depresiva tras la intervención. Los cuidadores también obtuvieron puntuaciones estadísticamente significativas en el Zarit (p=0,010). Los SPCD mejoraron en el GI: repetición (p<0,001), depresión (p=0,013), apatía e indiferencia (p=0,003), trastornos del sueño y del ritmo diurno (p=0,006) y trastornos de la alimentación (p=0,019) a los 3 meses. Identificador Clinicaltrial.gov: NCT03732521.
ConclusionesLa terapia no farmacológica de intervención terapéutico-cognitiva individual dirigida a cuidadores y conducida por personal de enfermería experto en su manejo tiene un impacto favorable en el control y reducción de los SPCD de los pacientes con demencia.
The behavioural and psychological symptoms of dementia (BPSD) are frequently associated with patients with dementia, aggravating their cognitive and behavioural status, which generates anguish for their main caregivers. Non-pharmacological therapies are a method to approach BPSD.
AimTo analyse the effectiveness of a behavioural educational intervention and support to the family caregiver in reducing overload, and whether this reduction has a positive impact on the BPSD of the patient with dementia.
MethodA randomised, controlled, double-blind trial was conducted with patients with dementia and their principal caregivers (PC). The PC were randomised to either the intervention (IG) or control group (CG). The intervention comprised an individual cognitive-behavioural education intervention performed by outpatient nursing, with periodic telephone contacts, over 3 months. The CG received treatment as usual. Cognitive function was assessed using the cognitive scale Mini-Mental State Exploration (MMSE), Neuropsychiatric inventory (NPI-10) and depressive Geriatric Depression Scale (GDS). And caregiver-reported burden using the Zarit Caregiver Burden Inventory. The qualitative and qualitative data of the BPSD were collected at baseline and after the intervention.
ResultsThe mean total age of the patients was 78.96 (± 6.64) years, and 50% were men. And in the PC (n=28) it was 58.64 (± 11.69) years, and 92.9% were women. The IG (n=13) showed a better score than the CG (n=15) in the MMSE P<.001 and the GDS P<.001, although without changes in the NPI-10 (P=0,419), between the start visit and at 3 months, indicating improvement in cognitive and depressive symptoms after the intervention. The PC also obtained statistically significant scores on the Zarit scale (P=.010). BPSD improved significantly in the IG: repetition P<.001, depression (P =.013), apathy and indifference (P=.003), sleep and diurnal rhythm disorders (P=.006), and eating disorders (P=.019) at 3 months. Clinicaltrials.gov Identifier: NCT03732521.
ConclusionsNon-pharmacological therapy of individual therapeutic-cognitive intervention targeted at caregivers and carried out by nursing personnel expert in its management, has a favourable impact on the control and reduction of the BPSD of patients with dementia.
La demencia es un síndrome neuropsiquiátrico con un pico de incidencia a partir de los 65 años1. En el 2015 se estimó una cifra de 47 millones de personas con demencia en el mundo y si la prevalencia se mantiene, en el año 2050 alcanzará los 130 millones, todo ello influido por el incremento de la longevidad y la supervivencia en la población2.
Una de las principales características de las demencias es el deterioro cognitivo con afectación progresiva de las funciones diarias, con frecuencia asociado a las alteraciones del comportamiento. Así pues, aparecen los síntomas psicológicos y conductuales de las demencias (SPCD), definidos como «síntomas de alteración de la percepción, del pensamiento, del estado de ánimo o de la conducta»3. Estas alteraciones, como agitación, depresión, euforia, delirios y alucinaciones, se relacionan entre sí. Aproximadamente 5 de cada 6 pacientes con demencia desarrollarán SPCD4,5. El 20% de las personas iniciarán con SPCD los primeros 2 años tras el diagnóstico de demencia y al menos el 50% presentará nuevos SPCD cada mes6. Los SPCD como la agitación pueden estar presentes varios meses en el 50-80% de los casos. Estos síntomas son las manifestaciones que más sufrimiento generan en el paciente, sus cuidadores y en la sociedad en general7. Además, empeoran las 2esferas sintomáticas (cognitiva y funcional) que conllevan un mayor coste económico, estrés en el cuidador, discapacidad funcional y disminución en la calidad de vida (cuidador y paciente), todo ello precipitando la institucionalización temprana de los enfermos con demencia8,9.
En líneas generales, el abordaje terapéutico de los SPCD debería ser multidisciplinar y coordinado en los diferentes niveles asistenciales, asociando terapias tanto farmacológicas como no farmacológicas (TNF)10,11. Las TNF en la demencia se encuadran en el modelo biopsicosocial de cuidados a los pacientes12. En comparación con los fármacos, presentan un perfil de efectos adversos más favorable por el valor añadido del contacto social y la posibilidad de una mayor individualización13-15.
Encontramos evidencias en la literatura sobre la eficacia de las intervenciones educativas ambulatorias en el cuidador familiar en cuanto a la disminución de la sobrecarga y la mejora de su estado de ánimo15,16 pero se mantienen incógnitas al relacionar si dicha mejora puede tener un impacto indirecto sobre los SPCD del paciente, o bien sobre su cuidador.
Así pues, el objetivo del presente este estudio fue analizar la eficacia de una intervención educativa conductual individual y de apoyo al cuidador familiar sobre la reducción de su sobrecarga y si dicha reducción tiene un impacto positivo sobre los SPCD del paciente con demencia.
MétodosDiseño y población de estudioSe realizó un ensayo clínico, aleatorizado, doble ciego y comparativo entre una muestra de pacientes con demencia que recibieron tratamiento médico aislado comparado con otro grupo de tratamiento más intervención educativa por parte de enfermería de soporte a sus cuidadores principales en el Hospital de Tortosa Verge de la Cinta (HTVC), desde marzo del 2014 hasta noviembre del 2017. El estudio obtuvo el dictamen favorable del Comité de Ética de Investigación Clínica de referencia con el código CEIC-10/2014 y fue registrado en el ClinicalTrials.gov con el número de identificación NCT03732521.
La población de estudio fueron todos los pacientes con presencia de SPCD y sus cuidadores principales atendidos en la Unidad de Trastornos Cognitivos y de la Conducta (UTCC) del HTVC que aceptaron voluntariamente su participación mediante la autorización del consentimiento informado tras cumplir los siguientes criterios de selección.
Criterios de inclusión- a.
Pacientes con edad ≥ 65 años con diagnóstico de demencia y en tratamiento con inhibidores de la acetilcolinesterasa y memantina durante un periodo mínimo de 6 meses.
- b.
Puntuación entre 4 y 6 en la escala Global de Severidad de Reisberg17, ambos incluidos.
- c.
Puntuación ≥ 4 en la escala Neuropsychiatric Inventory (NPI-10)18, con síntomas presentes al menos un mes anterior a la visita, sin ser atribuibles a enfermedad médica intercurrente ni a un síndrome confusional agudo.
- d.
Residentes en domicilio familiar y que acudan a consulta acompañados de un cuidador principal, que acceda a firmar el consentimiento informado tras obtener toda la información del estudio en cuestión. Se entiende como cuidador principal el familiar que convive en el mismo domicilio, se encarga principalmente de los cuidados diarios del paciente y lo acompaña a las visitas en el centro sanitario.
- a.
Pacientes que presenten enfermedades médicas intercurrentes que le confieran un pronóstico vital inferior a 6 meses.
- b.
Pacientes en los que los SPCD puedan estar en el contexto de una enfermedad toxico-metabólica, dolor no controlado o delirium, según criterio clínico.
- c.
Pacientes en tratamiento con neurolépticos típicos, benzodiacepinas de acción larga, opioides mayores o fármacos que potencialmente puedan alterar el estado de consciencia.
Se recogieron variables sociodemográficas como la edad, el sexo, los años de escolarización y los antecedentes familiares de enfermedad psiquiátrica.
Las variables clínicas incluían el tipo de demencia, los años desde el diagnóstico, los factores de riesgo cardiovascular (hipertensión, diabetes mellitus, dislipidemia, sobrepeso, presencia de hábito tabáquico o enólico y cardiopatías).
Además, se recogieron variables funcionales, los tratamientos farmacológicos para los SPCD asociados a la demencia y la cuantificación y evaluación cualitativa de los SPCD clasificada en: resuelto (R), mejora (M), empeora (E), sin cambios (SC) y no presenta (NP).
Las variables neuropsicológicas se recogieron mediante las escalas NPI-10, MMSE y GDS de Reisberg. El inventario NPI-10 permite obtener información sobre la presencia de síntomas psiquiátricos y conductuales en pacientes con demencia, y explora 10aspectos: delirios, alucinaciones, agitación, depresión/disforia, ansiedad, euforia/júbilo, apatía/indiferencia, desinhibición, irritabilidad/labilidad y conducta motora sin finalidad. Cada aspecto o ítem incluye una pregunta, si se responde afirmativamente, se pasa a la siguiente, y si se responde negativamente, se pasa a una subescala. La puntuación total para las subescalas es el producto de la frecuencia multiplicada por la gravedad. También se utilizó el MMSE, que evalúa el estado mental mediante las áreas: orientación espacial y temporal, memoria inmediata, atención y cálculo, memoria diferida, lenguaje y praxis: nominación, repetición, comprensión de órdenes verbales, lectura, escritura espontánea y copia de dibujo, y construcción visual. La puntuación total se obtiene de la suma del total de aciertos, así que a mayor puntuación, mejor estado cognitivo, aunque su puntuación de corte es de 24 y 27 según el nivel de estudios de los pacientes. Y por último, el GDS de Reisberg, instrumento diseñado para detectar la posible presencia de depresión, está compuesto por 30 ítems con respuestas dicotómicas (sí/no). La puntuación total se obtiene de la suma de todos los ítems, su intervalo es de 0-30 y sus puntos de corte son: normal (0-10 puntos) y posible depresión (11-30 puntos).
Finalmente, la sobrecarga del cuidador se evaluó con el test de Zarit, que se compone de 22 preguntas; cada ítem se valora por la frecuencia (nunca, casi nunca, a veces, bastantes veces y casi siempre) y su puntuación va de 0 a 4. La puntuación total se obtiene de la suma de todas las preguntas y su puntuación máxima es de 88 puntos. No existen normas ni puntos de corte, aunque se considera que «no hay sobrecarga» con una puntuación inferior a 46 puntos y existe «sobrecarga intensa» en una puntuación superior a 56.
Procedimientos, aleatorización y reclutamientoTras la inclusión del paciente en el estudio, se aleatorizó en el grupo intervención (GI) (práctica clínica habitual e intervención educativa de enfermería en el cuidador familiar) o en el grupo control (CG) (práctica clínica habitual) indistintamente con una proporción 1:1 mediante el software no comercial Epidat 3.0 (Xunta de Galicia y OPS-OMS). El tamaño de la muestra se calculó mediante el software gratuito (Granmo, Institut Municipal d’Investigació Mèdica, Barcelona) versión 7.12. El cálculo se realizó teniendo en cuenta como variable dependiente la escala de sobrecarga del cuidador Zarit19, aceptando un riesgo alfa de 0,05 y un riesgo beta inferior a 0,2 en un contraste bilateral. Se asignaron 18 cuidadores en el GI y 18 en el GC, para detectar una diferencia igual o superior a 4 puntos entre los grupos, con una tasa de pérdidas de seguimiento del 10%.
Los pacientes y los cuidadores, tras su asignación al grupo de estudio, fueron evaluados por un neurólogo que identificaba la presencia de SPCD, ajustaba el tratamiento y evaluaba las escalas NPI-10, MMSE, GDS de Reisberg y Zarit. Se registraron las puntuaciones totales de las escalas y en el caso de la NPI-10, el valor utilizado fue el resultado de multiplicar la frecuencia por la gravedad.
Los cuidadores del GI fueron citados a los 15 días para una primera visita en la consulta de enfermería, que disponía de los resultados de las escalas e identificación previa de los SPCD evaluados por el neurólogo. La enfermera intervencionista revisaba los SPCD de la primera visita y posteriormente realizaba la intervención educativa. Hubo controles telefónicos para reforzar las intervenciones y valorar la aparición de nuevos SPCD a los 30 y 60 días. Ambos grupos fueron citados a los 90 días con un nuevo neurólogo, ciego al grupo de asignación, el cual revaluó las escalas NPI-10, MMSE, GDS de Reisberg y Zarit. Se realizó una valoración cualitativa de los SPCD remitida por el cuidador mediante una clave de respuesta clasificada como: R, M, E, SC y NP (fig. 1).
Intervención educativaEl equipo de enfermería que aplicó la intervención educativa estaba compuesto por 2enfermeras expertas de la UTCC, que fueron previamente formadas por un profesional de neuropsicología para homogenizar su abordaje.
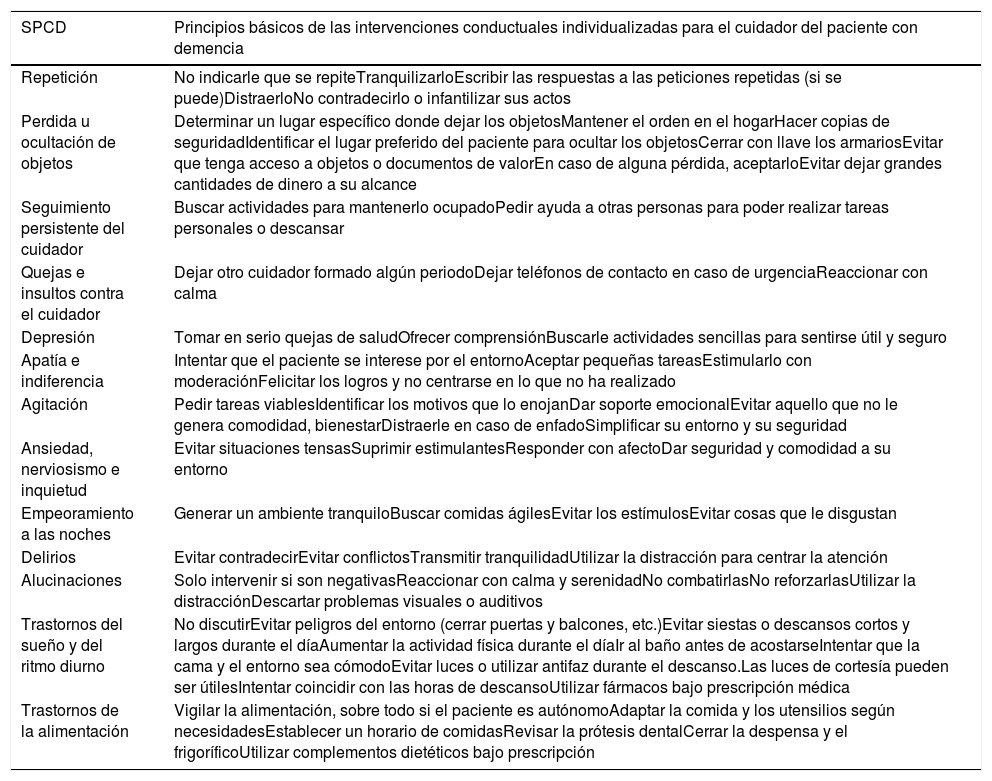
Se definieron los SPCD previamente, así como las intervenciones para cada caso, en lo referente a la actitud con el paciente y la modificación del ambiente domiciliario en el que tuvo lugar el síntoma (tabla 1). Todo ello fue recogido en un dosier que posteriormente se entregó a los cuidadores principales del GI con adaptaciones individualizadas según el contexto social y familiar. Cada intervención educativa presencial tuvo una duración estimada entre 90 y 120 min, y las visitas telefónicas, de 30 min.
SPCD establecidos para el estudio e intervenciones conductuales
| SPCD | Principios básicos de las intervenciones conductuales individualizadas para el cuidador del paciente con demencia |
|---|---|
| Repetición | No indicarle que se repiteTranquilizarloEscribir las respuestas a las peticiones repetidas (si se puede)DistraerloNo contradecirlo o infantilizar sus actos |
| Perdida u ocultación de objetos | Determinar un lugar específico donde dejar los objetosMantener el orden en el hogarHacer copias de seguridadIdentificar el lugar preferido del paciente para ocultar los objetosCerrar con llave los armariosEvitar que tenga acceso a objetos o documentos de valorEn caso de alguna pérdida, aceptarloEvitar dejar grandes cantidades de dinero a su alcance |
| Seguimiento persistente del cuidador | Buscar actividades para mantenerlo ocupadoPedir ayuda a otras personas para poder realizar tareas personales o descansar |
| Quejas e insultos contra el cuidador | Dejar otro cuidador formado algún periodoDejar teléfonos de contacto en caso de urgenciaReaccionar con calma |
| Depresión | Tomar en serio quejas de saludOfrecer comprensiónBuscarle actividades sencillas para sentirse útil y seguro |
| Apatía e indiferencia | Intentar que el paciente se interese por el entornoAceptar pequeñas tareasEstimularlo con moderaciónFelicitar los logros y no centrarse en lo que no ha realizado |
| Agitación | Pedir tareas viablesIdentificar los motivos que lo enojanDar soporte emocionalEvitar aquello que no le genera comodidad, bienestarDistraerle en caso de enfadoSimplificar su entorno y su seguridad |
| Ansiedad, nerviosismo e inquietud | Evitar situaciones tensasSuprimir estimulantesResponder con afectoDar seguridad y comodidad a su entorno |
| Empeoramiento a las noches | Generar un ambiente tranquiloBuscar comidas ágilesEvitar los estímulosEvitar cosas que le disgustan |
| Delirios | Evitar contradecirEvitar conflictosTransmitir tranquilidadUtilizar la distracción para centrar la atención |
| Alucinaciones | Solo intervenir si son negativasReaccionar con calma y serenidadNo combatirlasNo reforzarlasUtilizar la distracciónDescartar problemas visuales o auditivos |
| Trastornos del sueño y del ritmo diurno | No discutirEvitar peligros del entorno (cerrar puertas y balcones, etc.)Evitar siestas o descansos cortos y largos durante el díaAumentar la actividad física durante el díaIr al baño antes de acostarseIntentar que la cama y el entorno sea cómodoEvitar luces o utilizar antifaz durante el descanso.Las luces de cortesía pueden ser útilesIntentar coincidir con las horas de descansoUtilizar fármacos bajo prescripción médica |
| Trastornos de la alimentación | Vigilar la alimentación, sobre todo si el paciente es autónomoAdaptar la comida y los utensilios según necesidadesEstablecer un horario de comidasRevisar la prótesis dentalCerrar la despensa y el frigoríficoUtilizar complementos dietéticos bajo prescripción |
En la visita inicial el neurólogo ajustó el tratamiento médico a cada paciente.
Para las alucinaciones y los delirios se utilizaron quetiapina o risperidona, según el perfil de comorbilidades y la tolerancia de cada paciente.
Para la depresión o la ansiedad se emplearon citalopram a dosis bajas, mirtazapina y, en caso de no respuesta, duloxetina o venlafaxina. El fármaco se eligió según comorbilidades o tolerancia del paciente.
Solo fueron aceptadas las benzodiacepinas de acción corta a dosis bajas si los pacientes las estaban tomando previamente a la inclusión del estudio (lorazepam o lormetazepam)20-24.
Análisis de datosPara el análisis estadístico se utilizó el paquete SPSS v23.0 para Windows (IBM). Todas las pruebas fueron aplicadas con el 95% de confianza. Los resultados se presentan en forma de tabla, con sus respectivas frecuencias absolutas y relativas. Las variables numéricas están representadas por medidas de tendencia central y medidas de dispersión descritas como media ± desviación estándar. Se utilizó la prueba de normalidad de Shapiro-Wilk para las variables cuantitativas. La comparación entre la visita inicial y la final de las variables del mismo grupo se realizó mediante las pruebas de la chi al cuadrado y t de Student, según el tipo de variables. Se aplicó la correlación de Pearson (distribución normal) y la correlación de Spearman (distribución no normal) para la comparación de los 2grupos.
ResultadosDe un total de 36 pacientes con demencia y sus cuidadores principales incluidos en el estudio (18 en el GC y 18 en el GI), completaron el estudio 28 participantes (n=15 en el GC y n=13 en el GI). Los motivos de pérdida de seguimiento por parte del cuidador fueron: razones médicas (n=3), falta de tiempo (n=3), empeoramiento del paciente (n=1) y periodo vacacional (n=1).
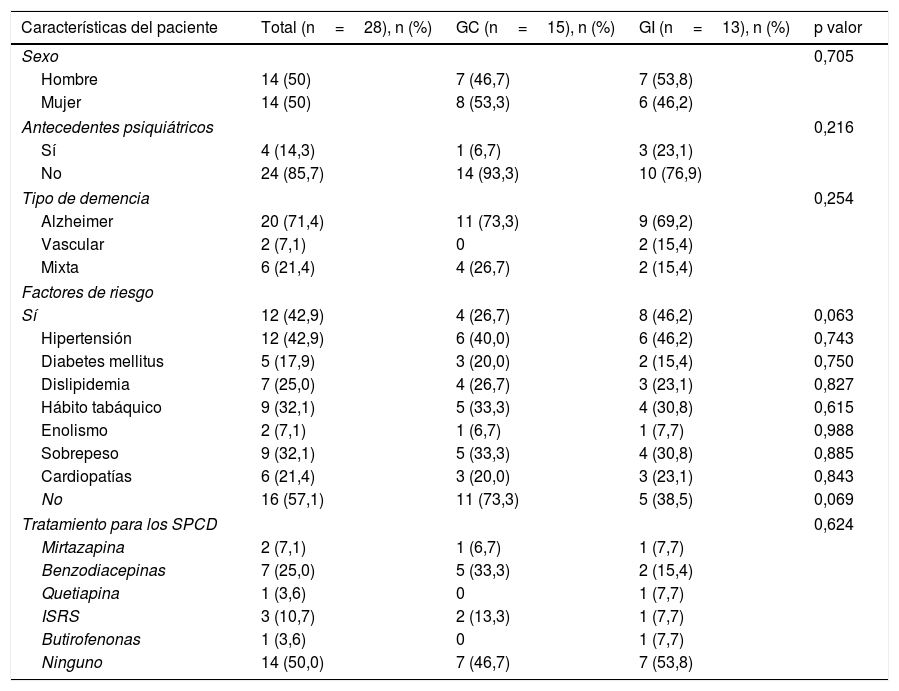
Las características sociodemográficas de los participantes y sus cuidadores principales se pueden observar en la tabla 2. Con relación a los pacientes, la edad media total fue de 78,96 ± 6,64) años y el 50% eran hombres. El 14,3% presentaba antecedentes psiquiátricos en el momento de la inclusión, encontrándose el 50% en algún tratamiento psicofarmacológico para el control de los SPCD asociados a su demencia. La enfermedad de Alzheimer fue el tipo de demencia mayoritaria (71,4%), seguido de la demencia mixta4,21 y vascular1,7, con una media de evolución desde el diagnóstico de 2,11 ± 1,54 años. El 57,1% no tenía factores de riesgo cardiovascular y de los que sí los tenían (42,9%), el factor de riesgo mayoritario fue la hipertensión arterial (42,9%) seguida del hábito tabáquico (32,1%), el sobrepeso (32,1%) y la dislipidemia (25,0%).
Características basales de los pacientes y sus cuidadores familiares
| Características del paciente | Total (n=28), n (%) | GC (n=15), n (%) | GI (n=13), n (%) | p valor |
|---|---|---|---|---|
| Sexo | 0,705 | |||
| Hombre | 14 (50) | 7 (46,7) | 7 (53,8) | |
| Mujer | 14 (50) | 8 (53,3) | 6 (46,2) | |
| Antecedentes psiquiátricos | 0,216 | |||
| Sí | 4 (14,3) | 1 (6,7) | 3 (23,1) | |
| No | 24 (85,7) | 14 (93,3) | 10 (76,9) | |
| Tipo de demencia | 0,254 | |||
| Alzheimer | 20 (71,4) | 11 (73,3) | 9 (69,2) | |
| Vascular | 2 (7,1) | 0 | 2 (15,4) | |
| Mixta | 6 (21,4) | 4 (26,7) | 2 (15,4) | |
| Factores de riesgo | ||||
| Sí | 12 (42,9) | 4 (26,7) | 8 (46,2) | 0,063 |
| Hipertensión | 12 (42,9) | 6 (40,0) | 6 (46,2) | 0,743 |
| Diabetes mellitus | 5 (17,9) | 3 (20,0) | 2 (15,4) | 0,750 |
| Dislipidemia | 7 (25,0) | 4 (26,7) | 3 (23,1) | 0,827 |
| Hábito tabáquico | 9 (32,1) | 5 (33,3) | 4 (30,8) | 0,615 |
| Enolismo | 2 (7,1) | 1 (6,7) | 1 (7,7) | 0,988 |
| Sobrepeso | 9 (32,1) | 5 (33,3) | 4 (30,8) | 0,885 |
| Cardiopatías | 6 (21,4) | 3 (20,0) | 3 (23,1) | 0,843 |
| No | 16 (57,1) | 11 (73,3) | 5 (38,5) | 0,069 |
| Tratamiento para los SPCD | 0,624 | |||
| Mirtazapina | 2 (7,1) | 1 (6,7) | 1 (7,7) | |
| Benzodiacepinas | 7 (25,0) | 5 (33,3) | 2 (15,4) | |
| Quetiapina | 1 (3,6) | 0 | 1 (7,7) | |
| ISRS | 3 (10,7) | 2 (13,3) | 1 (7,7) | |
| Butirofenonas | 1 (3,6) | 0 | 1 (7,7) | |
| Ninguno | 14 (50,0) | 7 (46,7) | 7 (53,8) | |
| Edad (años) | Media±DE | Media±DE | Media±DE | p valor |
| Años de diagnóstico de la demencia | 78,96±6,64 | 79,20±6,91 | 78,69±6,58 | 0,845 |
| 2,11±1,54 | 2,00±1,41 | 2,23±1,72 | 0,701 |
| Características del cuidador | Total (n=28) | GC (n=15) | GI (n=13) | p valor |
| Edad (años) | Media±DE | Media±DE | Media±DE | |
| Escolarización (años) | 58,64±11,69 | 58,53±12,99 | 58,77±10,52 | 0,959 |
| 8,36±3,57 | 8,00±3,89 | 8,77±3,27 | 0,580 |
| n (%) | n (%) | n (%) | p valor | |
| Sexo | 0,916 | |||
| Hombre | 2 (7,1) | 1 (6,7) | 1 (7,7) | |
| Mujer | 26 (92,9) | 14 (93,3) | 12 (92,3) |
Chi al cuadrado. Correlación significativa p valor (< 0,05).
En la muestra de cuidadores, de los que el 92,9% fueron mujeres, la edad media fue de 58,64 ± 11,69 años y tenían 8,36 ± 3,57 años de escolarización. La distribución entre los 2grupos de estudio (familiares y cuidadores) fue similar, sin obtención de significación estadística en las variables sociodemográficas.
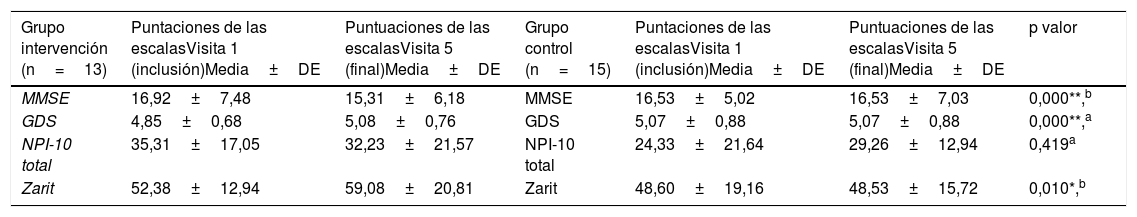
La comparación de las puntuaciones obtenidas en las escalas del paciente (MMSE y GDS) mostró diferencias significativas entre el GI y el GC comparando la visita inicial con el seguimiento a los 3 meses. Se observó que el GI redujo la puntuación en la escala MMSE significativamente (p<0,001) entre la visita de inicio (16,92 ± 7,48) y la de 3 meses (15,31 ± 6,18) en comparación con el GC, cuyas puntuaciones fueron 16,53 ± 5,02 en la visita inicial y 16,53 ± 7,03 en la final, indicando una leve mejora en su estado cognitivo. En cuanto a la clasificación, no se observaron diferencias significativas.
La escala GDS también obtuvo resultados significativos (p<0,001), ya que el GI puntuó en la visita inicial 4,85 ± 0,68 y 5,08 ± 0,76) en la final en comparación con el GC (visita inicial 5,07 ± 0,88 y final 5,07 ± 0,88), indicando una leve mejora en la clínica depresiva. La escala NPI-10 no obtuvo significación estadística (p=0,419) pero se observó una tendencia a la mejoría en los SPCD en el GI (visita inicial 35,31 ± 17,05 vs. final 32,23 ± 21,57), mientras que el GC mostró peores resultados (visita inicial 24,33 ± 21,64 vs. final 29,26 ± 12,94).
El test de Zarit de sobrecarga del cuidador principal también obtuvo puntuaciones estadísticamente significativas (p=0,010) pero en este caso mostró un empeoramiento en la sobrecarga del cuidador del GI en la visita final (59,08 ± 20,81) respecto a la inicial (52,38 ± 12,94), mientras que el GC obtuvo mejores puntuaciones (48,53 ± 15,72) vs. la inicial (48,60 ± 19,16). Aunque en la clasificación del Zarit no se obtuvo significación, se observó que el GI presentaba puntuaciones medias de sobrecarga intensa, mientras que el GC se situaba en sobrecarga leve (tabla 3).
Comparación de las puntuaciones de las escalas del paciente y su cuidador, entre la visita de inclusión y a los 90 días, según grupo de asignación
| Grupo intervención (n=13) | Puntaciones de las escalasVisita 1 (inclusión)Media±DE | Puntuaciones de las escalasVisita 5 (final)Media±DE | Grupo control (n=15) | Puntaciones de las escalasVisita 1 (inclusión)Media±DE | Puntuaciones de las escalasVisita 5 (final)Media±DE | p valor |
|---|---|---|---|---|---|---|
| MMSE | 16,92±7,48 | 15,31±6,18 | MMSE | 16,53±5,02 | 16,53±7,03 | 0,000**,b |
| GDS | 4,85±0,68 | 5,08±0,76 | GDS | 5,07±0,88 | 5,07±0,88 | 0,000**,a |
| NPI-10 total | 35,31±17,05 | 32,23±21,57 | NPI-10 total | 24,33±21,64 | 29,26±12,94 | 0,419a |
| Zarit | 52,38±12,94 | 59,08±20,81 | Zarit | 48,60±19,16 | 48,53±15,72 | 0,010*,b |
| n (%) | n (%) | n (%) | n (%) | p valor | ||
| MMSE clasificación | MMSE clasificación | 0,250 | ||||
| ≥ 27 (normal) | 2 (15,4) | 1 (7,7) | ≥ 27 (normal) | 0 | 0 | |
| ≤ 24 (sospecha patológica) | 0 | 1 (7,7) | ≤ 24 (sospecha patológica) | 1 (6,7) | 2 (2 (13,3) | 0,559 |
| 12-24 (deterioro) | 12-24 (Deterioro) | |||||
| 9-12 (demencia) | 5 (38,5) | 7 (53,8) | 9-12 (demencia) | 9 (60,0) | 8 (53,3) | |
| 6 (46,2) | 4 (30,8) | 5 (33,3) | 5 (33,3) | |||
| Zarit clasificación | Zarit clasificación | |||||
| <47 (no sobrecarga) | 4 (30,8) | 3 (23,1) | <47 (no sobrecarga) | 6 (40,0) | 9 (60,0) | |
| 47-55 (sobrecarga leve) | 3 (23,1) | 3 (23,1) | 47-55 (sobrecarga leve) | 5 (33,3) | 1 (6,7) | |
| >55 (sobrecarga intensa) | 6 (46,2) | 7 (53,8) | > 55 (sobrecarga intensa) | 4 (26,7) | 5 (33,3) |
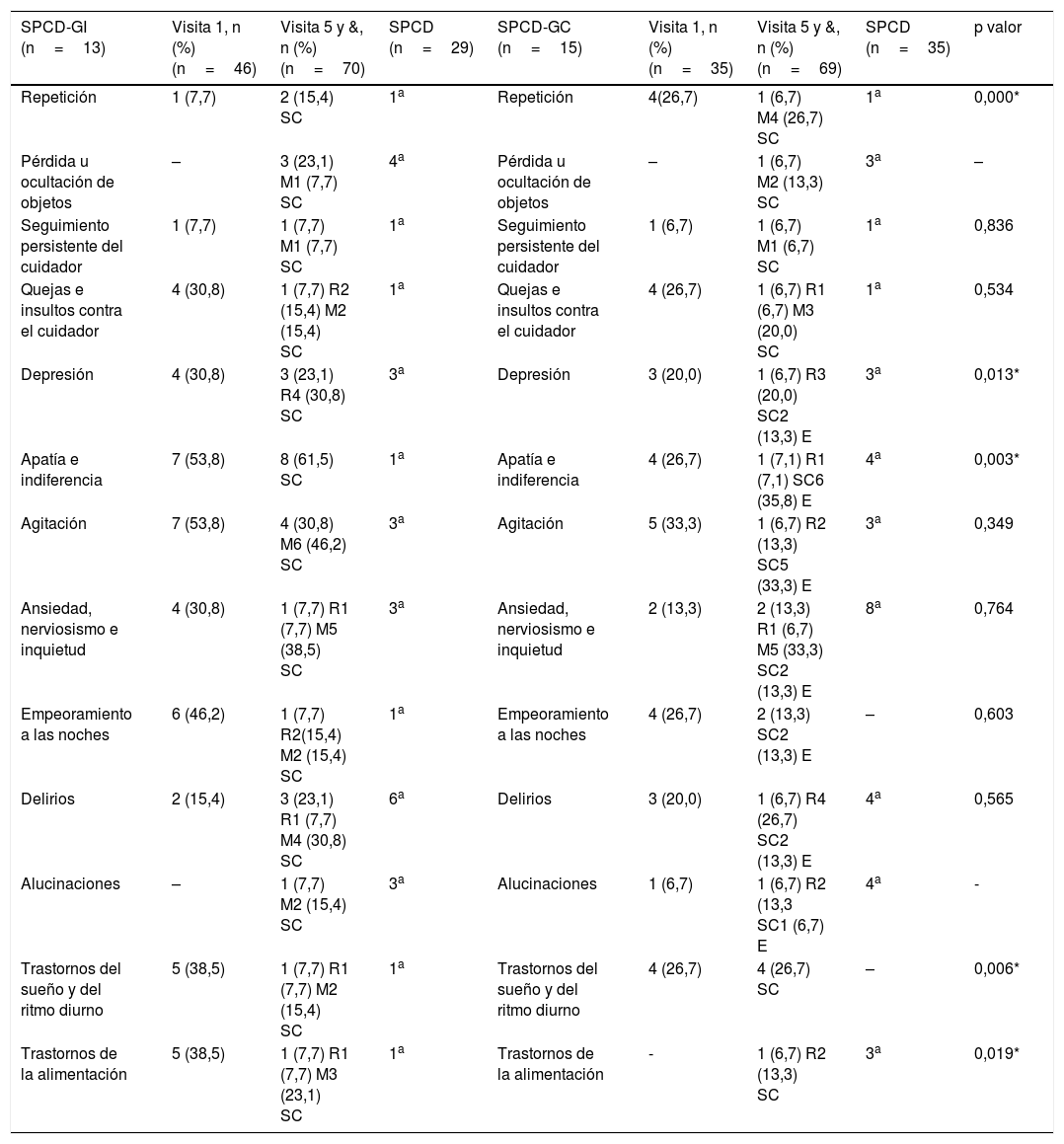
Se identificaron todos los SPCD previamente establecidos en el estudio en ambos grupos en la visita inicial o final. Al comparar la nueva aparición de SPCD entre la visita inicial y final, así como su evaluación entre los grupos, se observaron diferencias estadísticamente significativas a favor del GI en los SPCD: repetición (p<0,001), depresión (p=0,013), apatía e indiferencia (p=0,003), trastornos del sueño y del ritmo diurno (p=0,006) y trastornos de la alimentación (p=0,019) (tabla 4).
SPCD identificados des de la visita de inclusión hasta los 90 días, SPCD de nueva aparición, y valoración de su estado final según grupo de asignación
| SPCD-GI (n=13) | Visita 1, n (%)(n=46) | Visita 5 y &, n (%)(n=70) | SPCD (n=29) | SPCD-GC (n=15) | Visita 1, n (%) (n=35) | Visita 5 y &, n (%) (n=69) | SPCD (n=35) | p valor |
|---|---|---|---|---|---|---|---|---|
| Repetición | 1 (7,7) | 2 (15,4) SC | 1a | Repetición | 4(26,7) | 1 (6,7) M4 (26,7) SC | 1a | 0,000* |
| Pérdida u ocultación de objetos | – | 3 (23,1) M1 (7,7) SC | 4a | Pérdida u ocultación de objetos | – | 1 (6,7) M2 (13,3) SC | 3a | – |
| Seguimiento persistente del cuidador | 1 (7,7) | 1 (7,7) M1 (7,7) SC | 1a | Seguimiento persistente del cuidador | 1 (6,7) | 1 (6,7) M1 (6,7) SC | 1a | 0,836 |
| Quejas e insultos contra el cuidador | 4 (30,8) | 1 (7,7) R2 (15,4) M2 (15,4) SC | 1a | Quejas e insultos contra el cuidador | 4 (26,7) | 1 (6,7) R1 (6,7) M3 (20,0) SC | 1a | 0,534 |
| Depresión | 4 (30,8) | 3 (23,1) R4 (30,8) SC | 3a | Depresión | 3 (20,0) | 1 (6,7) R3 (20,0) SC2 (13,3) E | 3a | 0,013* |
| Apatía e indiferencia | 7 (53,8) | 8 (61,5) SC | 1a | Apatía e indiferencia | 4 (26,7) | 1 (7,1) R1 (7,1) SC6 (35,8) E | 4a | 0,003* |
| Agitación | 7 (53,8) | 4 (30,8) M6 (46,2) SC | 3a | Agitación | 5 (33,3) | 1 (6,7) R2 (13,3) SC5 (33,3) E | 3a | 0,349 |
| Ansiedad, nerviosismo e inquietud | 4 (30,8) | 1 (7,7) R1 (7,7) M5 (38,5) SC | 3a | Ansiedad, nerviosismo e inquietud | 2 (13,3) | 2 (13,3) R1 (6,7) M5 (33,3) SC2 (13,3) E | 8a | 0,764 |
| Empeoramiento a las noches | 6 (46,2) | 1 (7,7) R2(15,4) M2 (15,4) SC | 1a | Empeoramiento a las noches | 4 (26,7) | 2 (13,3) SC2 (13,3) E | – | 0,603 |
| Delirios | 2 (15,4) | 3 (23,1) R1 (7,7) M4 (30,8) SC | 6a | Delirios | 3 (20,0) | 1 (6,7) R4 (26,7) SC2 (13,3) E | 4a | 0,565 |
| Alucinaciones | – | 1 (7,7) M2 (15,4) SC | 3a | Alucinaciones | 1 (6,7) | 1 (6,7) R2 (13,3 SC1 (6,7) E | 4a | - |
| Trastornos del sueño y del ritmo diurno | 5 (38,5) | 1 (7,7) R1 (7,7) M2 (15,4) SC | 1a | Trastornos del sueño y del ritmo diurno | 4 (26,7) | 4 (26,7) SC | – | 0,006* |
| Trastornos de la alimentación | 5 (38,5) | 1 (7,7) R1 (7,7) M3 (23,1) SC | 1a | Trastornos de la alimentación | - | 1 (6,7) R2 (13,3) SC | 3a | 0,019* |
–: SPCD no presentes; &: clave para clasificar la evaluación final de los SPCD: resuelto (R), mejora (M), empeora (E), sin cambios (SC) y no presenta (NP).
Además, en el GI no hubo empeoramiento de ningún SPCD en la evaluación final: 6 de los SPCD se clasificaron como resueltos en algún caso y se identificaron 29 nuevos casos entre las visitas. Por otra parte, el GC mostró 6 resoluciones de los SPCD iniciales, empeoró en 7 SPCD e incrementó 35 nuevos casos en diferentes SPCD a los 3 meses.
Limitaciones del estudioLa detección y el reclutamiento de los pacientes y sus cuidadores formaron parte de la rutina asistencial, por lo que no se puede descartar un sesgo de selección además de la dificultad en el cumplimiento de los criterios de inclusión para la selección de pacientes. El sexo de los cuidadores estuvo desequilibrado, así como el grado de sobrecarga del cuidador. Las pérdidas de seguimiento afectaron a ambos grupos, reduciéndose de este modo el total de participantes y, a su vez, influyó en el análisis posterior de los resultados. Debido a la variabilidad de los SPCD asociados a la demencia y sus subtipos, las intervenciones expuestas en el presente trabajo se centran en los principios básicos de su abordaje, lo que puede afectar a la validez externa del estudio. Finalmente, se estimó un periodo corto de intervención y seguimiento en ambos grupos, que pudo influir en la valoración del impacto de la intervención.
Discusión y conclusionesEl perfil clínico y sociodemográfico de los pacientes y sus cuidadores principales incluidos en el presente estudio es comparable con el de otros trabajos realizados en población con demencia, otras enfermedades neurodegenerativas o, en general, pacientes dependientes1,3,4,25.
Cuando aparecen SPCD en pacientes con demencia, su cuidador familiar refiere incapacidad o dificultad para gestionarlos, generando estrés y sobrecarga en el proceso, además de dificultades de afrontamiento tanto para él como para el paciente26-28. Existen estudios que demuestran el beneficio del uso de las TNF en pacientes con demencia. Entre ellas, encontramos las intervenciones educativas individuales de carácter conductual, destinadas a mejorar los SPCD o del bienestar del cuidador29,30.
Desgraciadamente, aunque los SPCD se identifiquen en la práctica clínica diaria de las unidades de trastornos cognitivos, las TNF no se incorporan en la rutina asistencial de los consultas de enfermería31,32, por lo que los estudios que valoran su impacto presentan ciertas limitaciones28. En nuestro estudio, hemos detectado diferencias significativas en el MMSE y el GDS a favor del GI, indicando una ligera mejoría en el estado cognitivo y depresivo de los pacientes en la visita final del estudio en comparación con la inicial.
También se encontraron diferencias en el test de sobrecarga del cuidador. Sin embargo, no fue en beneficio de los cuidadores del GI, quizá porque curiosamente presentaban mayor sobrecarga desde un inicio. Este hecho ha podido influir en los resultados, ya que aunque la escala NPI-10 no fuera significativa, sí mostró un descenso de SPCD en el GI. Es posible que los cuidadores que más se beneficien de las TNF sean los más sobrecargados y, a su vez, aunque se observen mejoras directamente en las escalas de sobrecarga del cuidador o identificación de SPCD, sí que indirectamente se refleja la mejora cognitiva y depresiva del paciente.
Se identificó un mayor número de SPCD en la visita de inclusión en el GI, aunque, en cambio, en la visita final ambos grupos se equipararon. Los SPCD con mejor pronóstico a favor de la intervención educativa conductual se centraron significativamente en el GI y en los SPCD de repetición, depresión, apatía e indiferencia, trastornos del sueño y del ritmo diurno, y trastornos de la alimentación, todos ellos de mayor impacto en pacientes con demencia y que coinciden con otros estudios realizados14,29,33,34. Así pues, ningún SPCD del GI empeoró en la evaluación final, a diferencia del GC.
A pesar de las limitaciones mencionadas, este estudio se suma a los beneficios de las intervenciones conductuales individuales de carácter educativo dirigidas al cuidador principal y realizado por enfermería experta en el manejo del paciente. Por ello se recomienda integrar la TNF educativa individual y conductual de los SPCD en las unidades de trastorno cognitivo, en el modelo o plan de atención de cuidados de enfermería, desde una perspectiva multidisciplinar para dar respuesta a necesidades reales y tangibles de los cuidadores principales.
FinanciaciónSociedad Española de Enfermería Neurológica. Premio de Investigación. XX Congreso Anual, 2013.
Conflicto de interesesNinguno de los autores declara ningún tipo de conflicto de interés.
Este trabajo se realizó con la ayuda de Rosa Benet-Martí y Sonia Gálvez-Vicente. Se agradece la colaboración del Dr. Juan José Baiges-Octavio y el resto de equipo del Servicio de Neurología del HTVC, por su soporte en la ejecución y la revisión científica.