O stent liberador de everolimus XIENCE V® é um stent farmacológico de nova geração que incorpora uma plataforma de cromo‐cobalto de baixo perfil (81μm) e um polímero de elevada biocompatibilidade (fluoropolímero), o qual carreia e controla a liberação do fármaco everolimus. Estudos recentes demonstram segurança e eficácia sustentadas do dispositivo XIENCE V® no tratamento de populações da prática clínica. Nosso objetivo foi reportar resultados clínicos de 12 meses do protocolo brasileiro BRAVO.
MétodosO registro BRAVO foi um estudo prospectivo, não randomizado, de braço único, multicêntrico (25 centros), que avaliou os resultados clínicos tardios de 535 pacientes minimamente selecionados, tratados com o stent farmacológico XIENCE V®.
ResultadosCerca de 40% dos pacientes tinham diabetes, 25% infarto agudo do miocárdio prévio e 42% apresentaram‐se com síndrome coronária aguda. A maioria das lesões (69%) era de elevada complexidade (ACC/AHA tipo B2/C). As médias da extensão e do diâmetro nominais dos stents foram, respectivamente, 19,9 ± 5,3mm e 3,0 ± 0,4mm. Os sucessos angiográfico e de procedimento foram de 99,7 e 98%, respectivamente. Aos 12 meses, a taxa cumulativa de eventos cardíacos adversos maiores, disponível em 100% dos pacientes, foi de 5,6% (morte cardíaca: 1,3%; infarto agudo do miocárdio: 3,0%; revascularização da lesão‐alvo: 2,2%). Já a trombose de stent ocorreu em cinco pacientes (0,9%), sendo reportada apenas uma ocorrência entre 6 e 12 meses.
ConclusõesO stent farmacológico XIENCE V® demonstrou segurança e eficácia sustentadas ao final de 12 meses no tratamento de lesões coronárias complexas em pacientes da prática diária.
The Xience VTM everolimus‐eluting stents is a new generation drug‐eluting stent (DES) that incorporates a low profile cobalt‐chromium platform (81μm) and a highly biocompatible polymer (fluoropolymer), which carries and controls the release of everolimus. Recent studies have demonstrated sustained safety and efficacy of the Xience VTM in the treatment of real‐world populations. Our aim was to report the clinical results of 12 months of the BRAVO Brazilian protocol.
MethodsThe BRAVO Registry was a prospective, non‐randomized, single‐arm, multicenter (25 centers) study that evaluated the late clinical results of 535 minimally selected patients treated with the drugeluting stent Xience VTM in Brazilian daily practice.
ResultsOverall, 40% of patients had diabetes, 25% prior myocardial infarction, and 42% presented with acute coronary artery syndrome. The majority of lesions (69%) was highly complex (ACC/AHA type B2 or C). The mean length and the nominal stent diameter were 19.9 ± 5.3mm and 3.0 ± 0.4mm, respectively. The angiographic and procedural successes were 99.7 and 98%, respectively. At 12 months, the cumulative rate of major adverse cardiac events, available in 100% of patients, was 5.6% (cardiac death: 1.3%; acute myocardial infarction: 3.0%; revascularization of the target lesion: 2.2%). Stent thrombosis occurred in 5 patients (0,9%), and only 1 case was reported between 6 and 12 months.
ConclusionsThe drug‐eluting stent Xience V™ demonstrated sustained safety and efficacy up to 12 months in the treatment of complex coronary lesions in patients from daily practice.
De maneira geral, as novas gerações de stents farmacológicos (SF) têm demonstrado elevada eficácia e segurança no tratamento de pacientes com lesões coronárias na prática diária.1–3 Em comparação com os SF mais antigos,4,5 tais dispositivos caracterizam‐se pela presença de componentes metálicos de menor perfil, sistemas carreadores de fármaco com biocompatibilidade otimizada e potentes agentes antiproliferativos.6–13
O stent XIENCE V® (Abbott Vascular, Santa Clara, Estados Unidos) incorpora uma plataforma de cromo‐cobalto com espessura de 81μm e um polímero não trombogênico (f luoropolímero), o qual carreia e controla a liberação do fármaco everolimus.6 Estudos recentes com o stent XIENCE V® incluindo populações de mundo real mostraram baixa ocorrência de eventos cardíacos adversos maiores (ECAM) e trombose de stent nas fases tardia e muito tardia.14–19
Especificamente no seguimento de 6 meses do registro BRAVO (BRazil Xience™ V Everolimus‐Eluting Coronary Stent System “Real‐World” Outcomes Registry), que avaliou 535 pacientes, as taxas cumulativas de ECAM (4,3%), morte cardíaca (1,1%) e trombose de stent (0,8%) foram relativamente baixas, especialmente considerando uma coorte brasileira complexa tratada em múltiplos centros na prática diária.20 Contudo, dados do seguimento de longo prazo ainda são necessários, a fim de melhor avaliar o impacto desse dispositivo em nossa população. Dessa forma, nosso objetivo foi reportar os resultados clínicos do seguimento de 12 meses dos pacientes incluídos no protocolo BRAVO.
MétodosProtocolo e procedimentoOs detalhes do protocolo e os resultados clínicos iniciais do registro BRAVO foram reportados previamente.20 Em resumo, tratouse de um estudo clínico prospectivo, não randomizado, de braço único, multicêntrico (25 centros), nacional, pós‐comercialização, que utilizou um sistema de captura de dados eletrônico validado, gerenciado de forma independente por uma Organização Representativa de Pesquisa Clínica, em São Paulo (SP). O objetivo do estudo foi avaliar os resultados clínicos tardios em pacientes minimamente selecionados (exclusões: ponte de safena e expectativa de vida < 24 meses) submetidos à intervenção coronária percutânea (ICP) com o SF XIENCE V® na prática diária brasileira. Foram incluídos pacientes com pelo menos uma lesão com estenose ≥ 50%, localizada em artéria coronária nativa com anatomia favorável à ICP com implante de stent. No geral, os procedimentos de ICP foram realizados de acordo com as diretrizes atuais,21 sendo a estratégia final deixada a critério do operador. O stents foram disponibilizados nas seguintes medidas: 2,5, 3,0 e 3,5mm de diâmetro e 8, 12, 15, 18, 23 e 28mm de extensão. Em relação às recomendações de terapia antiplaquetária dupla (TAD) pós‐procedimento, a aspirina foi prescrita indefinidamente e o tienopiridínico (clopidogrel) foi prescrito por, no mínimo, 12 meses.
Desfechos clínicos e definiçõesO desfecho primário do estudo foi a ocorrência de ECAM no seguimento de 12 meses. Os desfechos clínicos tardios considerados incluíram revascularização da lesão‐alvo (RLA) aos 6 e 12 meses, trombose de stent e sangramento maior até 12 meses. O desfecho combinado de ECAM foi definido como: morte cardíaca, infarto agudo do miocárdio (IAM) e RLA. Revascularização do vaso‐alvo (RVA) incluiu os casos de RLA.
As tromboses de stent foram definidas de acordo com os critérios do Academic Research Consortium (ARC).22 Sangramento maior seguiu os critérios Thrombolysis in Myocardial Infarction (TIMI), incluindo hemorragia intracraniana ou queda ≥ 5 g/dL na concentração de hemoglobina ou queda absoluta ≥ 15% no hematócrito.23
O seguimento clínico foi programado aos 30 dias, 6, 12 e 24 meses pós‐procedimento e consistiu em visita médica ou contato telefônico realizado segundo protocolo predefinido. Um total de 535 pacientes foi incluído entre setembro de 2008 e setembro de 2010, sendo que todos (100%) completaram o seguimento clínico aos 12 meses.
Todos os eventos adversos tiveram suas informações conferidas diretamente na documentação fonte e foram posteriormente adjudicados por um Comitê de Eventos Clínicos independente, que incluiu três experientes profissionais das áreas de Cardiologia Clínica e Invasiva. Para a análise atual, foram reportados os resultados clínicos até 12 meses.
Análise estatísticaAs variáveis categóricas são apresentadas como frequências e porcentuais. As variáveis quantitativas são apresentadas como média e desvio padrão.
ResultadosCaracterísticas basais e do procedimentoAs características clínicas e angiográficas basais são apresentadas na tabela 1. No geral, 40% dos pacientes tinham diabetes, 25% tinham IAM prévio, e 42% apresentaram‐se com síndrome coronária aguda (SCA), incluindo 29% com angina instável, 9% com IAM sem supradesnivelamento do segmento ST e 4% com IAM com supradesnivelamento do segmento ST. Em relação ao procedimento de ICP, 14% receberam múltiplos stents, 42% tiveram pós‐dilatação com cateter balão, e as médias de extensão nominal e do diâmetro nominal dos stents foram, respectivamente, 19,9 ± 5,3mm e 3,0 ± 0,4mm. Ao final do procedimento, os sucessos angiográficos e de procedimento foram de 99,7 e 98%, respectivamente.
Características clínicas e angiográficas basais
| Variável | n = 535 (770 lesões) |
|---|---|
| Idade, anos | 62,7 ± 11,1 |
| Sexo feminino, n (%) | 171 (32,0) |
| Diabetes melito, n (%) | 214 (40,0) |
| Em uso de insulina | 60 (11,2) |
| Hipertensão arterial sistêmica, n (%) | 433 (80,9) |
| Dislipidemia, n (%) | 407 (76,1) |
| História de tabagismo, n (%) | 234 (43,7) |
| Tabagismo atual | 101 (18,9) |
| História familiar de DAC, n (%) | 265 (49,5) |
| Infarto do miocárdio prévio, n (%) | 133 (24,9) |
| ICP prévia, n (%) | 206 (38,5) |
| CRM prévia, n (%) | 54 (10,1) |
| AVE prévio, n (%) | 21 (3,9) |
| ICC classe funcional III ou IVa, n (%) | 39 (7,3) |
| Insuficiência renalb, n (%) | 33 (6,2) |
| Doença vascular periférica, n (%) | 25 (4,7) |
| Apresentação clínica de SCA, n (%) | 224 (41,9) |
| Vaso‐alvo, n (%) | |
| Descendente anterior | 335 (46,1) |
| Circunflexa | 181 (23,5) |
| Coronária direita | 213 (27,7) |
| Tronco de coronária esquerda | 21 (2,7) |
| Bifurcação, n (%) | 89 (11,6) |
| Oclusão total, n (%) | 48 (6,2) |
| Reestenose intra‐stent, n (%) | 54 (7,0) |
| Lesão tipo B2/Cc, n (%) | 531 (69,0) |
| Extensão da lesão, mm | 17,8 ± 7,3d |
| Diâmetro de referência do vaso, mm | 3,0 ± 1,4d |
| Diâmetro da estenose, % | 82,9 ± 10,1d |
DAC: doença arterial coronária; ICP: intervenção coronária percutânea; CRM: cirurgia de revascularização do miocárdio; AVE: acidente vascular encefálico; ICC: insuficiência cardíaca congestiva; SCA: síndrome coronária aguda.
a De acordo com a classificação da New York Heart Association.
b Definida pela dosagem de creatinina sérica basal ≥ 1,5 mg/dL.
c De acordo com a classificação modificada American College of Cardiology/American Heart Association.
d Estimativa pela análise visual, conforme reportado pelo operador.
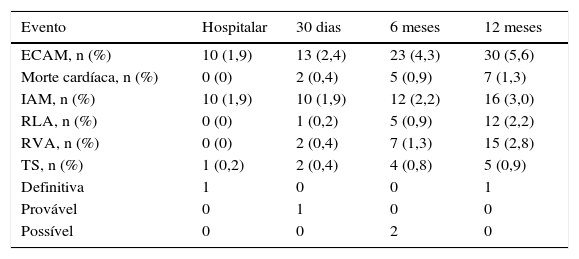
A tabela 2 mostra as taxas cumulativas de eventos adversos até 12 meses de seguimento clínico. Entre 6 e 12 meses, ocorreram sete novos casos de ECAM, incluindo duas mortes cardíacas. No primeiro caso, uma paciente de 53 anos, com múltiplos fatores de risco (hipertensão arterial sistêmica − HAS, diabetes, dislipidemia, tabagismo, IAM e cirurgia de revascularização do miocárdio − CRM prévios), tratou inicialmente duas lesões na coronária direita na vigência de SCA, mas evoluiu com IAM inferior com supradesnivelamento do segmento ST seguido de morte no dia 245 pós‐procedimento. No segundo caso, uma paciente de 70 anos, com antecedentes de HAS, dislipidemia e diabetes, tratou a artéria descendente anterior no procedimento índice devido ao quadro clínico de angina estável classe funcional III; no entanto, apresentou recorrência da lesão no vaso tratado e progressão de doença aterosclerótica, sendo submetida à CRM e evoluindo com complicações pós‐operatórias e morte no dia 289. Ademais, outros três pacientes tiveram morte não cardíaca devido à evolução de neoplasia de pâncreas (dia 246), politraumatismo (dia 280) e insuficiência respiratória (dia 295).
Taxas cumulativas de eventos adversos até 12 meses de seguimento (n = 535)
| Evento | Hospitalar | 30 dias | 6 meses | 12 meses |
|---|---|---|---|---|
| ECAM, n (%) | 10 (1,9) | 13 (2,4) | 23 (4,3) | 30 (5,6) |
| Morte cardíaca, n (%) | 0 (0) | 2 (0,4) | 5 (0,9) | 7 (1,3) |
| IAM, n (%) | 10 (1,9) | 10 (1,9) | 12 (2,2) | 16 (3,0) |
| RLA, n (%) | 0 (0) | 1 (0,2) | 5 (0,9) | 12 (2,2) |
| RVA, n (%) | 0 (0) | 2 (0,4) | 7 (1,3) | 15 (2,8) |
| TS, n (%) | 1 (0,2) | 2 (0,4) | 4 (0,8) | 5 (0,9) |
| Definitiva | 1 | 0 | 0 | 1 |
| Provável | 0 | 1 | 0 | 0 |
| Possível | 0 | 0 | 2 | 0 |
ECAM: eventos cardíacos adversos maiores; IAM: infarto agudo do miocárdio; RLA: revascularização da lesão‐alvo; RV: revascularização do vaso‐alvo; TS: trombose de stent.
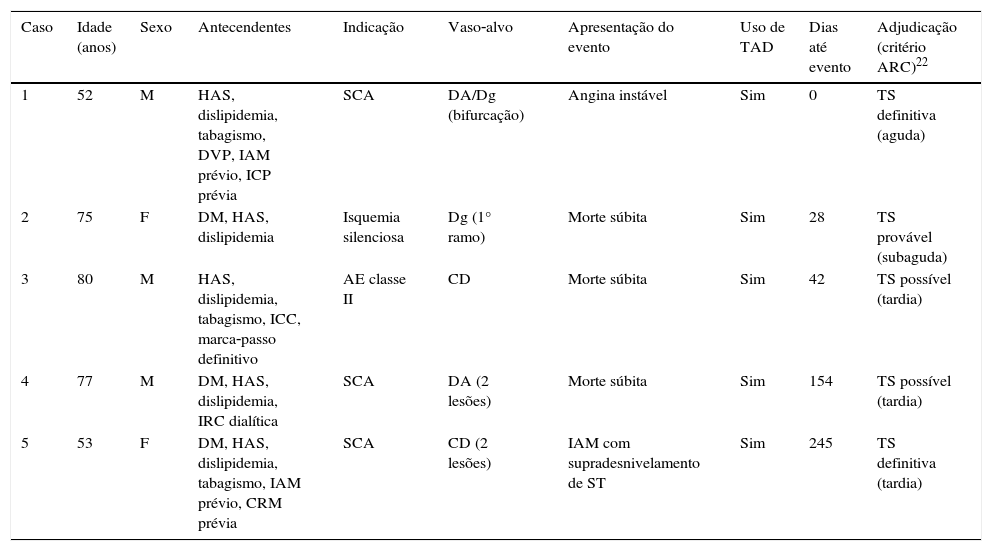
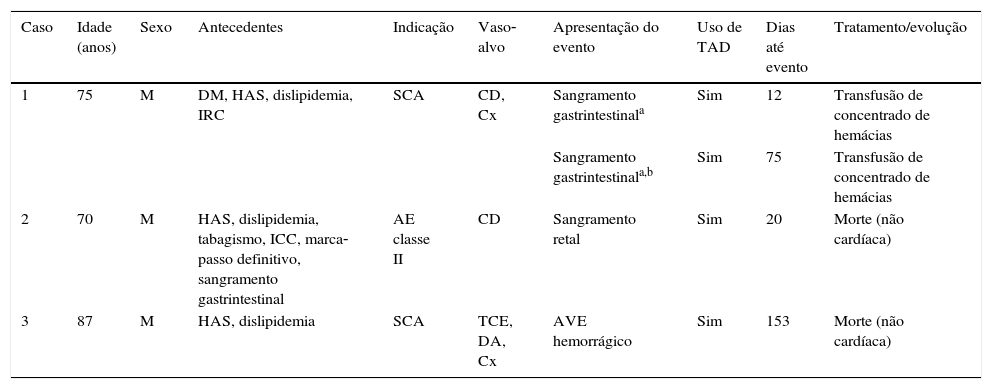
A taxa cumulativa de qualquer trombose de stent reportada até 12 meses foi de 0,9%, somando cinco casos; já a taxa de trombose de stent definitiva/provável foi de 0,6% (três casos). A descrição detalhada dos casos é apresentada na tabela 3. Por último, foram reportados casos de sangramento maior pelo critério TIMI em três pacientes até 12 meses de seguimento, sendo que, em um dos casos, o paciente apresentou dois episódios distintos de sangramento gastrintestinal (tabela 4).
Descrição dos casos de trombose de stent reportados até 12 meses de seguimento (ordenados pelo tempo até o evento a partir do procedimento índice)
| Caso | Idade (anos) | Sexo | Antecendentes | Indicação | Vaso‐alvo | Apresentação do evento | Uso de TAD | Dias até evento | Adjudicação (critério ARC)22 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 52 | M | HAS, dislipidemia, tabagismo, DVP, IAM prévio, ICP prévia | SCA | DA/Dg (bifurcação) | Angina instável | Sim | 0 | TS definitiva (aguda) |
| 2 | 75 | F | DM, HAS, dislipidemia | Isquemia silenciosa | Dg (1° ramo) | Morte súbita | Sim | 28 | TS provável (subaguda) |
| 3 | 80 | M | HAS, dislipidemia, tabagismo, ICC, marca‐passo definitivo | AE classe II | CD | Morte súbita | Sim | 42 | TS possível (tardia) |
| 4 | 77 | M | DM, HAS, dislipidemia, IRC dialítica | SCA | DA (2 lesões) | Morte súbita | Sim | 154 | TS possível (tardia) |
| 5 | 53 | F | DM, HAS, dislipidemia, tabagismo, IAM prévio, CRM prévia | SCA | CD (2 lesões) | IAM com supradesnivelamento de ST | Sim | 245 | TS definitiva (tardia) |
TAD: terapia antiplaquetária dupla; ARC: Academic Research Consortium; M: masculino; HAS: hipertensão arterial sistêmica; DVP: doença vascular periférica; IAM: infarto agudo do miocárdio; ICP: intervenção coronária percutânea; SCA: síndrome coronária aguda; DA: artéria coronária descendente anterior; Dg: ramo diagonal; TS: trombose de stent; F: feminino; DM: diabetes melito; ICC: insuficiência cardíaca congestiva; AE: angina estável; CD: artéria coronária direita; IRC: insuficiência renal crônica; CRM: cirurgia de revascularização do miocárdio.
Descrição dos casos de sangramento maior pelo critério TIMI17 até 12 meses de seguimento (ordenados pelo tempo até o evento a partir do procedimento índice)
| Caso | Idade (anos) | Sexo | Antecedentes | Indicação | Vaso‐alvo | Apresentação do evento | Uso de TAD | Dias até evento | Tratamento/evolução |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 75 | M | DM, HAS, dislipidemia, IRC | SCA | CD, Cx | Sangramento gastrintestinala | Sim | 12 | Transfusão de concentrado de hemácias |
| Sangramento gastrintestinala,b | Sim | 75 | Transfusão de concentrado de hemácias | ||||||
| 2 | 70 | M | HAS, dislipidemia, tabagismo, ICC, marca‐passo definitivo, sangramento gastrintestinal | AE classe II | CD | Sangramento retal | Sim | 20 | Morte (não cardíaca) |
| 3 | 87 | M | HAS, dislipidemia | SCA | TCE, DA, Cx | AVE hemorrágico | Sim | 153 | Morte (não cardíaca) |
TAD: terapia antiplaquetária dupla; M: masculino; DM: diabetes melito; HAS: hipertensão arterial sistêmica; IRC: insuficiência renal crônica; SCA: síndrome coronária aguda; CD: artéria coronária direita; Cx: artéria circunflexa; ICC: insuficiência cardíaca congestiva; AE: angina estável; TCE: tronco de coronária esquerda; DA: artéria coronária descendente anterior; AVE: acidente vascular encefálico.
a Evento associado à diminuição nos níveis séricos de hemoglobina ≥ 5 g/dL.
b Segundo evento de sangramento no mesmo paciente (caso 1).
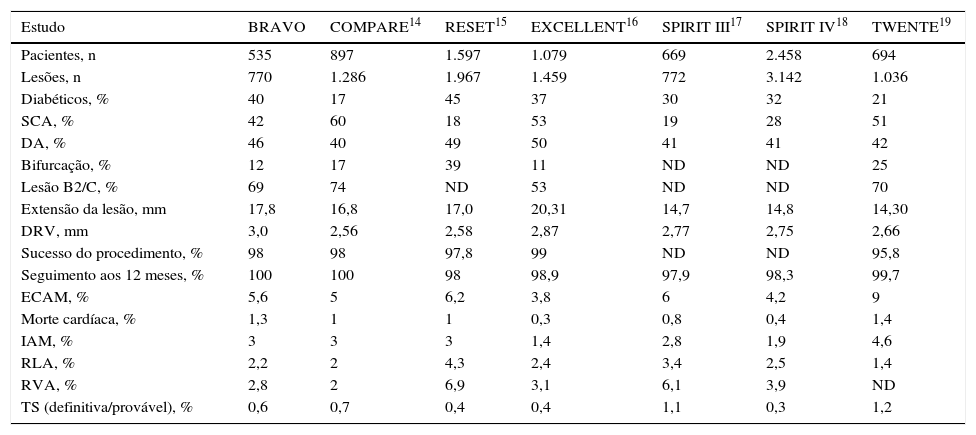
De maneira geral, os resultados clínicos encontrados aos 12 meses na análise atual, a qual envolveu um número relativamente grande de pacientes (n = 535) minimamente selecionados, provenientes da prática diária nacional, confirmaram o perfil de segurança e eficácia já observado em nosso registro aos 6 meses.20 Mostraram‐se também comparáveis a uma série de estudos reportados com o dispositivo XIENCE V® em populações de mundo real, nos quais foram evidenciadas altas taxas de sucesso do procedimento (96 a 99%), além de segurança e efetividade clínica sustentadas durante o seguimento tardio e muito tardio14–19 (tabela 5). Tais achados sugerem, de maneira inequívoca, um desempenho bastante favorável deste SF de segunda geração liberador de everolimus em diferentes cenários clínicos, incluindo subgrupos de elevado risco.
Comparação de estudos clínicos com o stent farmacológico liberador de everolimus XIENCE V®
| Estudo | BRAVO | COMPARE14 | RESET15 | EXCELLENT16 | SPIRIT III17 | SPIRIT IV18 | TWENTE19 |
|---|---|---|---|---|---|---|---|
| Pacientes, n | 535 | 897 | 1.597 | 1.079 | 669 | 2.458 | 694 |
| Lesões, n | 770 | 1.286 | 1.967 | 1.459 | 772 | 3.142 | 1.036 |
| Diabéticos, % | 40 | 17 | 45 | 37 | 30 | 32 | 21 |
| SCA, % | 42 | 60 | 18 | 53 | 19 | 28 | 51 |
| DA, % | 46 | 40 | 49 | 50 | 41 | 41 | 42 |
| Bifurcação, % | 12 | 17 | 39 | 11 | ND | ND | 25 |
| Lesão B2/C, % | 69 | 74 | ND | 53 | ND | ND | 70 |
| Extensão da lesão, mm | 17,8 | 16,8 | 17,0 | 20,31 | 14,7 | 14,8 | 14,30 |
| DRV, mm | 3,0 | 2,56 | 2,58 | 2,87 | 2,77 | 2,75 | 2,66 |
| Sucesso do procedimento, % | 98 | 98 | 97,8 | 99 | ND | ND | 95,8 |
| Seguimento aos 12 meses, % | 100 | 100 | 98 | 98,9 | 97,9 | 98,3 | 99,7 |
| ECAM, % | 5,6 | 5 | 6,2 | 3,8 | 6 | 4,2 | 9 |
| Morte cardíaca, % | 1,3 | 1 | 1 | 0,3 | 0,8 | 0,4 | 1,4 |
| IAM, % | 3 | 3 | 3 | 1,4 | 2,8 | 1,9 | 4,6 |
| RLA, % | 2,2 | 2 | 4,3 | 2,4 | 3,4 | 2,5 | 1,4 |
| RVA, % | 2,8 | 2 | 6,9 | 3,1 | 6,1 | 3,9 | ND |
| TS (definitiva/provável), % | 0,6 | 0,7 | 0,4 | 0,4 | 1,1 | 0,3 | 1,2 |
SCA: síndrome coronária aguda; DA: artéria coronária descendente anterior; ND: não disponível; DRV: diâmetro de referência do vaso; ECAM: eventos cardíacos adversos maiores; IAM: infarto agudo do miocárdio; RLA: revascularização da lesão‐alvo; RVA: revascularização do vaso‐alvo; TS: trombose de stent.
No registro BRAVO, a taxa de ECAM aos 6 meses foi de 4,3%20; entretanto, observaram‐se sete novas ocorrências desse desfecho entre 6 e 12 meses, representando um pequeno incremento (da ordem de 1,3%) no período. Digno de nota é o fato de que a nova revascularização, devido à recorrência tardia da estenose ou à progressão da doença, foi o principal fator determinante em seis dos sete novos casos reportados. Na era da angioplastia com balão, o principal mecanismo de recorrência tardia parecia ser o remodelamento ou retração vascular, sendo que a reestenose angiográfica binária ocorreu em até 50% dos casos. Já os casos de recorrência pós‐stents metálicos têm sido associados, principalmente, à hiperplasia neointimal, com taxas variando entre 20 e 30%.4,5,24,25
Chamou a atenção, em ambas as situações, que o pico de incidência parece ocorrer em tempo semelhante, entre 3 e 6 meses.26 Todavia, com os SF, a formação de tecido neointimal é inibida de forma significativa – reestenose angiográfica binária usualmente < 10%, sendo que tal processo também é retardado, devido à atuação local do fármaco antiproliferativo.1,4–12,27 Logo, mesmo que improvável, podem ocorrer casos de recorrência numa fase mais tardia (> 6 meses), em comparação com os stents não farmacológicos (≤ 6 meses). Contudo, os preditores classicamente associados à reestenose pós‐ICP (diabetes, lesões longas, vasos de fino calibre, lesões complexas etc.) permanecem os mesmos.28,29
Curiosamente, além da hiperplasia neointimal, estudos recentes evidenciaram um novo mecanismo de recorrência pós‐stent, incluindo o processo de neoaterosclerose, o qual pode ocorrer mesmo em SF de segunda geração.30,31 Análises seriadas de angiografia coronária quantitativa nos estudos SPIRIT II e III demonstraram taxas relativamente baixas de reestenose angiográfica binária no segmento tratado com o stent XIENCE V® (3,4 a 4,7%, aos 6 e 8 meses, respectivamente), as quais estiveram associadas a taxas de RLA de 1,8% aos 6 meses (SPIRIT II) e 3,4% aos 12 meses (SPIRIT III).17,18 De maneira similar, as taxas de reestenose clínica no registro BRAVO foram 0,9% aos 6 meses e 2,2% aos 12 meses, a despeito da alta prevalência de diabetes, SCA e lesões complexas. Tais achados evidenciam a efetividade clínica dos SF de segunda geração, em especial do sistema liberador de everolimus, mesmo em populações de maior complexidade (tabela 5).
Apesar da marcante eficácia na redução de hiperplasia neointimal, reestenose e, consequentemente, necessidade de nova revascularização, demonstrada pelos SF de primeira geração vs. stents não farmacológicos,4,5 as preocupações relacionadas à segurança, particularmente nas fases tardia e muito tardia,3 acabaram por alavancar a pesquisa e o desenvolvimento de novos sistemas de SF, objetivando um melhor perfil nesse quesito (segurança). Uma série de estudos demonstrou, de forma bastante clara, o caráter multifatorial associado à gênese da trombose de stent pós‐implante de SF.3,32,33 Destacam‐se, entre outras, as características associadas a: comorbidades e apresentação clínica (diabetes, insuficiência renal, SCA etc.); morfologia da lesão e procedimento (lesões complexas, bifurcação, trombo, ICP multiarterial, subexpansão do stent, dissecção etc.); interrupção da TAD (principalmente nos primeiros 6 meses); e tipo do stent.
Mesmo assim, à luz das evidências atuais, não está completamente determinado até que ponto (ou em que grau) uma ou outra dessas características, ou a combinação delas, pode influenciar e/ou predizer a ocorrência da trombose de stent. Em relação aos SF, a espessura das hastes, a biocompatibilidade dos sistemas carreadores e o mecanismo de ação do fármaco antiproliferativo têm sido considerados componentes determinantes para o desempenho e o perfil de segurança, tanto imediata quanto tardia/muito tardia. Dentre os mais utilizados SF de segunda geração, as plataformas metálicas de cromo‐cobalto e platina‐cobalto de espessura fina (74 a 91μm) são comumente encontradas.6,9,10,13 Já os sistemas carreadores incorporam agentes “não trombogênicos” ou polímeros biodegradáveis, com melhor perfil de biocompatibilidade comparado aos polímeros duráveis usados nos SF mais antigos.6–13,34
Por último, os fármacos da família “limus” prevalecem atualmente.6–13 Três estudos randomizados comparando os stents XIENCE V® vs. Taxus® liberador de paclitaxel (Boston Scientific, Natick, Estados Unidos) mostraram menores taxas de ECAM e trombose de stent com o primeiro no seguimento de 12 meses.14,17,18 Outras três análises randomizadas demonstraram não inferioridade do SF liberador de everolimus vs. stent CYPHER® liberador de sirolimus (Cordis Corp., Warren, Estados Unidos) nos desfechos clínicos no seguimento de 12 ou 18 meses;15,16,35 entretanto, a trombose de stent muito tardia (> 1 ano) parece ser menor com o sistema liberador de everolimus.3
As taxas de trombose de stent reportadas até 1 ano com o stent XIENCE V® variaram entre 0,4 a 1,2%. Em nossa população, essa taxa (definitiva/provável) foi de 0,6%, a despeito da alta prevalência de diabéticos (40%), SCA (42%) e lesões complexas (69% tipo B2/C). Considerando‐se apenas a trombose de stent (definitiva/provável) tardia (entre 1 e 12 meses), a taxa foi extremamente baixa (0,2%), representando apenas uma ocorrência.
Digno de nota foi o fato de a maioria dos pacientes que tiveram qualquer trombose de stent (n = 5) apresentar múltiplas comorbidades clínicas e SCA no procedimento índice, embora estivesse em uso de TAD no momento do evento trombótico. Ainda assim, a avaliação da incidência de eventos no seguimento clínico muito tardio (ainda não reportada) é necessária para se conhecer a sustentabilidade desses resultados.
ConclusõesResultados do seguimento clínico tardio do registro brasileiro multicêntrico BRAVO demonstraram segurança e eficácia sustentadas do stent farmacológico liberador de everolimus XIENCE V® no tratamento de lesões coronárias complexas, em pacientes da prática diária minimamente selecionados, incluindo taxas relativamente baixas de trombose de stent (< 1%) e revascularização da lesão‐alvo (2,2%) ao final de 12 meses.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Fazem parte do Estudo BRAVO os seguintes investigadores: Alexandre Abizaid − Instituto Dante Pazzanese de Cardiologia, São Paulo (SP), Brasil; Amanda G. M. R. Sousa − Instituto Dante Pazzanese de Cardiologia, São Paulo (SP), Brasil; Andrea S. Abizaid − Instituto Dante Pazzanese de Cardiologia, São Paulo (SP), Brasil; Antônio C. N. Ferreira − Hospital Mater Dei S.A., Belo Horizonte, MG, Brasil; Ari Mandil − Hospital Lifecenter, Belo Horizonte, MG, Brasil; César R. Medeiros − Hospital Rede D’Or, Unidades Copa, Barra e Quinta D’Or, Rio de Janeiro, RJ, Brasil; Costantino R. Costantini − Hospital Cardiológico Costantini, Curitiba, PR, Brasil; Décio Salvadori − Hospital Beneficência Portuguesa, São Paulo (SP), Brasil; Erlon O. de Abreu‐Silva – Cardiovascular Research Center, São Paulo (SP), Brasil; Flávio R. A. Oliveira − Maximagem Diagnóstico por Imagem Ltda., Recife, PE, Brasil; Gilberto Nunes − Santa Casa de Misericórdia, Porto Alegre, RS, Brasil; Hélio Castello Jr. − Hospital Bandeirantes, São Paulo (SP), Brasil; Heloísa M. S. Guimarães − Centro Integrado de Medicina Intervencionista, Belém, PA, Brasil; José Airton Arruda − CIAS Unimed, Vitória, ES, Brasil; José Armando Mangione − Hospital Beneficência Portuguesa, São Paulo (SP), Brasil; José Eduardo Sousa − Instituto Dante Pazzanese de Cardiologia, São Paulo (SP), Brasil; Juliana P. de Castro − Cardiovascular Research Center, São Paulo (SP), Brasil; Luiz
A. Mattos − Instituto Dante Pazzanese de Cardiologia, São Paulo (SP), Brasil; Marco Perin − Hospital Israelita Albert Einstein, São Paulo (SP), Brasil; Marco V. Wainstein − Hospital Moinhos de Vento, Porto Alegre, RS, Brasil; Marcos Marino − Hospital Madre Teresa, Nova Lima, MG, Brasil; Maurício L. Prudente − Encore Cardiologia e Radiologia Intervencionista, Goiânia, GO, Brasil; Newton Stadler S. Filho − Instituto de Neurologia de Curitiba, Curitiba, PR, Brasil; Norberto T. Duda − Hospital São Vicente de Paulo, Passo Fundo, RS, Brasil; Paulo Caramori − Hospital São Lucas da Pontifícia Universidade Católica de Porto Alegre, Porto Alegre, RS, Brasil; Ricardo A. Costa − Instituto Dante Pazzanese de Cardiologia, São Paulo (SP), Brasil; Roberto Botelho − Instituto do Coração do Triângulo Mineiro, Uberlândia, MG, Brasil; Rodrigo F. Cardoso − Hemocor, Rio de Janeiro, RJ, Brasil; Rogério Sarmento‐Leite − Instituto de Cardiologia/Fundação Universitária de Cardiologia, Porto Alegre, RS, Brasil.