Em pacientes considerados inoperáveis ou de alto risco para substituição cirúrgica da válvula aórtica, o implante transcateter da válvula aórtica (TAVI) foi estabelecido como o tratamento de escolha.1
A obstrução coronária após o TAVI, mesmo incomum, é uma complicação aguda potencialmente fatal. A incidência dessa complicação catastrófica é descrita em menos de 1% da maioria dos registros atuais.2,3 A taxa de mortalidade aguda e tardia pós‐obstrução coronária é muito alta. Após intervenção coronária percutânea (ICP) bem‐sucedida, ela é de 22%, e após a cirurgia de revascularização do miocárdio bem‐sucedida, é de 50%, enquanto a ICP sem sucesso está correlacionada com 100% de mortalidade. Em geral, a mortalidade em 30 dias fica próxima de 40%.3
A apresentação clínica inclui hipotensão refratária grave e profunda ou parada cardíaca imediata, alterações eletrocardiográficas, tais como elevação do segmento ST, depressão do segmento ST e arritmias ventriculares com colapso hemodinâmico, e anormalidades da motilidade segmentar à ecocardiografia. Infelizmente, apenas a presença de hipotensão sem alterações eletrocardiográficas também não é incomum. O fato de que, em algumas ocasiões, o fluxo coronário não está completamente obstruído pode explicar as apresentações iniciais menos graves.
Tem sido demonstrado que a obstrução coronária pós‐TAVI está relacionada na maior parte dos casos com o deslocamento de um folheto nativo volumoso e calcificado em direção a/sobre um óstio coronário durante o implante da válvula.4 Em teoria, a complicação também pode ser consequência de um implante elevado da válvula, com o manguito de vedação sendo colocado contra o óstio coronariano. Um cálculo desalojado da valva nativa poderia migrar e obstruir uma artéria coronária, mesmo horas após o procedimento, como recentemente relatado.5
O risco de obstrução coronária é difícil de avaliar, uma vez que não há uma medida única a ser considerada, mas um conjunto de fatores clínicos, anatômicos e do método que desempenham um papel diferente em cada procedimento. Um registro recente forneceu uma visão mais aprofundada das características basais, identificando idade avançada, sexo feminino, válvula cirúrgica prévia e valor mais alto do EuroSCORE como preditores clínicos, ao mostrar que o uso de válvula expansível por balão dobra o risco como fator de procedimento.3 O fato de que os requisitos anatômicos para a válvula autoexpansível eram muito mais conservadores do que os requisitos para a válvula expansível por balão, resultou em um viés de seleção que pode, ao menos parcialmente, explicar essa diferença. Por outro lado, as válvulas autoexpansíveis têm seus próprios desafios: é mais difícil realizar a proteção coronária com um cateter‐guia preso por trás das hastes metálicas (nível da aorta ascendente) desse tipo de válvula. Além disso, o acesso coronário através da gaiola de metal de uma válvula autoexpansível pode ser particularmente difícil ou impossível. Um implante duplicado de uma válvula autoexpansível pode estender a área das hastes do stent recoberto até o nível mais alto em uma configuração particularmente desfavorável.
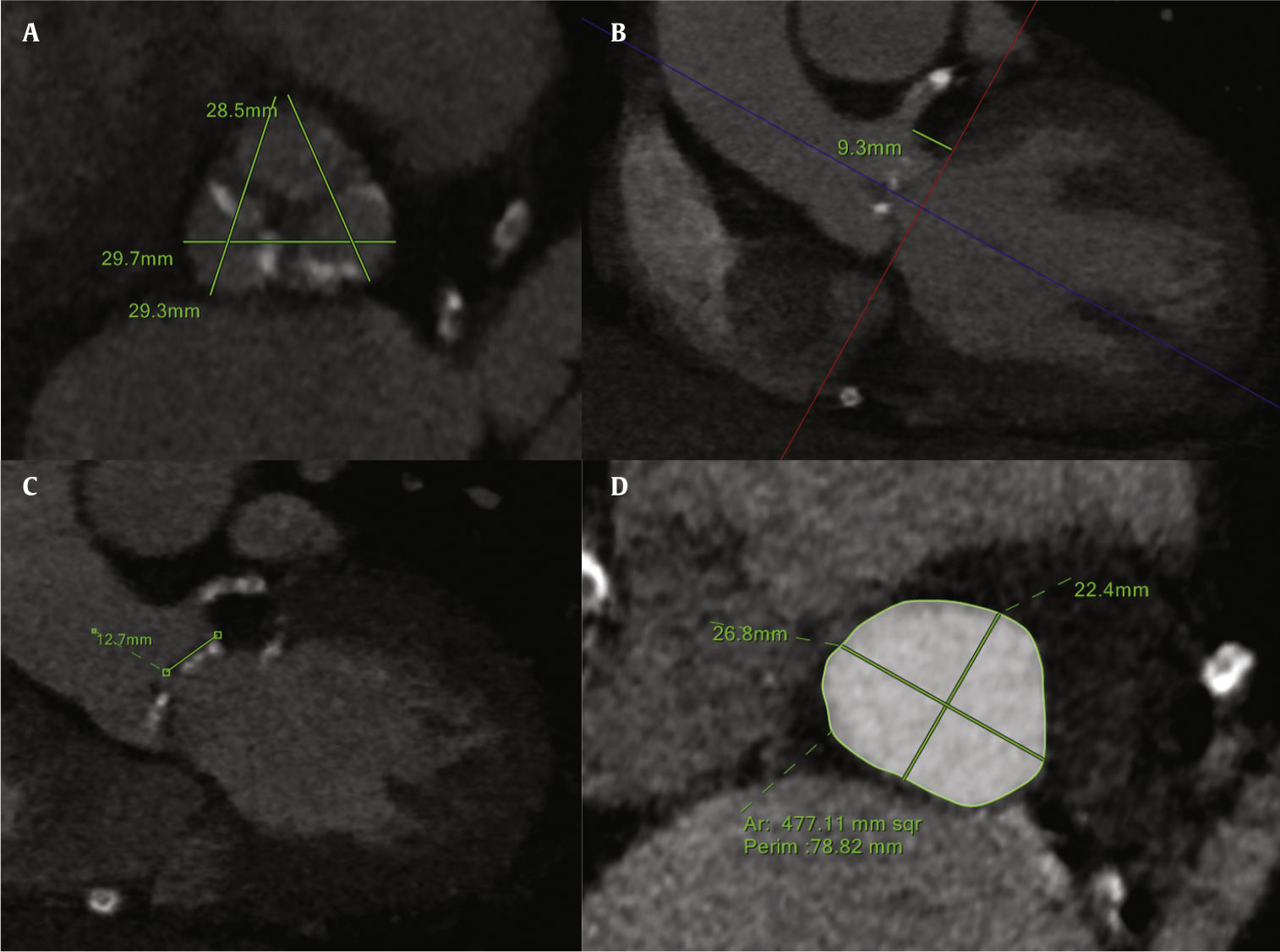
Os principais preditores anatômicos de obstrução coronária são a altura coronária, as dimensões do seio coronário e o tamanho da raiz da aorta (fig. 1). A mensuração da altura coronária perpendicular ao plano anular é mais conservadora e demonstrou ser mais reprodutível. No entanto, ela também pode ser medida da inserção do folheto até a borda inferior do óstios coronários, de forma oblíqua. O tronco da coronária esquerda (TCE; 89%) é mais comumente afetado em comparação com a artéria coronária direita (CD; 4%), ou obstrução bilateral (7%),3 mais provavelmente devido ao nível geralmente mais elevado da origem do óstio da CD. O ponto de corte para a altura do TCE é<12mm (média de 11mm), enquanto para a CD é desconhecido, dado o baixo número de pacientes relatados. Uma raiz de aorta estreita, semelhante a um tubo, juntamente seios de Valsalva rasos, também está fortemente associada à obstrução coronária. O ponto de corte para a largura dos seios de Valsalva é<30mm. É fundamental ressaltar que a medida dos seios de Valsalva deve ser tomada em relação ao anel, uma vez que a diferença entre eles vai representar o espaço onde o folheto será acomodado após o implante da válvula. Uma razão seios de Valsalva/anel menor que 1,26±0,04 mostrou estar altamente correlacionada com essa complicação (razão de chances ‐ RC=20; intervalo de confiança de 95% ‐ IC95%: 1,28‐333).3,6
Análise por tomografia computadorizada com multidetectores do complexo valvar aórtico. (A) Dimensões dos seios de Valsalva. (B) Altura do tronco da coronária esquerda, medida perpendicularmente a partir do anel aórtico. (C) Comprimento do folheto esquerdo. (D) Medidas do anel aórtico (área, perímetro, diâmetros máximo e mínimo).
Outros preditores mais fracos reconhecidos na análise por tomografia computadorizada são o grau de calcificação da válvula, a presença de nódulos calcificados excêntricos volumosos em relação aos óstios coronários e o comprimento do folheto.6 O comprimento do folheto deve ser medido em corte coronal oblíquo, da inserção até a ponta do folheto. Seu valor absoluto é inútil, a menos que seja associado à altura coronária. De fato, foi postulado que o risco de obstrução aumenta quando a razão altura do óstio do TCE/comprimento do folheto cai abaixo de 1/1.
Somente a integração desses fatores, juntamente das considerações pré‐procedimento, tais como o sobre/subdimensionamento adequado da válvula, pode ajudar na obtenção de um resultado confiável e previsível, muitas vezes aceitando pequenos vazamentos paravalvulares a fim de evitar complicações catastróficas, como a obstrução coronária e ruptura anelar.
Nesses casos, devem‐se instituir medidas preventivas somente se a avaliação final do risco/benefício após a exibição de imagens 3D for favorável ao TAVI, ao invés da substituição cirúrgica da válvula aórtica/tratamento médico.
Após identificar um paciente de alto risco, a equipe intervencionista deve se preparar para proteger a coronária em risco. Esses pacientes devem ser tratados em uma sala cirúrgica híbrida totalmente equipada, sob anestesia geral e com a orientação de um especialista em ecografia em 3D.
Em casos duvidosos, nos quais a tomografia computadorizada e a ecografia em 3D apresentam correlação fraca ou o risco é considerado moderado, uma aortografia em projeção cranial/oblíqua anterior esquerda durante a valvoplastia aórtica com balão pode simular o resultado final após o implante da válvula.7
Nessa edição da Revista Brasileira de Cardiologia Invasiva, Furini et al.8 apresentam de forma elegante o artigo “Oclusão coronária após TAVI: relatório de estratégia de segurança”. Os autores descrevem em detalhe as medidas tomadas a fim de evitar obstrução coronária em um caso de alto risco. É digno de nota o fato de o grupo ter realizado uma aortografia durante a valvoplastia aórtica com balão para avaliar a patência coronária. Essa técnica é bem conhecida e parece algo útil, especialmente se confirmar a ausência de fluxo coronário com a insuflação do balão no local da válvula. No entanto, não está claro qual é o melhor passo seguinte em casos com coronárias patentes durante a insuflação do balão.
Vários fatores podem impedir a técnica de simular adequadamente o implante real da válvula. Em primeiro lugar, a aortografia precisa ser feita apenas quando o balão estiver completamente expandido. Além disso, o tamanho nominal do balão deve ser, teoricamente, igual ao tamanho exterior final da válvula implantada. Essa última afirmação é obviamente muito difícil de ser concretizada, devido à disponibilidade limitada de tamanho do balão e ao fato de que o sobre ou subdimensionamento finais não são fáceis de prever, especialmente em casos que necessitam de pós‐dilatação devido ao vazamento paravalvar (particularmente, isso raramente deveria ser feito se uma possível obstrução coronária for considerada). Por razões de segurança, haverá, obviamente, uma tendência geral para usar balões para valvoplastia menores do que o necessário.
Neste relato de caso, apesar de não haver nenhum comprometimento coronário na aortografia, ainda assim os operadores decidiram proteger a CD com um guia e um stent.
É importante ressaltar o fato de que nessa população frágil, a minimização do uso de contraste e da manipulação da válvula pode fazer a diferença em termos de nefropatia induzida por contraste e acidente vascular cerebral. Além disso, apenas a valvoplastia aórtica com balão foi responsável por cerca de 10% das oclusões coronárias durante o TAVI em um registro recente,3 e vários grupos têm evitado a etapa de valvoplastia antes do TAVI. Assim, o uso do guia na coronária em risco também pode ser considerado antes desta manobra.
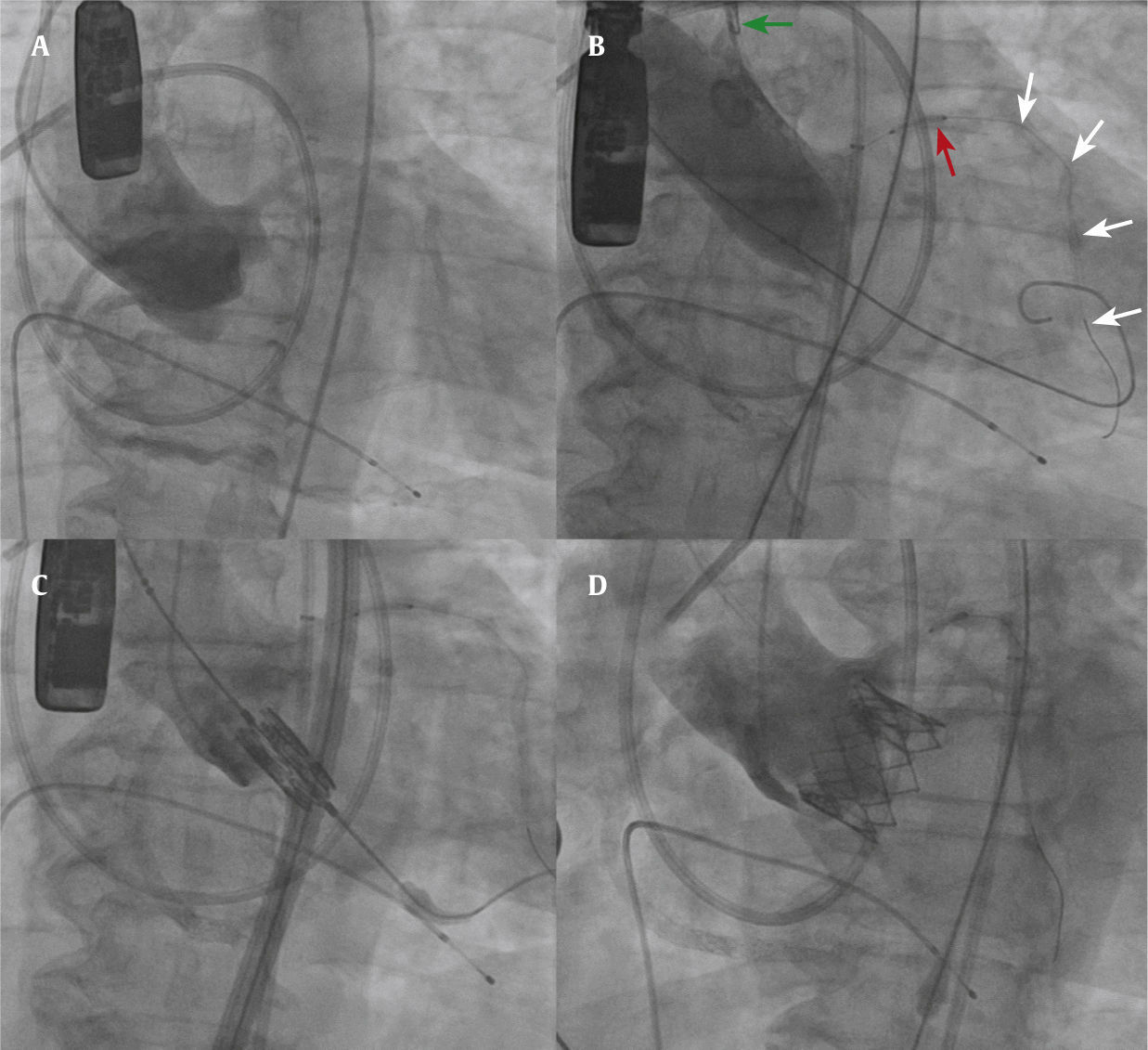
Devido à dificuldade em implantar um stent uma vez que a obstrução coronária esteja estabelecida, sugerimos a proteção da coronária em risco com um guia e um stent (fig. 2). Como descrito por Furini et al.,8 depois de registrar a ausência do fluxo ou o fluxo prejudicado na artéria coronária, puxar o stent e implantá‐lo no óstio seria muito mais fácil do que tentar fazê‐lo avançar contra um folheto calcificado obstruído. Além disso, acredita‐se que a própria plataforma do stent pode contribuir para evitar a oclusão coronária, impedindo que o tecido da válvula se desloque sobre o óstio. Desse modo, após o implante da válvula, se nenhuma intervenção for necessária, o stent deve ser removido com cuidado e uma nova avaliação deve ser feita antes de remover o guia da coronária.
Imagens por fluoroscopia de um caso de proteção coronariana. (A) Aortografia em corte coplanar demonstrando as três cúspides alinhadas da valva aórtica e a origem baixa do tronco da coronária esquerda. (B) Valvoplastia aórtica com balão. O cateter guia é puxado para dentro da aorta ascendente (seta verde). Observe o stent não implantado (seta vermelha) e o guia coronariano (setas brancas). (C) Válvula balão‐expansível em posição antes do implante. (D) Aortografia após o implante da válvula, demonstrando uma boa posição, sem evidência de obstrução coronariana.
É digno de nota o fato de que alguns grupos começaram a proteger as coronárias com um balão desinflado. Infelizmente, em alguns casos, após a dilatação dos óstios pelo balão, o recuo imediato do folheto “esmagado” entre as hastes das válvulas e os óstios coronários impede o avanço dos stents. É interessante observar que o grupo da Mayo Clinic descreveu recentemente o uso de insuflação temporária do balão no óstio do TCE durante a valvoplastia e o TAVI, a fim de evitar a embolização coronária, depois de ter identificado, por ecocardiografia transtorácica 3D, detritos móveis na cúspide da coronária esquerda.9 Essa deve certamente ser considerada uma medida excepcional, impulsionada por medidas específicas altamente individualizadas de baixa altura do óstio coronário, de seios de Valsalva e de diâmetros de raiz estreitos e de calcificação excêntrica desfavoravelmente situada.
A fim de evitar a necessidade de um acesso arterial extra para proteção coronária, pode‐se considerar a utilização de um cateter‐guia 6 F com orifícios laterais que irão substituir o cateter tipo pigtail para a aortografia. A economia de acesso arterial pode ser crítica nos próximos anos, se os ensaios clínicos em curso favorecerem o uso de dispositivos de proteção embólica (que vão exigir um local de acesso arterial dedicado).
Após o implante da válvula, o ecocardiografista treinado deve assegurar a função ventricular esquerda global adequada, a presença de fluxo laminar nas artérias coronárias e a ausência de novas alterações da motilidade segmentar. A identificação de fluxo turbulento, juntamente do cenário clínico descrito anteriormente, irá confirmar a complicação em curso e deverá alertar o intervencionista para realizar uma angioplastia em regime de urgência para restabelecer o fluxo coronário.
Considerando que a compressão do stent após o implante não é rara, a identificação de fluxo laminar coronário usando ecocardiografia transesofágica 3D, ou a avaliação de patência do stent com o ultrassom intravascular ou angiografia deve ser cuidadosamente realizada após angioplastia coronária/stent. Não raro, um segundo stent precisa ser implantado para obter suficiente força radial e melhorar a área mínima do lúmen. É importante ressaltar que o stent deve projetar‐se para fora do verdadeiro óstio, criando um túnel através dos folhetos comprimidos em direção à aorta. Uma técnica de dilatação em forma de coroa (“flaring”) proximal do stent para completar a intervenção pode facilitar uma nova intervenção, se necessária, no futuro.
O tratamento dessa complicação exige uma ação imediata, a fim de restabelecer a perfusão coronária. Mesmo quando a artéria coronária não foi previamente protegida, cerca de 80% dos pacientes podem ser resgatados por meio de ICP bem‐sucedida. No entanto, a maioria deles vai necessitar de suporte hemodinâmico ou conversão para cirurgia cardíaca aberta. Em algumas situações o rápido início da circulação extracorpórea temporária pode ser útil se a cirurgia de revascularização puder resolver o problema.
Tem sido relatado que um dispositivo retrógrado de suporte ventricular esquerdo como o Impella® pode ser benéfico na presença de instabilidade hemodinâmica devido à obstrução coronária.10 Esse dispositivo surge como uma alternativa rápida para circulação extracorpórea para o tratamento de choque durante o TAVI, devido ao fato de um grande acesso arterial já estar disponível. Por outro lado, essa opção pode ser limitada pela dificuldade de recruzar a válvula recém‐implantada (isso é especialmente verdadeiro se um duplo implante autoexpansível foi utilizado); portanto, manter o guia no ventrículo esquerdo durante a avaliação ecocardiográfica pós‐TAVI de uma possível obstrução coronária pode ser importante. Teoricamente, um balão intra‐aórtico seria de pouca ajuda se a coronária estiver bloqueada, mas seu uso pode ser considerado se houver oclusão parcial.
O declínio em complicações catastróficas após TAVI pode ser explicado pelo avanço das próteses valvulares, a diminuição do diâmetro dos introdutores, a evolução dos métodos de imagem, e experiência dos operadores. Além disso, os avanços na triagem pré‐procedimento cuidadosa e o planejamento utilizando imagens em 3D, como a tomografia computadorizada com multidetectores e a ecocardiografia, contribuíram enormemente para a identificação de pacientes de alto risco.
A conscientização das características de alto risco para obstrução coronária, as medidas profiláticas e o reconhecimento e manejo imediatos dessa complicação são fundamentais para um TAVI bem‐sucedido. Uma equipe cardíaca bem consolidada e com boa atuação, composta não apenas por cirurgiões cardíacos e cardiologistas intervencionistas, mas também por especialistas em imagens em tomografia computadorizada cardiovascular e ecocardiografistas intervencionistas e anestesiologistas cardíacos, bem como uma equipe técnica e de enfermagem totalmente treinada tem um papel crítico no resultado final desse procedimento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.