O stent MGuard™, revestido por malha polimérica microscópica, tem a finalidade de reduzir a embolização distal de fragmentos durante a intervenção coronária percutânea (ICP) em enxertos de veia safena (EVS). Avaliamos os desfechos clínicos precoces e tardios de pacientes submetidos à ICP de EVS com stents MGuard™ vs. stents farmacológicos (SF).
MétodosEstudo observacional, retrospectivo, realizado em dois centros terciários, envolvendo uma coorte de pacientes com lesões em EVS, tratados de forma eletiva ou de emergência com stents MGuard™ ou SF.
ResultadosForam incluídos 271 pacientes, sendo 220 tratados com SF. O Grupo MGuard™ apresentou maior proporção de mulheres (25,5% vs. 10,5%; p=0,01), com média de idades de 65,0 ± 13,9 anos vs. 69,0 ± 9,6 anos (p = 0,06). O Grupo SF utilizou com maior frequência filtro de proteção distal (5,8% vs. 10,0%; p = 0,001). Sucesso angiográfico foi obtido na maioria dos casos (96,2% vs. 98,0%; p = 0,22). O Grupo MGuard™ teve menores taxas de eventos cardiovasculares adversos maiores (ECAM) na fase hospitalar que o Grupo SF (1,9% vs. 13,6%; p = 0,01) devido exclusivamente à menor incidência de infarto periprocedimento. Entretanto, a taxa de ECAM em 1 ano foi maior no grupo MGuard™ (14,3% vs. 4,4%; p = 0,01) à custa de maior taxa de revascularização da lesão alvo (7,1% vs. 1,3%; p = 0,048).
ConclusõesA utilização de stent MGuard™ resultou em redução de eventos na fase hospitalar, porém, no longo prazo, os SF foram superiores em reduzir desfechos maiores, sobretudo a necessidade de revascularização da lesão alvo.
The MGuard™ stent, which has a microscopic polymer mesh coating, is intended to reduce the distal embolization of fragments during percutaneous coronary intervention (PCI) in saphenous vein grafts (SVG). This study evaluated the early and late clinical outcomes of patients undergoing PCI in SVG with MGuard™ stents vs. drug‐eluting stents (DES).
MethodsObservational, retrospective study conducted at two tertiary centers, involving a cohort of patients with SVG lesions submitted to elective or emergency treatment with MGuard™ stents or DES.
ResultsA total of 271 patients were included, of whom 220 were treated with DES. The MGuard™ group had a higher proportion of women (25.5% vs. 10.5%; p = 0.01), with a mean age of 65.0 ± 13.9 years vs. 69.0 ± 9.6 years (p = 0.06). The DES group more frequently used distal protection filter (5.8% vs. 10.0%; p = 0.001). Angiographic success was attained in most cases (96.2% vs. 98.0%; p = 0.22). The MGuard™ group had lower rates of early major adverse cardiovascular events (MACE) than the DES group (1.9% vs. 13.6%; p = 0.01), due solely to the lower incidence of periprocedural infarction. However, the MACE rate at 1 year was higher in the MGuard™ group (14.3% vs. 4.4%; p = 0.01) at the expense of a higher rate of target lesion revascularization (7.1% vs. 1.3%; p = 0.048).
ConclusionsThe use of the MGuard™ stent resulted in a reduction of events during hospitalization; however, in the long term the DES were superior in reducing major outcomes, mainly the need for target lesion revascularization.
O tratamento intervencionista de enxertos de veia safena (EVS) permanece desafiador, mesmo nos dias atuais da Cardiologia Intervencionista, devido a maiores taxas de complicações agudas e de desfechos clínicos tardios, em comparação à intervenção em leitos coronários naturais.1
A intervenção coronária percutânea (ICP) neste cenário tem desafios técnicos singulares, devido à presença de material friável nas lesões, propensos à embolização distal durante o procedimento, acarretando maior risco de complicações, como o fenômeno no reflow e o infarto agudo do miocárdio (IAM) periprocedimento.2,3
Embora os stents farmacológicos (SF) tenham promovido redução das taxas de reestenose em virtualmente todos os cenários clínicos e angiográficos, impulsionando os resultados da ICP, ainda persistem dúvidas sobre a eficácia e a segurança tardia desses dispositivos quando utilizados no tratamento de lesões em EVS.4,5
Nesse cenário, vem ganhando destaque o uso do stent MGuard™ (InspireMD, Tel‐Aviv, Israel), revestido por uma malha microscópica ultrafina, com o objetivo de reduzir a embolização distal de fragmentos e, consequentemente, as taxas de complicações agudas e tardias pós‐ICP.6–8
Na presente análise, objetivamos avaliar os desfechos clínicos precoces e tardios da ICP com uso de stent MGuard™ vs. SF em EVS.
MétodosDesenho do estudo e população‐alvoTrata‐se de um estudo observacional, retrospectivo, realizado em dois centros terciários, envolvendo uma coorte de pacientes com lesões em EVS, tratados com stent MGuard™ ou com SF.
A população desta análise incluiu pacientes submetidos à ICP de EVS de forma eletiva ou de emergência, na rotina dos Serviços de Cardiologia Invasiva dos centros envolvidos, entre 2007 e 2012. Os pacientes do estudo foram selecionados no banco de dados local, e a coleta de dados foi realizada por meio da revisão de prontuários, relatórios médicos e angiografias, bem como por contato telefônico.
Dispositivos do estudoO stent MGuard™ é uma plataforma metálica de aço inoxidável 316L recortada a laser, com espessura da haste de 80 a 95 uM, recoberta por uma dupla rede de fibras microscópicas de tereftalato de polietileno, as quais se encontram aderidas às hastes metálicas. Durante o implante do stent, a rede se estira e desliza sobre as hastes do stent em expansão, criando poros de ≤ 200 mícrons de diâmetro. Os stents MGuard™ estavam disponíveis nos diâmetros de 2,5 a 4,0mm e nas extensões de 12 a 39mm. Detalhes sobre este stent já foram publicados previamente.3,6–8
No grupo dos SF, foram utilizados stents eluidores de fármacos diversos, tanto de primeira como de segunda geração, com destaque para os stents com eluição de sirolimus, zotarolimus, everolimus e paclitaxel.
ProcedimentoDe uma forma geral, as intervenções foram realizadas de acordo com as diretrizes atuais.9 A realização de pré e/ou pós‐dilatação ficou a critério do operador, assim como o uso de filtro de proteção distal e inibidores da glicoproteína IIb/IIIa.
A terapia antiplaquetária dupla pré‐procedimento era constituída por aspirina (100 a 300mg) e dose de ataque de clopidogrel (300 a 600mg). Após a intervenção, aspirina 100mg ao dia foi prescrita indefinidamente e clopidogrel 75mg ao dia foi mantido por 12 meses. Durante a ICP, a terapia antitrombínica consistiu em heparina não fracionada na dose de 100 UI/kg (ou 70 UI/kg, em caso do uso de inibidor da glicoproteína IIb/IIIa), objetivando‐se alcançar tempo de coagulação ativado > 250 segundos (ou entre 200 e 250 segundos, em caso de uso de inibidor da glicoproteína IIb/IIIa).
Análise angiográficaAs análises angiográficas qualitativas e quantitativas foram realizadas offline por um operador experiente, seguindo protocolo predefinido. De maneira geral, as cineangiografias pré e pós‐procedimento foram realizadas após a administração intracoronária de nitroglicerina (50 a 200μg), em pelo menos duas projeções ortogonais correspondentes, sendo armazenadas em formato digital DICOM.
O fluxo coronário foi determinado de acordo com os critérios do estudo Thrombolysis in Myocardial Infarction (TIMI).
A análise de angiografia coronária quantitativa (ACQ) foi realizada utilizando‐se um programa computadorizado dedicado e com detecção semiautomática de bordas do lúmen (QAngio XA, Medis Medical Imaging System, Leiden, Holanda).
Seguimento clínico e definiçõesO objetivo da atual análise foi avaliar a taxa de eventos cardiovasculares adversos maiores (ECAM), definida como a ocorrência de óbito, IAM não fatal e revascularização da lesão alvo (RLA), tanto na fase hospitalar, quanto na fase tardia (1 ano).
IAM não fatal foi definido como elevação maior que três vezes acima do valor de referência laboratorial dos níveis da isoenzima MB da creatinoquinase (CK‐MB). Revascularização da lesão alvo foi definida como nova revascularização por ICP ou enxerto cirúrgico do segmento previamente tratado. Sucesso angiográfico foi definido como o implante bem‐sucedido do stent MGuard™ na lesão alvo.
Análise estatísticaAs variáveis contínuas foram apresentadas como média ± desvio padrão e foram comparadas pelo teste t de Student. As variáveis categóricas foram reportadas como números absolutos e porcentagens, e comparadas pelo teste qui quadrado de Pearson ou teste exato de Fisher, quando apropriado. Considerou‐se estatisticamente significante p < 0,05. As análises foram realizadas com o auxílio do programa estatístico Statistical Package for Social Science (SPSS), versão 16.0 (SPSS Inc., Chicago, EUA).
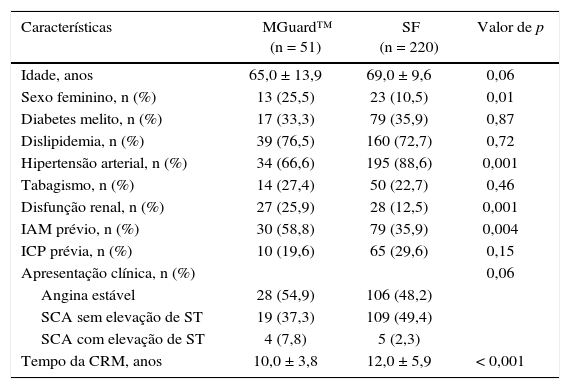
ResultadosForam analisados 271 pacientes, sendo 220 no Grupo SF. A média de idade dos pacientes foi de 65,0 ± 13,9 anos no grupo MGuard™ e 69,0 ± 9,6 anos no Grupo SF (p = 0,06). O grupo MGuard™ apresentou maior proporção de pacientes do sexo feminino (25,5% vs. 10,5%; p = 0,01), IAM prévio (58,8% vs. 35,9%; p = 0,003) e disfunção renal (25,9% vs. 12,5%; p = 0,001) e menor proporção de hipertensos (66,6% vs. 88,6%; p = 0,001). O tempo desde a realização da cirurgia de revascularização miocárdica foi menor no grupo MGuard™ (10,0 ± 3,8 anos vs. 12,0 ± 5,9 anos; p < 0,001). As características clínicas dos pacientes estão apresentadas na tabela 1.
Características clínicas basais
| Características | MGuard™ (n = 51) | SF (n = 220) | Valor de p |
|---|---|---|---|
| Idade, anos | 65,0 ± 13,9 | 69,0 ± 9,6 | 0,06 |
| Sexo feminino, n (%) | 13 (25,5) | 23 (10,5) | 0,01 |
| Diabetes melito, n (%) | 17 (33,3) | 79 (35,9) | 0,87 |
| Dislipidemia, n (%) | 39 (76,5) | 160 (72,7) | 0,72 |
| Hipertensão arterial, n (%) | 34 (66,6) | 195 (88,6) | 0,001 |
| Tabagismo, n (%) | 14 (27,4) | 50 (22,7) | 0,46 |
| Disfunção renal, n (%) | 27 (25,9) | 28 (12,5) | 0,001 |
| IAM prévio, n (%) | 30 (58,8) | 79 (35,9) | 0,004 |
| ICP prévia, n (%) | 10 (19,6) | 65 (29,6) | 0,15 |
| Apresentação clínica, n (%) | 0,06 | ||
| Angina estável | 28 (54,9) | 106 (48,2) | |
| SCA sem elevação de ST | 19 (37,3) | 109 (49,4) | |
| SCA com elevação de ST | 4 (7,8) | 5 (2,3) | |
| Tempo da CRM, anos | 10,0 ± 3,8 | 12,0 ± 5,9 | < 0,001 |
SF: stent farmacológico; IAM: infarto agudo do miocárdio; ICP: intervenção coronária percutânea; SCA: síndrome coronária aguda; CRM: cirurgia de revascularização miocárdica.
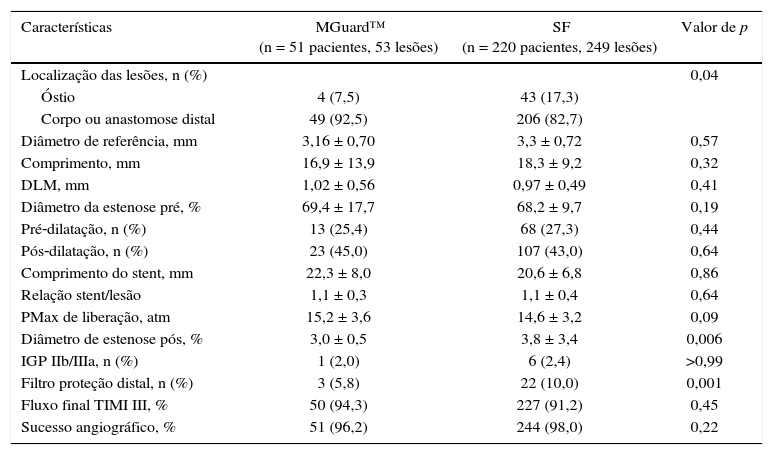
As características angiográficas e do procedimento estão apresentadas na tabela 2. A maior parte das lesões tratadas estava localizada no corpo ou anastomose distal do enxerto, em especial no grupo MGuard™. Diâmetro luminal mínimo, comprimento da lesão e grau de estenose foram similares entre os grupos. O Grupo SF utilizou com maior frequência filtro de proteção distal quando comparado ao Grupo MGuard™ (5,8% vs. 10,0%; p = 0,001), mas a utilização de inibidores da glicoproteína IIb/IIIa não mostrou diferença entre os grupos (2,0% vs. 2,7%; p > 0,99). Sucesso angiográfico foi obtido na maioria dos casos, em ambos os grupos (96,2% vs. 98%, p = 0,22).
Características angiográficas e do procedimento
| Características | MGuard™ (n = 51 pacientes, 53 lesões) | SF (n = 220 pacientes, 249 lesões) | Valor de p |
|---|---|---|---|
| Localização das lesões, n (%) | 0,04 | ||
| Óstio | 4 (7,5) | 43 (17,3) | |
| Corpo ou anastomose distal | 49 (92,5) | 206 (82,7) | |
| Diâmetro de referência, mm | 3,16 ± 0,70 | 3,3 ± 0,72 | 0,57 |
| Comprimento, mm | 16,9 ± 13,9 | 18,3 ± 9,2 | 0,32 |
| DLM, mm | 1,02 ± 0,56 | 0,97 ± 0,49 | 0,41 |
| Diâmetro da estenose pré, % | 69,4 ± 17,7 | 68,2 ± 9,7 | 0,19 |
| Pré‐dilatação, n (%) | 13 (25,4) | 68 (27,3) | 0,44 |
| Pós‐dilatação, n (%) | 23 (45,0) | 107 (43,0) | 0,64 |
| Comprimento do stent, mm | 22,3 ± 8,0 | 20,6 ± 6,8 | 0,86 |
| Relação stent/lesão | 1,1 ± 0,3 | 1,1 ± 0,4 | 0,64 |
| PMax de liberação, atm | 15,2 ± 3,6 | 14,6 ± 3,2 | 0,09 |
| Diâmetro de estenose pós, % | 3,0 ± 0,5 | 3,8 ± 3,4 | 0,006 |
| IGP IIb/IIIa, n (%) | 1 (2,0) | 6 (2,4) | >0,99 |
| Filtro proteção distal, n (%) | 3 (5,8) | 22 (10,0) | 0,001 |
| Fluxo final TIMI III, % | 50 (94,3) | 227 (91,2) | 0,45 |
| Sucesso angiográfico, % | 51 (96,2) | 244 (98,0) | 0,22 |
SF: stent farmacológico; DLM: diâmetro luminal mínimo; PMax: pressão máxima; IGP IIb/IIIa: inibidores da glicoproteína IIb/IIIa; TIMI: Thrombolysis in Myocardial Infarction.
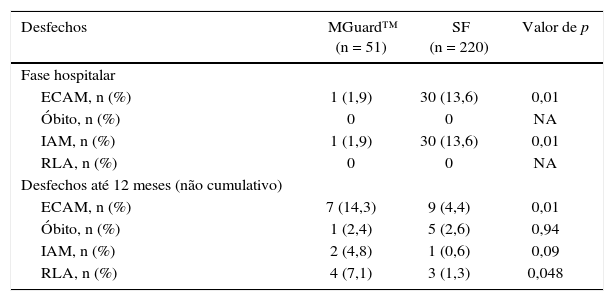
O Grupo MGuard™ teve melhores desfechos clínicos hospitalares (ECAM: 2,0% vs. 13,6%; p = 0,014; odds ratio − OR: 7,89; intervalo de confiança de 95% − IC 95% 1,05‐59,3), devido exclusivamente à menor incidência de IAM periprocedimento (2,0% vs. 13,6%; p = 0,014), e não mostrou diferença nas taxas de óbito e RLA (tabela 3).
Desfechos clínicos hospitalares e tardios
| Desfechos | MGuard™ (n = 51) | SF (n = 220) | Valor de p |
|---|---|---|---|
| Fase hospitalar | |||
| ECAM, n (%) | 1 (1,9) | 30 (13,6) | 0,01 |
| Óbito, n (%) | 0 | 0 | NA |
| IAM, n (%) | 1 (1,9) | 30 (13,6) | 0,01 |
| RLA, n (%) | 0 | 0 | NA |
| Desfechos até 12 meses (não cumulativo) | |||
| ECAM, n (%) | 7 (14,3) | 9 (4,4) | 0,01 |
| Óbito, n (%) | 1 (2,4) | 5 (2,6) | 0,94 |
| IAM, n (%) | 2 (4,8) | 1 (0,6) | 0,09 |
| RLA, n (%) | 4 (7,1) | 3 (1,3) | 0,048 |
SF: stent farmacológico; ECAM: eventos cardiovasculares adversos maiores; IAM: infarto agudo do miocárdio; RLA: revascularização da lesão alvo; NA: não aplicável.
Entretanto, contrariamente aos desfechos hospitalares iniciais, a taxa de ECAM em até 1 ano de seguimento foi estatisticamente maior no grupo MGuard™ (14,3% vs. 4,4%; p = 0,01; OR: 0,24; IC 95%: 0,07‐0,76). Na análise desses desfechos clínicos tardios, não houve diferença nas incidências de óbito (2,4% vs. 2,6%; p = 0,94) e IAM (4,8% vs. 0,6%; p = 0,09), porém verificou‐se maior taxa de RLA no grupo MGuard™ (7,1% vs. 1,3%; p = 0,048).
DiscussãoO presente estudo tem como principal observação o fato de o stent MGuard™ ter demonstrado sua eficácia na fase imediata da ICP, com redução do IAM periprocedimento. Por outro lado, devido ao fato de não se tratar de uma endoprótese eluidora de fármaco antiproliferatvio, sua eficácia no médio prazo foi reduzida quando comparada aos SF hoje considerados padrão‐ouro para prevenção de reestenose após ICP.
O desempenho do dispositivo MGuard™ foi testado em diversos estudos. Grube et al. publicaram um estudo prospectivo com 41 pacientes avaliando o stent MGuard™, sendo que ICP em enxertos de safena representou 56% dos procedimentos. Nesse estudo, nenhum paciente recebeu inibidor da glicoproteína IIb/IIIa ou dispositivo de proteção embólica distal. As taxas de sucesso angiográfico e do procedimento foram de 100 e 95%, respectivamente. No seguimento de 6 meses, 19,5% dos pacientes foram submetidos à revascularização do vaso alvo. Já no acompanhamento mais tardio desses pacientes (12 meses a 27 meses), observou‐se apenas uma revascularização do vaso alvo adicional.10
Costa Jr. et al., em estudo angiográfico protocolar aos 6 meses após implante do stent MGuard™ com 30 pacientes, encontrou média de idade dos pacientes de 63 anos, com 38% de diabéticos. Nenhum paciente usou dispositivo de proteção embólica distal. A perda tardia luminal foi de 1,0 ± 0,4mm e a porcentagem da obstrução volumétrica intra‐stent foi de 28,5 ± 15,6%.11
Guimarães et al. testaram o dispositivo MGuard™ em uma análise retrospectiva com 65 pacientes, dos quais 68% das intervenções foi em EVS. A taxa de sucesso angiográfico foi de 91,8% e, no seguimento mais tardio (2,6 ± 1,4 anos), a taxa de RLA foi de 12,3%.7
Os achados desses estudos assemelham‐se aos nossos, que alcançamos sucesso angiográfico em 98% dos procedimentos, e a taxa de nova revascularização após 12 meses do implante do dispositivo MGuard™ foi de 7,1%.
Quanto ao desempenho dos SF em relação aos stents convencionais, o estudo randomizado RRISC (Reduction of Restenosis in Saphenous Vein Grafts with Cypher Sirolimus‐Eluting Stent) selecionou 75 pacientes (96 lesões em enxertos de safena) para receber SF Cypher™ ou stent não farmacológico. Nessa análise, o uso do SF foi associado a 37% de redução do risco de reestenose binária (11,3% vs. 30,6%; p < 0,024), com taxas semelhantes de morte e IM no seguimento a curto prazo.12
Em nossa análise, por sua vez, as taxas de IAM hospitalar foram favoráveis ao grupo MGuard™ frente aos SF (2,0% vs. 13,6%; p = 0,01), achado que pode ser justificado pelo fato desse dispositivo ser revestido por uma malha microscópica ultrafina, que poderia ser capaz de reduzir a embolização distal e as complicações resultantes. Quanto à taxa de IAM na evolução tardia (4,8% vs. 0,6%; p = 0,09), a ausência de significância estatística pode ter sido resultante do número de pacientes incluídos do estudo.
Esteves et al. publicaram estudo comparativo, não randomizado, de ICP em enxertos de safena, com 38 pacientes (16 no grupo MGuard™ e 22 no grupo com stent convencional com uso de filtro de proteção embólica distal), demonstrando taxas de ECAM similares entre os grupos.6
Já Assali et al. publicaram os resultados da comparação entre 68 pacientes tratados com SF e 43 pacientes que receberam stents não farmacológicos para lesões em EVS. No seguimento de 2 anos, o uso de stents não farmacológicos associou‐se à marcante redução da sobrevida livre de eventos (58,1% no grupo stents não farmacológicos vs. 79,4% no grupo SF; p = 0,02), essencialmente às custas da redução da taxa de RLA (14,7% vs. 32,6%; p = 0,03).13
Em um outro estudo randomizado, Brilakis et al. compararam SF Taxus™ com stents não farmacológicos em ICP de EVS (39 pacientes no grupo stents não farmacológicos e 41 pacientes no grupo com SF). No seguimento clínico (média de 1,5 ano), o uso de SF associou‐se à significativa redução da taxa de ECAM (28% vs. 5%; risco relativo − RR = 0,38; IC 95% 0,15‐0,74; p < 0,003), bem como à redução da RLA (46% vs. 22%; RR = 0,65; IC 95% 0,42‐ 0,96; p < 0,03), sem que houvesse diferença nas taxas de infarto e óbito.14
Duas recentes metanálises abrangendo mais de 5 mil pacientes verificaram melhores desfechos com uso de SF comparados ao uso de stents não farmacológicos, principalmente às custas de menores taxas de RLA.15,16
Nosso estudo vem ao encontro destes descritos, com taxas de ECAM aos 12 meses mais elevadas no grupo MGuard™ (dispositivo não eluidor de fármacos) comparados ao grupo SF, às custas essencialmente de uma maior incidência de RLA (7,1% vs. 1,3%; p = 0,048). Considerando as maiores taxas de eventos no tratamento dos enxertos venosos comparado à intervenção em leitos coronários nativos, e a faixa etária média dos pacientes (≥ 65 anos em ambos os grupos), observa‐se que as taxas de ECAM e, principalmente, de RLA do presente estudo podem ser consideradas aceitáveis.
Limitações do estudoTrata‐se de um estudo retrospectivo, não randomizado, que apresenta como principais limitações o número reduzido de pacientes envolvidos e uma população heterogênea. Um estudo multicêntrico, randomizado e com acompanhamento mais prolongado se faz necessário para avaliarmos a eficácia do dispositivo MGuard™ a longo prazo em comparação aos SF.
ConclusõesA utilização de stent dedicado MGuard™ resultou em redução de eventos clínicos na fase hospitalar. Entretanto, no longo prazo, os stents farmacológicos foram superiores em reduzir desfechos adversos maiores, sobretudo a necessidade de revascularização da lesão‐alvo.
Os resultados sugerem que a próxima geração do MGuard™, com uso de fármaco antiproliferativo, pode vir a combinar o melhor dos dois instrumentais.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é de responsabilidade da Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.