Cardiodesfibriladores implantáveis (CDIs) são geralmente indicados para pacientes com arritmias malignas considerados de alto risco. A hiperatividade simpática desempenha um papel crítico no desenvolvimento, na manutenção e no agravamento de arritmias ventriculares. Novas opções de tratamento nessa população representam uma necessidade clínica. Nosso objetivo foi relatar os resultados de pacientes com CDIs e tempestade elétrica submetidos à denervação simpática renal para controle da arritmia.
MétodosOito pacientes com CDIs internados por tempestade elétrica refratária ao tratamento médico otimizado foram submetidos à denervação simpática renal. Condições subjacentes foram: doença de Chagas (n = 6), cardiomiopatia dilatada não isquêmica (n = 1) e cardiomiopatia isquêmica (n = 1). As informações sobre o número de taquicardias ventriculares/fibrilações ventriculares e episódios de terapias antitaquicardia na última semana pré‐procedimento e nos 30 dias pós‐tratamento foram obtidas por meio de interrogação dos CDIs.
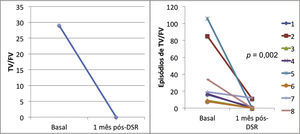
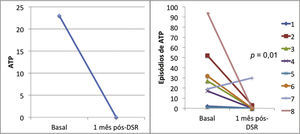
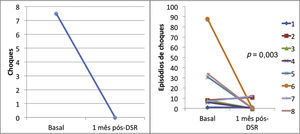
ResultadosAs medianas dos episódios de taquicardias ventriculares/fibrilações ventriculares, sobre‐estimulação e choques na semana que antecedeu a denervação simpática renal foram de 29 (9 a 106), 23 (2 a 94) e 7,5 (1 a 88), sendo significativamente reduzidas para 0 (0 a 12), 0 (0 a 30) e 0 (0 a 1), respectivamente, 1 mês após o procedimento (p = 0,002; p = 0,01; p = 0,003). Nenhum paciente morreu durante o acompanhamento. Não ocorreram complicações maiores relacionadas ao procedimento.
ConclusõesEm pacientes com CDIs e tempestade elétrica refratária ao tratamento médico otimizado, a denervação simpática renal reduziu significativamente a carga de arritmia e, consequentemente, as sobre‐estimulações e os choques. Ensaios clínicos randomizados, no contexto de denervação simpática renal para controle de arritmias cardíacas refratárias, são necessários para trazer maior robustez aos nossos achados.
Implantable cardioverter‐defibrillators (ICDs) are usually indicated for patients with malignant arrhythmias considered as high risk. Sympathetic hyperactivity plays a critical role in the development, maintenance, and worsening of ventricular arrhythmias. New treatment options in this population represent a clinical necessity. This study's objective was to report the outcomes of patients with ICDs and electrical storm submitted to renal sympathetic denervation for arrhythmia control.
MethodsEight patients with ICDs admitted for electrical storm refractory to optimal medical therapy underwent renal sympathetic denervation. Underlying diseases included Chagas disease (n = 6), non‐ischemic dilated cardiomyopathy (n = 1), and ischemic cardiomyopathy (n = 1). Information on the number of episodes of ventricular tachycardia/ventricular fibrillation and antitachycardia therapies in the week before the procedure and 30 days after treatment were obtained through interrogation of the ICDs.
ResultsThe median numbers of episodes of ventricular tachycardia/ventricular fibrillation, antitachycardia pacing, and shocks in the week before renal sympathetic denervation were 29 (9 to 106), 23 (2 to 94), and 7.5 (1 to 88), and significantly reduced to 0 (0 to 12), 0 (0 to 30), and 0 (0 to 1), respectively, 1 month after the procedure (p = 0.002; p = 0.01; p = 0.003, respectively). No patients died during follow‐up. There were no major complications related to the procedure.
ConclusionsIn patients with ICDs and electrical storm refractory to optimal medical treatment, renal sympathetic denervation significantly reduced arrhythmia load and, consequently, antitachycardia pacing and shocks. Randomized clinical trials in the context of renal sympathetic denervation to control refractory cardiac arrhythmias are needed to further support these findings.
Os cardiodesfibriladores implantáveis (CDIs) têm demonstrado eficácia nas prevenções primária e secundária de morte súbita cardíaca e, geralmente, são indicados para pacientes com arritmias malignas considerados de alto risco.1 Tempestade elétrica é definida como a ocorrência de três ou mais episódios de arritmias ventriculares (AV) potencialmente malignas em 24 horas, cuja reversão requer intervenção com terapia antitaquicardia, ou seja, sobre‐estimulação (ATP, sigla do inglês antitachycardia pacing) ou choque. Trata‐se de um evento grave e dramático quando estão presentes os choques de repetição, fato que leva à internação hospitalar em unidade de terapia intensiva, acarretando enorme desconforto aos pacientes, além do desgaste precoce da bateria do CDI. As opções terapêuticas para pacientes com choques recorrentes pelo CDI incluem o tratamento farmacológico com antiarrítmicos e betabloqueadores,2–4 bem como a ablação cardíaca por cateter.5,6 No entanto, ambas as abordagens são associadas à baixa eficácia em longo prazo e, no caso de ablação, esta pode estar associada a complicações potenciais.7 Novas opções de tratamento nessa população de pacientes de alto risco representam uma necessidade clínica.
A hiperatividade simpática desempenha um papel crítico no desenvolvimento, manutenção e agravamento de AV.8 A denervação simpática renal (DSR) percutânea mostrou diminuir a atividade simpática9 e, assim, reduzir a pressão arterial em pacientes com hipertensão arterial resistente por até 3 anos de seguimento em alguns estudos.10–12 Os efeitos de DSR sobre a atividade do sistema nervoso simpático sugerem que essa técnica possa ser utilizada em outros estados patológicos associados com aumento do tônus simpático, tais como doença crônica dos rins, insuficiência cardíaca e arritmias cardíacas.13 Particularmente para o tratamento de arritmias cardíacas, a DSR tem um forte racional fisiopatológico.14 Recentemente, alguns relatos de casos sugeriram benefícios da DSR em pacientes com tempestade elétrica.15,16 No entanto, os dados são escassos, e qualquer análise conclusiva referente a esse contexto fica prejudicada.
O presente estudo teve como objetivo descrever os resultados até 30 dias da DSR em pacientes com CDI e tempestade elétrica refratária ao tratamento médico otimizado.
MétodosCasuísticaEste foi um estudo prospectivo, realizado em um único hospital terciário de São Paulo (SP), o Instituto Dante Pazzanese de Cardiologia. A pesquisa foi aprovada pelo Comitê de Ética local e conduzida de acordo com os padrões de boa prática clínica. Todos os pacientes leram, entenderam e assinaram o Termo de Consentimento Livre e Esclarecido, o qual continha, de forma didática e resumida, as informações mais importantes do protocolo de pesquisa.
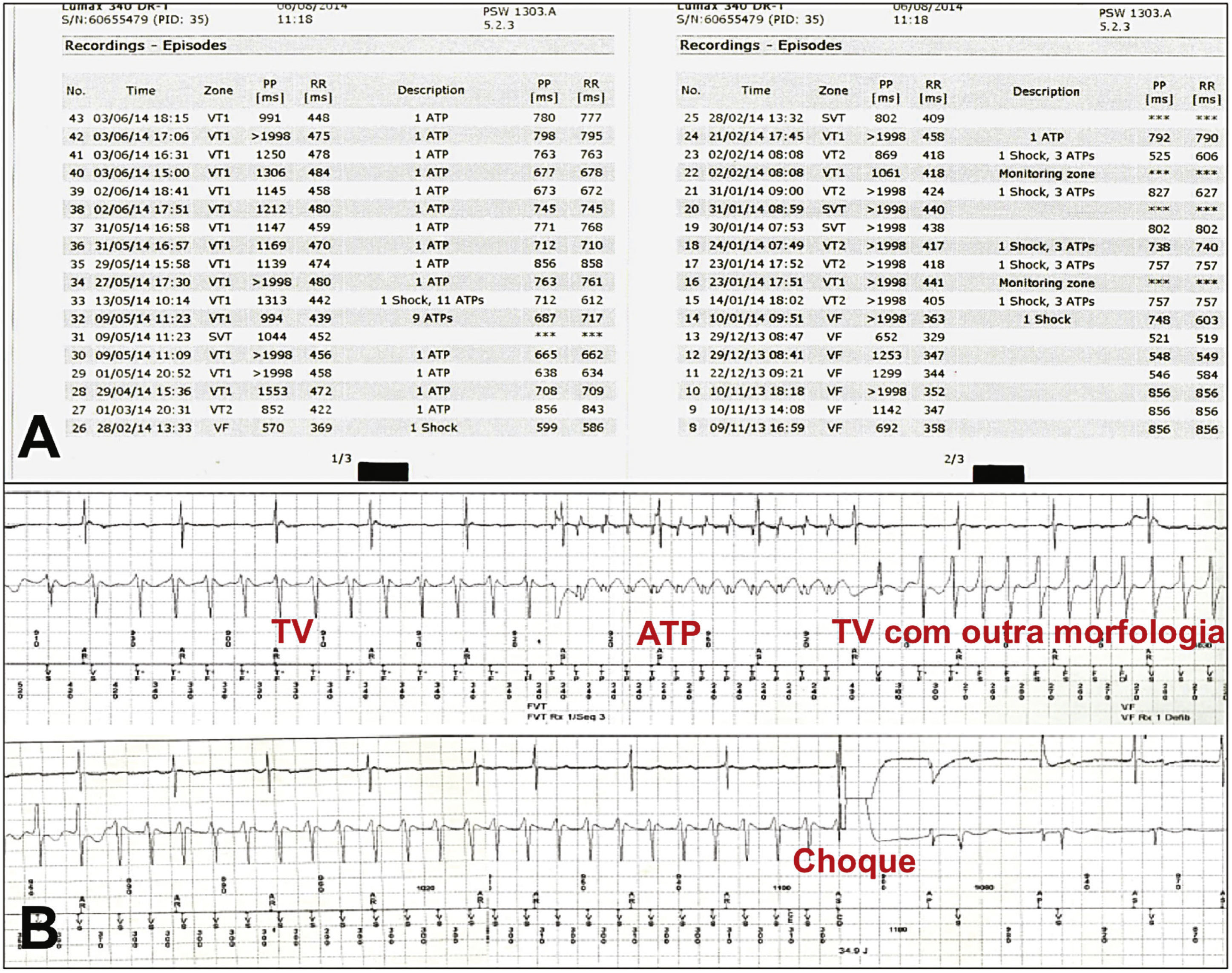
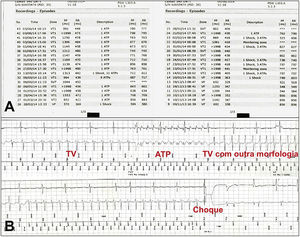
Treze pacientes consecutivos internados com AV, refratários ao tratamento médico otimizado e considerados inadequados para ablação cardíaca foram elegíveis para o estudo, entre agosto de 2013 e junho de 2014. A confirmação diagnóstica de tempestade elétrica foi feita por meio da interrogação do dispositivo, com análise dos eletrogramas intracavitários armazenados, e ratificação de que as terapias antitaquicardia foram apropriadas e eficazes (fig. 1). A tempestade elétrica foi definida pela ocorrência de três ou mais episódios de taquicardia ventricular sustentada (TV)/fibrilação ventricular (FV) em 24 horas, cujas reversões requereram terapia de sobre‐estimulação ou choque. A duração maior que 30 segundos e/ou instabilidade hemodinâmica especificaram as taquicardias ventriculares como sustentadas. O tratamento clínico otimizado abrangeu o controle de possíveis causas desencadeantes de AV, como os distúrbios hidroeletrolíticos e o uso de drogas antiarrítmicas. A ablação cardíaca foi qualificada como indevida na presença de TV polimórfica, FV, arritmias instáveis, arritmias não mapeáveis, trombo intracardíaco ou insucesso de ablação prévia.
(A) Confirmação diagnóstica de tempestade elétrica, por meio da interrogação do cardiodesfibrilador implantável e da análise dos eletrogramas intracavitários armazenados, ratificando que as terapias antitaquicardia foram apropriadas e eficazes. (B) Evidenciamos a tentativa sem sucesso de reversão de taquicardia ventricular por meio de sobre‐estimulação (ATP; sigla do inglês antitachycardia pacing), desencadeando início de outra taquicardia ventricular com morfologia distinta, a qual foi revertida por meio de choque. TV: taquicardia ventricular sustentada.
Infecção ativa, hipotensão significativa (pressão arterial sistólica ≤ 90mmHg ou necessidade de vasopressores), insuficiência renal (taxa de filtração glomerular TFG < 45mL/minuto) e artérias renais anatomicamente inadequadas para intervenção (< 20mm de extensão ou < 3,5mm de diâmetro, presença de estenose > 50%/fibrodisplasia/stent prévio) ou rim único foram critérios de exclusão.
A zona de monitoramento do CDI foi programada entre 120 e 130 bpm em todos os pacientes. As informações sobre o número de TV/FV e episódios de terapias antitaquicardia (sobre‐estimulação e choques) na última semana pré‐procedimento, bem como nos 30 dias pós‐tratamento, foram obtidas por meio de interrogação do CDI.
Procedimento de denervação simpática renalA DSR foi realizada como previamente descrito.17 Após a obtenção da via de acesso arterial femoral, heparina não fracionada foi administrada numa dose de 100 UI/kg. Aortografia junto às artérias renais foi realizada com cateter pigtail, seguida por cateterismo e arteriografia renal seletiva com cateter de Judkins, após a administração de nitroglicerina (50 a 200 mcg). Em todos os casos, o procedimento foi realizado utilizando o cateter de ablação cardíaca com ponta irrigada (Therapy Cool Path®, St. Jude Medical®, Minneapolis, EUA). Pelo menos quatro lesões por radiofrequência foram efetivadas ao longo de ambas as artérias renais, a partir dos segmentos distais em direção aos óstios. O cateter foi tracionado 5mm e rodado depois de cada aplicação de radiofrequência, produzindo, assim, uma configuração helicoidal das ablações. Devido à dor visceral gerada pela ablação, foi realizada analgesia com fentanil e morfina. Ao final do procedimento, uma arteriografia renal de controle foi feita para avaliar a integridade vascular.
Avaliação pós‐procedimento e seguimento clínicoOs introdutores foram removidos quando o tempo de coagulação ativado atingiu valores < 200 segundos. Compressão hemostática manual foi realizada por, pelo menos, 20 minutos, seguida de curativo compressivo. A deambulação foi permitida após 4 horas de repouso, na ausência de sangramento no sítio de punção. No período de repouso, foi dada atenção especial à ocorrência de complicações vasculares no acesso femoral, como hemorragias, hematomas e pseudoaneurismas, bem como a monitorização de arritmias. As medicações antiarrítmicas foram mantidas durante o seguimento. Os pacientes receberam alta hospitalar após controle dos episódios de AV.
Análise estatísticaAs variáveis categóricas foram apresentadas como frequências absolutas e relativas. As variáveis contínuas foram apresentadas como média ± desvio padrão ou mediana (amplitude) e comparadas pelo teste t de Student ou teste de Mann‐Whitney. As análises estatísticas foram realizadas utilizando o programa IBM SPSS Statistics®, versão 22,0 (IBM®, Armonk, EUA). Para todos os parâmetros comparados, valores de p < 0,05 foram considerados estatisticamente significativos.
ResultadosCaracterísticas basaisDos 13 pacientes internados com AV refratária, tempestade elétrica foi confirmada em 11, pois um deles apresentava ritmo idioventricular acelerado, abaixo da zona de detecção do CDI, persistente por vários dias, e outro tinha AV frequentes, porém sem critérios para diagnóstico de tempestade elétrica. Outros três foram excluídos da pesquisa devido à insuficiência renal/infecção ativa, rim único e ausência de CDI (que impossibilitou a qualificação/quantificação precisa das AV).
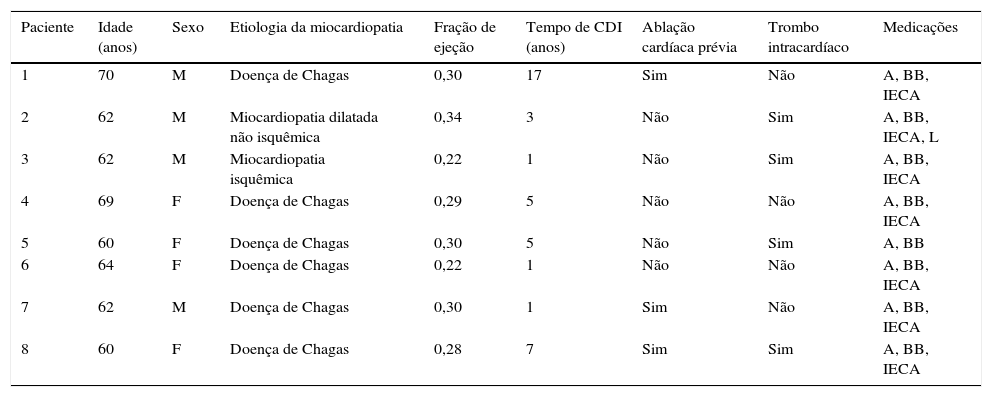
Nos oito pacientes remanescentes com tempestade elétrica refratária ao tratamento médico otimizado, a ablação cardíaca foi considerada inapropriada em quatro deles, por apresentarem TV polimórfica (três com ablação prévia sem sucesso); em três, por exibirem trombo intracardíaco; e em um, com ablação prévia sem sucesso/trombo intracardíaco. Assim, as características basais de cada um dos oito pacientes (quatro homens, com idade de 63,6 ± 3,9 anos) com CDI e tempestade elétrica, submetidos à DSR e incluídos na análise estão sumarizadas na tabela 1. Quatro eram hipertensos; um, diabético; quatro, dislipidêmicos; um, tabagista; dois apresentaram infarto do miocárdio prévio, e cinco, acidente vascular encefálico prévio. Doença de Chagas foi a etiologia de cardiomiopatia mais prevalente (n = 6), havendo também uma cardiomiopatia dilatada não isquêmica e outra isquêmica. A fração de ejeção foi de 0,28 ± 0,04. Os CDI foram implantados há 5 ± 5,4 anos (variando de 1 a 17 anos). O número de antiarrítmicos variou de 2 a 4 (3 ± 0,53). Três pacientes apresentavam sinais de hiperpigmentação cutânea pela amiodarona.
Características basais de cada paciente com cardiodesfibrilador implantável (CDI) e tempestade elétrica, submetidos à denervação simpática renal
| Paciente | Idade (anos) | Sexo | Etiologia da miocardiopatia | Fração de ejeção | Tempo de CDI (anos) | Ablação cardíaca prévia | Trombo intracardíaco | Medicações |
|---|---|---|---|---|---|---|---|---|
| 1 | 70 | M | Doença de Chagas | 0,30 | 17 | Sim | Não | A, BB, IECA |
| 2 | 62 | M | Miocardiopatia dilatada não isquêmica | 0,34 | 3 | Não | Sim | A, BB, IECA, L |
| 3 | 62 | M | Miocardiopatia isquêmica | 0,22 | 1 | Não | Sim | A, BB, IECA |
| 4 | 69 | F | Doença de Chagas | 0,29 | 5 | Não | Não | A, BB, IECA |
| 5 | 60 | F | Doença de Chagas | 0,30 | 5 | Não | Sim | A, BB |
| 6 | 64 | F | Doença de Chagas | 0,22 | 1 | Não | Não | A, BB, IECA |
| 7 | 62 | M | Doença de Chagas | 0,30 | 1 | Sim | Não | A, BB, IECA |
| 8 | 60 | F | Doença de Chagas | 0,28 | 7 | Sim | Sim | A, BB, IECA |
M: masculino; A: amiodarona; BB: betabloqueador; IECA: inibidor da enzima conversora de angiotensina; L: lidocaína; F: feminino.
Os diâmetros das artérias renais direita e esquerda foram 5,11 ± 1,01mm e 5,13 ± 0,96mm, respectivamente. As extensões das artérias renais direita e esquerda foram 41,0 ± 6,9mm e 29 ± 9,8mm, respectivamente. Em um caso, observou‐se uma artéria polar à direita, e, em outros dois pacientes, notou‐se a presença de três artérias polares, sendo duas à direita e uma à esquerda. Dois pacientes tinham estenose discreta proximal em artéria renal.
Todos os procedimentos foram realizados por via transfemoral. Em média, foram utilizados 88,1 ± 32,7mL de meio de contraste durante 21,6 ± 16,0 minutos de fluoroscopia. O número de aplicações de radiofrequência foi 6,3 ± 1,3 na artéria renal direita, e de 4,9 ± 1,2, na artéria renal esquerda. As características angiográficas e do procedimento estão dispostas na tabela 2.
Características angiográficas e do procedimento
| Variável | n = 8 |
|---|---|
| Diâmetro da ARD/ARE, mm | 5,11 ± 1,01/5,13 ± 0,96 |
| Extensão da ARD/ARE, mm | 41,0 ± 6,9/29 ± 9,8 |
| Volume de contraste, mL | 88,1 ± 32,7 |
| Tempo de fluoroscopia, minutos | 21,6 ± 16,0 |
| Número de aplicações de radiofrequência na ARD/ARE | 6,25 ± 1,28/4,86 ± 1,21 |
ARD: artéria renal direita; ARE: artéria renal esquerda.
O procedimento foi realizado sem complicações em todos os pacientes. Reduções discretas e focais na luz da artéria renal, sem limitação ao fluxo sanguíneo, foram observadas em dois casos (distal na artéria renal esquerda, e distal em ambas artérias renais) imediatamente após a aplicação de radiofrequência, tendo sido atribuídas a espasmo e/ou edema. Não ocorreram complicações relacionadas à punção femoral durante o período periprocedimento. Não houve elevação dos níveis séricos de creatinina (1,1 ± 0,3mg/dL inicial vs. 1,1 ± 0,2mg/dL aos 30 dias; p = 0,73), denotando manutenção da TFG durante o seguimento.
Os níveis pressóricos mantiveram‐se estáveis até 30 dias (pressão arterial sistólica de 109,6 ± 20,7mmHg inicial vs. 107,3 ± 17,3mmHg aos 30 dias; p = 0,81), não sendo necessário o ajuste de fármacos de uso crônico devido à disfunção ventricular, presente em todos os pacientes.
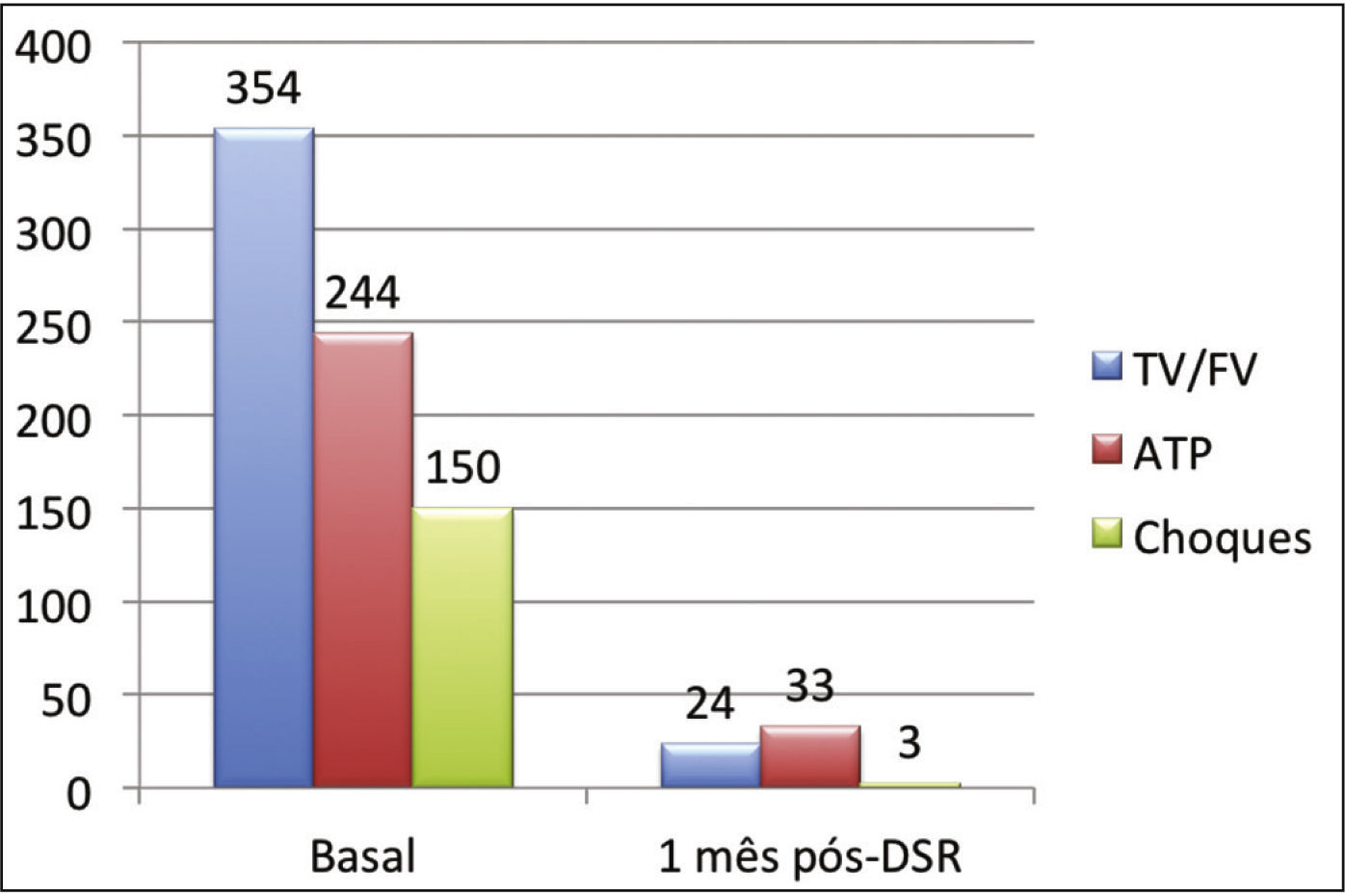
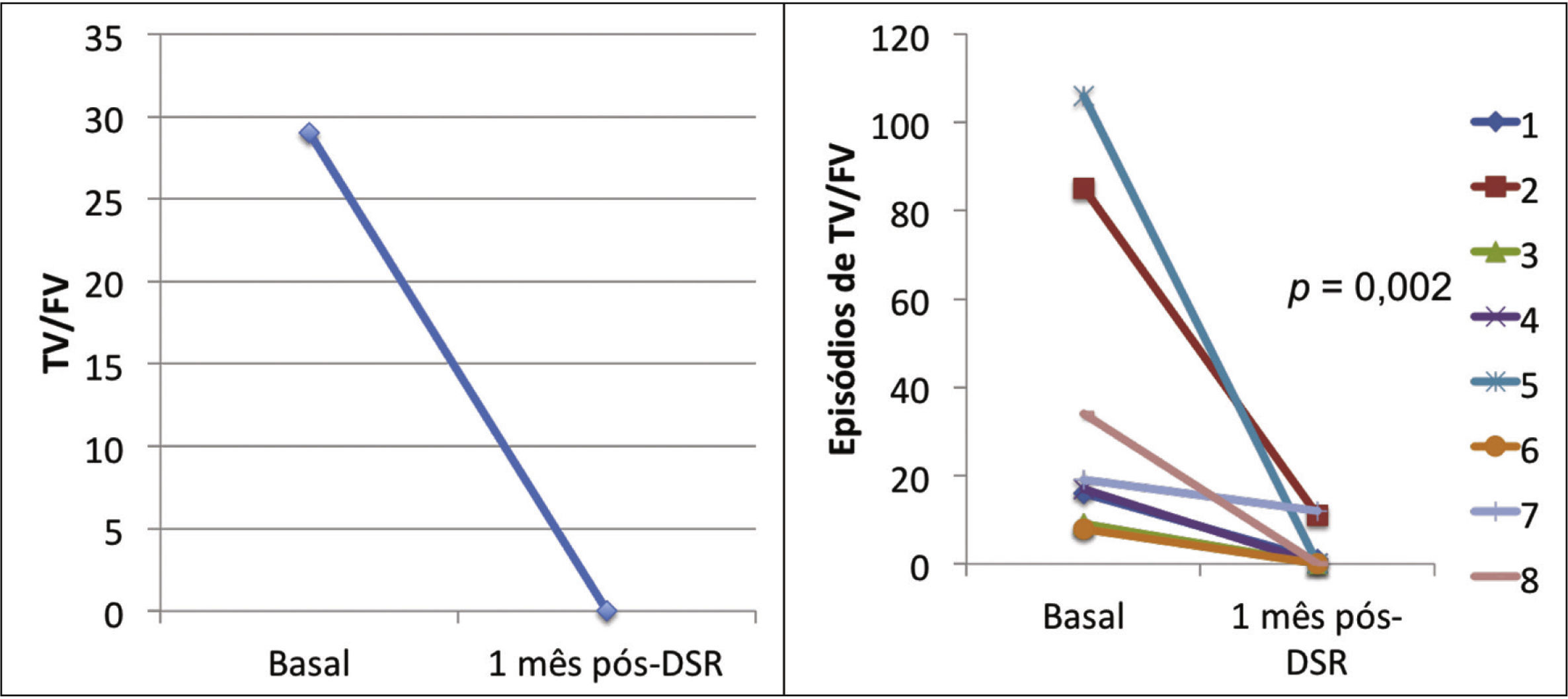
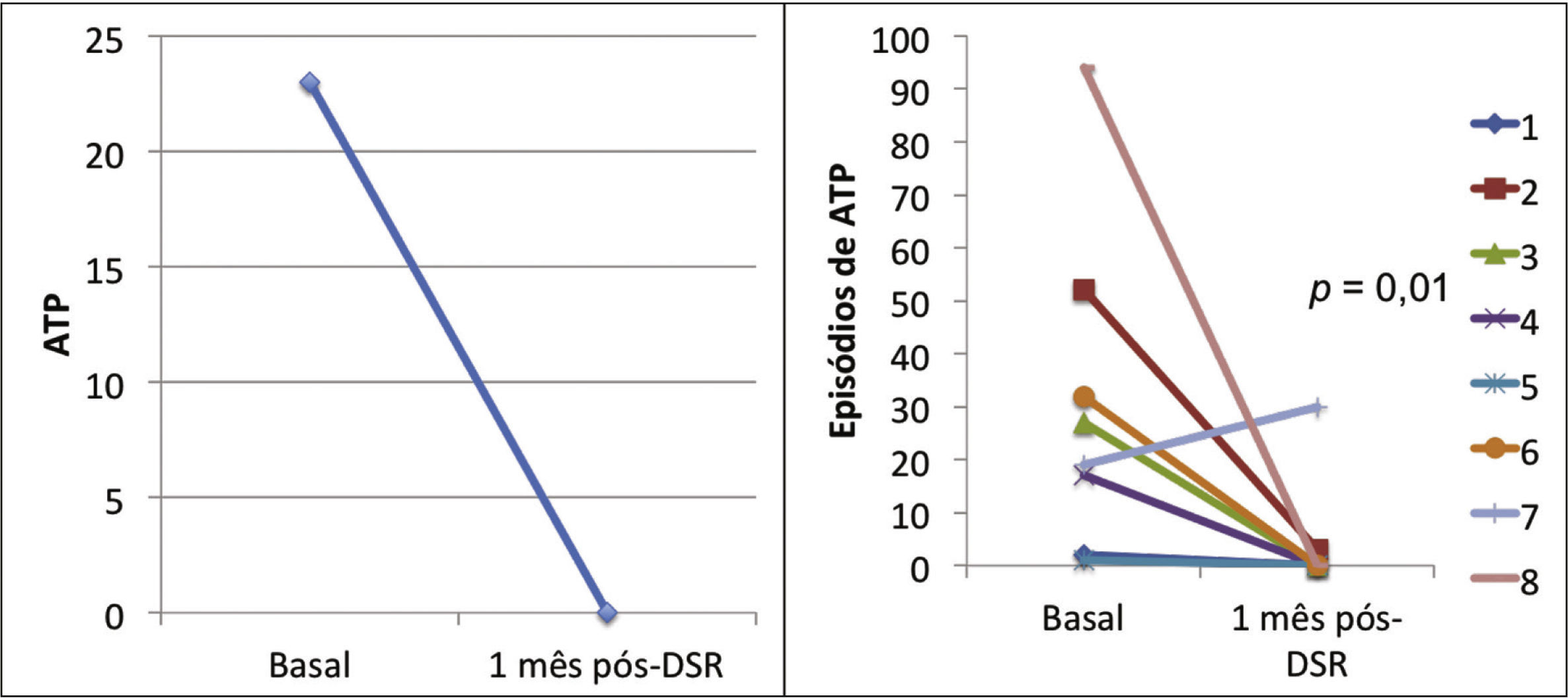
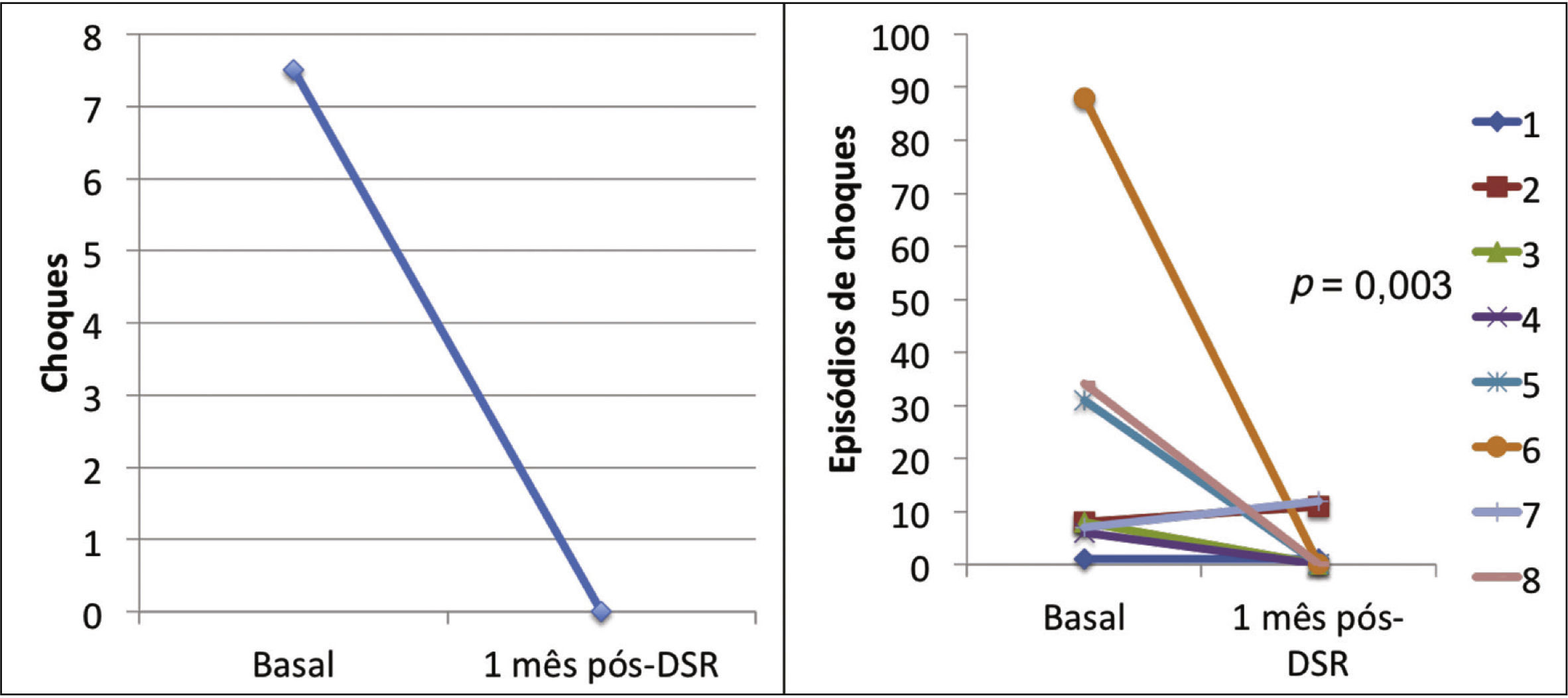
Efeito da denervação simpática renal sobre as arritmias ventriculares e terapias antitaquicardiaA mediana dos episódios de TV/FV, ATP e choques na semana que antecedeu à DSR, foi de 29 (9 a 106), 23 (2 a 94) e 7,5 (1 a 88), sendo significativamente reduzida para zero (zero a 12), zero (zero a 30) e zero (zero a 1), 1 mês após o procedimento (p = 0,002; p = 0,01; p = 0,003, respectivamente). Apenas três pacientes apresentaram AV após a DSR: o primeiro, 1 episódio de TV na primeira semana, que demandou um choque; o segundo, 10 TV na primeira semana, com reversões espontâneas e uma TV na quarta semana, a qual requereu 3 ATP e 1 choque; o terceiro, 2 TV e 10 ATP na primeira semana, 1 TV/11 ATP/1 choque na segunda semana e 9 TV/9 ATP na quarta semana.
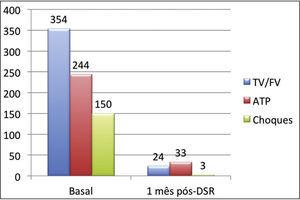
A incidência total de episódios de TV/FV e de terapias antitaquicardia (ATP e choques) pré e pós‐DSR está representada na figura 2. As figuras 3 a 5 ilustram a mediana dos episódios de TV/FV, ATP e choques, assim como a reposta individual de cada um dos oito pacientes submetidos à DSR. Não houve mudanças nos esquemas farmacológicos antiarrítmicos desde a alta hospitalar até o fim do seguimento. Nenhum paciente morreu durante o acompanhamento.
Em pacientes com CDI e tempestade elétrica refratária ao tratamento clínico otimizado, mostramos que a DSR reduziu significativamente a carga arrítmica, sem complicações relacionadas ao procedimento. A despeito do pequeno número de sujeitos incluídos na pesquisa, esta foi a maior casuística nesse contexto.
É importante ressaltar que nosso estudo incluiu pacientes com doença de Chagas, miocardiopatia dilatada não isquêmica e miocardiopatia isquêmica, embora a maioria deles fosse chagásica. É possível que, além do efeito no tônus autonômico, a DSR possa resultar em efeitos secundários benéficos por redução do excesso de volume e ativação hormonal vistos em casos tratados com insuficiência cardíaca; no entanto, apesar de disfunção cardíaca significativa em todos os pacientes, nenhum deles apresentava sinais/sintomas de congestão pulmonar/edema importantes, o que sugere que a redução das arritmias provavelmente não esteve relacionada a melhorias da insuficiência cardíaca.
O coração é densamente inervado por fibras simpáticas e está bem estabelecido que a ativação delas aumenta a frequência cardíaca e facilita a condução atrioventricular.18 Nos ventrículos, aumento do tônus simpático reduz o período refratário efetivo ventricular, aumenta a automaticidade e reduz o limiar para AV.19 Crescentes evidências clínicas e pré‐clínicas indicam que a modulação simpática por ablação cirúrgica ou por cateter pode representar nova opção de tratamento de arritmias cardíacas.20 Vaseghi et al.21 demonstraram recentemente que a denervação simpática cirúrgica reduziu a carga de choque pelo CDI em até 90%; apesar dos resultados promissores, os efeitos não seletivos da denervação cirúrgica podem resultar em disfunção autonômica, como demonstrado neste estudo com pequeno número de pacientes (alterações no padrão da transpiração em 10%, na sensibilidade da pele em 12% e ptose persistente em um paciente).
Ukena et al.15 relataram a primeira experiência em humanos de DSR percutânea em dois pacientes com insuficiência cardíaca e tempestade elétrica: um paciente com miocardiopatia hipertrófica, TV monomórfica apesar do uso de múltiplos antiarrítmicos e ablação cardíaca endocárdica/epicárdica prévia sem sucesso; outro paciente com miocardiopatia dilatada, episódios frequentes de FV e TV polimórficas que recusou ablação cardíaca. Em ambos os casos, uma redução significativa das AV foi documentada.
Nosso grupo16 descreveu uma redução substancial de TV/FV e terapias adequadas de CDI em um paciente com cardiomiopatia dilatada e contraindicação para ablação cardíaca por trombo no ventrículo esquerdo, submetido à DSR com cateter de ponta irrigada. Remo et al.22 mostraram recentemente os benefícios da DSR como terapia adjuvante em TV refratária em quatro pacientes com miocardiopatia subjacente, com resultados semelhantes nos pacientes isquêmicos e não isquêmicos. Em um modelo experimental, Linz et al.23 foram capazes de mostrar que DSR por radiofrequência reduziu significativamente a ocorrência de AV espontâneas e atenuou o elevação da pressão diastólica final do ventrículo esquerdo durante eventos isquêmicos.
Curiosamente, seis dos oito pacientes no presente estudo tinham doença de Chagas. Apesar da aplicação de medidas socioeconômicas e do desenvolvimento de medicamentos que permitem o tratamento na fase aguda da doença, a miocardiopatia chagásica crônica permanece um grande problema de saúde pública em muitos países da América Latina, afetando cerca de 15 a 16 milhões de pessoas, com taxa de mortalidade de 20 mil/ano.24
Cerca de dois terços das pessoas com sintomas crônicos desenvolvem lesões cardíacas, incluindo dilatação e disfunção ventricular grave, taquiarritmias, bradiarritmias e, não raramente, morte súbita.25 A morte súbita é responsável por aproximadamente 55 a 65% da mortalidade geral em pacientes com doença de Chagas, superando as mortes por insuficiência cardíaca.26 A natureza arritmogênica da doença de Chagas está relacionada com a presença de tecido fibrótico entremeado com áreas de miocárdio preservado e regiões discinéticas, gerando uma área de alta propensão para AV complexas.27
O tratamento de AV inclui fármacos antiarrítmicos, correção de causas reversíveis, tais como distúrbios eletrolíticos, e ablação cardíaca.28–30 Embora a amiodarona reduza o risco de morte súbita (em 29%) e morte cardiovascular (em 18%) nessa população, a terapia antiarrítmica é neutra, considerando‐se todas as causas de mortalidade, e está associada com aumento do risco de toxicidade pulmonar e da tiroide em duas e cinco vezes, respectivamente.31
Quase 50% dos pacientes submetidos à ablação convencional do endocárdio apresentam recorrência de sua arritmia.31 Frequentemente, TV em pacientes chagásicos têm vários sítios de origem, incluindo o subepicárdio, e são hemodinamicamente instáveis/não mapeáveis, dificultando sobremaneira sua abordagem.32 A ablação epicárdica, nestes casos, é muitas vezes um grande desafio, especialmente naqueles com disfunção ventricular grave e clinicamente deteriorados. Logo, a DSR pode representar uma alternativa de tratamento para pacientes com doença de Chagas que apresentem AV refratárias.
Não houve óbito até os 30 dias de seguimento. No entanto, o período de acompanhamento foi curto para tirarmos conclusões relativas à mortalidade nessa população de alto risco incluída no estudo, com doença cardíaca avançada e disfunção ventricular severa, preditores de mau prognóstico.
Limitações do estudoO desenho não randomizado, o tamanho relativamente pequeno da amostra e a ausência de um grupo controle representam potenciais limitações do presente estudo, embora não haja nenhuma publicação mais expressiva relativa ao tema. Apesar de a atividade simpática não ter sido medida diretamente, associação significativa entre DSR e redução da carga de AV foi notável. A maioria dos pacientes tinha miocardiopatia chagásica, e a resposta à DSR pode ser distinta nesta população.
ConclusõesNossa pesquisa ilustrou a importância da hiperatividade simpática em pacientes com arritmia ventricular e sugeriu um desempenho potencial da denervação simpática renal por cateter nesse cenário. Em pacientes com cardiodesfibriladores implantáveis e tempestade elétrica refratária ao tratamento médico otimizado, a denervação simpática renal reduziu significativamente a carga de arritmia e, consequentemente, as sobre‐estimulações e os choques. Ensaios clínicos randomizados e rigorosamente delineados no contexto da denervação simpática renal para controle de arritmias cardíacas refratárias são necessários para aumentar a robustez de nossos achados. Se comprovada ser segura e eficaz nesse panorama, a denervação simpática se tornará uma estratégia importante para tratamento de arritmias ventriculares.
Fonte de financiamentoNão há.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é da responsabilidade Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.