Describir los hallazgos clínicos en un caso de oligoamnios fetal severo asociado a la administración materna de diclofenaco, así como revisar los efectos de los antiinflamatorios no esteroideos (AINE) durante la gestación.
Sujetos y métodosPresentamos un caso clínico que ilustra la complicación descrita en una gestante de 27 semanas con un cólico nefrítico, que desarrolló oligoamnios agudo tras la terapia antiinflamatoria.
ResultadosResolución del oligoamnios tras la supresión de diclofenaco.
ConclusionesEl uso de AINE debe realizarse con precaución durante la gestación por sus posibles efectos adversos, entre los que destaca la alteración de la función renal y el cierre prematuro del ductus arterioso.
To describe the clinical findings in a case of severe fetal oligohydramnios associated with maternal ingestion of diclofenac, as well as to review the adverse effects of non-steroidal anti-inflammatory drugs (NSAIDs) during pregnancy.
Subjects and methodsWe present the case of a woman at 27 weeks of pregnancy with nephritic colic who developed acute oligohydramnios after receiving anti-inflammatory treatment.
ResultsThe oligohydramnios resolved after discontinuation of diclofenac.
ConclusionsNSAIDs should be used with caution during pregnancy due to possible adverse effects, including impaired renal function and premature constriction of the ductus arteriosus.
Los antiinflamatorios no esteroideos (AINE) son fármacos de uso común entre la población general en el tratamiento de una amplia variedad de procesos inflamatorios, dolorosos, febriles y reumáticos.
Altamente efectivos, su administración durante la gestación está limitada debido a su asociación con múltiples efectos secundarios1. Estos se deben principalmente a su mecanismo de acción; los AINE bloquean la síntesis de prostaglandinas a través de la inhibición de la ciclooxigenasa (COX)1–4. Se conocen 2 isoformas de la enzima: la COX-1 se expresa de forma constitutiva en múltiples tejidos, incluyendo el renal, mientras que la COX-2 es inducida por múltiples estímulos1.
La principal fuente de información acerca de la seguridad de los AINE en el embarazo deriva de su indicación en el tratamiento de la amenaza de parto prematuro y polihidramnios1,5. El fármaco más estudiado en relación con los efectos maternos y fetales es la indometacina, usada como agente tocolítico durante más de 30 años5.
Su uso durante el primer trimestre de la gestación se ha relacionado con un aumento significativo del riesgo de aborto, aunque se necesitan más estudios que confirmen dicha asociación. Así mismo, se han descrito malformaciones cardiacas y defectos de la línea media4,5 pero estudios de cohortes y de casos-controles no han encontrado asociación estadísticamente significativa entre la exposición a AINE y las malformaciones congénitas, el bajo peso al nacimiento o el parto prematuro6,7.
Los riesgos asociados al uso de AINE durante el tercer trimestre de la gestación están ampliamente descritos; las complicaciones maternas incluyen prolongación del embarazo, aumento de la hemorragia posparto y alteraciones gástricas8,9. Las complicaciones fetales comprenden alteración de la perfusión renal con el consiguiente oligoamnios y cierre prematuro del ductus arterioso que puede conducir a la producción de hipertensión pulmonar persistente e ingurgitación tricuspídea2,8–10.
En el presente artículo se describe un caso clínico que ilustra una de las principales complicaciones asociadas al uso de AINE, en el que se desarrolla oligoamnios tras la exposición de la gestante a diclofenaco en el tercer trimestre de embarazo.
Caso clínicoSe trata de una gestante de 38 años de edad que ingresa en la semana 27+1 por sospecha de cólico nefrítico tras clínica de dolor en la fosa renal, irradiado por el trayecto ureteral hacia hipogastrio, habiendo presentado ingresos previos por el mismo motivo.
Entre los antecedentes de interés destacan hipotiroidismo en tratamiento, asma e intolerancia a codeína.
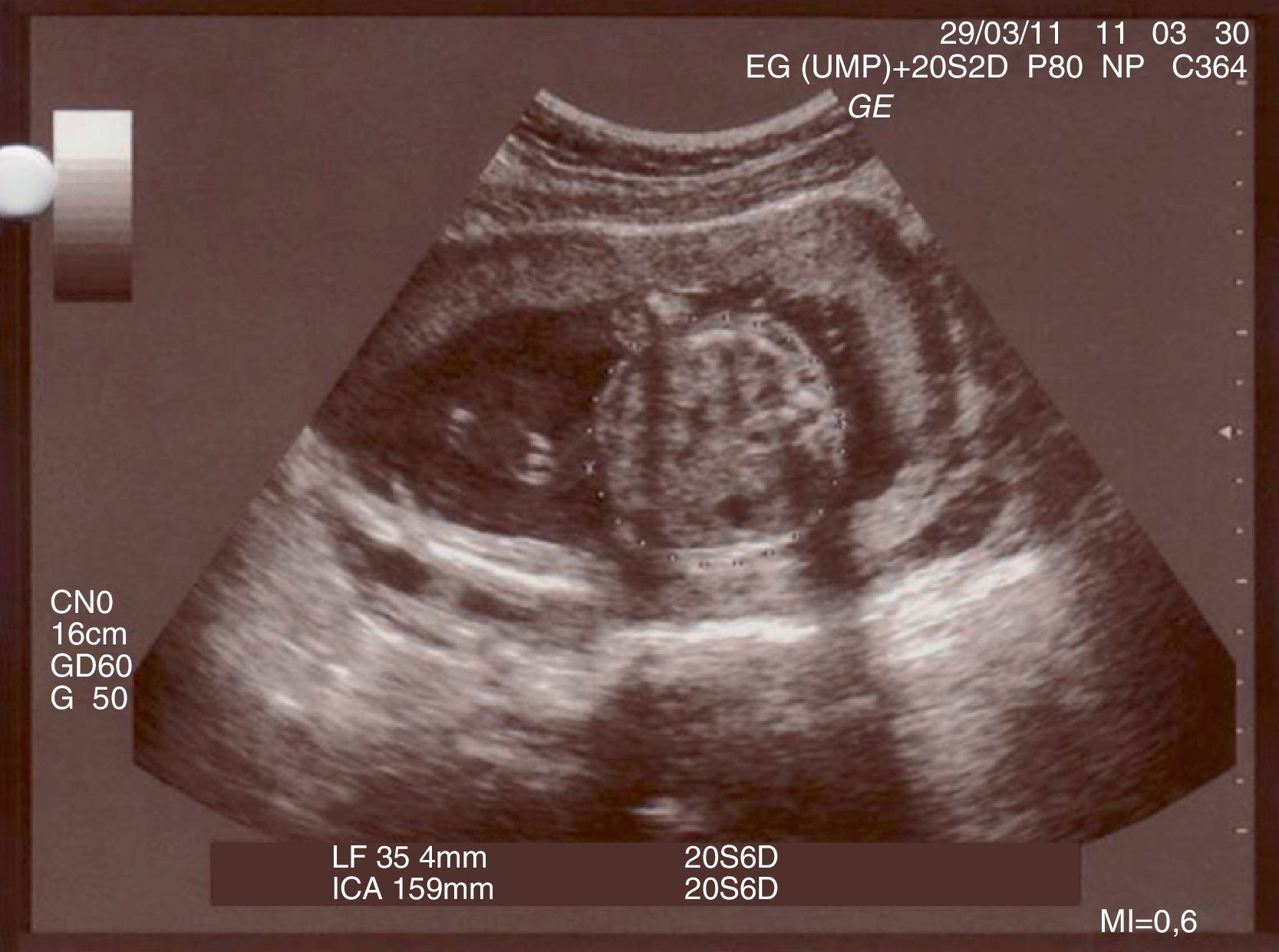
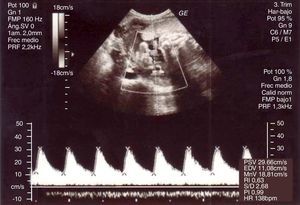
Durante su ingreso se practican registros cardiotocográficos que muestran patrón reactivo y adinamia; controles analíticos que evidencian hemograma y fórmula normal y ecografías dentro de la normalidad (fig. 1). Se realiza sobrecarga oral de glucosa por test de O'Sullivan alterado, siendo diagnosticada de diabetes gestacional en control con medidas higiénico-dietéticas.
La paciente permanece sintomática a pesar de la sueroterapia y el tratamiento analgésico intravenoso instaurado (buscapina, paracetamol, metamizol y diazepam), por lo que 2 días más tarde se inicia tratamiento con diclofenaco 50mg cada 12 horas por vía intramuscular. Ante la persistencia del dolor se asocia dolantina y se solicita ecografía renal materna que muestra una mínima dilatación pielocalicial bilateral.
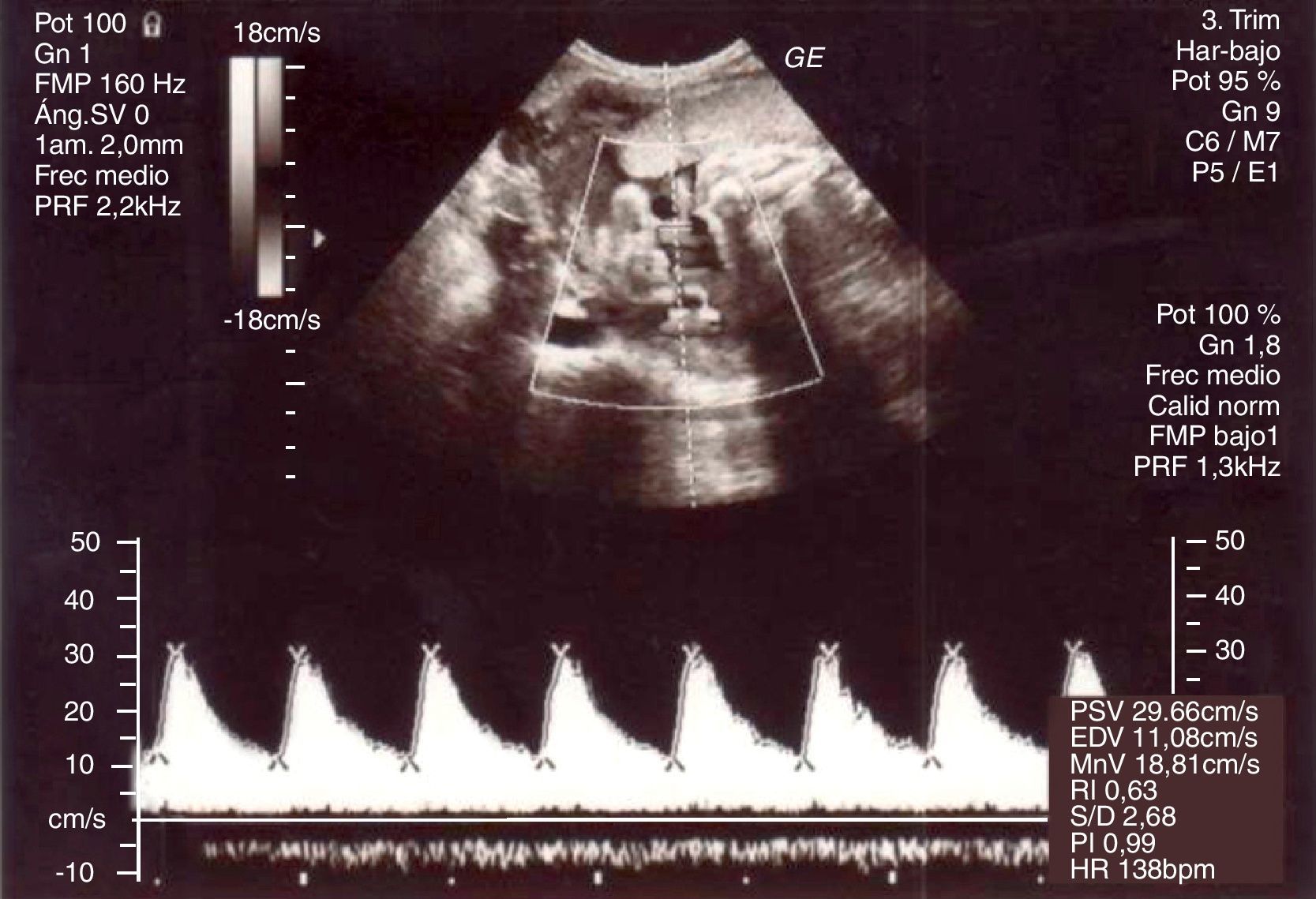
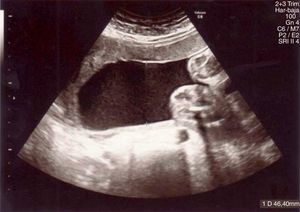
Posteriormente, cede la clínica y se realiza un control ecográfico que evidencia una gestación única con feto en presentación podálica y oligoamnios severo (columna máxima vertical<2cm e índice de líquido amniótico<5cm), con estudio anatómico sin hallazgos patológicos y Doppler normal (fig. 2).
Ante el hallazgo de oligoamnios grave, se descarta rotura prematura de membranas pretérmino, CIR y malformaciones fetales, se toman cultivos cérvico-vaginales, se pautan corticoides para la maduración pulmonar fetal y se suspende la administración de diclofenaco tras 6 dosis.
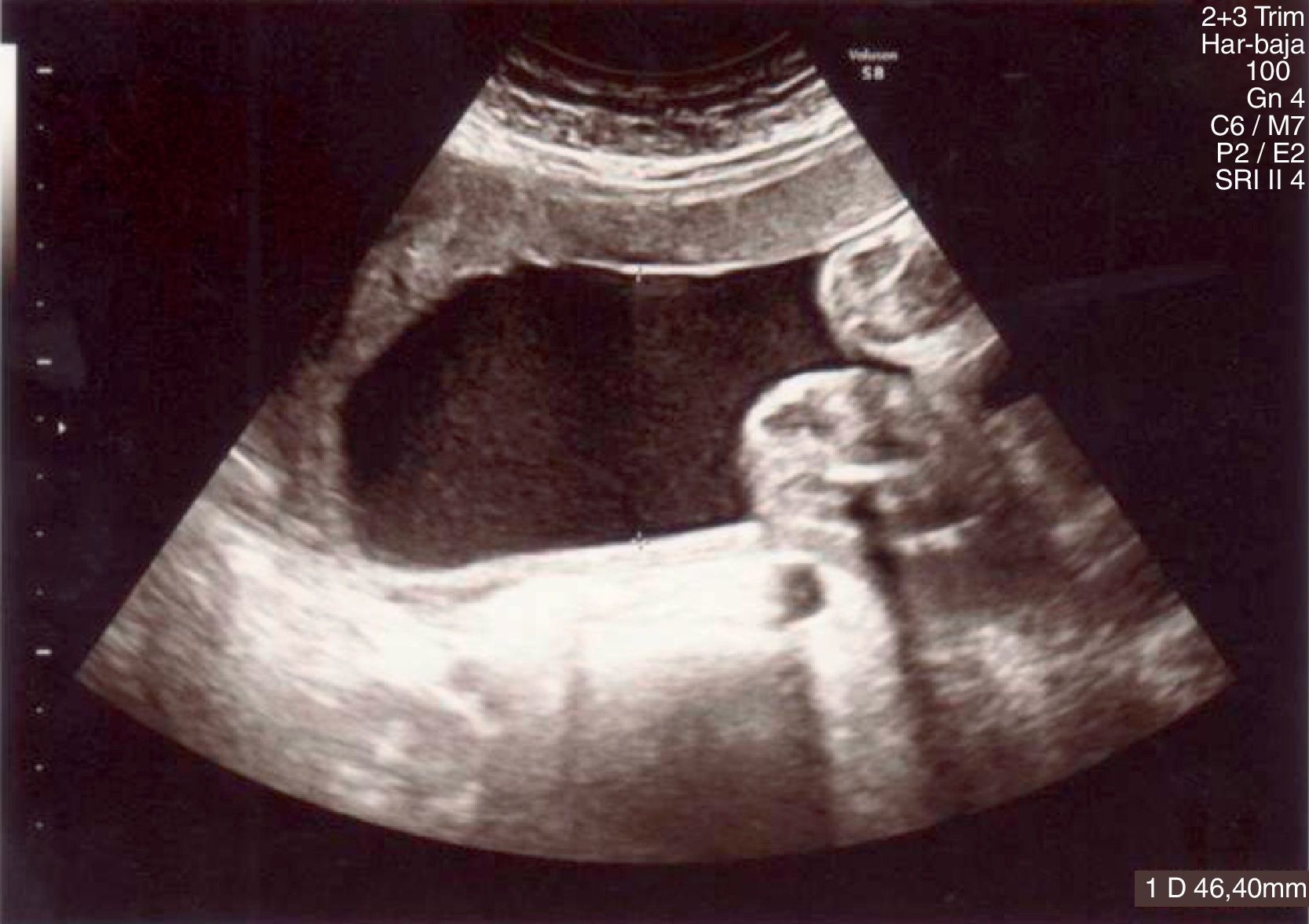
Los controles ecográficos posteriores muestran una mejoría en el volumen de líquido amniótico (LA) hasta su completa normalización en 48 horas (fig. 3).
Tras la comprobación de la recuperación del LA y la mejoría clínica de la paciente, se procede al alta hospitalaria.
En semana 35 ingresa por hipertensión y proteinuria, pautándose tratamiento antihipertensivo. Ante la aparición de preeclampsia leve en la semana 35 en gestante con diabetes gestacional y feto con maduración pulmonar realizada, se procede a la inducción del parto. Se produce un parto eutócico y nace un recién nacido varón de 2.430 g y con una puntuación Apgar 9/10 que vive sano. El puerperio transcurre sin complicaciones.
DiscusiónSe presenta el caso de una gestante expuesta de forma puntual a diclofenaco durante el tercer trimestre de gestación, que desarrolló un oligoamnios grave aunque reversible tras la interrupción de la terapia establecida.
El diclofenaco, derivado arilacético, es un potente agente analgésico y espasmolítico, usado de forma extensa en el tratamiento de distintas enfermedades y condiciones11,12, compartiendo con otros AINE sus propiedades farmacodinámicas3. Su uso durante la gestación no está exento de riesgos; la posibilidad de alterar la función renal fetal y producir oligoamnios, como ilustra este caso, llama a la precaución en su administración durante el embarazo.
El diclofenaco se encuentra clasificado en la categoría B de riesgo fetal, siendo D durante el tercer trimestre de la gestación según la Food and Drug Administration11–13.
No existen estudios controlados en humanos, por lo que sólo debe utilizarse si los posibles riesgos justifican los beneficios. Aunque el número de exposiciones es pequeño, los resultados no ponen de manifiesto una asociación entre el uso de este fármaco y malformaciones congénitas4.
En caso de necesidad, si se utilizaran durante la gestación, especialmente hacia el final, se deben realizar ecocardiografías y estudios Doppler periódicamente para detectar de forma temprana si se están produciendo alteraciones en el volumen del líquido amniótico o cierre prematuro del ductus arterioso14.
El hecho de que tras el cese de la terapia antiinflamatoria se normalice el líquido amniótico, apoya la relación causal entre la administración de diclofenaco y el oligoamnios3,13,15. En el presente caso, horas después de suspender el tratamiento, se produjo una recuperación espontánea del líquido amniótico.
La aparición de complicaciones renales, aunque infrecuentes, no deben ser infraestimadas. Los efectos nefrotóxicos de los AINE están en relación con su mecanismo de acción1.
La especial sensibilidad a estos fármacos en las últimas semanas del embarazo, podría ser explicada a nivel molecular por un aumento en la expresión de la COX-2 cerca del término, lo que precipitaría y exacerbaría sus efectos a nivel del ductus arterioso y del riñón8,9,16,17. Además, su uso se podría asociar con prolongación de la gestación y aumento de la hemorragia periparto, debido a la inhibición en la síntesis prostaglandínica8,9. Por tanto, la edad gestacional, el tipo de AINE, la dosis empleada, la duración del tratamiento y la vía de utilización son factores relacionados con la aparición de estos efectos.
Existen en la literatura numerosos artículos sobre los posibles efectos secundarios de la exposición a los AINE durante la gestación, así como casos clínicos sobre los mismos.
Algunos estudios en humanos han observado una asociación entre la exposición prenatal a AINE y el riesgo de aborto, aunque estos resultados son limitados por diversos motivos4. En primer lugar, que no se han considerado otros factores confusores, como el uso de otros fármacos o la existencia de otras condiciones que se pudieran relacionar con el evento final. Además, el diseño de los estudios no es el adecuado para establecer una relación de causalidad y el número de casos estudiado es pequeño.
Un comité de expertos publicó en 2004 una guía sobre la terapia antiinflamatoria durante la gestación en la que ponen de manifiesto la relación de los AINE con la fertilidad y el riesgo de aborto, y la posible teratogenicidad debido a su asociación con malformaciones cardiacas y defectos de la línea media. No obstante, se necesitan más estudios que confirmen dicha asociación5.
La expresión de la COX en el tejido endotelial y muscular del ductus arterioso explicaría la relación entre la administración de AINE y el cierre prematuro del mismo, conduciendo a la producción de hipertensión pulmonar persistente, ingurgitación tricuspídea y fallo del ventrículo derecho5,10,16.
Aunque la evidencia es insuficiente para predecir el riesgo a largo plazo del tratamiento con AINE durante el final del embarazo, los resultados de un metaanálisis documentaron que su uso durante el tercer trimestre se asoció a un aumento significativo del riesgo de constricción o cierre prematuro del ductus arterioso comparado con placebo9.
Del mismo modo, la COX se expresa en los túbulos y en la médula renal, de manera que es la inhibición en la síntesis de prostaglandinas la que ocasiona una disminución en la perfusión renal fetal, con lo que disminuye la producción de orina y se produce oligoamnios, pudiendo conducir al fracaso renal en la etapa neonatal5.
Landau et al. publicaron un caso de oligoanuria persistente tras varios días de tratamiento con dosis terapéuticas con nimesulida en las últimas 2 semanas de gestación18. Holmes et al. describieron el desarrollo de un oligoamnios severo en una gestante de 27 semanas con el uso del mismo fármaco19. Benini et al. relataron un caso de fracaso renal transitorio en el periodo neonatal tras la ingestión materna de diclofenaco1.
El presente caso ilustra una de las principales complicaciones asociadas al uso de antiinflamatorios durante la gestación, como es el oligoamnios. Por ello, su administración debe realizarse con prudencia, especialmente cerca del término, realizando controles ecográficos de forma periódica para la detección temprana de posibles complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.