Los inhibidores de puntos de control inmunitario, también conocidos como inhibidores de checkpoint inmune, son medicamentos que cada vez están siendo más usados en dermatología por la excelente respuesta de los pacientes con cáncer de piel.
Esto ha llevado a que cada vez más los dermatólogos tengamos presente su mecanismo de acción, respuesta esperada y, además, sus efectos adversos cutáneos y extra cutáneos.
Si bien, en la literatura hay reportes de caso, series de caso y recientemente algunas revisiones de la literatura, aún no hay una epidemiología clara y establecida, ni guías de tratamiento o recomendaciones claras de manejo.
Caso clínicoPaciente femenina de 63 años, natural y residente en Bogotá D.C, con diagnóstico de melanoma maligno invasivo localizado en la región suprapúbica izquierda, estadio IIIC (T4BN2BM0), positivo para mutación NRAS exón 3. Como tratamiento se realizó resección local amplia con vaciamiento inguinoilíaco bilateral y posteriormente se inició inmunoterapia adyuvante con nivolumab (480&#¿;mg IV cada mes).
Cuando se encontraba recibiendo el ciclo 9/12 presentó la aparición súbita de lesiones que describía como «manchas rojas» que comprometían los miembros superiores y el tronco.
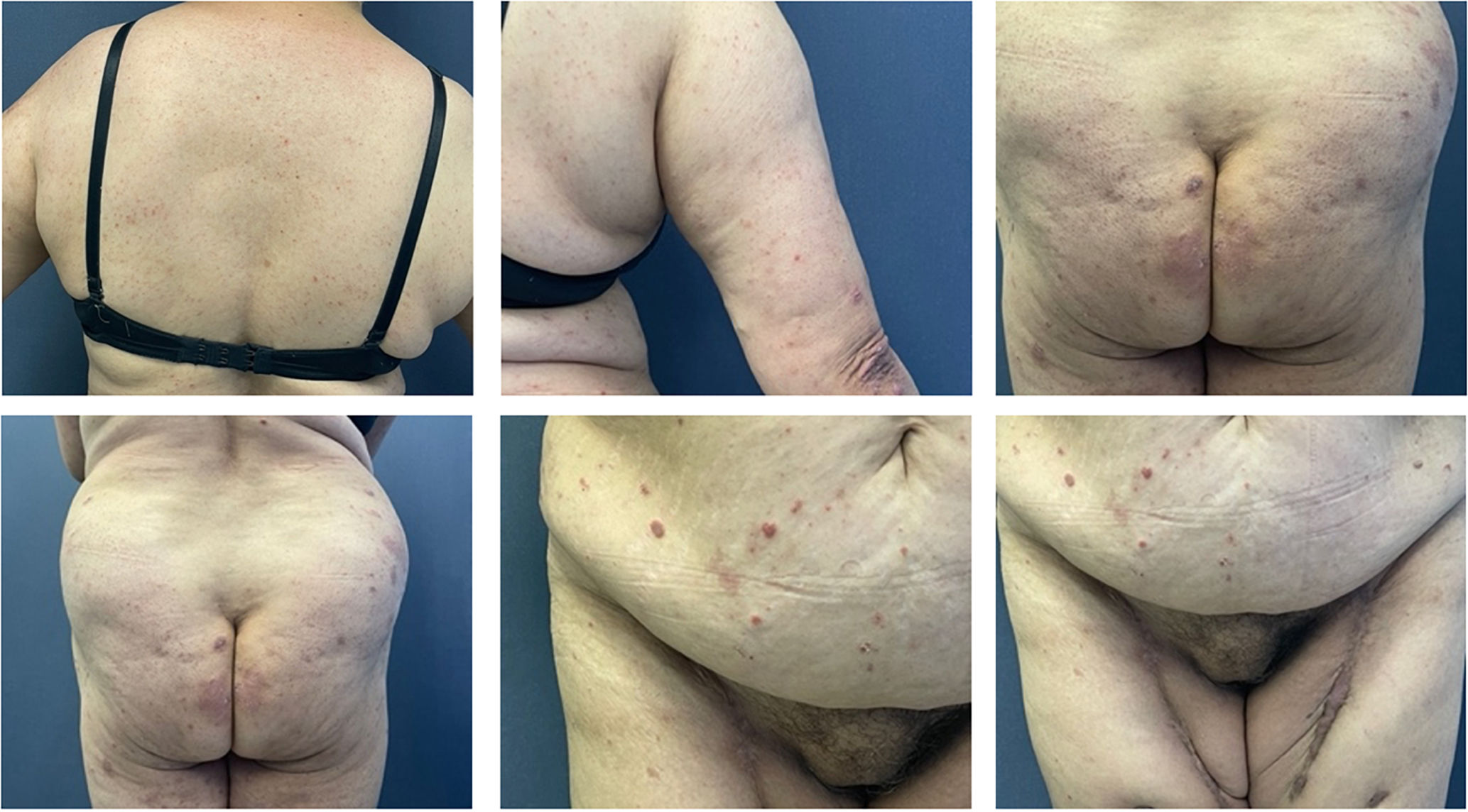
En el examen físico se encontraba en buenas condiciones generales, fototipo IV, con placas eritematosas de bordes regulares y bien definidos con descamación en su superficie, de hasta 5&#¿;cm de diámetro, localizadas en el tronco, los glúteos, los codos y los miembros inferiores, sin adenopatías palpables (fig. 1).
Ante la sospecha de una posible asociación con la inmunoterapia, se toma una biopsia de piel, con sospecha de reacción psoriasiforme asociada al medicamento.
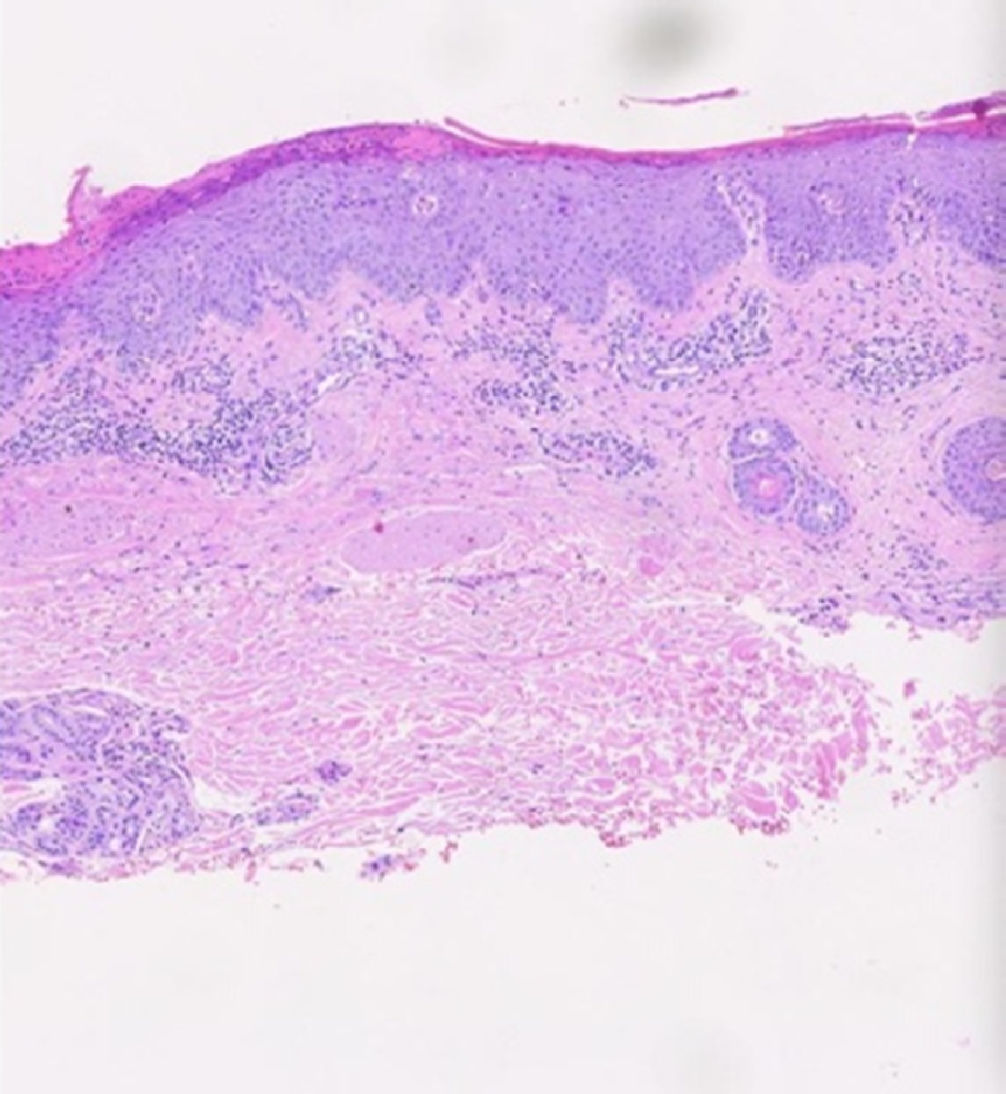
Asiste a consulta de control con resultado de patología, el cual confirmaba la sospecha diagnóstica (fig. 2).
Los cortes muestran un fragmento superficial de piel revestida por epidermis con hiperqueratosis, paraqueratosis con glóbulos de suero y neutrófilos, focal hipogranulosis, acantosis psoriasiforme, espongiosis, exocitosis de linfocitos y algunos queratinocitos apoptóticos; dermis con leve infiltrado inflamatorio mononuclear acompañado de neutrófilos y ocasionales eosinófilos. Los hallazgos histopatológicos podrían corresponder a una reacción psoriasiforme por medicamentos, en un contexto clínico adecuado.
Teniendo en cuenta el grado de compromiso cutáneo, sopesando los riesgos y los beneficios, se indica continuar con la inmunoterapia y se indica tratamiento tópico con esteroides de moderada potencia, presentando mejoría parcial del compromiso cutáneo y completa satisfactoriamente los 12 ciclos de inmunoterapia.
ComentarioLos inhibidores de los checkpoint inmune son medicamentos que han demostrado su eficacia en el control de malignidad cutánea y sistémica; se trata, de anticuerpos monoclonales que actúan bloqueando dianas específicas implicadas en la fisiopatología de estas entidades, dentro de los que resaltamos los inhibidoras de antígeno linfocitario 4, conocidos por su sigla en inglés CTLA-4 y los anti-PD-L1 que se refieren al ligando de proteína de muerte programada 11.
En nuestro caso nos enfocaremos en el nivolumab, medicamento que estaba recibiendo nuestra paciente y que es aprobado como monoterapia o terapia combinada para el tratamiento de melanoma, carcinoma escamocelular de cabeza y cuello, carcinoma de células renales, pulmonar, entre otros1.
El nivolumab es un anticuerpo monoclonal tipo IgG4 contra el receptor PD-L1, que promueve la actividad de linfocitos T en tejido tumoral y a nivel sistémico, aprobado por la EMA desde el 20151.
Su uso ha venido en aumento, lo que ha motivado a diferentes autores a conocer los efectos adversos que los pacientes han presentado y su perfil de seguridad.
Hay algunas publicaciones en la literatura que describen ampliamente las reacciones adversas a estos medicamentos: inicialmente, De Bock et al.2 y posteriormente, Coleman et al.3; estas 2 publicaciones impulsaron a que en 2020 Cutroneo et al. realizaran la revisión de la literatura que hay en nuestro conocimiento hasta la fecha, encontrando 8.213 reportes de efectos adversos cutáneos a anti-CTLA-4 y antiPD-1/PD-L1, de estos, el 3,8% reportaban psoriasis o reacción psoriasiforme confirmada, pero en el 70,8% de los casos los pacientes tenían antecedente personal de psoriasis, siendo entonces una exacerbación de su dermatosis de base y en general más del 30% de los pacientes presentan reacciones cutáneas leves, sin compromiso sistémico adicional y resaltamos que el medicamento que más comúnmente se asoció a psoriasis es el nivolumab1,4.
La explicación fisiopatológica de la aparición de lesiones en la piel de los pacientes recibiendo inmunoterapia, es el estímulo del sistema inmune frente a las células tumorales, actuando así como desencadenantes de autoinmunidad a nivel cutáneo, y es por esto que se describen en la literatura pacientes que desarrollan psoriasis, alopecia areata, vitíligo, eritema nudoso, pioderma gangrenoso, sarcoidosis, liquen, dermatomiositis y otras entidades más1,2,5.
La aparición de la psoriasis de novo o exacerbación de la dermatosis de base se da por la inhibición de PD-L1 que impacta sobre las vías Th1/Th17, llevando a una sobreexpresión de IL-17 y a la típica cascada inflamatoria con actividad antitumoral1,3,6.
En cuanto a la epidemiología y frecuencia de presentación de psoriasis como efecto adverso asociado a la inmunoterapia, es más común en los hombres entre los 65 y 85 años; la mayoría de pacientes presentan compromiso leve a moderado, lo que ha permitido continuar y finalizar satisfactoriamente los ciclos de inmunoterapia usando esteroides tópicos, sin secuelas adicionales y teniendo que suspenderla únicamente en menos del 2% de los casos1,2.
El momento en general en el que aparecen las lesiones psoriasiformes en la piel de los pacientes, según describe la literatura, es alrededor del primer mes en los pacientes con antecedente de psoriasis y a los 2 meses en promedio cuando describen aparición de novo, pero hay reportes de aparición de lesiones en la piel a los 10 meses de inicio de la terapia, nuestra paciente presentó las primeras lesiones más tarde respecto al promedio, mientras cursaba el noveno mes de inmunoterapia4,5,.
La gravedad de los efectos adversos cutáneos debe ser establecida según los criterios comunes de toxicidad7,8:
- •
Grado I: erupciones morbilifomes o eritema con o sin síntomas asociados comprometiendo menos del 10% de la superficie corporal total (SCT).
- •
Grado II: compromiso del 10–30% de la SCT, con o sin prurito u otros síntomas asociados.
- •
Grado III: compromiso de más del 30% de SCT, con o sin prurito u otros síntomas asociados.
- •
Grado IV: dermatitis exfoliativa, ampollosa o ulcerativa generalizada.
- •
Grado V: muerte.
Las manifestaciones clínicas descritas son las típicas de una psoriasis, siendo más común la psoriasis vulgar o el compromiso en placas. Los pacientes, al igual que en nuestro caso, presentan placas eritematosas, bien definidas, con descamación que comprometen más frecuentemente el tronco y las extremidades, aunque también se ha descrito casos de psoriasis guttata, inversa, palmoplantar y del cuero cabelludo6,9,.
Cuando buscamos confirmar el diagnóstico al tomar una biopsia de piel, esperamos encontrar los mismos hallazgos histológicos de la psoriasis clásica, donde hay presencia de paraqueratosis, infiltrado neutrofílico, ausencia de granulosa, acantosis y espongiosis9,10.
En cuanto al tratamiento, en general se describe el uso de esteroides tópicos como monoterapia, también en combinación con análogos de la vitamina D tópicos, tal como se trataría la psoriasis vulgar, y llama la atención que en algunos reportes de caso y a pesar de la gran controversia del uso de esteroides sistémicos en psoriasis por la posible agudización al suspenderlo o efecto «rebote», reportan buena evolución. También se ha usado la fototerapia UVB, acitretin, metotrexato y en un caso etanercept, sin usarse rutinariamente los tratamientos biológicos aprobados para psoriasis posiblemente teniendo presente el diagnóstico de malignidad1,4,5,8,10.
Nuestro objetivo al publicar este caso, es resaltar la importancia de tener presente que, si bien estos medicamentos son una herramienta fundamental y valiosa para el tratamiento de cáncer de piel, debemos estar familiarizados con sus posibles efectos adversos, y posterior a la revisión de la literatura concluimos que hasta un 60% de pacientes en general pueden presentar eventos adversos cutáneos y extracutáneos.
Hay varios reportes en la literatura de reacciones psoriasiformes al igual que nuestra paciente, en quien no se requirió suspender la inmunoterapia, logrando controlar los síntomas y teniendo un desenlace positivo, resaltamos la importancia de publicar y describir estos casos con el fin de tener en un futuro cercano una guía y recomendaciones para su tratamiento y seguimiento, principalmente en la era de la inmunoterapia.
Consentimiento informadoLos autores certifican que se ha obtenido consentimiento informado de la paciente para la realización y publicación de este caso clínico.
FinanciaciónLa presente publicación no ha recibido ayudas específicas provenientes de agencias del sector público, comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.