Aproximadamente un 2-7% de los pacientes con cáncer colorrectal (CCR) presentarán metástasis pulmonares (MP) como única localización, mientras que otro 10% presentarán además metástasis hepáticas (MH)1.
La resección pulmonar (RP) constituye la mejor opción terapéutica y ofrece supervivencias estimadas a 5 años del 46,1%2. Sin embargo, pocos pacientes son candidatos debido a la extensión de la enfermedad o a la recurrencia tras la resección del tumor primario.
Con objeto de determinar la supervivencia y los factores de progresión tras la resección, se realizó un estudio retrospectivo sobre una serie prospectiva y unicéntrica de los pacientes que fueron intervenidos de RP por MP de CCR entre enero de 2013 y diciembre de 2014, con seguimiento hasta septiembre de 2020. Se excluyeron los casos sometidos a re-RP por metástasis. El proyecto fue aprobado por el Comité Ético de Investigación Clínica de Euskadi.
Las variables cuantitativas fueron descritas usando la mediana y el rango o la media y su desviación estándar, mientras que las variables cualitativas se describieron como porcentajes. Se empleó el t-test para las variables continuas que seguían una distribución normal y el test U de Mann-Whitney para las que no seguían una distribución normal. Para las variables categóricas se usó el test de Ji-cuadrado.
Se consideraron MP metacrónicas las diagnosticadas transcurridos≥6 meses desde la intervención del CCR. Se definieron: 1) intervalo libre de enfermedad desde la intervención del CCR o las MH hasta la intervención de las MP; 2) supervivencia libre de progresión desde la intervención de las MP hasta la fecha de recurrencia; 3) supervivencia global desde la intervención de las MP hasta el exitus o último seguimiento. Los pacientes fueron censurados si fallecieron por causas diferentes o si continuaban vivos al final del seguimiento.
La supervivencia fue estimada empleando el método de Kaplan-Meier. Para tratar de identificar las variables que influyeron en la progresión y el exitus se realizó un análisis bivariante mediante el test de Log-Rank. Se consideró estadísticamente significativo el valor p<0,05. Las variables que fueron significativas en el análisis bivariante se incluyeron en un análisis multivariante. Se utilizó el software estadístico R, versión 4.0.1 (A language and environment for statistical computing; R Foundation for Statistical Computing, Viena, Austria).
Durante el periodo de estudio se intervinieron 94 pacientes por probables MP. En 36 la indicación fue por sospecha de origen colorrectal (38,3%). Se excluyeron 2 casos por resultado patológico de neoplasia pulmonar primaria, y otros 2 por contar con RP previa por metástasis de CCR.
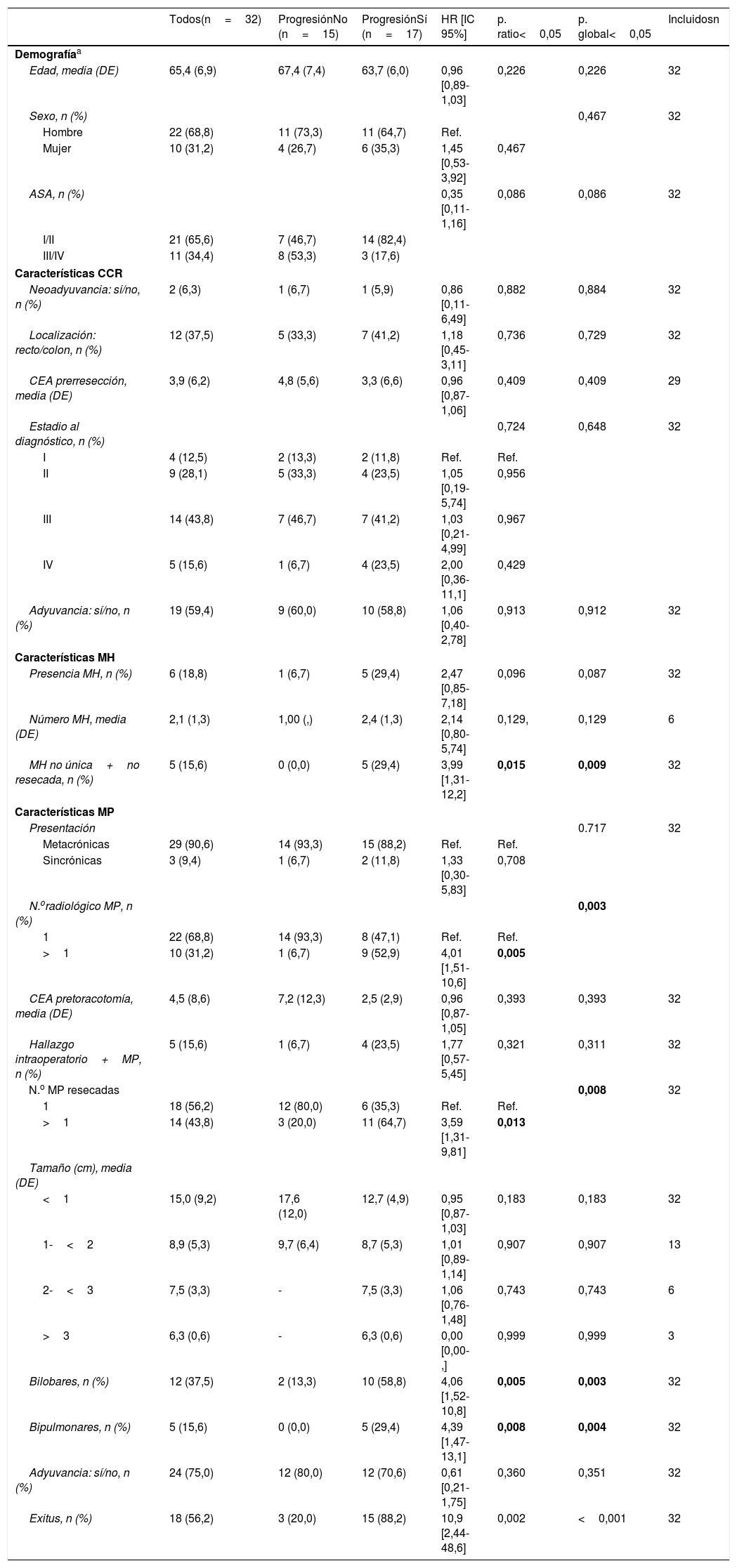
Un total de 32 sujetos fueron incluidos en el estudio. Los aspectos demográficos y las características del CCR, las MH y las MP se muestran en la tabla 1.
Análisis bivariante de los factores de progresión estudiados
| Todos(n=32) | ProgresiónNo (n=15) | ProgresiónSí (n=17) | HR [IC 95%] | p. ratio<0,05 | p. global<0,05 | Incluidosn | |
|---|---|---|---|---|---|---|---|
| Demografíaa | |||||||
| Edad, media (DE) | 65,4 (6,9) | 67,4 (7,4) | 63,7 (6,0) | 0,96 [0,89-1,03] | 0,226 | 0,226 | 32 |
| Sexo, n (%) | 0,467 | 32 | |||||
| Hombre | 22 (68,8) | 11 (73,3) | 11 (64,7) | Ref. | |||
| Mujer | 10 (31,2) | 4 (26,7) | 6 (35,3) | 1,45 [0,53-3,92] | 0,467 | ||
| ASA, n (%) | 0,35 [0,11-1,16] | 0,086 | 0,086 | 32 | |||
| I/II | 21 (65,6) | 7 (46,7) | 14 (82,4) | ||||
| III/IV | 11 (34,4) | 8 (53,3) | 3 (17,6) | ||||
| Características CCR | |||||||
| Neoadyuvancia: sí/no, n (%) | 2 (6,3) | 1 (6,7) | 1 (5,9) | 0,86 [0,11-6,49] | 0,882 | 0,884 | 32 |
| Localización: recto/colon, n (%) | 12 (37,5) | 5 (33,3) | 7 (41,2) | 1,18 [0,45-3,11] | 0,736 | 0,729 | 32 |
| CEA prerresección, media (DE) | 3,9 (6,2) | 4,8 (5,6) | 3,3 (6,6) | 0,96 [0,87-1,06] | 0,409 | 0,409 | 29 |
| Estadio al diagnóstico, n (%) | 0,724 | 0,648 | 32 | ||||
| I | 4 (12,5) | 2 (13,3) | 2 (11,8) | Ref. | Ref. | ||
| II | 9 (28,1) | 5 (33,3) | 4 (23,5) | 1,05 [0,19-5,74] | 0,956 | ||
| III | 14 (43,8) | 7 (46,7) | 7 (41,2) | 1,03 [0,21-4,99] | 0,967 | ||
| IV | 5 (15,6) | 1 (6,7) | 4 (23,5) | 2,00 [0,36-11,1] | 0,429 | ||
| Adyuvancia: sí/no, n (%) | 19 (59,4) | 9 (60,0) | 10 (58,8) | 1,06 [0,40-2,78] | 0,913 | 0,912 | 32 |
| Características MH | |||||||
| Presencia MH, n (%) | 6 (18,8) | 1 (6,7) | 5 (29,4) | 2,47 [0,85-7,18] | 0,096 | 0,087 | 32 |
| Número MH, media (DE) | 2,1 (1,3) | 1,00 (,) | 2,4 (1,3) | 2,14 [0,80-5,74] | 0,129, | 0,129 | 6 |
| MH no única+no resecada, n (%) | 5 (15,6) | 0 (0,0) | 5 (29,4) | 3,99 [1,31-12,2] | 0,015 | 0,009 | 32 |
| Características MP | |||||||
| Presentación | 0.717 | 32 | |||||
| Metacrónicas | 29 (90,6) | 14 (93,3) | 15 (88,2) | Ref. | Ref. | ||
| Sincrónicas | 3 (9,4) | 1 (6,7) | 2 (11,8) | 1,33 [0,30-5,83] | 0,708 | ||
| N.oradiológico MP, n (%) | 0,003 | ||||||
| 1 | 22 (68,8) | 14 (93,3) | 8 (47,1) | Ref. | Ref. | ||
| >1 | 10 (31,2) | 1 (6,7) | 9 (52,9) | 4,01 [1,51-10,6] | 0,005 | ||
| CEA pretoracotomía, media (DE) | 4,5 (8,6) | 7,2 (12,3) | 2,5 (2,9) | 0,96 [0,87-1,05] | 0,393 | 0,393 | 32 |
| Hallazgo intraoperatorio+MP, n (%) | 5 (15,6) | 1 (6,7) | 4 (23,5) | 1,77 [0,57-5,45] | 0,321 | 0,311 | 32 |
| N.o MP resecadas | 0,008 | 32 | |||||
| 1 | 18 (56,2) | 12 (80,0) | 6 (35,3) | Ref. | Ref. | ||
| >1 | 14 (43,8) | 3 (20,0) | 11 (64,7) | 3,59 [1,31-9,81] | 0,013 | ||
| Tamaño (cm), media (DE) | |||||||
| <1 | 15,0 (9,2) | 17,6 (12,0) | 12,7 (4,9) | 0,95 [0,87-1,03] | 0,183 | 0,183 | 32 |
| 1-<2 | 8,9 (5,3) | 9,7 (6,4) | 8,7 (5,3) | 1,01 [0,89-1,14] | 0,907 | 0,907 | 13 |
| 2-<3 | 7,5 (3,3) | - | 7,5 (3,3) | 1,06 [0,76-1,48] | 0,743 | 0,743 | 6 |
| >3 | 6,3 (0,6) | - | 6,3 (0,6) | 0,00 [0,00-,] | 0,999 | 0,999 | 3 |
| Bilobares, n (%) | 12 (37,5) | 2 (13,3) | 10 (58,8) | 4,06 [1,52-10,8] | 0,005 | 0,003 | 32 |
| Bipulmonares, n (%) | 5 (15,6) | 0 (0,0) | 5 (29,4) | 4,39 [1,47-13,1] | 0,008 | 0,004 | 32 |
| Adyuvancia: sí/no, n (%) | 24 (75,0) | 12 (80,0) | 12 (70,6) | 0,61 [0,21-1,75] | 0,360 | 0,351 | 32 |
| Exitus, n (%) | 18 (56,2) | 3 (20,0) | 15 (88,2) | 10,9 [2,44-48,6] | 0,002 | <0,001 | 32 |
ASA: American Society of Anesthesiologists; CCR: cáncer colorrectal; CEA: antígeno carcinoembrionario; DE: desviación estándar; MH: metástasis hepáticas; MP: metástasis pulmonares; VATS: cirugía toracoscópica videoasistida; IC: intervalo de confianza.
La distribución del CCR fue de 20 tumores en colon (62,5%) y 12 en recto (37,5%). Diecinueve pacientes recibieron adyuvancia postoperatoria (59,4%).
Presentaron MH susceptibles de tratamiento quirúrgico o ablativo 6 pacientes (18,8%), 5 de ellos antes de la aparición de las MP. Se indicó radiofrecuencia en un caso, microondas en otro, y resección en los otros 4. Todos salvo uno recibieron quimioterapia posterior.
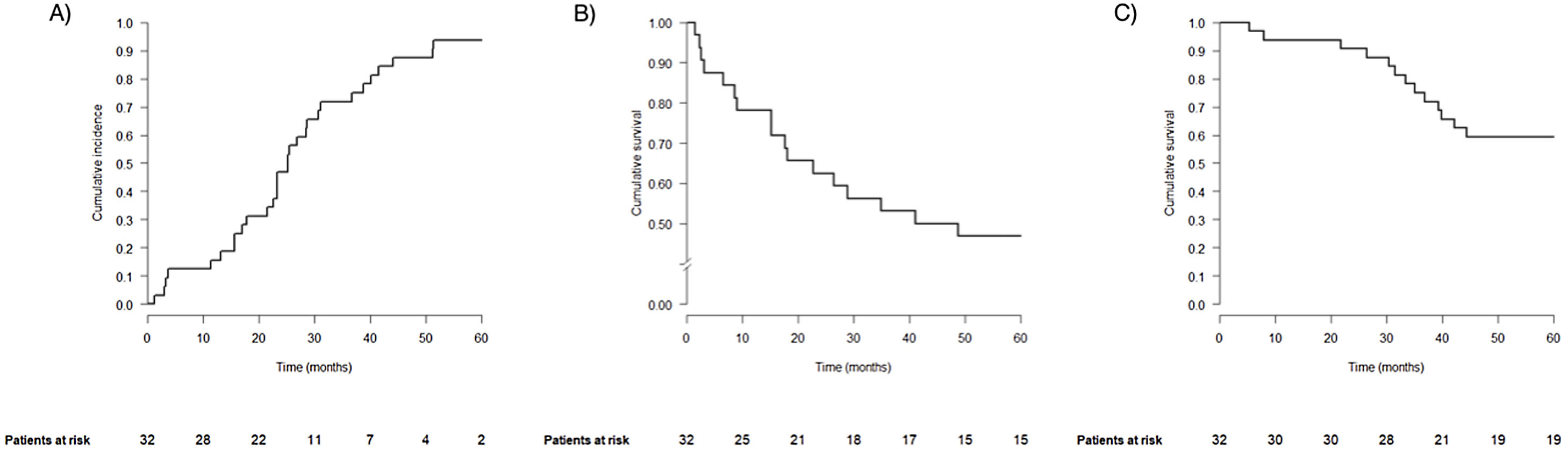
La curva de incidencia acumulada de las MP se muestra en la figura 1A. El intervalo libre de enfermedad promedio fue de 25 meses, y la mayoría de los pacientes presentaron MP metacrónicas (n=29, 90,6%). La media de lesiones diagnosticadas en el estudio preoperatorio fue de 1,4±0,7, presentando 22 pacientes MP única (68,8%). Contaron con hallazgo intraoperatorio de más MP 5 pacientes (15,6%), resecándose un promedio de 2 lesiones (rango 1-14). Doce casos tuvieron localización bilobar (37,5%), de los cuales en 5 fue bipulmonar (15,6%). En total se resecaron 64 MP mediante 36 RP atípicas, una de ellas por cirugía toracoscópica videoasistida, y una RP anatómica del segmento VI izquierdo. Todas fueron R0. Veinticuatro pacientes recibieron tratamiento adyuvante posterior (75%).
Tras una mediana de seguimiento de 72 meses, se observó progresión en 17 pacientes (53,1%). La mediana de tiempo hasta la recurrencia fue de 44,9 meses, y la supervivencia libre de progresión fue de 78,1, 62,5 y 46,9% a uno, 2 y 5 años, respectivamente (fig. 1B). Recibieron tratamientos con intención curativa 12 de ellos (70,6%, relativo), 3 mediante re-RP.
Hasta el final del seguimiento fallecieron 18 pacientes (56,3%), 3 de ellos sin evidencia de enfermedad. La supervivencia global a uno, 2 y 5 años fue del 93,8, 90,6 y 59,4%, respectivamente (fig. 1C).
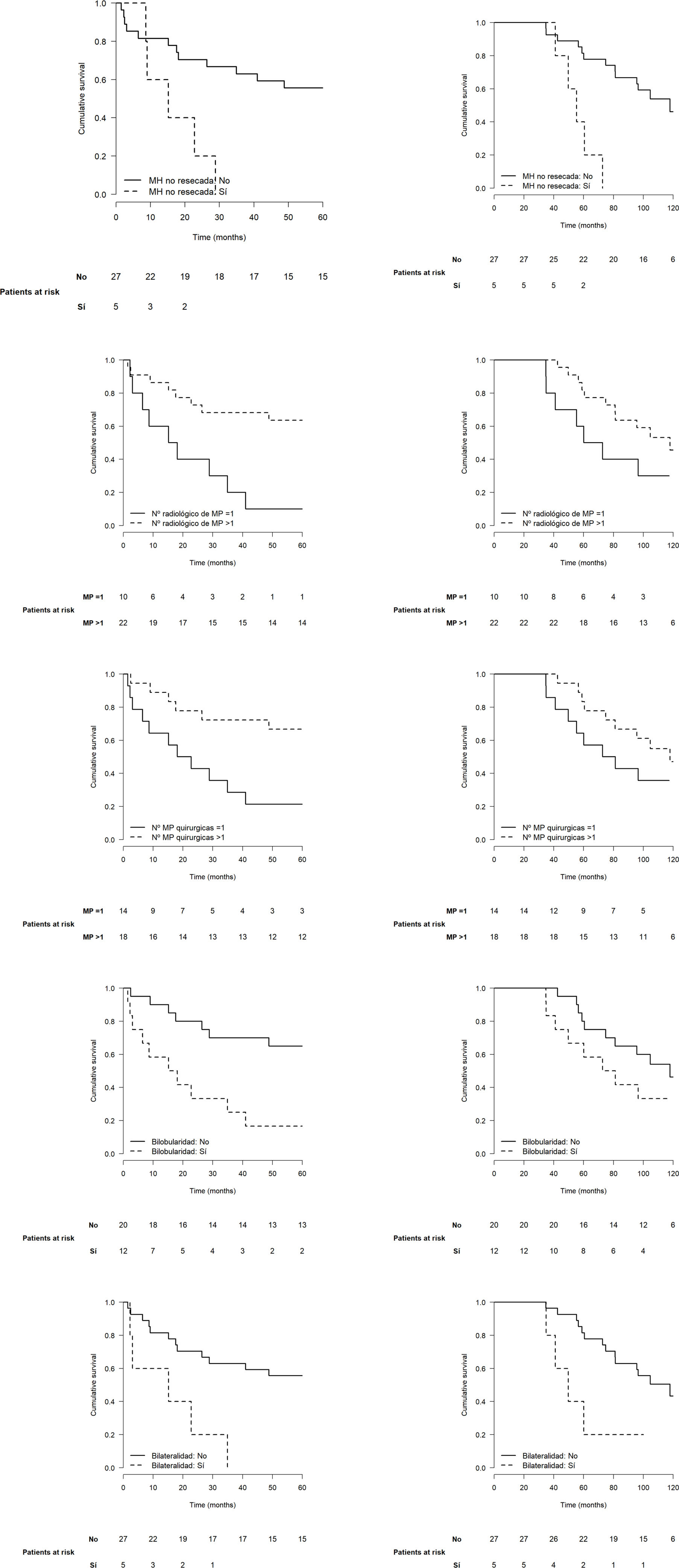
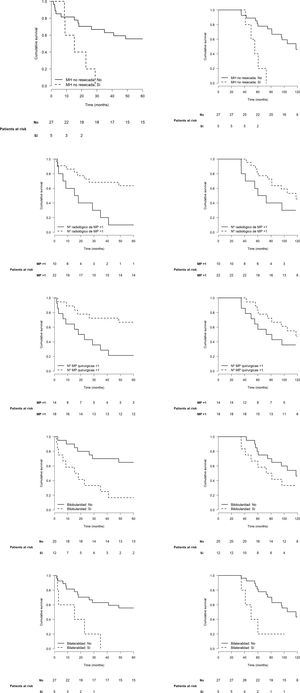
El análisis bivariante sobre la progresión mostró significación estadística para las variables MH no única o no resecada (HR 3,99 [1,31-12,2], p=0,015), número radiológico de MP>1 (HR 4,01 [1,51-10,6], p<0,005), número de MP resecadas>1 (HR 3,59 [1,31-9,81], p=0,013), bilateralidad (HR 4,39 [1,47-13,1], p=0,008) y bilobularidad de las MP (HR 4,06 [1,52-10,2], p=0,005) (tabla 1). Las variables que mostraron significación estadística sobre el exitus fueron la presencia de MH (HR 2,94 [1,02-8,47], p=0,046), las MP sincrónicas (HR 5,68 [1,50-21,5], p=0,010) y las MP bipulmonares (HR 3,83 [1,21-12,2], p=0,023).
La figura 2 muestra las curvas de recurrencia y supervivencia de los pacientes según los factores que tuvieron mayor influencia en el pronóstico. Ninguna variable mostró significación estadística en el análisis multivariante, probablemente por el tamaño de la cohorte.
A diferencia de las MH, las MP no cuentan con unos factores pronósticos claramente definidos. Entre los más estudiados destacan el número de MP≥3, la bilateralidad, la bilobularidad, el CEA pretoracotomía y la resección metastásica extrapulmonar3,4. A este respecto, la indicación de resección secuencial de las MH y las MP debería limitarse a un máximo de 2-3 factores de riesgo, lo cual ofrecería supervivencias estimadas a 5 años del 77 vs. 27%, respectivamente5.
Las RP sublobares («metastasectomías») presentan una baja morbimortalidad6. Se consideran suficientes desde el punto de vista oncológico y de elección si su realización es técnicamente factible7,8. Por otra parte, en pacientes con valores de CEA normales y recidiva localizada tras la RP, la re-RP puede ofrecer supervivencias similares a 5 años9. De igual manera, la RP mediante cirugía toracoscópica videoasistida parece eficaz en ausencia de factores de riesgo10. Actualmente, la mayoría de las RP practicadas en nuestro centro son cirugías toracoscópicas videoasistidas.
En nuestra experiencia, una correcta selección de los pacientes sometidos a RP por metástasis colorrectales, en combinación con las terapias adyuvantes y de rescate, ofreció una elevada supervivencia tanto global como libre de enfermedad. Son necesarios ensayos prospectivos, aleatorizados y controlados para obtener mayores niveles de evidencia.
A Silvia Pérez Fernández, Bioestadística-Coordinación Científica en el Instituto de Investigación Sanitaria BioCruces-Bizkaia.
A Sheila Fernández Gil, Data Manager-Soporte de la Ejecución de la Investigación Clínica en el Instituto de Investigación Sanitaria BioCruces-Bizkaia.