Las terapias respiratorias no invasivas (TRNI) fueron ampliamente utilizadas en la primera ola de la pandemia de COVID-19, en escenarios distintos según los medios disponibles. El objetivo fue presentar la supervivencia a 90 días y los factores asociados a esta de los pacientes tratados con TRNI en un centro de tercer nivel sin Unidad de Cuidados Respiratorios Intermedios. Como objetivo secundario comparar los resultados obtenidos de las distintas terapias.
MétodosEstudio observacional de pacientes tratados con TRNI fuera de un ambiente de Cuidados Intensivos o Unidad de Cuidados Respiratorios Intermedios, diagnosticados de COVID-19 y con síndrome de distrés respiratorio agudo por criterios radiológicos y de ratio SpO2/FiO2. Se desarrolló un modelo multivariante de regresión logística para determinar las variables independientemente asociadas, y se compararon los resultados de la terapia de alto flujo con cánula nasal y la presión positiva continua en la vía aérea.
ResultadosSe trataron 107 pacientes y sobrevivieron 85 (79,4%) a los 90 días. Antes de iniciar la TRNI el ratio medio de SpO2/FiO2 fue de 119,8±59,4. Un mayor score de SOFA se asoció significativamente a la mortalidad (OR 2,09; IC95% 1,34 – 3,27), mientras que la autopronación fue un factor protector (OR 0,23; IC95% 0,06 – 0,91). La terapia de alto flujo con cánula nasal fue utilizada en 63 sujetos (58,9%), y la presión positiva continua en la vía aérea en 41 (38,3%). No se encontraron diferencias entre ellas.
ConclusiónAproximadamente cuatro de cada cinco pacientes tratados con TRNI sobrevivieron a los 90 días, y no se encontraron diferencias significativas entre la terapia de alto flujo con cánula nasal y la presión positiva continua en la vía aérea.
Non-invasive respiratory therapies (NRT) were widely used in the first wave of the COVID-19 pandemic in different settings, depending on availability. The objective of our study was to present 90-day survival and associated factors in patients treated with NRT in a tertiary hospital without an Intermediate Respiratory Care Unit. The secondary objective was to compare the outcomes of the different therapies.
MethodsObservational study of patients treated with NRT outside of an intensive care or intermediate respiratory care unit setting, diagnosed with COVID-19 and acute respiratory distress syndrome by radiological criteria and SpO2/FiO2 ratio. A multivariate logistic regression model was developed to determine independently associated variables, and the outcomes of high flow nasal cannula and continuous positive airway pressure were compared.
ResultsIn total, 107 patients were treated and 85 (79.4%) survived at 90 days. Before starting NRT, the mean SpO2/FiO2 ratio was 119.8±59.4. A higher SOFA score was significantly associated with mortality (OR 2,09; 95% CI 1.34-3.27), while self-pronation was a protective factor (OR 0.23; 95% CI 0.06-0.91). High flow nasal cannula was used in 63 subjects (58.9%), and continuous positive airway pressure in 41 (38.3%), with no differences between them.
ConclusionApproximately 4 out of 5 patients treated with NRT survived to 90 days, and no significant differences were found between high flow nasal cannula and continuous positive airway pressure.
En los momentos iniciales de incertidumbre por la pandemia de COVID-19 se llegó a dudar de la eficacia de las terapias respiratorias no invasivas (TRNI), como la terapia de alto flujo con cánula nasal (TAFCN) o la presión positiva, por sus pobres resultados con virus similares y por el riesgo de contagio al personal sanitario1,2. No obstante, haya sido por pura necesidad ante la falta de camas en Unidades de Cuidados Intensivos (UCI), por sentido común o por instinto de supervivencia, fueron utilizadas ampliamente y ahora se sabe que tuvieron un papel importante3,4. Un metaanálisis reciente concluyó que un 19% de los pacientes hospitalizados requirieron algún tipo de TRNI5 y más aún, para responder a la pregunta sobre su utilidad en el escenario de un ensayo clínico, otro metaanálisis ha concluido que cualquier TRNI es superior a la oxigenoterapia convencional en el escenario de cualquier síndrome de distrés respiratorio agudo (SDRA)6.
En el contexto de la avalancha de pacientes experimentada en marzo de 2020 en Lombardía o Madrid, los Servicios de Neumología se vieron obligados a cerrar filas frente a la COVID-19, en el intento de sobrevivir fuera de un ambiente de Cuidados Intensivos, por la falta de recursos y por el conocimiento previo de las TRNI. Fue así como se puso en boga el desarrollo de Unidades de Cuidados Respiratorios Intermedios (UCRI) para tratar a estos pacientes en la mayor parte de los centros hospitalarios7, pero no en todos. El objetivo principal del estudio fue describir la experiencia de un centro de tercer nivel que no contó con una UCRI ni con la centralización de estas terapias en una planta de Neumología, en términos de supervivencia de los pacientes tratados con TRNI a 90 días y los factores asociados a esta. Como objetivos secundarios, comparar los resultados obtenidos entre la TAFCN y la presión positiva continua en la vía aérea (CPAP).
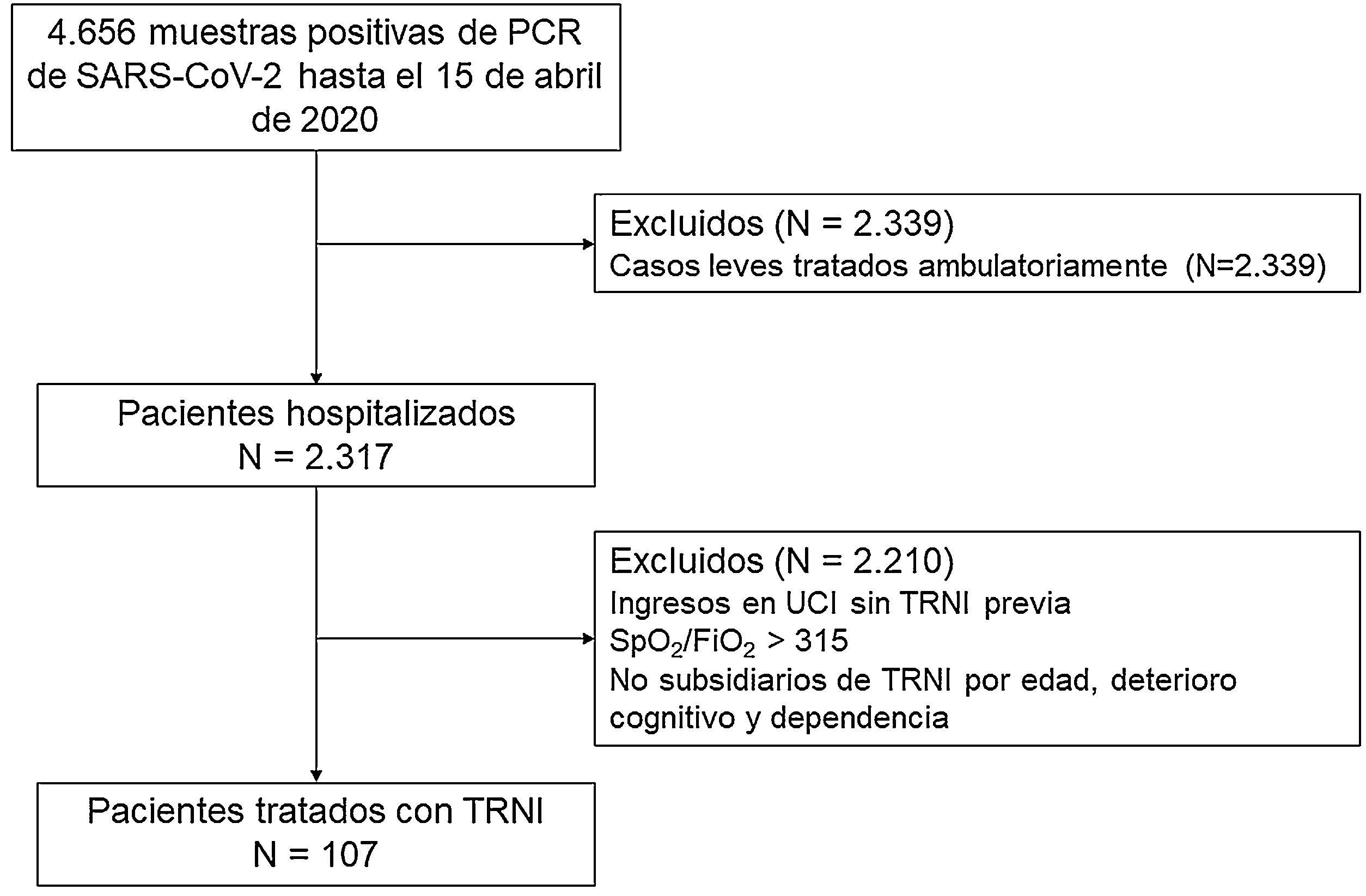
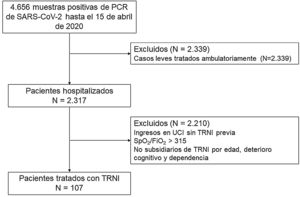
MetodologíaDiseño del estudioEstudio observacional, descriptivo y prospectivo de la cohorte COVID-19 de pacientes consecutivos con insuficiencia respiratoria hipoxémica grave secundaria a un SDRA, tratados con TRNI por el Servicio de Neumología de un hospital terciario de Madrid, España, con un área de aproximadamente 350.000 habitantes. El hospital habitualmente alberga 1.349 camas, incluidas 23 en la UCI, aunque dadas las circunstancias de la pandemia incrementó su capacidad a 1.565 camas, 134 de estas en un ambiente de UCI, con un pico de 1.171 pacientes con COVID-19 ingresados simultáneamente el 29 de marzo de 2020. La cohorte de estudio fue recogida entre el 15 de marzo y 15 de abril, y el seguimiento finalizó el 30 de julio de 2020. El estudio siguió las recomendaciones contenidas en la Declaración de Helsinki y fue aprobado por el Comité de Ética local, quien dispensó el consentimiento informado escrito en vista de la premura del escenario. La redacción del manuscrito siguió la última versión de la Iniciativa STROBE8. Los criterios de inclusión fueron: a) sujetos >18 años; b) reacción en cadena de polimerasa positiva para SARS-CoV-2 en exudado nasofaríngeo; c) infiltrado intersticial o alveolar bilateral documentado mediante radiografía o tomografía computarizada; y d) ratio de saturación por pulsioximetía (SpO2)/fracción inspirada de oxígeno (FiO2) <315. Los criterios de exclusión fueron: a) necesidad de ingreso en UCI para ventilación invasiva sin TRNI previa o la administración de esta durante menos de treinta min con necesidad urgente de intubación orotraqueal; b) edad mayor de 90 años; c) deterioro cognitivo grave; y d) dependencia para las actividades básicas de la vida diaria. Se utilizó el cociente SpO2/FiO2 en lugar del habitualmente utilizado de presión arterial de oxígeno y fracción inspirada de oxígeno (PaO2/FiO2) dada la imposibilidad de obtener muestras arteriales en el contexto de la catástrofe y la dispersión de los pacientes. El diagrama de flujo de pacientes se presenta en la figura 1.
Las TRNI incluyeron TAFCN, CPAP y ventilación mecánica no invasiva (VMNI). El tipo de terapia fue elegido según la disponibilidad de dispositivos, y se administró en cualquier cama del hospital. El dispositivo de TAFCN utilizado fue el AIRVO2® (Fisher and Pykel, Auckland, NZ), mientras que la CPAP o VMNI fue administrada con los respiradores V60®, V680®, Trilogy® EVO, Trilogy® 100 (Philips Respironics, Murrysville, PA, EE. UU.), Astral®150 (ResMed, San Diego, CA, EE. UU.), EOVE®150 (Air Liquide, Paris, Francia), y YH-730® (Yuwell, Danyang, China). La TAFCN se empleó de forma continua, con desescaladas de 5-10% diarios de flujo o FiO2 si la condición clínica del paciente lo permitía. La CPAP se administró en un protocolo de dos h en la mañana, dos h en la tarde y toda la noche para garantizar la tolerancia a la terapia, y si la SpO2/FiO2 permitía descansos a oxigenoterapia convencional porque se empezó a aplicar a partir de los últimos días de marzo como terapia precoz. En los casos con SpO2/FiO2 <100 se propuso de manera continua o con descansos a TAFCN si se disponía del dispositivo. Además, fueron aplicados con tubuladura única con fuga pasiva previamente filtrada para virus con una eficacia del 99,999%, con mascarilla oronasal en la totalidad de casos, y con la adición de oxígeno suplementario a través del mezclador interno de la máquina o con una pieza adaptadora. Se consideró que una TRNI fue bien tolerada si el paciente pudo cumplir más de 24 h de tratamiento. No se reportaron problemas del suplemento de oxígeno en el hospital.
La autopronación consciente se propuso a todos los pacientes sobre todo a partir de la última semana de marzo, cuando se tuvo alguna experiencia vox populi de que mejoraba el intercambio gaseoso. No se siguió un protocolo definido, pero se incluyeron todos los pacientes que pudieron autopronarse al menos tres h por turno y toda la noche. El personal sanitario involucrado en el tratamiento utilizó los equipos de protección individual con la mayor seguridad posible, y la monitorización disponible fue con pulsioximetría continua en aproximadamente dos tercios de los casos. El ingreso en UCI de los pacientes más graves con fallo de otros órganos o no respondedores a TRNI fue discutido con un equipo multidisciplinar de Medicina Intensiva y Anestesiología, en función del pronóstico y evidentemente de la disponibilidad de camas. Los datos fueron obtenidos de los registros electrónicos del centro, que fueron revisados por dos investigadores independientes (DLP y JTT) para reducir la posibilidad de sesgo.
Variables analizadasVariables resultado. La variable principal fue la supervivencia a 90 días después del inicio de TRNI y los factores asociados a esta. Para tal efecto, se recogieron variables clínicas, analíticas, terapéuticas, y las asociadas a las TRNI. Clínicas: edad, sexo, hipertensión arterial, diabetes, obesidad, enfermedad coronaria, enfermedad pulmonar obstructiva crónica, índice de comorbilidad de Charlson ajustado por edad9, fecha de ingreso, fecha del inicio de síntomas, criterio de IOT. Analíticas: conteo absoluto de linfocitos, D-dímero, lactato deshidrogenasa, proteína C-reactiva, y ferritina. Terapéuticas: hidroxicloroquina, lopinavir/ritonavir, azitromicina, corticosteroides, tocilizumab, anakinra e interferón beta. Sobre las TRNI: índice ROX10 en los pacientes tratados con TAFCN, puntuación del Sequential Organ Failure Assessment Score (SOFA) antes del tratamiento, fecha de inicio y fin de la TRNI, ratio SpO2/FiO2 antes del tratamiento, y las h 1, 24, 48 y 72 después de haberse iniciado. Otros tratamientos de soporte como la autopronación o la sedación ligera con morfina y midazolam fueron registrados. También documentaron los contagios de COVID-19 del personal sanitario involucrado directamente en la administración de las TRNI.
EstadísticaLas características basales se presentan de acuerdo con los objetivos del estudio. Las variables cualitativas se presentan como n (%) y las cualitativas como medias±desviaciones estándar, o medianas (rango intercuartílico) según sea el caso. La normalidad de las distribuciones fue evaluada mediante la prueba de Kolmogorov–Smirnov. Las diferencias entre variables cuantitativas fueron analizadas con la prueba de t de Student o la U de Mann-Whitney si la distribución era normal o no, respectivamente. Las variables cuantitativas se compararon con la prueba de chi-cuadrado y la corrección exacta de Fisher. Las variables asociadas con un valor de p ≤ 0,10 a la variable resultado en un modelo de regresión logística sin ajustar fueron incluidas en el modelo multivariante. Los resultados son expresados como odds ratio (OR) e intervalo de confianza al 95% (IC95%), y un valor de p ≤ 0,05 se consideró estadísticamente significativo. Como análisis de sensibilidad, se compararon los subgrupos de pacientes con y sin indicación de IOT, y se analizaron las características de los pacientes sobrevivientes y fallecidos en cada uno de ellos. El análisis estadístico fue realizado con el programa SPSS, versión 22.0 (SPSS Inc., Chicago, IL).
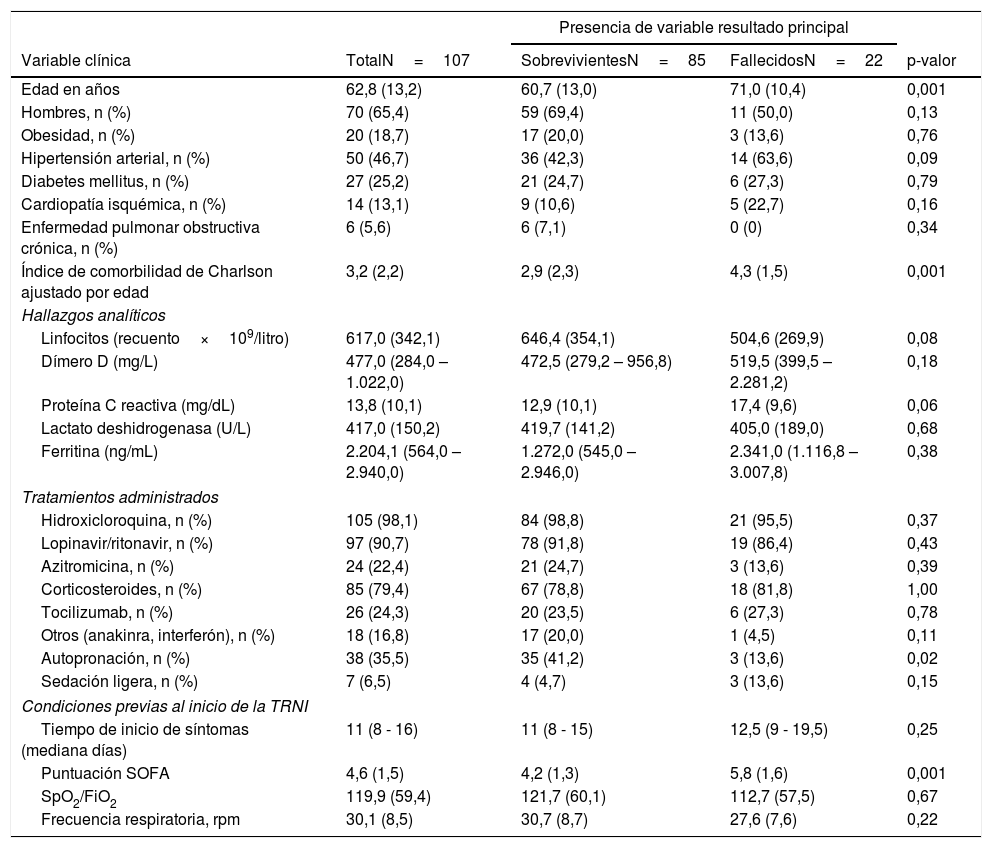
ResultadosSe incluyeron 107 sujetos en el estudio. La edad media fue de 62,8±13,2 años, y 70 fueron hombres (65,4%). Antes de iniciar la TRNI la puntuación media de SOFA fue de 4,7±1,5 y la ratio media de SpO2/FiO2 fue de 119,8±59,4, mientras que 77 sujetos presentaban una ratio SpO2/FiO2 <100 (71,9%). Después de 90 días la supervivencia fue del 79,4% con 85 individuos vivos. Ochenta pacientes habían sido dados de alta (74,8%) y seis permanecían ingresados (5,6%). Un fallecimiento ocurrió en domicilio por progresión de un glioblastoma multiforme metastásico después de haber superado el episodio de COVID-19 en el hospital. De los 25 pacientes «no intubables», a los 90 días habían sobrevivido 13 pacientes (52%), todos ellos de alta en su domicilio. Del total de 82 pacientes intubables, 17 precisaron de ingreso en UCI para ventilación invasiva (15,9% de la cohorte general y 20,7% del subgrupo de intubables). La tabla 1 presenta las características basales, analíticas, terapéuticas y de las condiciones previas al inicio de la TRNI.
Variables clínicas, hallazgos analíticos, tratamientos administrados y las condiciones respiratorias previas al inicio de las terapias respiratorias no invasivas en función de la supervivencia a los 90 días, en un centro de tercer nivel sin Unidad de Cuidados Intermedios
| Presencia de variable resultado principal | ||||
|---|---|---|---|---|
| Variable clínica | TotalN=107 | SobrevivientesN=85 | FallecidosN=22 | p-valor |
| Edad en años | 62,8 (13,2) | 60,7 (13,0) | 71,0 (10,4) | 0,001 |
| Hombres, n (%) | 70 (65,4) | 59 (69,4) | 11 (50,0) | 0,13 |
| Obesidad, n (%) | 20 (18,7) | 17 (20,0) | 3 (13,6) | 0,76 |
| Hipertensión arterial, n (%) | 50 (46,7) | 36 (42,3) | 14 (63,6) | 0,09 |
| Diabetes mellitus, n (%) | 27 (25,2) | 21 (24,7) | 6 (27,3) | 0,79 |
| Cardiopatía isquémica, n (%) | 14 (13,1) | 9 (10,6) | 5 (22,7) | 0,16 |
| Enfermedad pulmonar obstructiva crónica, n (%) | 6 (5,6) | 6 (7,1) | 0 (0) | 0,34 |
| Índice de comorbilidad de Charlson ajustado por edad | 3,2 (2,2) | 2,9 (2,3) | 4,3 (1,5) | 0,001 |
| Hallazgos analíticos | ||||
| Linfocitos (recuento×109/litro) | 617,0 (342,1) | 646,4 (354,1) | 504,6 (269,9) | 0,08 |
| Dímero D (mg/L) | 477,0 (284,0 – 1.022,0) | 472,5 (279,2 – 956,8) | 519,5 (399,5 – 2.281,2) | 0,18 |
| Proteína C reactiva (mg/dL) | 13,8 (10,1) | 12,9 (10,1) | 17,4 (9,6) | 0,06 |
| Lactato deshidrogenasa (U/L) | 417,0 (150,2) | 419,7 (141,2) | 405,0 (189,0) | 0,68 |
| Ferritina (ng/mL) | 2.204,1 (564,0 – 2.940,0) | 1.272,0 (545,0 – 2.946,0) | 2.341,0 (1.116,8 – 3.007,8) | 0,38 |
| Tratamientos administrados | ||||
| Hidroxicloroquina, n (%) | 105 (98,1) | 84 (98,8) | 21 (95,5) | 0,37 |
| Lopinavir/ritonavir, n (%) | 97 (90,7) | 78 (91,8) | 19 (86,4) | 0,43 |
| Azitromicina, n (%) | 24 (22,4) | 21 (24,7) | 3 (13,6) | 0,39 |
| Corticosteroides, n (%) | 85 (79,4) | 67 (78,8) | 18 (81,8) | 1,00 |
| Tocilizumab, n (%) | 26 (24,3) | 20 (23,5) | 6 (27,3) | 0,78 |
| Otros (anakinra, interferón), n (%) | 18 (16,8) | 17 (20,0) | 1 (4,5) | 0,11 |
| Autopronación, n (%) | 38 (35,5) | 35 (41,2) | 3 (13,6) | 0,02 |
| Sedación ligera, n (%) | 7 (6,5) | 4 (4,7) | 3 (13,6) | 0,15 |
| Condiciones previas al inicio de la TRNI | ||||
| Tiempo de inicio de síntomas (mediana días) | 11 (8 - 16) | 11 (8 - 15) | 12,5 (9 - 19,5) | 0,25 |
| Puntuación SOFA | 4,6 (1,5) | 4,2 (1,3) | 5,8 (1,6) | 0,001 |
| SpO2/FiO2 | 119,9 (59,4) | 121,7 (60,1) | 112,7 (57,5) | 0,67 |
| Frecuencia respiratoria, rpm | 30,1 (8,5) | 30,7 (8,7) | 27,6 (7,6) | 0,22 |
Los resultados se presentan como n (porcentaje), media (desviación estándar) o mediana (rango intercuartílico).
rpm: respiraciones por minuto; SOFA: sequential organ failure assessment; TRNI: terapia respiratoria no invasiva.
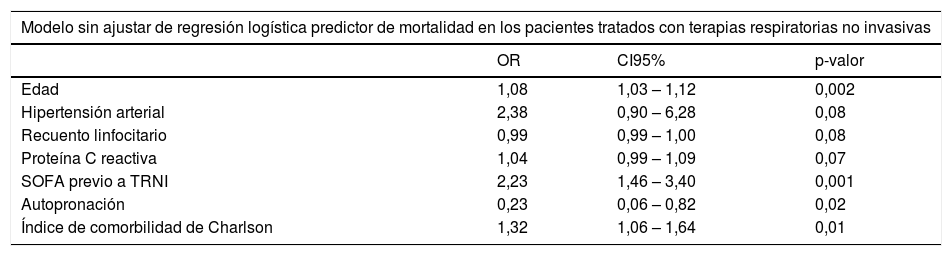
El modelo multivariante ajustado por edad determinó que a mayor puntuación SOFA previo al inicio de TRNI se aumentaba la probabilidad de fallecimiento después de 90 días del cuadro clínico, mientras que la autopronación fue un factor favorable para sobrevivir en este período (tabla 2).
Modelos de regresión logística para determinar las variables asociadas a la supervivencia a los 90 días de los pacientes tratados con terapias respiratorias no invasivas en un centro de tercer nivel sin Unidad de Cuidados Intermedios
| Modelo sin ajustar de regresión logística predictor de mortalidad en los pacientes tratados con terapias respiratorias no invasivas | |||
|---|---|---|---|
| OR | CI95% | p-valor | |
| Edad | 1,08 | 1,03 – 1,12 | 0,002 |
| Hipertensión arterial | 2,38 | 0,90 – 6,28 | 0,08 |
| Recuento linfocitario | 0,99 | 0,99 – 1,00 | 0,08 |
| Proteína C reactiva | 1,04 | 0,99 – 1,09 | 0,07 |
| SOFA previo a TRNI | 2,23 | 1,46 – 3,40 | 0,001 |
| Autopronación | 0,23 | 0,06 – 0,82 | 0,02 |
| Índice de comorbilidad de Charlson | 1,32 | 1,06 – 1,64 | 0,01 |
| Modelo ajustado de regresión logística predictor de mortalidad en los pacientes tratados con terapias respiratorias no invasivas | |||
|---|---|---|---|
| OR | CI95% | p-valor | |
| SOFA previo a TRNI | 2,09 | 1,34 – 3,27 | 0,001 |
| Autopronación | 0,23 | 0,06 – 0,91 | 0,04 |
| Índice de comorbilidad de Charlson | 1,13 | 0,88 – 1,46 | 0,34 |
SOFA: sequential organ failure assessment; TRNI: terapia respiratoria no invasiva.
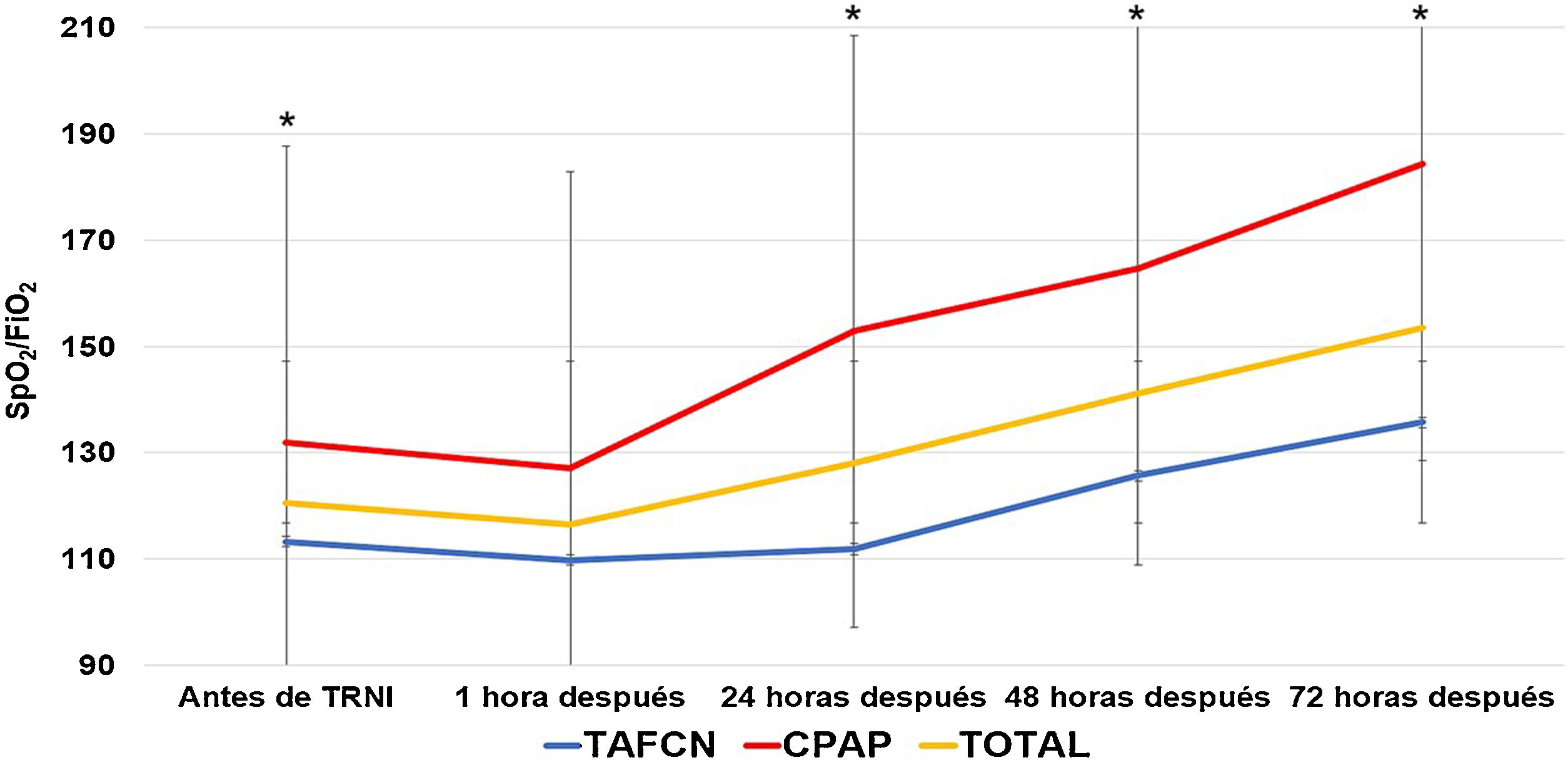
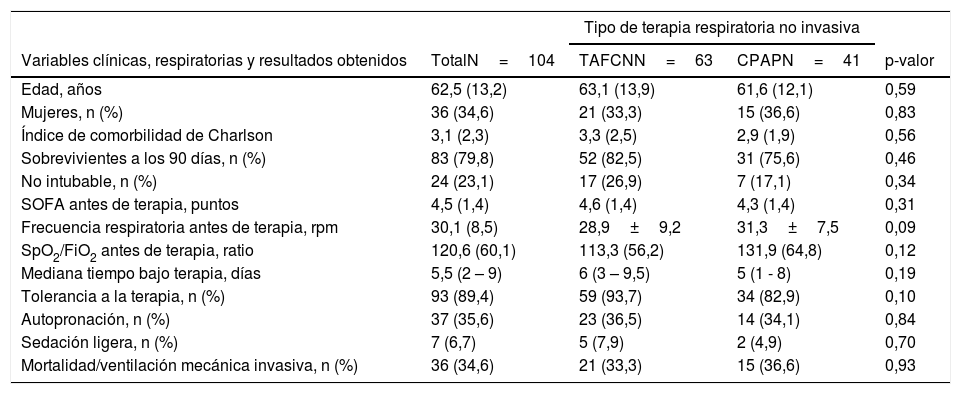
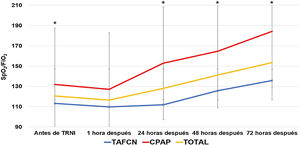
La TRNI más frecuentemente utilizada fue la TAFCN (63 sujetos, 58,9%), seguida por la CPAP (41 sujetos, 38,3%) y la VMNI (3 sujetos, 2,8%). La mediana de tiempo de tratamiento con las TRNI fue de 6,2 días (rango 1-23 días, RIC 2-9), y fueron bien toleradas en 96 casos (89,7%). Los parámetros medios de TAFCN en las primeras 48 h fueron de 50±9,7 L/m y FiO2 de 91,2±9,0, y de 10,2±1,6 cmH2O de CPAP. El índice ROX medio previo al inicio de TAFCN fue de 1,4±1,2, sin encontrarse diferencias (p=0,83) entre el subgrupo de pacientes sobrevivientes a los 90 días (1,4±1,3) y los que fallecieron (1,3±0,7). La tabla 3 presenta las características y resultados obtenidos en función de la TRNI empleada, en la que no se encontraron diferencias significativas en ninguna de las variables analizadas. Independientemente de la TRNI, se observaron diferencias significativas a las 24, 48 y 72 h desde su inicio (fig. 2). Después de una hora de terapia, la frecuencia respiratoria fue significativamente inferior que antes de la TRNI (29,7±8,5 vs. 23,8±10,6 respiraciones/minuto, p=0,001), sin observarse diferencias significativas entre los subgrupos de sobrevivientes y fallecidos.
Variables clínicas, respiratorias y resultados obtenidos en función de la terapia respiratoria no invasiva aplicada, en pacientes tratados en un centro de tercer nivel sin Unidad de Cuidados Intermedios
| Tipo de terapia respiratoria no invasiva | ||||
|---|---|---|---|---|
| Variables clínicas, respiratorias y resultados obtenidos | TotalN=104 | TAFCNN=63 | CPAPN=41 | p-valor |
| Edad, años | 62,5 (13,2) | 63,1 (13,9) | 61,6 (12,1) | 0,59 |
| Mujeres, n (%) | 36 (34,6) | 21 (33,3) | 15 (36,6) | 0,83 |
| Índice de comorbilidad de Charlson | 3,1 (2,3) | 3,3 (2,5) | 2,9 (1,9) | 0,56 |
| Sobrevivientes a los 90 días, n (%) | 83 (79,8) | 52 (82,5) | 31 (75,6) | 0,46 |
| No intubable, n (%) | 24 (23,1) | 17 (26,9) | 7 (17,1) | 0,34 |
| SOFA antes de terapia, puntos | 4,5 (1,4) | 4,6 (1,4) | 4,3 (1,4) | 0,31 |
| Frecuencia respiratoria antes de terapia, rpm | 30,1 (8,5) | 28,9±9,2 | 31,3±7,5 | 0,09 |
| SpO2/FiO2 antes de terapia, ratio | 120,6 (60,1) | 113,3 (56,2) | 131,9 (64,8) | 0,12 |
| Mediana tiempo bajo terapia, días | 5,5 (2 – 9) | 6 (3 – 9,5) | 5 (1 - 8) | 0,19 |
| Tolerancia a la terapia, n (%) | 93 (89,4) | 59 (93,7) | 34 (82,9) | 0,10 |
| Autopronación, n (%) | 37 (35,6) | 23 (36,5) | 14 (34,1) | 0,84 |
| Sedación ligera, n (%) | 7 (6,7) | 5 (7,9) | 2 (4,9) | 0,70 |
| Mortalidad/ventilación mecánica invasiva, n (%) | 36 (34,6) | 21 (33,3) | 15 (36,6) | 0,93 |
Los resultados se presentan como n (porcentaje), media (desviación estándar) o mediana (rango intercuartílico).
rpm: respiraciones por minuto; SOFA: sequential organ failure assessment.
Evolución temporal de la media del ratio de saturación periférica de oxígeno/fracción inspirada de oxígeno (SpO2/FiO2) según la terapia respiratoria no invasiva (TRNI) utilizada. *Diferencias significativas (p < 0,05) al comparar las medias entre sí. TAFCN: terapia de alto flujo con cánula nasal; CPAP: presión positiva continua en la vía aérea.
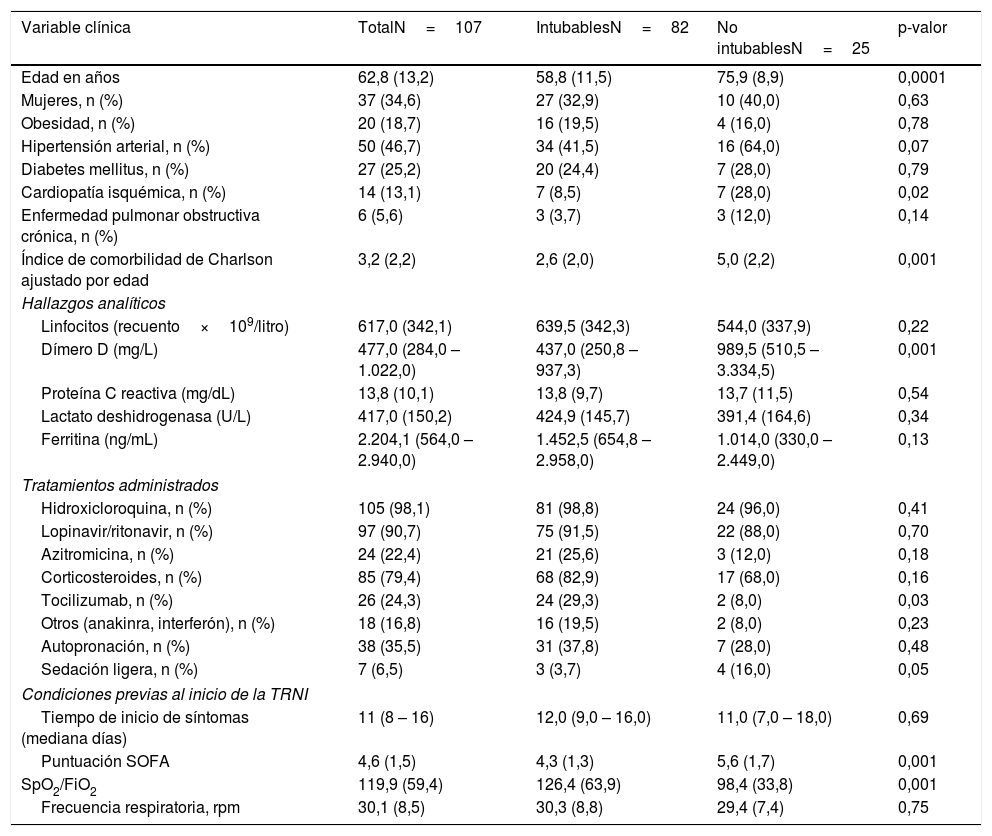
El análisis de sensibilidad en función del criterio de intubación orotraqueal determinó una mayor edad, dímero D y puntuación SOFA en los pacientes no candidatos a intubación, así como una mayor proporcionalidad de cardiopatía isquémica y peor ratio SpO2/FiO2 antes de la TRNI (tabla 4). En el anexo, las tablas 1 y 2 del material online suplementario se presentan las características de los subgrupos de pacientes intubables y no intubables. De 88 miembros del personal sanitario directamente involucrados, 9,1% testaron positivo para SARS-CoV-2, cuatro médicos de 28 (14,3%) y tres miembros de Enfermería de 60 (5%). Finalmente, como complicaciones, un paciente de 84 años presentó un neumotórax que se trató de forma expectante y fue dado de alta sin incidencias.
Variables clínicas, hallazgos analíticos, tratamientos administrados y las condiciones respiratorias previas al inicio de las terapias respiratorias no invasivas en función del criterio de intubación orotraqueal, en un centro de tercer nivel sin Unidad de Cuidados Intermedios
| Variable clínica | TotalN=107 | IntubablesN=82 | No intubablesN=25 | p-valor |
|---|---|---|---|---|
| Edad en años | 62,8 (13,2) | 58,8 (11,5) | 75,9 (8,9) | 0,0001 |
| Mujeres, n (%) | 37 (34,6) | 27 (32,9) | 10 (40,0) | 0,63 |
| Obesidad, n (%) | 20 (18,7) | 16 (19,5) | 4 (16,0) | 0,78 |
| Hipertensión arterial, n (%) | 50 (46,7) | 34 (41,5) | 16 (64,0) | 0,07 |
| Diabetes mellitus, n (%) | 27 (25,2) | 20 (24,4) | 7 (28,0) | 0,79 |
| Cardiopatía isquémica, n (%) | 14 (13,1) | 7 (8,5) | 7 (28,0) | 0,02 |
| Enfermedad pulmonar obstructiva crónica, n (%) | 6 (5,6) | 3 (3,7) | 3 (12,0) | 0,14 |
| Índice de comorbilidad de Charlson ajustado por edad | 3,2 (2,2) | 2,6 (2,0) | 5,0 (2,2) | 0,001 |
| Hallazgos analíticos | ||||
| Linfocitos (recuento×109/litro) | 617,0 (342,1) | 639,5 (342,3) | 544,0 (337,9) | 0,22 |
| Dímero D (mg/L) | 477,0 (284,0 – 1.022,0) | 437,0 (250,8 – 937,3) | 989,5 (510,5 – 3.334,5) | 0,001 |
| Proteína C reactiva (mg/dL) | 13,8 (10,1) | 13,8 (9,7) | 13,7 (11,5) | 0,54 |
| Lactato deshidrogenasa (U/L) | 417,0 (150,2) | 424,9 (145,7) | 391,4 (164,6) | 0,34 |
| Ferritina (ng/mL) | 2.204,1 (564,0 – 2.940,0) | 1.452,5 (654,8 – 2.958,0) | 1.014,0 (330,0 – 2.449,0) | 0,13 |
| Tratamientos administrados | ||||
| Hidroxicloroquina, n (%) | 105 (98,1) | 81 (98,8) | 24 (96,0) | 0,41 |
| Lopinavir/ritonavir, n (%) | 97 (90,7) | 75 (91,5) | 22 (88,0) | 0,70 |
| Azitromicina, n (%) | 24 (22,4) | 21 (25,6) | 3 (12,0) | 0,18 |
| Corticosteroides, n (%) | 85 (79,4) | 68 (82,9) | 17 (68,0) | 0,16 |
| Tocilizumab, n (%) | 26 (24,3) | 24 (29,3) | 2 (8,0) | 0,03 |
| Otros (anakinra, interferón), n (%) | 18 (16,8) | 16 (19,5) | 2 (8,0) | 0,23 |
| Autopronación, n (%) | 38 (35,5) | 31 (37,8) | 7 (28,0) | 0,48 |
| Sedación ligera, n (%) | 7 (6,5) | 3 (3,7) | 4 (16,0) | 0,05 |
| Condiciones previas al inicio de la TRNI | ||||
| Tiempo de inicio de síntomas (mediana días) | 11 (8 – 16) | 12,0 (9,0 – 16,0) | 11,0 (7,0 – 18,0) | 0,69 |
| Puntuación SOFA | 4,6 (1,5) | 4,3 (1,3) | 5,6 (1,7) | 0,001 |
| SpO2/FiO2 | 119,9 (59,4) | 126,4 (63,9) | 98,4 (33,8) | 0,001 |
| Frecuencia respiratoria, rpm | 30,1 (8,5) | 30,3 (8,8) | 29,4 (7,4) | 0,75 |
Los resultados se presentan como n (porcentaje), media (desviación estándar) o mediana (rango intercuartílico).
rpm: respiraciones por minuto; SOFA: sequential organ failure assessment; TRNI: terapia respiratoria no invasiva.
Los hallazgos principales del estudio fueron que en un ambiente sin UCRI, aproximadamente cuatro de cada cinco pacientes tratados con TRNI durante la primera ola de la pandemia había sobrevivido a los tres meses después del episodio agudo, sin encontrarse diferencias entre la TAFCN y la CPAP. A fecha de hoy no conocemos de otros estudios llevados a cabo en este contexto.
Hasta hace poco, la comparación de estos resultados con otros estudios no habría sido sensata dado que las TRNI fuera de UCI no habían sido objeto de estudio. De hecho, en varios trabajos no puede determinarse dónde se aplicaron y buena parte de ellas se aplicó dentro de una UCI11–13. Afortunadamente, se ha publicado en agosto de 2020 la experiencia italiana de nueve UCRI y las denominadas Unidades Respiratorias de Monitorización, equipadas ad hoc para tratar a los pacientes más graves fuera de las UCI de forma centralizada, dado que el norte de Italia se vio colapsado sin poder ofrecer una cama de UCI a pacientes que en otras circunstancias se les habría ingresado sin titubear. En esta serie se determinó que en los 670 pacientes incluidos el uso de las TRNI no se asoció a una mayor mortalidad, que fue del 27% a los 30 días, y que la mayor edad y número de comorbilidades se asociaron significativamente a un peor pronóstico3. A destacar, nuestra serie presentó una puntuación SOFA más grave antes de la TRNI (4,6 frente a 3,3), peor gradiente respiratorio (SpO2/FiO2 120, equivalente a una PaO2/FiO2 <100, frente a la PaO2/FiO2 italiana de 152), y una mortalidad inferior en el triple de tiempo de seguimiento.
Un aspecto de capital importancia trata sobre cuál terapia aplicar de inicio, dado que la heterogeneidad de los abordajes es patente en los consensos de las sociedades científicas. La European Society of Intensive Care Medicine, la Society of Critical Care Medicine14, la Chinese Thoracic Society15, la Australian and New Zealand Intensive Care Society16 y nuestra propia Sociedad Española de Neumología y Cirugía Torácica17 recomiendan la TAFCN como la primera línea de tratamiento, mientras que la National Health System of the United Kingdom18 y la Associazione Italiana Pneumologi Ospedalieri recomiendan CPAP, específicamente mediante helmet en el caso de la italiana19. Por su parte la Sociedad alemana es restrictiva y aconseja que los pacientes con una PaO2/FiO2 ≤ 200 deberían ser intubados y conectados a ventilación mecánica20. Ninguna Sociedad recomienda la VMNI como primera línea de tratamiento. A efectos prácticos, en nuestro caso esto dependió de la disponibilidad de equipos y de la seguridad del personal sanitario, siendo de suma relevancia recordar que nuestros pacientes no estuvieron centralizados y que fueron atendidos por personal de Enfermería no habituado al manejo de TRNI, con lo cual deseamos destacar la labor titánica llevada a cabo por este colectivo irremplazable.
Respecto a la TAFCN, la publicación con más pacientes incluyó a 146 casos de cuatro UCI respiratorias de París, y concluyó que se redujo significativamente la IOT pero no la mortalidad al compararse con oxigenoterapia convencional4. Nuestra SpO2/FiO2 previa a la TRNI también fue inferior que la PaO2/FiO2 de 126 reportada y nuestro SOFA mayor, con una puntuación de 4,6 frente a 4 de la serie francesa. Antes de este trabajo, existían series con pocos sujetos y revisiones de literatura, en los que todos coinciden que debe existir un balance entre el posible efecto beneficioso del alto flujo con la potencial aerosolización en las habitaciones que podría poner en peligro la salud del personal sanitario21–25. De hecho, un documento de opinión de expertos resalta el uso de la TAFCN para pacientes con COVID-19 por su facilidad de uso y comodidad del paciente, siempre y cuando los pacientes estén debidamente monitorizados26. Nuestro grupo está totalmente de acuerdo con este argumento.
Referente a la presión positiva, existen pocas experiencias en la literatura. En la serie italiana referida, la CPAP fue la terapia más utilizada en consonancia con lo propuesto por su Sociedad y se trató a 330 pacientes, de los cuales habían fallecido 100 a los 30 días, es decir una supervivencia del 70%3. Cabe destacar que casi la mitad de este subgrupo fue intubada o falleció al analizar el compuesto de IOT/muerte (156 sujetos, 47,3%) y en la nuestra este porcentaje se acercó al tercio de la población (36,6%), con una presión media de 10,2±1,6 cmH2O, idéntica a la de nuestro grupo. Cabe resaltar que casi todas las CPAP aplicadas en Italia fueron mediante helmet, y las nuestras fueron con mascarilla oronasal. Otro estudio francés reciente reportó resultados aceptables con CPAP al compararse con oxigenoterapia convencional, pero con un seguimiento de siete días y sin especificación de los parámetros27. No obstante, una CPAP con FiO2 menor al 80% probablemente no hubiese sido efectiva y es importante tener en cuenta el uso de dispositivos que permitan alcanzar buenas cifras de FiO2. Una condición preponderante en el uso de las TRNI es la tolerancia a las distintas interfases, entre la que es destacable la mayor tolerancia referida a la TAFCN. En nuestra serie el 83% de los pacientes tratados con CPAP la toleraron adecuadamente, no muy lejano al 86,6% reportado en una serie de 157 pacientes tratados con CPAP y helmet en tres áreas de alta dependencia de Milán28. Nuestro grupo abogó por la no utilización de la VMNI en el SDRA de COVID-19 porque creemos que aumenta la posibilidad de un daño pulmonar autoinducido si no se administra alguna sedación que mejore el esfuerzo y frecuencia respiratorios y en un ambiente más monitorizado, situación que no se presentó en nuestro centro. El uso de VMNI fue anecdótico, en tres pacientes con una clara sospecha de hipercapnia sobreañadida y confirmada gasométricamente, por obesidad y enfermedad pulmonar obstructiva crónica previamente conocidas.
La pronación en pacientes conscientes ha demostrado tener un efecto beneficioso, al menos en trabajos observacionales y en principio siempre combinada con una TRNI29–32. En nuestra serie demostró ser un factor protector de mortalidad y proponemos su uso siempre que sea posible y en un ambiente monitorizado. Brevemente, la puntuación de SOFA se asoció a un peor pronóstico, de acuerdo con lo publicado en otras series33,34. Finalmente, nuestra serie reportó un 9% del personal sanitario contagiado de COVID-19, menor al 11% del trabajo italiano referido en múltiples ocasiones. Se ha hipotetizado que la TAFCN podría ser una fuente de aerosolización peligrosa pero lo cierto es que hay trabajos de banco que proponen que es más segura que la propia mascarilla reservorio35. En todo caso, nunca será suficiente el hincapié en el uso de la mayor protección posible al aplicarse estos tratamientos.
Limitaciones y fortalezasEl presente trabajo tiene varias limitaciones, entre las que destacan cuatro: no se pudo comparar con un grupo control tratado con oxigenoterapia convencional dada la urgencia del escenario y por lo tanto no se puede aseverar que las TRNI influyeron positivamente en la supervivencia; no se utilizó la habitual ratio de PaO2/FiO2 en aras de emplear un parámetro más práctico como la SpO2/FiO2, el cual ha sido validado en numerosos trabajos previos36–38; es un estudio observacional unicéntrico y por tanto sus resultados no son extrapolables a otros hospitales; y no se puede descartar a cabalidad la existencia de un posible sesgo de selección en el caso de los pacientes no intubables. Sobre esta última limitación, sin sorpresa alguna todos los ocho pacientes que se consideraron no candidatos a una TRNI fallecieron durante el ingreso, dada su edad, deterioro cognitivo o grado de dependencia importantes. No obstante, dadas las características catastróficas del escenario, no se pudo determinar por cuántos pacientes con estos criterios de exclusión no fuimos contactados dado que su médico responsable consideró que efectivamente no se habrían beneficiado de terapia alguna. De tal manera que pretendimos utilizar el mismo rasero que en una situación no COVID y por lo tanto tratamos a todos los pacientes que consideramos recuperables como en cualquier otro escenario, todo ello en el contexto lógico de la disponibilidad de los dispositivos. A pesar de estas limitaciones, nuestro trabajo tiene fortalezas. Esta sería la primera serie publicada de pacientes muy graves tratados con TRNI fuera de un ambiente de UCI y UCRI, con el mayor seguimiento publicado hasta la fecha, y con resultados aceptables al ser comparados con otra series.
ConclusionesTodos los caminos llevan a Roma. En el fragor de la batalla se anduvo por vías distintas, pero con el objetivo común de recuperar a pacientes de suma gravedad que no pudieron ingresarse en Cuidados Intensivos. Nuestro estudio destaca el rol desempeñado por el personal de Neumología por el mayor conocimiento de las TRNI y en condiciones verdaderamente extraordinarias, aunque es evidente que dadas sus características no se puede aseverar que fueron las TRNI las causantes únicas o directas de los resultados presentados. En todo caso, reconocemos la idoneidad y coste-efectividad de las UCRI para la aplicación y monitorización de estas terapias.
Autoría/colaboradoresDaniel López-Padilla y José Rafael Terán Tinedo contribuyeron de igual forma a la primera autoría, participaron en la recogida de datos y asumen la responsabilidad de la integridad y precisión de su análisis, al igual que contribuyeron con el diseño del estudio, interpretación, análisis y redacción del documento final.
Francisco José Caballero Segura, Virginia Gallo González, Beatriz Recio Moreno, Zichen Ji, Christian Castro-Riera, Elena Ojeda Castillejo, Manuel Desco Menéndez, Paola Benedetti, Alicia Cerezo Lajas, Javier de Miguel-Díez, Irene Milagros Domínguez Zabaleta, Alicia Ferreira Moreno, Marta Fuentes-Alonso, Julia García de Pedro, Javier García López, Walther Iván Girón Matute, Rosa M. Gómez García, Katiuska Liendo Martínez, Alicia Oliva Ramos, Virginia Parra León, Fernando Pedraza Serrano, Gema Sánchez Muñoz, Pilar Sanz Sanz, Sergio Suárez Escudero, Julio Vargas Espinal, Iago Sousa Casasnovas y Felipe Díez del Hoyo contribuyeron con la interpretación y redacción del documento final.
Soledad López Martín y Luis Puente Maestú contribuyeron sustancialmente con el diseño del estudio, interpretación, análisis y redacción del documento final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.