En la cirrosis, algunas sustancias tóxicas se acumulan en el cerebro y alteran la expresión de diversos receptores neuronales. En este sentido, se ha propuesto el uso de plantas medicinales como el Rosmarinus officinalis L. en diversas patologías debido su actividad hepatoprotectora, antioxidante y neuroprotectora. En el presente trabajo se evaluó la expresión de las subunidades NR1, NR2A y NR2B del receptor a Glutamato en la corteza prefrontal de la rata en un modelo de daño hepático inducido con tetracloruro de carbono después del tratamiento con Rosmarinus officinalis L.
MétodosSe utilizaron un total de 24 ratas macho Wistar de 80-90g. de peso corporal. Se formaron 3 grupos de trabajo: grupo testigo (T) sin ningún tratamiento, grupo tetracloruro de carbono (CCl4) y grupo CCl4 más Rosmarinus officinalis L (CCl4 +ROM; 1.5g/kg del extracto por vía oral).
ResultadosLa expresión de las subunidades NR1, NR2A y NR2B incrementaron en los animales cirróticos con respecto al grupo T, sin embargo el tratamiento con Rosmarinus officinalis L fue capaz de disminuir la expresión a niveles normales comparados con los grupos de CCl4 y T. Estos resultados podrían deberse a una mejora en la función hepática.
ConclusiónEl tratamiento con el extracto de Rosmarinus officinalis L en los animales cirróticos modifica la expresión de las subunidades del receptor NMDA debido a la mejora en la función hepatocelular dada la presencia de compuestos antioxidantes y flavonoides.
In cirrhosis some toxic substances accumulate in brain and modify the expression of several neuronal receptors. Thus, the use of medicinal plants such as Rosmarinus officinalis L. has been proposed in several pathologies due to its hepatoprotective, antioxidant and neuroprotective activity. In this study we evaluated the expression of the subunits NR1, NR2A and NR2B of the glutamate receptor in rat prefrontal cortex in a model of hepatic damage induced with carbon tetrachloride after a treatment with Rosmarinus officinalis L.
MethodsWe used a total of 24 male Wistar rats weighing 80-90g. body weight. We formed three study groups: control group (C) without a treatment, carbon tetrachloride group (CC14), and CC14 group plus Rosmarinus officinalis L (CCl4+ROM; 1.5g/kg of extract orally).
ResultsThe expression of the NR1, NR2A and NR2B subunits in cirrhotic animals increased compared to the control group, however treatment with Rosmarinus officinalis L. was able to reduce this expression to normal levels compared with CC14 and CCl4+ROM groups. These results could be due to an improvement in hepatic function.
ConclusionTreatment with extract of Rosmarinus officinalis L. in cirrhotic animals modifies the expression of subunits of the NMDA receptor due to an improvement in hepatocellular function in the presence of antioxidant compounds and flavonoids.
La cirrosis hepática es un estado patológico que se presenta cuando se produce daño crónico al hígado y como resultado provoca cicatrización diseminada del tejido, lo que impide que el flujo sanguíneo circule de manera libre a través del tejido cicatrizante1. Los mecanismos que originan la cirrosis son el alcohol y el daño hepático crónico secundario debido a infección por virus de hepatitis B o C. Sin embargo, se sabe que el daño tisular por estrés oxidativo es uno de los factores importantes presente en el fallo hepático2. Por otro lado, el uso de modelos experimentales de daño hepático han sugerido algunos mecanismos potenciales en el desarrollo de esta patología, además han demostrado su efecto sobre otros órganos como el cerebro, que podría desencadenar el inicio de la encefalopatía hepática (EH)3. En la EH la alteración de la función cerebral es consecuencia de un fallo previo en la función normal del hígado4. Este fallo deteriora el proceso de detoxificación del amoníaco y de otras sustancias tóxicas que pueden llegar al cerebro y alterar su función5. Uno de los factores que contribuye a las alteraciones neurológicas debidas al fallo hepático tanto aguda como crónica es la hiperamonemia5.
El sistema de neurotransmisión que más se ha involucrado en el fallo hepático es el glutamatérgico6. Las alteraciones de este sistema afectan la función de los receptores NMDA (N-Metil-D-aspartato) y de algunos transportadores al glutamato (Glu), condición que se ha relacionado con el deterioro cognitivo y motor de sujetos con EH7. Se ha reportado que el fallo hepático aguda disminuye la expresión del transportador a Glu de tipo astrocítico (GLT-1) e induce un incremento en la concentración extracelular de Glu en diferentes regiones cerebrales8,9. Por su parte, diferentes modelos de hiperamonemia crónica y fallo hepático crónica han mostrado una disminución en los sitios de unión a receptores NMDA en la corteza cerebral, hipocampo, cuerpo estriado y tálamo10. Se ha sugerido que esta disminución se presenta como una respuesta adaptativa de los receptores para evitar su sobreactivación. Cabe mencionar que la hiperamonemia o fallo hepático aguda no modifican la unión de estos receptores11. Por otro lado, se ha reportado que bajo condiciones de daño hepático algunas sustancias tóxicas pueden llegar al cerebro y provocar cambios morfológicos únicamente sobre los astrocitos; sin embargo, en modelos de hepatotoxicidad inducida con tetracloruro de carbono (CCl4) se ha reportado la existencia de muerte neuronal mediada por mecanismos de excitotoxicidad vía activación de receptores NMDA, similar a lo observado en isquemia cerebral12,13.
El tratamiento de la cirrosis es costoso y aumenta al avanzar la enfermedad. La incidencia de enfermedades asociadas a fallo hepático, como la EH, es alta y afecta notablemente la calidad de vida de un gran número de personas, pudiendo conducir en sus estados avanzados al coma y a la muerte14. Además, y a pesar de los avances en el conocimiento de las enfermedades del hígado, no existe un tratamiento efectivo. Las estrategias terapéuticas están encaminadas al manejo paliativo que retrasa la aparición de la sintomatología asociada a la cirrosis y consiste principalmente en dietas con bajo contenido de grasas y en suplementos vitamínicos15. El único tratamiento efectivo por el momento es el trasplante de hígado con el cual se logra la sobrevida de hasta un 70% durante el primer año posterior a la cirugía15. Por otro lado, se ha propuesto que las plantas medicinales constituyen una alternativa viable para resolver en buena medida los problemas de salud. Así, tanto la etnobotánica como la medicina popular han reportado una gran variedad de plantas medicinales, utilizadas en las enfermedades gastrointestinales con efecto hepatoprotector debido a su alto contenido de compuestos hidroxifenólicos; por ejemplo, se ha demostrado que la silymarina, que es un compuesto obtenido del Silybum marianum [Asterácea], presenta efecto hepatoprotector contra múltiples daños al hígado16. Además, se ha reportado la efectividad de una mezcla de 7 plantas llamada HD-03 en diferentes modelos de hepatotoxicidad, que es capaz de regular el metabolismo del amoníaco y disminuir las características morfológicas neuronales bajo el modelo EH por la administración crónica de CCl417. Por otro lado, se sabe que el extracto obtenido del Rosmarinus officinalis L contiene flavonoides, fenoles, aceites volátiles, terpenos y posee alta actividad antioxidante; la cual ha sido atribuida al carnosol y al ácido carnósico (AC)18. En este sentido, trabajos previos obtenidos en el laboratorio se ha demostrado que el extracto de Rosmarinus officinalis L posee efecto hepatoprotector contra la inducción de cirrosis hepática en un modelo de administración crónica de CCl419, así como un efecto protector sobre la morfología neuronal y la expresión del ARNm para el trasportador GLT-120. En este sentido, el propósito de este estudio fue evaluar la expresión de las subunidades NR1, NR2A y NR2B del receptor a glutamato en la corteza prefrontal de ratas con daño hepático inducido con CCL4 después del tratamiento con Rosmarinus officinalis L.
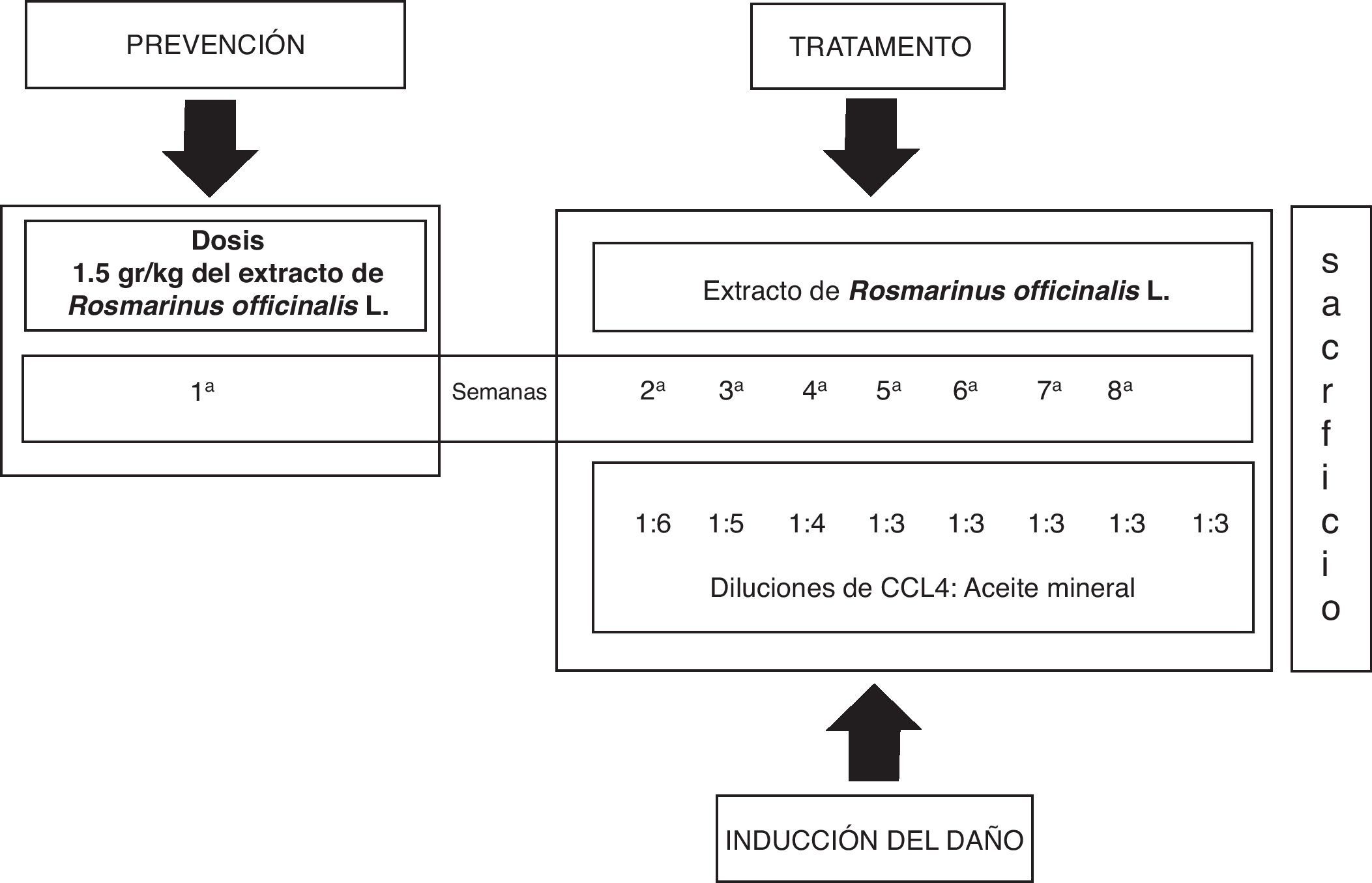
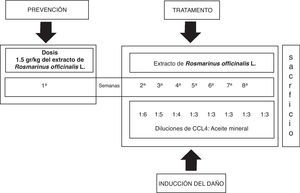
Sujetos y métodosTodos los experimentos se llevaron a cabo de acuerdo con la Guía para el cuidado y uso de animales de laboratorio del Instituto Nacional de Salud (NIH Publicación N.° 8023, 1978). En este estudio se incluyeron 24 ratas macho de la cepa Wistar, con un rango de peso corporal entre 80-90 g, que fueron mantenidas en condiciones estándar de bioterio con ciclos luz-obscuridad 12:12 y acceso libre al agua y a la comida. Se conformaron tres grupos de trabajo: grupo testigo (T) sin ningún tratamiento, grupo de CCl4 y grupo CCl4 más el extracto de Rosmarinus officinalis L (CCl4+ROM; 1,5 g/kg del extracto por vía oral). Los tratamientos se administraron 3 veces a la semana durante 8 semanas.
Inducción del daño hepático con CCl4 y tratamiento con el extracto de Rosmarinus officinalis LEl daño al hígado fue inducido con la aplicación intraperitoneal de 0,2ml de una mezcla de CCl4 y aceite mineral en proporciones 1:1 (v/v), 3 veces a la semana durante 8 semanas en volúmenes decrecientes de la mezcla inicial de aceite mineral y CCL4; primera semana 1:6, segunda semana 1:5, tercera semana 1:4 y la cuarta semana 1:3 hasta la octava semana21. El extracto de la planta fue administrado por vía oral antes del daño hepático (1,5 g/kg de peso corporal) durante una semana previa a la administración del CCL4. El tratamiento continuó el día 8, una hora antes de la administración del CCl4, después cada tercer día durante 8 semanas (fig. 1).
Preparación del extractoLa planta fue recolectada en los meses de julio y agosto de 2009 en el ejido de San Javier, ubicado en la carretera la Barca Atotonilco en Guadalajara, Jalisco, México. Un ejemplar fue identificado (número de registro IBUG-156 409) y fue depositado en el herbario del Instituto de botánica de la Universidad de Guadalajara. Las hojas fueron secadas a la sombra a 22°C. Posteriormente, de 1kg de hojas se realizó una primera extracción con 5 litros de n-hexano a 60°C por 1h. Una segunda extracción se realizó con 2 l de n-hexano. El líquido resultante se extrajo con 6 l de etanol al 60% a 60°C durante 2 h. El extracto se filtró y el residuo se lavó con 2 l de etanol (60%) a 60°C. Por último, se evaporó en un rotavapor (modelo R152 de Rotavapor Buchi) a 40°C y fue almacenado a –20°C hasta el día de su utilización.
Experimentos de biología molecularVeinticuatro horas después de los tratamientos los animales de los tres grupos fueron sacrificados por decapitación. Se extrajo el encéfalo en condiciones asépticas y se utilizó material previamente estéril para disecar la corteza prefrontal. El tejido fue pesado y almacenado a –70°C hasta el día de su utilización para la extracción del ácido ribonucleico (ARN) total.
Obtención y cuantificación del ácido ribonucleico totalLa extracción del ARN total se realizó mediante el método de isotiocianato de guanidina22. El precipitado de ARN que se formó fue suspendido en agua tratada con dietil pirocarbonato al 1%. La cantidad y la calidad del ARN extraído fueron evaluadas mediante el índice de absorbancia de 260/280nm, considerándose óptimas aquellas muestras cuyo índice de absorbancia fue de 1,7 a 2,0.
Transcriptasa reversa y reacción en cadena de la polimerasa semicuantitativaPara la síntesis del ácido desoxirribonucleico complementario (ADNc) se utilizó la transcriptasa reversa del virus de la leucemia murina de Molovney. Se tomaron 2 μg de ARN de cada muestra y se adicionó agua estéril a un volumen total de 6μl. Las muestras se desnaturalizaron a 70°C durante 10 min. Inmediatamente después fueron incubadas en baño de hielo con agitación continua durante 5 min. Posteriormente, se adicionó un volumen total de 14μl de la mezcla de retrotranscriptasa, la cual consistió en lo siguiente; amortiguador para RT 5X, dNTP (desoxinucleótidos trifosfatados 2,5mM) (ditiotreitol 1,0mM), indicadores aleatorios (random primers) 1μg/μl e inhibidor de ARNsa (1 U/μl). La mezcla fue incubada con la transcriptasa reversa (200 U/μl) a 37°C durante 1 h. Con una etapa final de 95°C durante 10 min y al final se le adicionaron 5μl de agua estéril.
Para la reacción en cadena de la polimerasa, se utilizó una mezcla de reacción con la siguiente composición: agua estéril inyectable, iniciadores correspondientes a los genes de interés (tabla 1) dNTP (2,5mM), amortiguador 10X para PCR, MgCl2 (50mM), ADNc y Taq ADN polimerasa (1 U/μl).
Secuencias de oligonucleótidos utilizados para PCR semicuantitativa
| Subunidad | Gen BANK | Secuencia | Producto | Ciclos |
| NR1 | Posición 1915-2765NM_017010 | 5′-CTGGACTCATTTATGCAGCCTTTTCAGAGC-3′5′-GAGATCGCCTACAAGCGACACAAGGATGCC-3′ | 879 pb | 28 |
| NR2A | Posición 1868-2734NM_012573 | 5′-CCTTCTGCTTTCCTCGAACCCTTCAGTGCC-3′5′-GAGCACCTCTTCTACTGGAAGCTGCGCTTC-3′ | 906 pb | 24 |
| NR2B | Posición 2431-2857NM_012574.1 | 5′- ATATCCGTAATAACTATGCAGAAATGCATG -3′5′- CATCTGTTCTATTGGCAGTTCCCGCATTGC -3′ | 466 pb | 24 |
| β-actina | Posición 684-1201NM_031144 | 5′-CACCACAGCTGAGAGGGAAATCGTGCGTGA-3′5′- ATTTGCGGTGCACGATGGAGGGGCCGGACT-3 | 518 pb | 25 |
A las reacciones de amplificación se les adicionó aceite mineral para evitar su evaporación y las condiciones del termociclador fueron de una primera etapa 95°C por 5 min y se corrieron en forma automática por el número de ciclos que se especifica en la tabla 1. Cada ciclo consistió de 95°C por 1 min, 60°C por 1 min y 72°C por 1,5 min, con una etapa final de extensión a 72°C por 5 min. Además, se utilizó como control de la PCR la expresión del gen para β-actina.
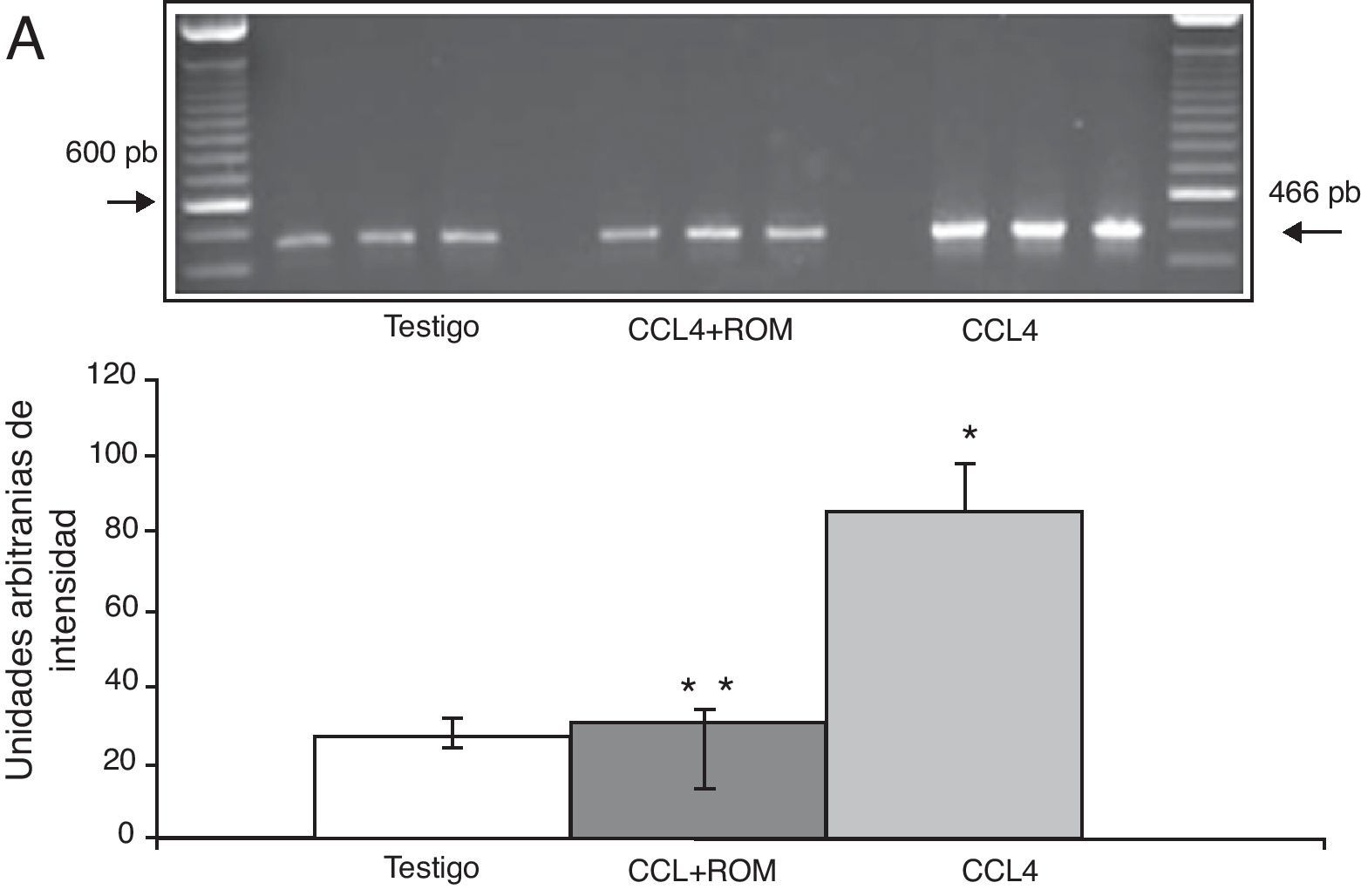
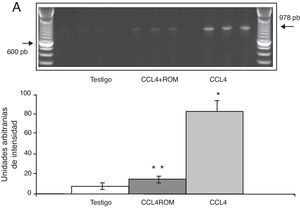
Los productos amplificados de la PCR se analizaron en una cámara horizontal de electroforesis, junto con un marcador de peso molecular de 100 pb en un gel de agarosa al 1,5% que contenía bromuro de etidio 0,5mg/ml por 45 min a 70 voltios en amortiguador TBE 1X (Tris-borato-EDTA). La intensidad de las bandas fue determinada mediante el sistema de fotodocumentación equipado con un software de análisis (Molecular Image Gel Doc XR System Quantity One 1-D Analysis Software). Los valores para la expresión de cada receptor se calcularon y normalizaron contra el área representada por la expresión del gen constitutivo para la β-actina. Los resultados son expresados en unidades arbitrarias del área por la intensidad máxima.
Análisis estadísticoPara la evaluación estadística de los datos se utilizó el análisis de varianza de una vía (ANOVA) y como prueba post hoc se usó la prueba Tukey para comparar los diferentes grupos de estudio. El nivel de significación aceptado fue p≤0,05.
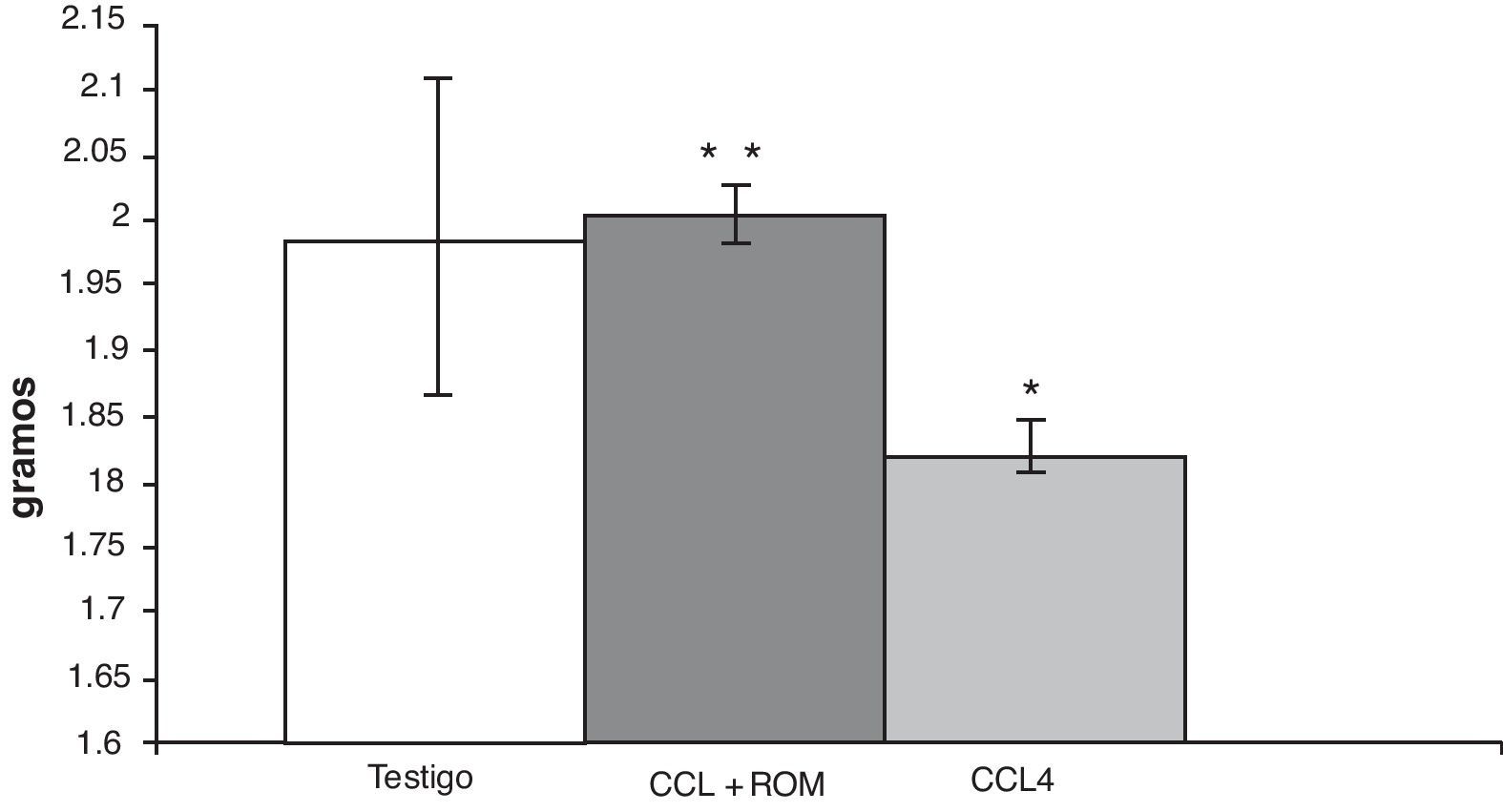
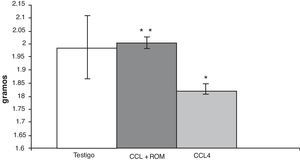
ResultadosPeso cerebralEn los animales del grupo CCl4, el análisis del peso cerebral mostró una disminución (180±5) de aproximadamente 10% en comparación con los animales del grupo T (197±3) y de aquellos cirróticos que recibieron el tratamiento con el extracto Rosmarinus officinalis L (200±5) (fig. 2).
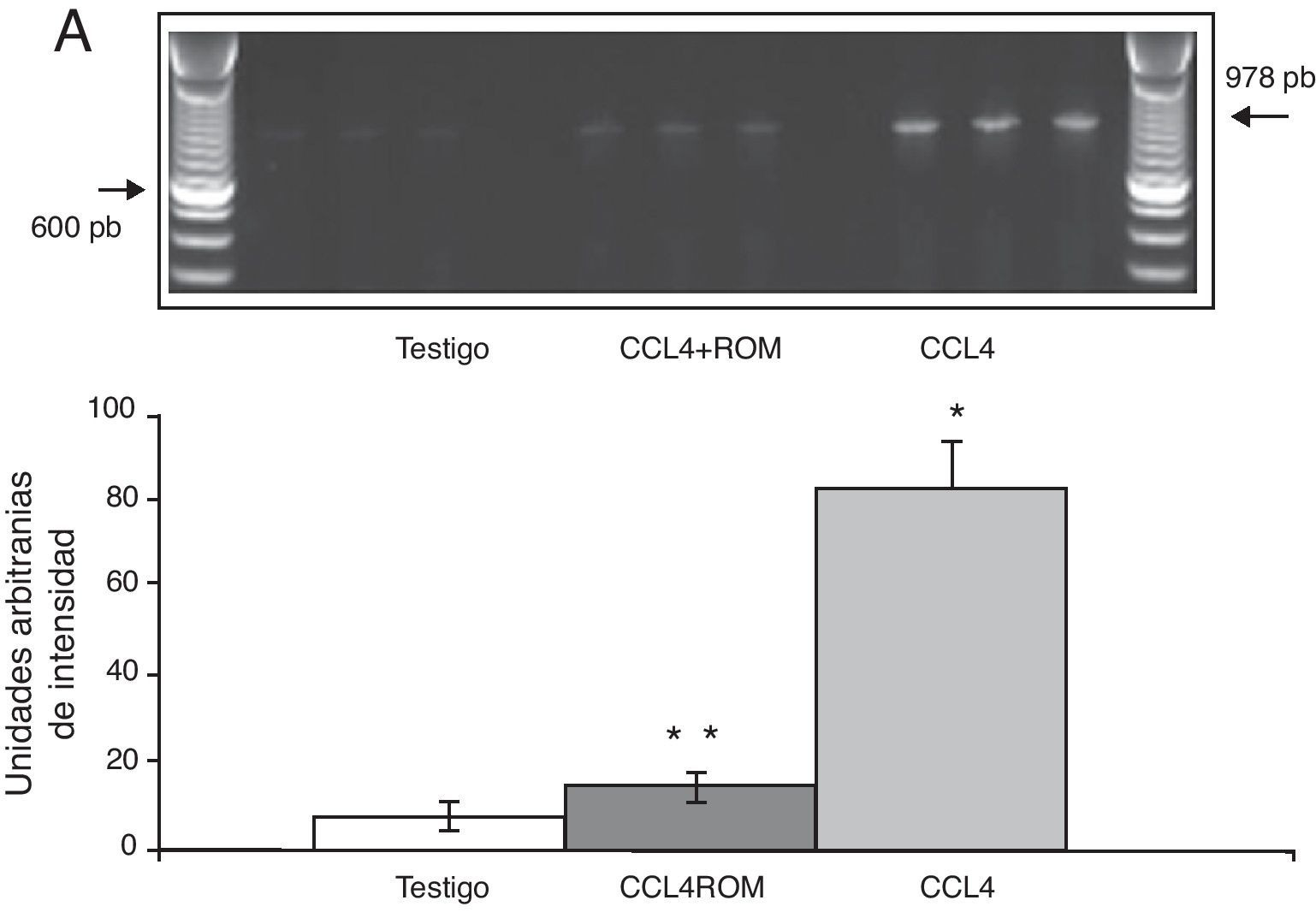
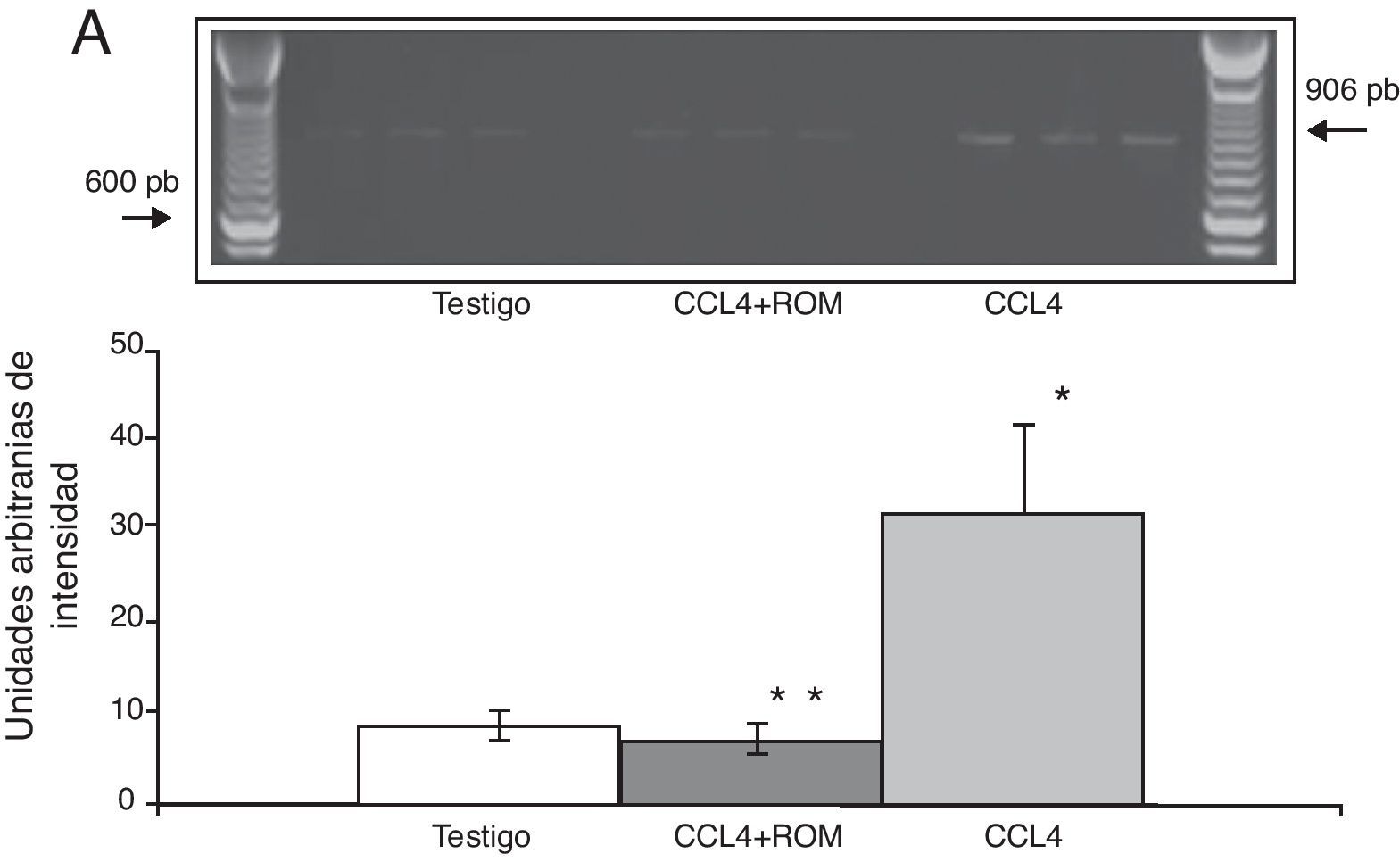
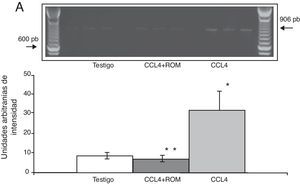
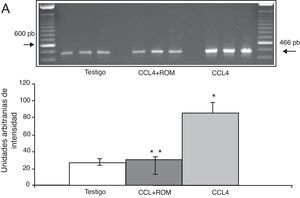
Expresión de las subunidades NR1, NR2A y NR2B del receptor NMDAPor su parte, la expresión del ARNm para la subunidades NR1 en la corteza prefrontal de la rata mostró un importante incremento en los animales a los cuales se les indujo el daño hepático (85±6) en comparación con los animales del grupo T (10±2) y CCL4+ROM (12±6) (fig. 3), en tanto que la expresión de la subunidad NR2A mostró un leve incremento los animales cirróticos (35±6) respecto a la subunidad NR1 como con los animales del grupo T (10±3) y CCL4+ROM (9.5±3) (fig. 4). Por último, se pudo observar que la expresión de la subunidad NR2B del receptor NMDA en la corteza prefrontal de la rata mostró un incremento estadísticamente significativo en los animales a los cuales se les indujo el daño hepático (90±5) en comparación con los animales del grupo T (10±5) y CCL4+ROM (9,5±5) (fig. 5). Cabe mencionar la marcada expresión de esta subunidad con respecto a las otras subunidades en los animales cirróticos, así como en aquellos a los cuales se les administró el extracto.
El buen estado del organismo depende del adecuado funcionamiento e interacción que existe entre los diferentes órganos. De manera específica, el hígado y el cerebro interactúan estrechamente dado que el hígado provee de nutrientes al cerebro que no puede producir por sí mismo y remueve sustancias tóxicas de la sangre, incluyendo aquellas que son liberadas por el propio cerebro (neurotóxicos) u otros órganos y que tienen que ser liberadas fuera de este. Por lo que, la disfunción del hígado puede causar alteraciones importantes en la función cerebral23. Los resultados obtenidos en el presente estudio mostraron que el hígado de los animales con daño hepático inducido con CCl4 exhiben características propias de daño hepático20,21, con modificaciones en el peso cerebral y la expresión del ARNm para las subunidades NR1, NR2A y NR2B del receptor NMDA en la corteza prefrontal.
Debido a la estrecha interacción que existe entre el hígado y el cerebro, probablemente la síntesis y aporte de nutrientes necesarios para el mantenimiento de la funcionalidad cerebral disminuye tras el daño hepático inducido con CCl45, lo cual podría provocar la reducción en el número de conexiones nerviosas que se establecen en el cerebro de manera natural y que probablemente se vea reflejada como una reducción del peso cerebral del grupo CCl4. Lo interesante es que el tratamiento del extracto administrado a los animales cirróticos mantuvo el peso cerebral sin cambios en comparación con el grupo de animales T.
Por su parte, la expresión del ARNm de las subunidades NR1, NR2A y NR2B del receptor NMDA se incrementan de manera significativa en los animales tratados con CCl4. En este sentido, se ha reportado que el daño hepático inducido con diferentes agentes hepatotóxicos, hiperamonemia o bien por la ligadura de los conductos biliares no modifica la unión de los receptores NMDA, sin embargo cambia la funcionalidad de los mismos10,24,25. En este sentido, se podría pensar que algunas de sus subunidades como componente estructural se modifican y, por consiguiente, la funcionalidad del receptor. A la fecha no se ha reportado la expresión de subunidades del receptor NMDA a nivel cerebral bajo condiciones de daño hepático.Cabe mencionar que el receptor NMDA al ser una estructura tetramérica funcional requiere de la presencia estructural de la subunidad NR1 y de la NR2, esta última es la encargada de reconocer al glutamato. Así, la función integral del receptor depende de la variabilidad en la composición de las subunidades que lo componen26. De manera particular, se ha reportado que la presencia de la subunidad NR2B en el receptor protege a la neurona de algún estimulo nocivo, en tanto que la NR1 y NR2A, según sus características electrofisiológicas, son más susceptibles al daño, dado que cuando se activan esta combinación de subunidades provoca que el canal dure más tiempo abierto26 y promueva el daño neuronal. En este sentido, los resultados de expresión de NR1 y NR2B fue mucho mayor en comparación con la subunidad NR2A, tanto animales cirróticos como en aquellos a los que se les dio el tratamiento con el extracto Rosmarinus officinalis L. Esto podría sugerir que el modelo de cirrosis hepática inducida con CCL4 podría desarrollar un mecanismo adaptativo diferente al reportado con otros modelos de daño hepático y EH, y que el incremento en la expresión de NR2B tanto en animales cirróticos como después del tratamiento con el extracto podría proteger a la neurona de sustancias tóxicas que pudieran desencadenar mecanismos de muerte o daño neuronal. Sin embargo, bajo este modelo de inducción de daño hepático con CCl4 se ha observado daño neuronal en la corteza prefrontal20. Al respecto muy probablemente los cambios en la expresión de las subunidades del receptor no fueron los suficientes como para tener un efecto protector sobre la neurona. Sin embargo, no hay que descartar la posibilidad de la puesta en marcha de un mecanismo de respuesta propio del modelo utilizado o bien la participación de otro tipo de receptores. Por otro lado, se ha demostrado que el daño hepático provoca una disminución en la expresión tanto de la proteína como del ARNm para el GLT-1, así como un incremento en la concentración extracelular de Glu9,11,20, condición que puede sobreactivar a los receptores NMDA e incrementar la entrada de calcio en la neurona posináptica y causar daño neuronal.
Las modificaciones en la expresión de las subunidades del receptor NMDA podría estar relacionada con el incremento en el número de astrositos, ya que se sabe que durante el daño hepático los niveles de amonio se encuentran elevados en el flujo sanguíneo27 y podría ser responsable del incremento en la expresión de las subunidades NR1, NR2A y NR2B del receptor tipo NMDA que expresan los astrocitos28.
El mecanismo de acción mediante el cual el extracto de Rosmarinus officinalis L ejerce su efecto no se conoce por completo; sin embargo, la presencia de antioxidantes y flavonoides son una posible explicación, por ejemplo se ha reportado que uno de sus componentes el AC posee efectos neuroprotectores y es capaz de penetrar la barrera hematoencefálica. Se ha demostrado que el AC activa la vía transcripcional de Keap1/Nrf2 y protege a las neuronas del estrés oxidativo y de la excitotoxicidad29. Los resultados del presente trabajo sugieren que el extracto además del efecto hepatoprotector que presenta, dado su alto contenido en polifenoles y a su actividad antioxidante8 podría ser utilizado como una sustancia neuroprotectora en patologías con alteración de la función cerebral a consecuencia de el fallo hepático. Sin embargo, son necesarios más estudios para evaluar la actividad de algunas enzimas implicadas en el metabolismo del glutamato, así como evaluar algunas enzimas con actividad antioxidante que activarían la vía Keap1/Nrf2; esto permitirá elucidar el mecanismo molecular de acción del extracto de Rosmarinus officinalis L a nivel cerebral.
FinanciaciónTrabajo parcialmente financiado por el Fondo COECYTJAL-UDG mediante el folio del proyecto PS-209-515.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.