La muerte súbita (e inesperada) en epilepsia (MSE) es la causa más frecuente de muerte prematura en este grupo de pacientes. La gran mayoría de los casos de MSE ocurren durante la noche, y por lo tanto no son observados, por lo que el mecanismo patológico exacto no ha sido aclarado aún. A pesar de ello la mayoría de los casos de muerte no explicable en pacientes con crisis epilépticas pueden atribuirse a una complicación poco frecuente pero muy grave de las mismas.
DesarrolloSe realiza un proceso de revisión de la literatura basada en una búsqueda sistemática y completa de publicaciones indexadas en PubMed. En esta revisión se resumen los principales desarrollos en clasificación, mecanismos fisiopatológicos, factores de riesgo, biomarcadores y prevención de MSE y se discuten nuevas áreas de investigación, valorándose de forma crítica una serie de conclusiones relevantes para la práctica clínica.
ConclusionesSegún el estado actual de conocimiento la MSE es probablemente un fenómeno heterogéneo con diferentes causas. Sin embargo, en la mayoría de los casos la causa más probable es una insuficiencia cardiorrespiratoria postictal, desencadenada por crisis generalizadas tónico-clónicas y que finalmente conduce a un paro cardíaco. La fisiopatología subyacente engloba probablemente múltiples factores, incluyendo tanto una predisposición genética como factores ambientales. Jóvenes adultos con crisis tónico-clónicas generalizadas no controladas están en mayor riesgo de fallecer por MSE. No obstante, también pacientes con un riesgo aparentemente bajo pueden sufrir una MSE. Actualmente se encuentran en investigación biomarcadores genéticos y de neuroimagen que podrían mejorar la identificación de pacientes de alto riesgo. La única medida preventiva demostrada hasta ahora es una terapia eficaz con antiepilépticos. Posiblemente una vigilancia del paciente durante la noche, así como una reanimación prematura podrían reducir la MSE.
Sudden unexpected death in epilepsy (SUDEP) is the most frequent cause of premature death in epileptic patients. Most SUDEP events occur at night and frequently go unnoticed; the exact pathophysiological mechanisms of this phenomenon therefore remain undetermined. Nevertheless, most cases of SUDEP are attributed to an infrequent yet extremely severe complication of epileptic seizures.
DevelopmentWe conducted a systematic literature search on PubMed. Our review article summarises scientific evidence on the classification, pathophysiological mechanisms, risk factors, biomarkers, and prevention of SUDEP. Likewise, we propose new lines of research and critically analyse findings that are relevant to clinical practice.
ConclusionsCurrent knowledge suggests that SUDEP is a heterogeneous phenomenon caused by multiple factors. In most cases, however, SUDEP is thought to be due to postictal cardiorespiratory failure triggered by generalised tonic-clonic seizures and ultimately leading to cardiac arrest. The underlying pathophysiological mechanism involves multiple factors, ranging from genetic predisposition to environmental factors. Risk of SUDEP is higher in young adults with uncontrolled generalised tonic-clonic seizures. However, patients apparently at lower risk may also experience SUDEP. Current research focuses on identifying genetic and neuroimaging biomarkers that may help determine which patients are at high risk for SUDEP. Antiepileptic treatment is the only preventive measure proven effective to date. Night-time monitoring together with early resuscitation may reduce the risk of SUDEP.
La epilepsia es uno de los trastornos neurológicos más frecuentes. En todo el mundo aproximadamente entre 35 y 70 millones personas sufren de epilepsia, presentando una prevalencia del 0,5-1%1. Dos de cada 3 pacientes tienen buen control de crisis bajo medicación antiepiléptica adecuada, y la mayoría de ellos puede vivir una vida normal2. No obstante, los adultos jóvenes con epilepsia tienen un riesgo 24 veces más alto de fallecer de forma súbita en comparación con la población general3. Estas muertes súbitas se deben en gran medida a la muerte súbita en epilepsia (MSE), que es responsable de un 20% de los fallecimientos prematuros en este grupo de pacientes4. En España no existen datos exactos sobre la incidencia de MSE, pero basándonos en datos de Estados Unidos cada año fallecerían por MSE en España aproximadamente entre 250 y 450 pacientes5. Teniendo en cuenta estas cifras, y por el hecho de que los pacientes, familiares y los grupos de apoyo intercambian información mediante el uso de las redes sociales, la necesidad de investigación clínica y experimental de alta calidad sobre la MSE está en el foco tanto de pacientes como de los profesionales de la medicina en España. Recientemente la Sociedad Española de Neurología ha iniciado un proyecto en su página web para que los médicos puedan registrar casos de MSE, con el de fin de establecer estrategias globales de prevención para los pacientes con epilepsia (Registro nacional de muerte súbita en España; disponible en: http://www.sen.es/investigacion/id/renmuertesubita). Esta revisión resume la información más importante y más reciente sobre el tema de MSE. El énfasis de la misma está en las áreas de epidemiología, fisiopatología, factores de riesgo y prevención.
Definición de la muerte súbita en epilepsiaLa MSE es la muerte repentina e inesperada de pacientes con epilepsia que no puede explicarse por otra causa, como podría ser por ejemplo un ataque cardíaco, estado de mal epiléptico, ahogamiento o accidentes confirmados por autopsia6. Sin embargo, diversos estudios sobre la incidencia de MSE han utilizado diferentes definiciones de esta, lo que probablemente ha influido en los resultados de los mismos7. Por este motivo, un grupo de expertos sugirió una clasificación de MSE más diferenciada para incrementar su precisión diagnóstica y facilitar así la comparación entre diferentes estudios. Como resultado de ello se distingue actualmente entre MSE definitiva, probable, posible, cuasi-MSE y casos inclasificables (tabla 1)8. Según esta clasificación la MSE definitiva cumple todos los criterios de la MSE, incluyendo una autopsia. Con la MSE posible hay una causa compatible, que sin embargo no es responsable de la muerte del paciente con absoluta certeza. Una cuasi-MSE existe cuando un paciente con epilepsia sufre un paro cardiovascular y sobrevive durante más de una hora, siempre y cuando la evaluación diagnóstica no revele ninguna causa estructural para el paro cardíaco.
Nueva propuesta de clasificación de la MSE según Nashef et al. (2012)
| Categorías | Criterios |
|---|---|
| MSE definitiva | Muerte repentina de un paciente con epilepsia que no puede explicarse por otra causa, como podría ser por ejemplo un ataque cardíaco, estado de mal epiléptico, ahogamiento o accidentes. Confirmado con autopsia |
| MSE probable | Muerte repentina de un paciente con epilepsia que no puede explicarse por otra causa, como podría ser por ejemplo un ataque cardíaco, estado de mal epiléptico, ahogamiento o accidentes. Sin autopsia disponible |
| MSE posible | Existe una posible causa alternativa de la muerte |
| Cuasi-MSE | El paciente con epilepsia sufre un paro cardiovascular y sobrevive durante más de una hora, siempre y cuando la evaluación diagnóstica no revele ninguna causa estructural para el paro cardíaco |
| No MSE | Se sabe la causa exacta de la muerte |
| Sin clasificación | No existe suficiente información para clasificar el caso |
MSE: muerte súbita en epilepsia.
Fuente: Nashef et al.8
Incluyendo los estudios poblacionales revisados la incidencia de MSE varía de 0,09 a 2,3 por cada 1.000 pacientes/año9. Sin embargo, la frecuencia de MSE aumenta en pacientes con epilepsia refractaria entre 2,2 a 10 por 1.000 pacientes/año10. En el extremo opuesto, en los niños, el riesgo de MSE está entre 0 a 0,2 por 1.000 pacientes/año10. No obstante, el riesgo acumulado de morir por MSE para un paciente con epilepsia refractaria desde su niñez es de casi un 15%5,11. Aunque la MSE es un fenómeno relativamente raro en comparación con otros trastornos neurológicos, en los Estados Unidos se encuentra en segundo lugar entre las causas neurológicas de números de años de vida perdidos (detrás del ictus), ya que afecta mayoritariamente a adultos jóvenes10. La mayoría de los casos de MSE ocurren antes de los 40 años, de lo que se deriva la importancia y las consecuencias de la MSE tanto para los afectados como para los sistemas de salud5.
Causas de muerte súbita en epilepsiaLos mecanismos patogénicos exactos implicados en la MSE no están aún clarificados y constituyen un tema de actualidad científica. Esto es debido principalmente al hecho de que la mayoría de los pacientes no son observados en el momento de la muerte12. Asimismo, por definición, no se encuentran causas estructurales de la muerte en la autopsia8, por lo que la investigación de la fisiopatología subyacente es una tarea compleja. Dado que la mayoría de los casos de MSE observados ocurrieron inmediatamente después de crisis generalizadas, es probable que en muchos casos la muerte se deba a una complicación asociada a las mismas12,13.
Algunos estudios apoyan la hipótesis de que la disfunción cardíaca es la principal causa subyacente de MSE, por ejemplo en forma arritmias asociadas a crisis epilépticas14. Otros estudios sugieren que la disfunción respiratoria es la principal causa de MSE, por ejemplo mediante apnea igualmente asociadas a crisis epilépticas15. Es posible que una interacción entre trastornos cardíacos y respiratorios sea la implicada en el desarrollo de la MSE. Dado el gran número de trastornos cardiorrespiratorios descritos tanto durante las crisis epilépticas como durante la fase interictal, es de suponer que la MSE no tenga una fisiopatología uniforme, sino que en cada caso existan diferentes causas16. En las siguientes secciones, sin embargo, se pondrá especial énfasis en las disfunciones cardíacas y respiratorias asociadas a las crisis epilépticas.
Trastornos de la función cardíaca asociados a crisis epilépticasSe han descrito diferentes tipos de disfunción cardíaca que pueden ocurrir durante una crisis epiléptica17. Muchas crisis van acompañadas de aumento de la frecuencia cardíaca (FC), denominada taquicardia ictal. La taquicardia ictal (FC>120 latidos por minuto) aparece, según diferentes estudios, en un 60% a 70% de las crisis de los pacientes con epilepsia focal18. La severidad de la misma depende de la duración, del tipo de crisis y de la propagación de la actividad epiléptica en el cerebro19,20. Por otro lado, la bradicardia (FC<60 latidos por minuto) (hasta 7% de los pacientes) y la asistolia (>4s) (de 0,2% a 0,4% de los pacientes) asociadas a crisis epilépticas son fenómenos mucho menos frecuentes21–23. Según un metaanálisis reciente son las bradiarritmias que ocurren justo después de una crisis las que pueden constituir un peligro, mientras que las bradicardias ictales parecen ser de naturaleza más bien benigna24.
Durante las crisis epilépticas los trastornos de la repolarización cardíaca, como la prolongación del intervalo QT, son comunes20. Dichos trastornos pueden promover la aparición de taquicardias ventriculares, que son un conocido factor de riesgo de muerte cardíaca súbita25. Según un estudio reciente, en casos de MSE se observaron 3 veces más patrones de conducción ventricular anormales en el ECG que en controles con epilepsia26. Sin embargo, las taquicardias ventriculares asociadas a crisis epilépticas son un fenómeno poco frecuente. Hasta el momento, solo 3 casos han sido descritos en la literatura, de los cuales uno fue clasificado como MSE y 2 como cuasi-MSE24.
Las crisis generalizadas no solamente pueden estar acompañadas de arritmias cardíacas, sino también de un deterioro de la función mecánica cardíaca, como es el caso de la miocardiopatía de Tako-Tsubo27. La miocardiopatía de Tako-Tsubo generalmente se desencadena por un estímulo emocional, y cursa con una sintomatología parecida a la del síndrome coronario agudo28. Se caracteriza por un trastorno del movimiento del ventrículo izquierdo y, en contraste con el síndrome coronario agudo, no existe oclusión de las arterias coronarias. Dos de los 74 casos de miocardiopatías de Tako-Tsubo publicados previamente murieron durante o poco después de una crisis epiléptica29.
A diferencia de la frecuencia cardíaca hay pocos datos acerca de la modulación de la presión arterial sistémica en relación con crisis epilépticas30. En un estudio reciente se ha descrito una presión arterial diastólica interictal elevada en pacientes que posteriormente fallecieron de MSE, en comparación con un grupo de control de pacientes con epilepsia refractaria, siendo esto un posible indicio de una disfunción autonómica31. Otro estudio actual ha cuantificado por primera vez sistemáticamente los cambios de la presión arterial sistémica en la fase periictal de 37 pacientes32. Según este estudio, durante las crisis focales la presión arterial sufre una elevación de un 30%. El grado de aumento y el perfil depende del tipo de crisis (parciales simples o complejas). Una caída de presión arterial durante las crisis es menos frecuente. Lamentablemente no fue posible determinar la presión arterial durante crisis secundariamente generalizadas, debido a artefactos de movimiento, pero en la fase postictal temprana se observó curiosamente una disociación de la presión arterial y de la frecuencia cardíaca: mientras la frecuencia cardiaca aumentó un 75% y se mantuvo elevada durante toda la fase postictal, la presión arterial se elevó tan solo un 15%, y después de 5minutos se redujo por debajo de los niveles preictales. Esta posible caída de la presión arterial podría apoyar la hipótesis del «apagado cerebral» (cerebral shutdown). Según esta hipótesis, la inhibición central desencadenada por crisis epilépticas podría conducir a una insuficiencia respiratoria y cardiovascular, que finalmente podría causar la muerte del paciente30.
Trastornos de la función respiratoria asociados con crisis epilépticasAdemás de los cambios cardíacos asociados a crisis epilépticas, con frecuencia se producen trastornos relacionados con las funciones respiratorias tales como una caída en la saturación de oxígeno (hipoxemia)33. Dado que en la mayoría de las unidades de epilepsia no se mide de forma continua la frecuencia respiratoria ni la saturación de oxígeno, existen relativamente pocos datos acerca de esta área. En un estudio reciente en el que se registraron 304 crisis en 56 pacientes, se mostró una hipoxemia por debajo del 90% en un tercio de las crisis, con una duración media de 70segundos15. En menos del 4% de las crisis se produjeron hipoxemias severas por debajo del 70% de saturación de oxígeno15. La frecuencia, duración y el grado de hipoxemia dependían del tipo y de la duración de crisis15. La hipoxemia es especialmente frecuente en crisis generalizadas, pero también en crisis parciales complejas. En el 50% de las crisis se observaron trastornos respiratorios centrales. En un estudio adicional se describió en aproximadamente un 30% de las crisis focales un aumento del contenido de CO2 en el aire exhalado de más de 50mmHg34. Además de los trastornos respiratorios hasta ahora descritos, las crisis generalizadas pueden conducir a un edema pulmonar neurogénico35.
Los resultados de los estudios mencionados sugieren por una parte que los trastornos de la función respiratoria asociados a crisis epilépticas pueden ser lo suficientemente graves como para causar una MSE. En el extremo opuesto puede plantearse la pregunta de por qué las crisis no conducen más frecuentemente a complicaciones médicas, en vista de los trastornos respiratorios que regularmente se asocian a las mismas36.
Evolución temporalComo la gran mayoría de los casos de MSE no son observados, los limitados conocimientos disponibles acerca de su fisiopatología están basados en la información obtenida a través de testigos o informes de casos aislados registrados durante la monitorización de vídeo-EEG13. De gran importancia ha sido el Mortality in Epilepsy Monitoring Unit Study (MORTEMUS), un estudio multicéntrico retrospectivo de grandes dimensiones que ha investigado la ocurrencia y los mecanismos implicados en casos de MSE y cuasi-MSE en centros de epilepsia12. Durante el período del estudio se documentaron 16 casos de MSE y 9 casos de cuasi-MSE mediante vídeo-EEG en 147 centros de epilepsia. En 9 casos de MSE y 3 de cuasi-MSE se dispuso de vídeo-EEG y un canal de ECG. A pesar del gran número de mecanismos patógenos potencialmente implicados en la MSE, en este estudio se demostró una secuencia de eventos muy similar entre individuos: todos los casos de MSE y 7 de los 9 de cuasi-MSE ocurrieron después de una crisis tónica-clónica generalizada, observándose un fracaso de las funciones cardiorrespiratorias dentro de los primeros 3minutos después de la crisis. Este fallo consistía por un lado en una bradicardia o asistolia alternando con aceleraciones periódicas del ritmo cardíaco, y por otro lado una bradipnea o apnea también alternando con aumentos recurrentes del esfuerzo respiratorio. En el EEG se observó una supresión eléctrica postictal generalizada (postictal electrical suppression), que consiste en una reducción de la amplitud por debajo de 10μV37. Por último, todos los casos de MSE terminaron, después de aproximadamente 3 a 15minutos, en una apnea y asistolia terminal. Desde una perspectiva clínica también es interesante la observación de que 14 de los 16 casos de MSE ocurrieron por la noche y que los pacientes fueron encontrados en posición de pronación12. En 7 de los 9 casos de cuasi-MSE se llevó a cabo una reanimación cardiorrespiratoria dentro de los primeros 3minutos tras la finalización de la crisis. En cambio, en 8 de 12 casos de MSE no se llevó a cabo ninguna reanimación cardiopulmonar sino hasta unos 10minutos tras el fin de la crisis.
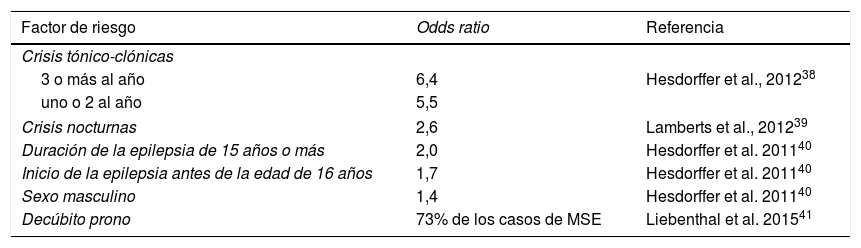
Factores de riesgo¿Que pacientes están en especial riesgo de sufrir una MSE? Del reconocimiento de factores de riesgo para MSE podrían derivar unas primeras medidas para la protección de los pacientes. Hasta ahora un control deficiente de crisis representa el mayor factor de riesgo conocido. En epilepsia refractaria la prevalencia de MSE es más alta que en epilepsia bien controlada. Pacientes con más de 2 crisis tónico-clónicas generalizadas al año están particularmente en riesgo de morir de MSE38. Adicionalmente, los pacientes con crisis nocturnas también presentan un mayor riesgo de MSE (tabla 2)39. Tanto el inicio temprano de la epilepsia (antes de la edad de 16 años) como un largo curso de la enfermedad (duración de la epilepsia de 15 años o más) están asociados con un mayor riesgo de MSE40. Existe asimismo un riesgo según la distribución de género, siendo los hombres más vulnerables que las mujeres40. Curiosamente, la posición del cuerpo parece tener una influencia sobre el riesgo de MSE, así un estudio describe que el 73% de los víctimas son encontrados muertos en decúbito prono —tal y como ocurre en el síndrome de muerte súbita del lactante41—. Los autores discuten una posible disfunción postictal de la respiración debido a la posición decúbito prono como una posible explicación para esta asociación41. La ingesta de múltiples fármacos antiepilépticos no presenta, según trabajos recientes, ningún factor de riesgo independiente, siendo más bien un marcador sustituto para la epilepsia refractaria38. Por el contrario, es probable que la falta de cumplimiento del tratamiento esté asociada a un mayor riesgo de MSE. Así, entre un 35% a 55% de los casos de MSE no se encontraron antiepilépticos en sangre o solo a niveles subterapéuticos42,43. Un extenso estudio de casos y controles del Reino Unido no encontró ningún tratamiento asociado con un mayor riesgo ni un mayor riesgo en pacientes en politerapia13. Un estudio reciente resume todos los factores de riesgo conocidos en una lista de verificación (checklist) para facilitar la identificación de pacientes de alto riesgo en la práctica clínica44.
Factores de riesgo de MSE identificados por metaanálisis
| Factor de riesgo | Odds ratio | Referencia |
|---|---|---|
| Crisis tónico-clónicas | ||
| 3 o más al año | 6,4 | Hesdorffer et al., 201238 |
| uno o 2 al año | 5,5 | |
| Crisis nocturnas | 2,6 | Lamberts et al., 201239 |
| Duración de la epilepsia de 15 años o más | 2,0 | Hesdorffer et al. 201140 |
| Inicio de la epilepsia antes de la edad de 16 años | 1,7 | Hesdorffer et al. 201140 |
| Sexo masculino | 1,4 | Hesdorffer et al. 201140 |
| Decúbito prono | 73% de los casos de MSE | Liebenthal et al. 201541 |
MSE: muerte súbita en epilepsia.
Aunque la MSE es un fenómeno poco frecuente, es la primera causa de muerte prematura en pacientes con epilepsia. La fisiopatología subyacente no se conoce en profundidad. Según los conocimientos actuales durante la fase postictal temprana se producen —probablemente causados por crisis tónico-clónicas generalizadas— alteraciones de las funciones cardíacas y respiratorias que finalmente resultan en un paro cardiorrespiratorio. Los estudios epidemiológicos indican que los hombres jóvenes con crisis tónico-clónicas generalizadas frecuentes presentan un riesgo especialmente alto de fallecer de MSE. Con el fin de asesorar mejor a pacientes y familiares sería de gran utilidad la identificación de marcadores adicionales de MSE. Una serie de trabajos recientes se han centrado en la identificación de biomarcadores genéticos, electroencefalográficos y de neuroimagen, los cuales se detallan a continuación.
Biomarcadores genéticosLa identificación de biomarcadores genéticos podría desempeñar un papel importante en la evaluación del riesgo MSE. Así como se han descrito factores genéticos para diferentes enfermedades neurológicas como demencia y enfermedad de Parkinson, también en la MSE son objeto de investigación y discusión activa45,46. Los genes de canales iónicos que se expresan tanto en el cerebro como en el corazón son candidatos importantes. Por ejemplo, en experimentos animales hay evidencia de que las mutaciones en un gen habitualmente relacionado con el síndrome de QT largo clásico no solo causan arritmias potencialmente letales, sino también epilepsia debido a una alteración de la función de la expresión en los canales de iones en el cerebro47,48. Un ejemplo de un gen expresado principalmente en el cerebro es el SCN1A gen, cuya mutación conduce al síndrome de Dravet y que se asocia con un riesgo significativamente alto de MSE49. A partir de estudios en animales se sabe que las mutaciones SCN1A pueden conducir a trastornos letales de la función cardíaca50. Según diferentes estudios tanto en animales como humanos, al menos 9 genes relacionados con «neuro-cardiopatías» podrían estar relacionados con la MSE y podrían ser los primeros genes candidatos para la misma45. Estudios posteriores, sin embargo, no han mostrado aún qué significado tienen estos genes para la predicción del riesgo de MSE. Sorprendentemente, la coincidencia de genes identificados en varias series de casos es moderada, de modo que cada vez se descubren nuevos genes candidatos51,52. El pequeño tamaño de la muestra, el uso de casos de MSE posibles en lugar de casos definitivos, la falta de controles y la heterogeneidad de los pacientes representan frecuentes problemas metodológicos.
Es de notar que el único estudio de tamaño considerable (con una cohorte de 68 casos de MSE definitivos) obtuvo un resultado negativo para el gen investigado53. Este estudio mostró que las mutaciones en el gen PHOX2B, un gen candidato prometedor por razones fisiopatológicas, no representa ningún factor de riesgo común para la MSE. De todo esto se concluye que probablemente no existe un único gen o unos pocos genes relacionados con la MSE. Las causas genéticas de la MSE son probablemente complejas y podrían consistir en una combinación de polimorfismos de nucleótidos únicos (variaciones de pares de bases individuales en un gen) y variaciones del número de copias en diferentes genes (desviaciones del número de copias de un segmento determinado de un gen) tales como SCN1A, KCNA1, RYR3 y HTR2C, que están involucrados en circuitos neuro-cardíacos y de control respiratorio54. En otro estudio se encontró en la comparación de 18 casos de MSE con 97 pacientes con epilepsia y 1.479 controles sanos una gran variedad de mutaciones distribuidas por todo el genoma55. La carga de mutaciones por individuo se encontraba aumentada en el grupo de MSE. Curiosamente, las mutaciones encontradas no se concentraron en unos pocos genes circunscritos o vías específicas, lo que sustenta una causa poligénica y multifactorial de la MSE.
Biomarcadores electroencefalográficos¿Pueden algunas constelaciones especiales de EEG indicar un mayor riesgo de MSE? Este podría ser el caso de la llamada supresión generalizada del EEG postictal (PGES), consistente en una reducción de la amplitud por debajo de 10μV, que ocurre frecuentemente tras crisis generalizadas tónico-clónicas37. De la observación de PGES en algunos casos de MSE se ha derivado la hipótesis de que la PGES es un marcador de supresión de la actividad cerebral y por lo tanto podría conducir a una inhibición de la actividad cardiovascular y respiratoria, causando finalmente una MSE. Como apunte de la importancia de este fenómeno, los 11 casos de MSE registrados en vídeo-EEG en el estudio MORTEMUS mostraron una PGES12. Adicionalmente, la duración de la PGES se correlaciona con la gravedad del trastorno respiratorio postictal56. Un reciente estudio de casos y controles también encontró que en los pacientes con una PGES de más de 50segundos existía posteriormente una mayor frecuencia de muertes por MSE, por lo que la PGES se ha postulado como el marcador de EEG con mayor riesgo asociado de MSE37. Esta relación, sin embargo, no fue confirmada en un estudio posterior con un grupo de pacientes más grande57. Resumiendo críticamente, hay que señalar que el fenómeno PGES se produce en al menos un 50% de todas las crisis tónico-clónicas generalizadas no letales, y este tiene en cada paciente una alta variabilidad respecto a su aparición y duración57,58. Además, durante la PGES en el EEG de superficie, en la mayoría de los casos la actividad cerebral local persiste en el EEG intracraneal59. En consecuencia, el valor de la PGES como biomarcador de EEG para el futuro de la MSE se valoraría como muy bajo.
Biomarcadores de neuroimagenLa aparición de casos de MSE posteriores a las crisis tónico-clónicas generalizadas, junto con la PGES, indica un mecanismo patológico centralmente mediado. Esta conclusión llevó a la búsqueda de correlatos cerebrales funcionales y estructurales y ha llevado a la MSE a un enfoque de los estudios de neuroimagen en los últimos años. Un reciente estudio de resonancia magnética (RM) cerebral comparó los patrones del RM funcional en estado de reposo en pacientes con epilepsia con bajo y alto riesgo de MSE, encontrándose una conectividad funcional reducida entre el puente troncoencefálico y el tálamo derecho, entre el mesencéfalo y el tálamo derecho, entre la circunvolución cingular anterior y el tálamo derecho, así como entre el tálamo izquierdo y el tálamo derecho en pacientes con alto riesgo de MSE60. Otro estudio observó una reducción significativa del volumen en el mesencéfalo dorsal en 2 pacientes de MSE61. Sin embargo, un estudio de mayores dimensiones que comparó la RM de 12 pacientes con MSE con 34 pacientes de alto riesgo, 19 pacientes de bajo riesgo y 15 voluntarios sanos, encontró un aumento en el volumen de la sustancia gris de la amígdala derecha, del hipocampo y de la corteza parahipocampal derechas en los pacientes de alto riesgo de MSE en comparación con los pacientes de bajo riesgo y controles sanos62. Estos resultados indican que la epilepsia refractaria puede estar asociada a cambios funcionales o estructurales en las regiones del cerebro que desempeñan un papel importante en el sistema nervioso autónomo central. Tales cambios podrían dar lugar a trastornos autonómicos que aumentan el riesgo de MSE. Sin embargo, estos estudios no proporcionan claros marcadores morfológicos o funcionales de RM que permitan un uso práctico.
Prevención de la muerte súbita en epilepsia¿Puede el conocimiento acerca de los factores de riesgo y la fisiopatología de la MSE ayudar a proteger a los pacientes de la misma? Dado que un control insuficiente de las crisis epilépticas es el factor de riesgo más importante y, según los conocimientos actuales, la MSE es un fenómeno asociado a las crisis, un mejor control de crisis constituye la principal medida para prevenir la MSE63. De hecho, un reciente metaanálisis de 112 ensayos clínicos demostró que la terapia adyuvante con antiepilépticos en pacientes con epilepsia refractaria en comparación con el placebo reduce 7 veces la odds ratio de MSE64. Desafortunadamente, y como es bien conocido, un tercio de los pacientes con epilepsia sufren crisis a pesar de las terapias antiepilépticas2. Algunos de ellos pueden ser tratados quirúrgicamente y quedar libres de crisis en un porcentaje considerable de casos65. Sin embargo, en qué medida la cirugía de la epilepsia modifica el riesgo de MSE no ha podido ser aclarado aún66. Al menos algunos estudios de casos y controles han mostrado que una cirugía de la epilepsia con resultado positivo reduce la mortalidad de forma significativa67,68. Para los pacientes no candidatos a una cirugía de la epilepsia existen otras alternativas al tratamiento farmacológico, como la estimulación del nervio vago69. La estimulación del nervio vago debe sin embargo ser considerada como un tratamiento paliativo, dado que rara vez conduce a la libertad de crisis70, aunque sí se ha demostrado que puede reducir la frecuencia de las crisis en pacientes con epilepsia refractaria71. En principio, una mejora en el control de crisis debe conducir a una reducción del riesgo de MSE. Sin embargo, los estudios previos en esta área proporcionan resultados contradictorios, por lo que no es posible concluir que esta terapia tenga un efecto protector72,73.
En los pacientes con crisis nocturnas una vigilancia puede probablemente reducir el riesgo de MSE13. Los resultados del estudio MORTEMUS sugieren que la reanimación iniciada por familiares o cuidadores en una etapa temprana puede evitar la MSE12. Sin embargo, no queda claro si una reanimación por personal no entrenado puede tener efectos sobre la tasa de MSE. No obstante, existen algunos indicios de que simples medidas de enfermería acortan los trastornos respiratorios postictales y la supresión generalizada postictal en el EEG34,74. La implantación de un marcapasos cardíaco parecería un terapia lógica de la MSE, ya que se ha mostrado su eficacia en el caso de asistolia ictal75. Sin embargo, hasta ahora no se ha podido demostrar ningún efecto sobre el riesgo de MSE. Contradictoriamente, en un estudio de casos y controles uno de los pacientes fallecidos por MSE era portador de un marcapasos previamente implantado por presentar bradicardia periictal25.
Información a los pacientes y familiares sobre la muerte súbita en epilepsia¿Deberíamos informar a los pacientes y a sus familiares acerca de la MSE? Actualmente, excluyendo la medicación antiepiléptica, no existen medidas eficaces para la prevención de la MSE64. Por tanto, cabe preguntarse si las enfermeras y los médicos que atienden a pacientes con epilepsia deberían educar sobre el riesgo de la misma. Instruir acerca de la MSE podría confundir a los pacientes, especialmente a aquellos que sufren de epilepsia refractaria, colectivo que experimenta un elevado grado de impotencia debido a las crisis.
Por otro lado, el mal cumplimiento o el cumplimiento parcial del tratamiento es común en pacientes con epilepsia76. En un análisis toxicológico post mortem de 74 casos de MSE solo en 26 pacientes se pudieron encontrar niveles de antiepilépticos en la sangre, lo que indica que la no ingestión de fármacos antiepilépticos estuvo probablemente involucrada en el desarrollo de las muertes43. Es por esto que la información a los pacientes sobre la MSE podría ayudar a aumentar el seguimiento del tratamiento, particularmente en pacientes que sufren crisis no controladas77. Como muestra del valor de esta medida, 7 de cada 27 pacientes que fueron informados sobre la MSE reportaron un mejor cumplimiento del tratamiento78. Según diferentes encuestas alrededor de un tercio de los pacientes o sus familiares desearían ser informados sobre la MSE en el momento de comunicarse el diagnóstico de epilepsia79,80. A pesar de esto, y según una encuesta también reciente, únicamente el 12% de los neurólogos en Alemania, Austria y Suiza hablan regularmente con sus pacientes acerca de la MSE81. Más aún, entre un 61% a 86% de los pacientes tratados en centros de epilepsia nunca habían oído hablar de la MSE79,80. Es posible que el miedo a las consecuencias psicológicas negativas en el paciente explique la cautela de muchos profesionales a la hora de mencionar el tema de la MSE82, aunque hasta la fecha poco se haya estudiado acerca de si esos temores son justificados. En relación con este último aspecto, en un estudio se informó a los padres de los niños epilépticos sobre la MSE y se les volvió a entrevistar de nuevo a los 3 meses83. Más del 90% de los padres declaró querer información sobre la MSE y en ningún caso se reportó un efecto negativo causado por tratar el tema83. Un reto diferente se plantea en caso del trato a los familiares de pacientes que murieron de MSE. La mayoría de los familiares de los pacientes fallecidos no fueron informados antes del evento sobre este tema84. Sin embargo, ellos habrían preferido una explicación anterior a la MSE84.
A modo de resumen, creemos que los médicos deberían de discutir de una manera apropiada con los pacientes con epilepsia y sus familiares acerca de la MSE, abordándola como complicación infrecuente pero grave. Al contrario que en el Reino Unido, donde la información sobre MSE está incluida en las actuales guías clínicas, en España de momento no hay recomendaciones sobre la información a pacientes y familiares sobre la MSE. El momento (por ejemplo en caso de incumplimiento terapéutico) y la forma adecuada de proporcionar esta información surgirán de forma individualizada según la constelación de circunstancias en cada paciente.
ConclusionesLa MSE es una complicación poco frecuente, pero grave, de las crisis epilépticas. Es debida probablemente a un fallo de la función cardiorrespiratoria desencadenada por las mismas. Para la prevención de la MSE parece ser crucial, en particular, el control de las crisis tónico-clónicas generalizadas. La farmacoterapia eficaz es la única medida preventiva con suficiente evidencia científica. En los pacientes que no responden adecuadamente a la medicación anticomicial las opciones de tratamiento no farmacológicas, como la cirugía de la epilepsia, deben de ser contempladas en una etapa temprana. La mayoría de los pacientes y sus familiares requieren una educación individual acerca de la MSE.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado con este trabajo.