Los cuerpos amiláceos (CoA) se presentan en aproximadamente el 60% de los hipocampos atróficos resecados de pacientes con epilepsia del lóbulo temporal farmacorresistente (ELTFR). Su presencia en la neocorteza temporal lateral ha sido observada con menor frecuencia.
ObjetivoEl objetivo es evaluar la presencia, la distribución y la densidad de CoA en el lóbulo temporal lateral de pacientes con ELTFR y displasia cortical focal (DCF) y la relación de su densidad con variables demográficas y clínicas.
MétodosAnalizamos histológicamente el tejido resecado de 35 pacientes con ELTFR. La densidad de los CoA fue evaluada con una escala semicuantitativa según los criterios de Cherian et al.
ResultadosLa presencia de CoA en la neocorteza de 9 pacientes estuvo asociada a esclerosis hipocampal (DCF tipo iiia, 7 casos), tumor neuroepitelial disembrioplásico (DCF tipo iiib, un caso) y angioma cavernoso (DCF tipo iiic, un caso). Todos los pacientes tuvieron afectación de la superficie meníngea (SM) y en 8 casos se localizaron en el parénquima cerebral (sustancia blanca) y alrededor de los vasos sanguíneos. La densidad de los CoA en SM tuvo una correlación negativa con la edad de inicio de las crisis (r=−0,828, p<0,05) y positiva con la duración de la enfermedad (r=0,678, p<0,05) pero no con la evolución clínica postquirúrgica.
ConclusionesEn pacientes con ELTFR con lesión principal (EH, tumor, malformación vascular) asociada a DCF ligeras se constata la acumulación de CoA en la neocorteza. No se encontró una asociación entre la presencia de CoA y la evolución clínica al año de la cirugía.
Corpora amylacea (CoA) are present in about 60% of atrophic hippocampi resected from patients with drug resistant temporal lobe epilepsy (DRTLE). They have also been described in the lateral temporal neocortex, although less frequently.
ObjectiveThe objective is to measure the presence, distribution and density of CoA in the lateral temporal lobes of patients with DRTLE and focal cortical dysplasia (FCD), also examining how CoA density may be linked to demographic and clinical traits.
MethodsResected tissue from 35 patients was analysed. CoA density was assessed with a semi-quantitative scale according to the criteria established by Cherian et al.
ResultsPresence of CoA in the neocortex of 9 patients was associated with hippocampal sclerosis (FCD type iiia, 7 cases), disembryoplastic neuroepithelial tumour (FCD type iiib, 1 case), and cavernous angioma (FCD type iiic, 1 case). The meningeal surface (MS) was involved in all cases, and 8 cases displayed CoA in the cerebral parenchyma (white matter) and around blood vessels. CoA density on the MS showed a negative correlation with age at seizure onset (r=−0.828, P<.05) and a positive correlation with disease duration (r=0.678, P<.05) but not with postoperative clinical outcome.
ConclusionsPatients with DRTLE and a primary lesion (hippocampal sclerosis, tumour, vascular malformation) associated with mild FCD were shown to have CoA deposits in the neocortex. No association was found between presence of CoA and clinical outcome one year after surgery.
El tratamiento quirúrgico constituye una alternativa terapéutica en los pacientes que presentan epilepsia del lóbulo temporal farmacorresistente (ELTFR), cuyo sustrato neuropatológico más frecuente es la esclerosis hipocampal (EH) o esclerosis mesial del temporal1, detectada por imágenes de resonancia magnética (IRM) entre el 87-89% de los pacientes2.
El término de cuerpos de poliglucosano (CP) es un nombre genérico, propuesto por Robitaille et al. para el grupo de cuerpos de Lafora, cuerpos semejantes a Lafora, cuerpos de Bielschowsky y cuerpos amiláceos (CoA), debido a sus semejanzas bioquímicas, no existiendo entre ellos diferencias histoquímicas ni ultraestructurales. Los CP son redondeados, amorfos, laminados y basófilos, de 10-50 μm de diámetro, compuestos por polímeros de glucosa3.
Los CP se consideran estructuras inespecíficas3; cuando se presentan en una cantidad superior se convierten en un hallazgo patognomónico de diferentes enfermedades, por lo que el término a utilizar depende de la clínica en que ellos se presenten, es decir, cuerpos de Lafora en la enfermedad de Lafora4, cuerpos de Bielschowsky en la coreoatetosis y parálisis cerebral5 y CoA en el envejecimiento normal y en enfermedades neurodegenerativas6.
La displasia cortical focal (DCF) es un subgrupo especial entre las malformaciones del desarrollo cortical, altamente epileptogénica y causa frecuente de epilepsia farmacorresistente7.
Los CoA se consideran como marcador de EH cuando la pérdida neuronal y la gliosis son difíciles de estimar debido a la fragmentación del hipocampo durante el acto quirúrgico8.
En la ELTFR, los CoA pueden ser observados en el hipocampo y en el tejido neocortical lateral; para ambas localizaciones son escasos los trabajos que refieren su presencia9-11.
Con estos antecedentes, el presente trabajo tuvo como objetivos evaluar la presencia, distribución y densidad de los CoA en el lóbulo temporal lateral de pacientes con ELTFR y DCF intervenidos quirúrgicamente, así como relacionar su densidad con variables demográficas y clínicas (edad, inicio de las crisis, duración de la enfermedad y evolución posquirúrgica).
Sujetos y métodosSe analizó la base de datos de pacientes con ELTFR sometidos a lobectomía temporal ajustada por electrocorticografía en el Centro Internacional de Restauración Neurológica, que no respondieron a los fármacos antiepilépticos (FAE) utilizados, al menos durante 2 años previos a la cirugía. De los pacientes intervenidos quirúrgicamente, examinamos histológicamente aquellos casos con DCF y CoA.
Todos los pacientes fueron sometidos a una rigurosa evaluación prequirúrgica protocolizada, que incluyó una evaluación clínica y neurológica, detallando la historia de las crisis; video-electroencefalograma (EEG); evaluación neuropsicológica y estudios de IRM, tanto estructural y funcional.
Los criterios imagenológicos utilizados para el diagnóstico de EH fueron: atrofia hipocampal (evidencia la pérdida neuronal), pérdida de la estructura interna del hipocampo, aumento de la intensidad de señales en T2 y FLAIR (gliosis), así como hipointensidad en T1-IR12,13.
Para el diagnóstico histológico de DCF, se utilizó la clasificación propuesta por Blümcke et al.14.
El tejido resecado en bloque (neocorteza) fue inmediatamente fijado en paraformaldehído durante 72 h, tallado en fragmentos de 3mm e incluidos en parafina. Los bloques fueron cortados a 6 mμ de grosor y teñidos con hematoxilina/eosina (H/E), Klüver-Barrera y ácido periódico de Schiff (PAS).
La densidad de los CoA fue valorada usando una escala semicuantitativa15: grado 3 con más de 10 CoA por campo de mayor aumento (CMA); grado 2 entre 6-10 CoA/CMA y grado 1 con una cantidad igual o menor de 5 CoA/CMA. Se analizó además la localización de los CoA en el tejido examinado.
Para el seguimiento clínico posquirúrgico de los pacientes (al año de la cirugía), utilizamos los criterios de la escala de Engel modificada16.
El análisis estadístico se ejecutó utilizando el procesador Statistical, versión 6. Se emplearon pruebas no paramétricas. Para los análisis de correlación se realizó un test de Spearman y un test de Mann-Whitney para comparaciones entre grupos independientes. Se consideraron significativos los resultados que alcanzaron p<0,05.
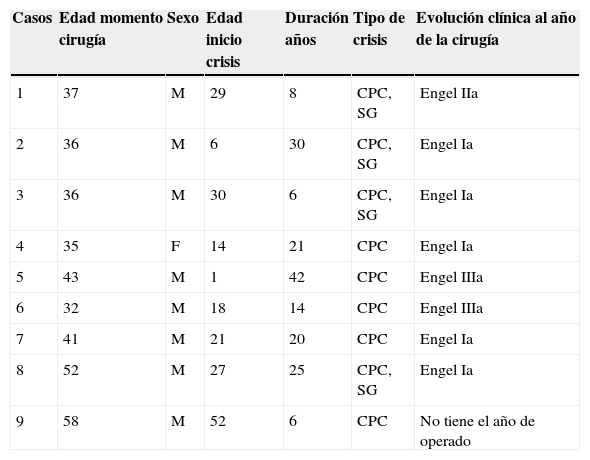
ResultadosLa tabla 1 resume los datos demográficos de los pacientes con CoA. De los 35 pacientes que conforman la base de datos de epilepsia del lóbulo temporal, 9 presentaron CoA para un 25,71%. La edad promedio en el momento de la cirugía fue de 41,11 años. En tanto, la duración promedio de la enfermedad previa a la intervención quirúrgica fue de 19,11 años.
Datos demográficos y clínicos de los pacientes con CoA y epilepsia del lóbulo temporal farmacorresistente. Evolución clínica
| Casos | Edad momento cirugía | Sexo | Edad inicio crisis | Duración años | Tipo de crisis | Evolución clínica al año de la cirugía |
|---|---|---|---|---|---|---|
| 1 | 37 | M | 29 | 8 | CPC, SG | Engel IIa |
| 2 | 36 | M | 6 | 30 | CPC, SG | Engel Ia |
| 3 | 36 | M | 30 | 6 | CPC, SG | Engel Ia |
| 4 | 35 | F | 14 | 21 | CPC | Engel Ia |
| 5 | 43 | M | 1 | 42 | CPC | Engel IIIa |
| 6 | 32 | M | 18 | 14 | CPC | Engel IIIa |
| 7 | 41 | M | 21 | 20 | CPC | Engel Ia |
| 8 | 52 | M | 27 | 25 | CPC, SG | Engel Ia |
| 9 | 58 | M | 52 | 6 | CPC | No tiene el año de operado |
CPC: crisis parciales complejas; SG: secundariamente generalizada.
Los estudios imagenológicos estructurales corroboraron en 7 de los 9 pacientes la presencia de EH. En 2 de ellos, este diagnóstico se confirmó histológicamente al observar pérdida neuronal selectiva en las áreas CA1 (sector de Sommer), CA4 (folium terminal) y en la capa de células granulares (CCG) del giro dentado asociada a una gliosis difusa. En los 5 enfermos restantes las estructuras mesiales no fueron evaluables al microscopio por la técnica quirúrgica realizada. En una paciente se apreció, con las IRM, una formación quística leptomeníngea en la región temporal derecha, con discretos signos expansivos. En el resto de los pacientes no se constataron anomalías neocorticales.
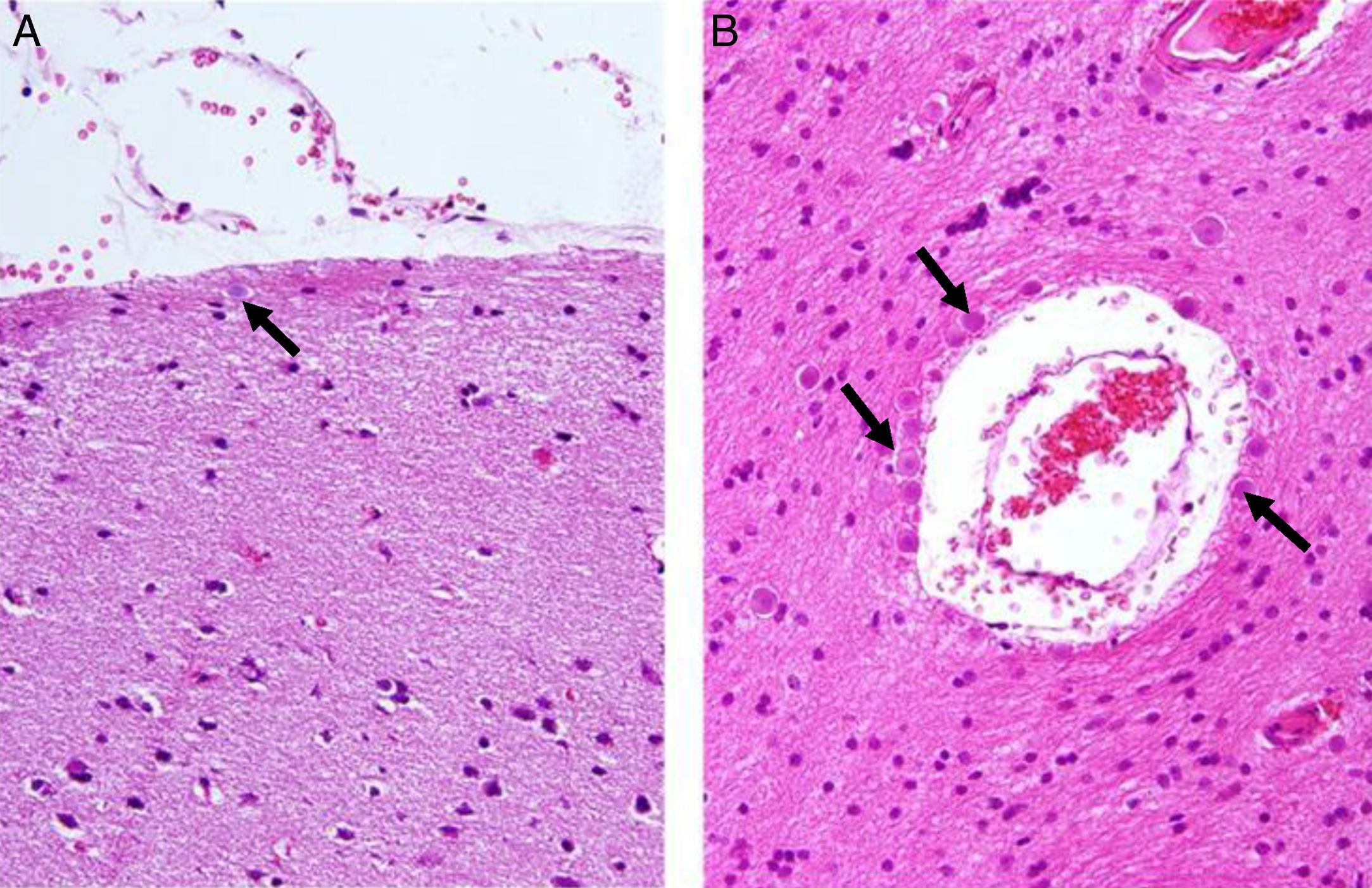
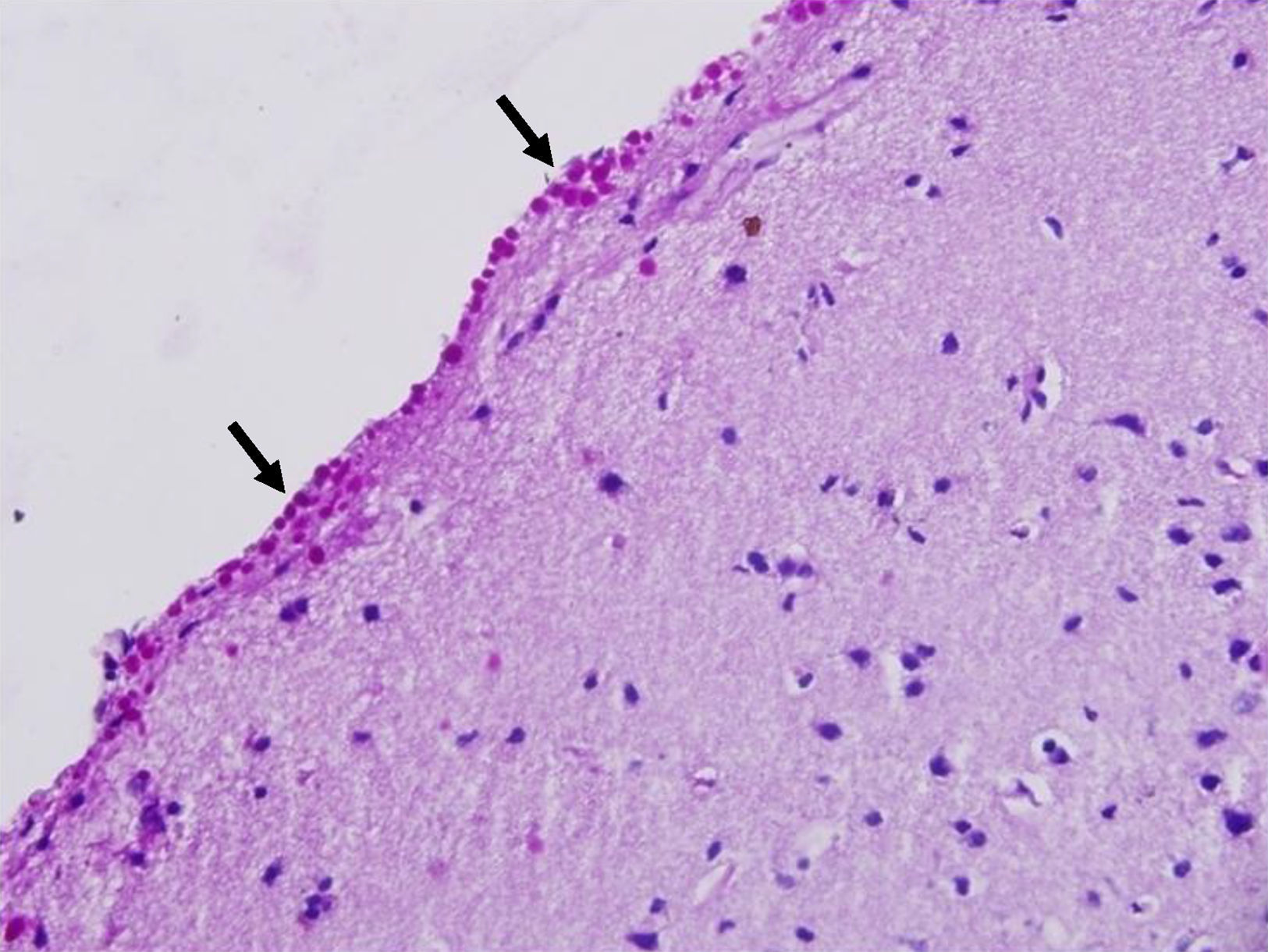
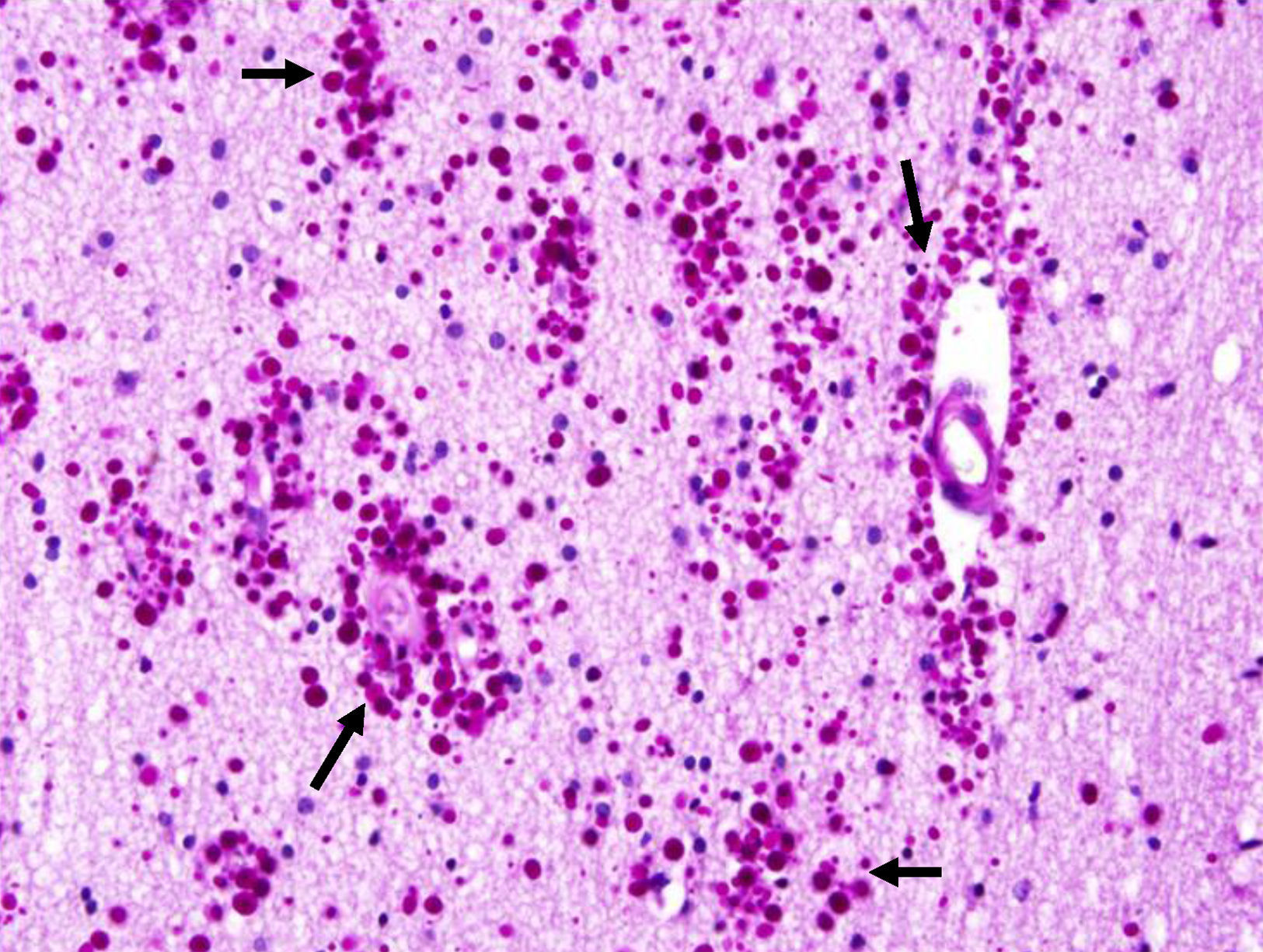
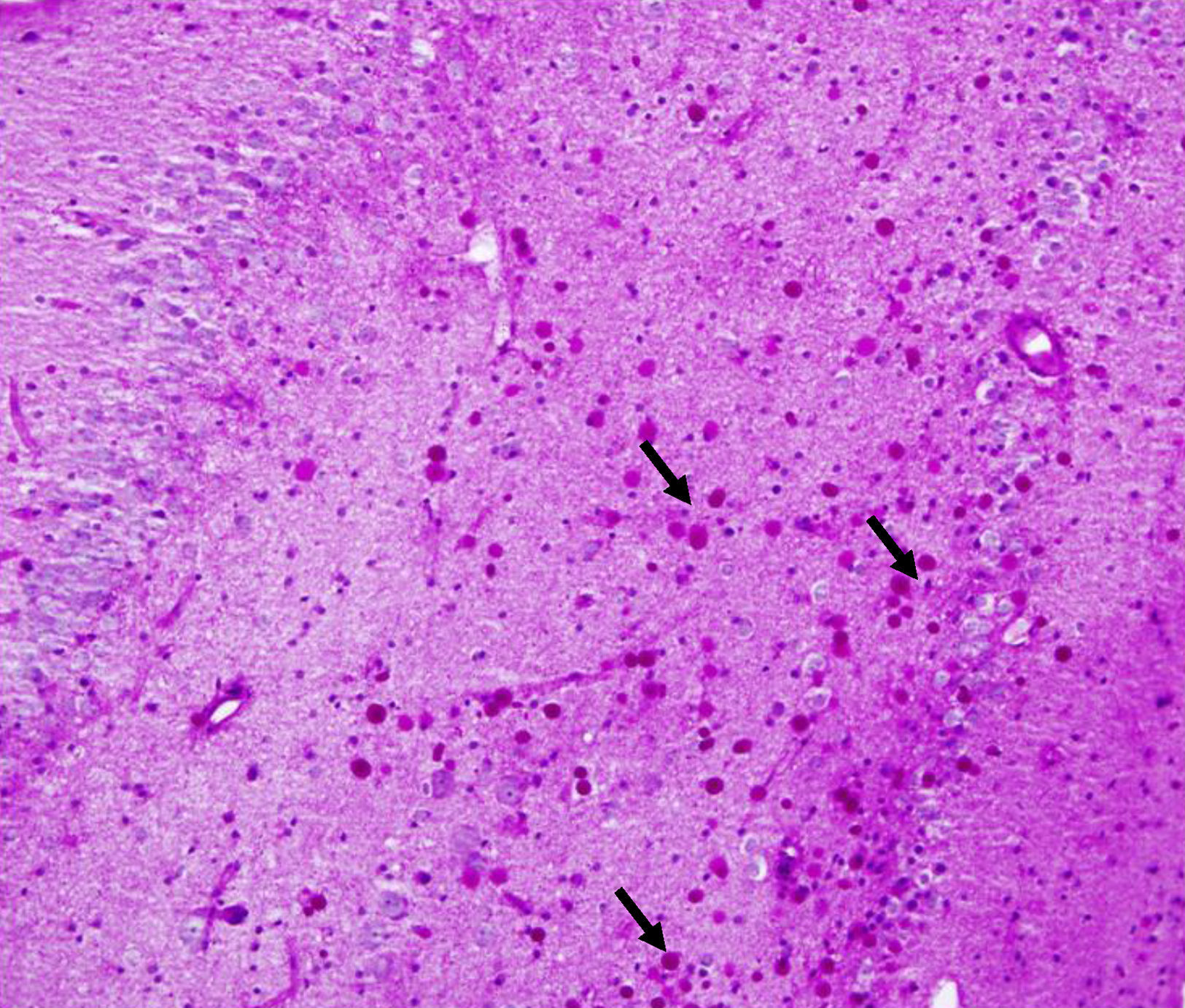
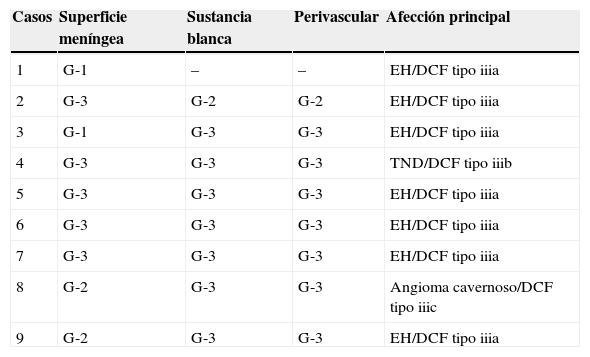
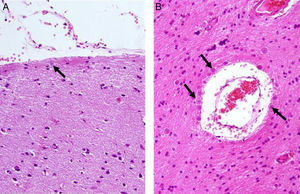
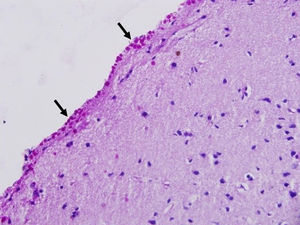
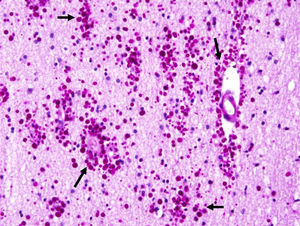
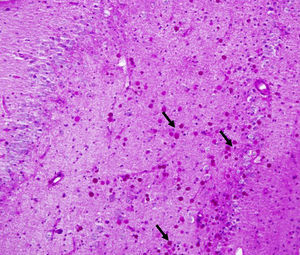
Los CoA se apreciaron con la H/E (fig. 1), destacándose mejor con la tinción de PAS (figs. 2-4) por su color rojo brillante, lo que permitió aplicar la escala semicuantitativa. La tabla 2 muestra la densidad en grados y la localización de los CoA, así como el diagnóstico de la afección principal en los 9 casos. El análisis histológico detallado de la neocorteza lateral demostró en los 9 pacientes anormalidades en la laminación de las capas corticales (DCF) asociada a EH (DCF tipo iiia, 7 casos); tumor neuroepitelial disembrioplásico (DCF tipo iiib, un caso) y angioma cavernoso (DCF tipo iiic, un caso). Se observó CoA en la superficie meníngea (SM) de los 9 pacientes, en tanto, en 8 enfermos estos se presentaron en la sustancia blanca y alrededor de los vasos sanguíneos. Cuatro de ellos presentaron la máxima densidad de CoA en las 3 localizaciones; sin embargo, no se constató diferencia estadísticamente significativa de la densidad de CoA en función de la localización. En los 2 hipocampos estudiados histológicamente apreciamos CoA, cuya densidad fue gradada como G-1 y G-3, localizados en el área CA4 y en la CCG (fig. 4) en un paciente y en el otro caso en el área CA4.
Distribución y densidad en grados de los CoA. Afección principal
| Casos | Superficie meníngea | Sustancia blanca | Perivascular | Afección principal |
|---|---|---|---|---|
| 1 | G-1 | – | – | EH/DCF tipo iiia |
| 2 | G-3 | G-2 | G-2 | EH/DCF tipo iiia |
| 3 | G-1 | G-3 | G-3 | EH/DCF tipo iiia |
| 4 | G-3 | G-3 | G-3 | TND/DCF tipo iiib |
| 5 | G-3 | G-3 | G-3 | EH/DCF tipo iiia |
| 6 | G-3 | G-3 | G-3 | EH/DCF tipo iiia |
| 7 | G-3 | G-3 | G-3 | EH/DCF tipo iiia |
| 8 | G-2 | G-3 | G-3 | Angioma cavernoso/DCF tipo iiic |
| 9 | G-2 | G-3 | G-3 | EH/DCF tipo iiia |
DCF: displasia cortical focal; EH: esclerosis hipocampal; G: grado; TND: tumor neuroepitelial disembrioplásico.
Relacionado con el seguimiento clínico posquirúrgico, la tabla 1 muestra la evolución clínica de los pacientes según la clasificación utilizada. Al año de la cirugía, 5 pacientes con CoA estaban libres de crisis, mientras que en 3 enfermos las crisis persisten.
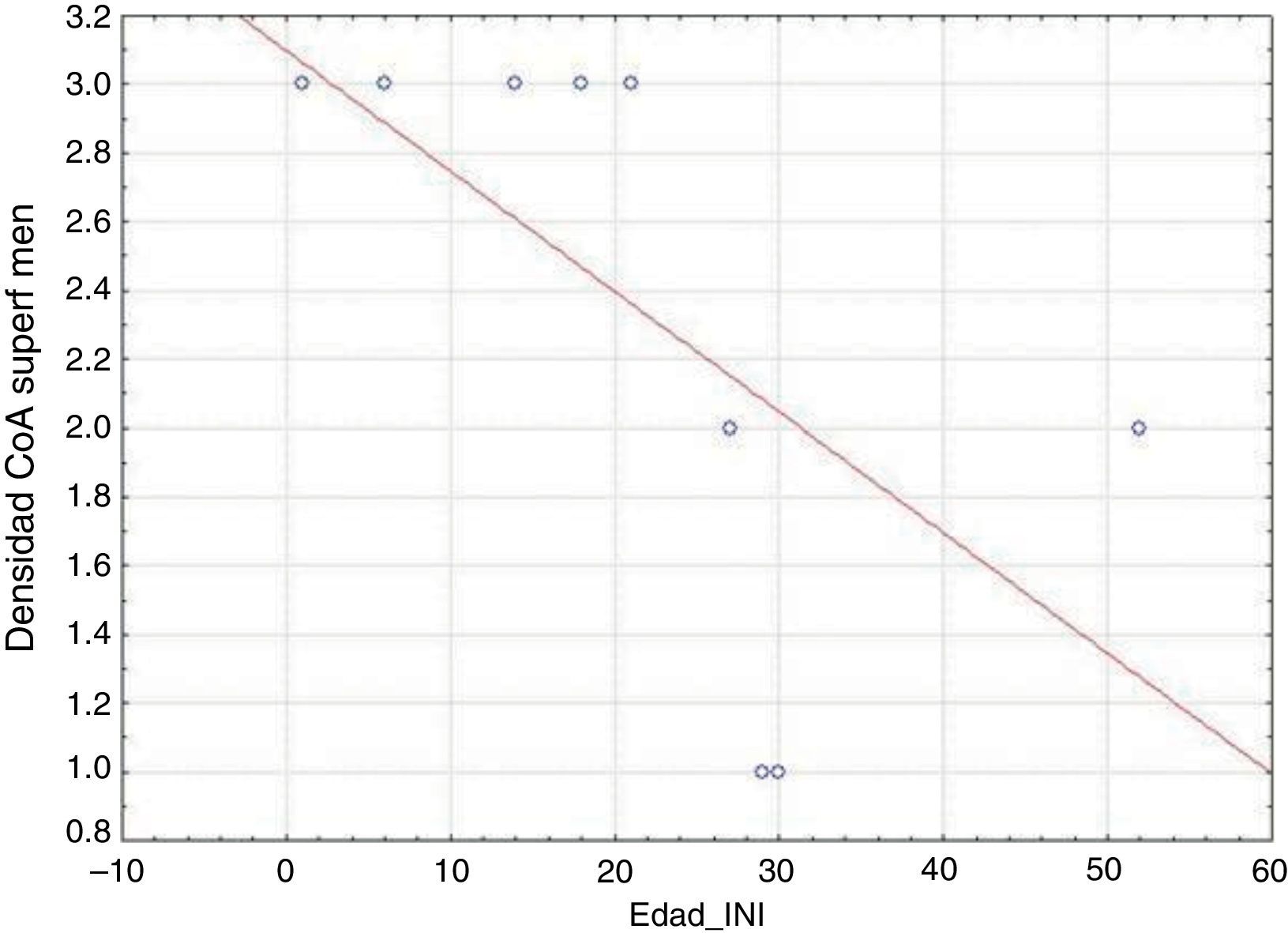
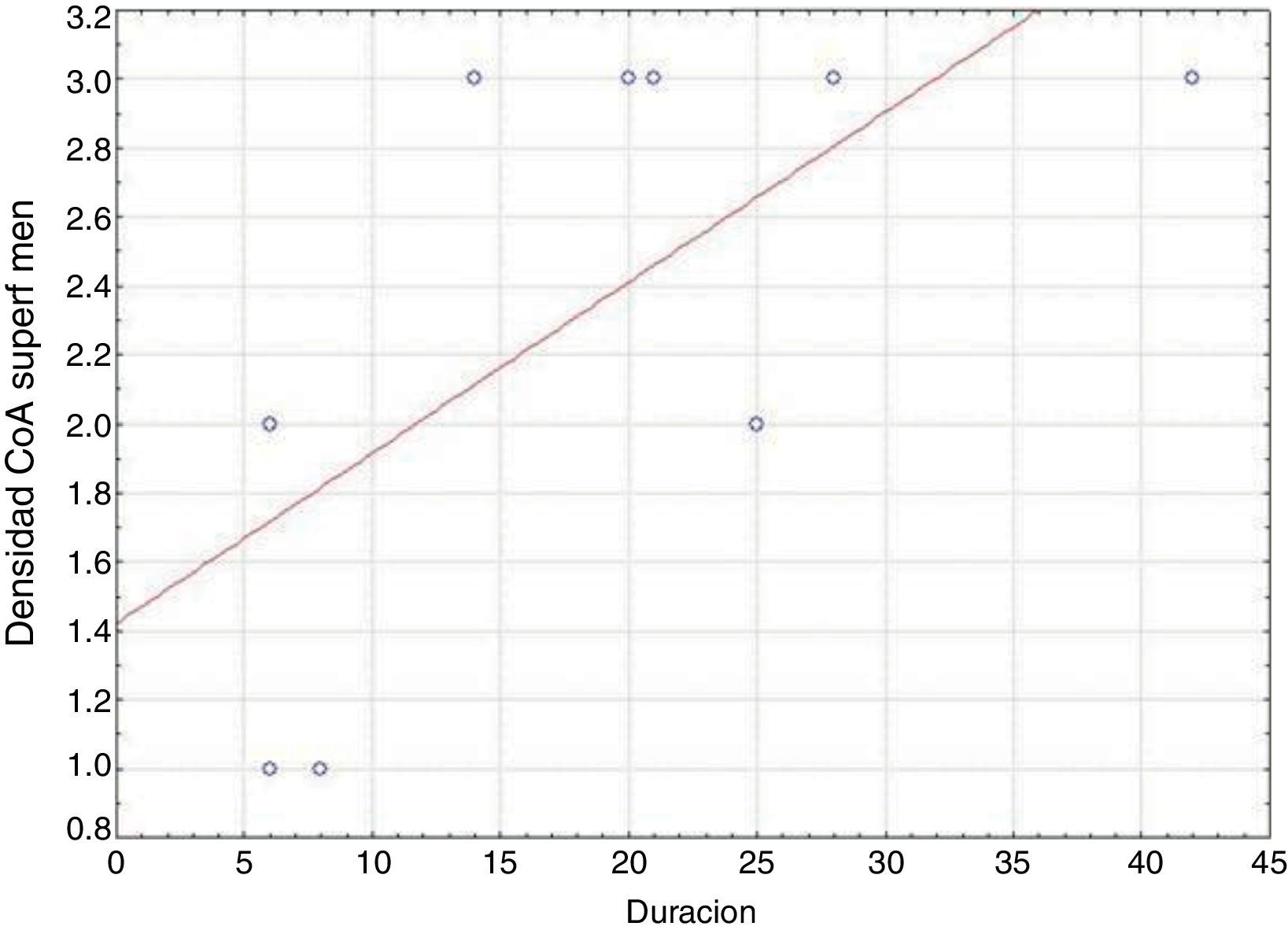
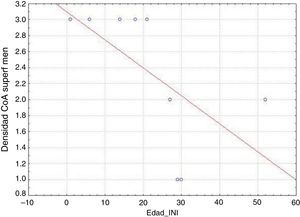
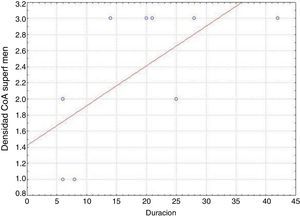
En nuestra serie, encontramos que los pacientes con un inicio temprano de las crisis presentaron una mayor densidad de CoA en la SM (correlación negativa, r=−0,828) (fig. 5). En tanto, los pacientes con una mayor duración de la epilepsia mostraron un aumento de la densidad de CoA en la SM (correlación positiva, r=0,678) (fig. 6). A su vez, no existió una correlación entre la edad en el momento de la cirugía y la densidad de CoA. No se encontró una asociación entre la presencia de CoA y la evolución clínica al año de la cirugía (p=0,18).
Como comentamos anteriormente, la literatura científica refleja escasos artículos que describen la presencia de CoA en la neocorteza lateral temporal de pacientes con epilepsia farmacorresistente. Dos de los trabajos son informes de casos11,17 y el resto asociados a otras alteraciones microscópicas, tales como anormalidades neuronales, satelitosis glial perivascular, gliosis reactiva y DCF9,18,19.
Keller en su artículo plantea que la acumulación de CoA es un fenómeno relacionado a la edad6. Esta afirmación no es válida para nuestros pacientes por 2 razones: el promedio de edad en el momento de la cirugía fue de 41,11 años y no existió relación entre la densidad de CoA en las diferentes localizaciones estudiadas y la edad en el momento de la intervención quirúrgica. No obstante, al hacer un análisis de la disposición de estas estructuras, apreciamos que la distribución de los CoA en nuestro trabajo fue un tanto similar a lo observado en el envejecimiento cerebral (región subpial, subependimaria y perivascular)17.
Además del envejecimiento cerebral, existen otras condiciones que favorecen el desarrollo de los CoA, tales como la hipoxia crónica, la diabetes mellitus y la esclerosis múltiple, entre otras20. Ninguno de nuestros pacientes presentaba estas afecciones; solo 2 presentaron un insulto perinatal.
En estudios previos10,11,17 o series de pacientes8,9,15,18,19,21-26 han descrito la acumulación abundante de CoA en la neocorteza y en el hipocampo de pacientes con ELTFR y EH. En los hipocampos resecados, los CoA han sido observados en las siguientes áreas: CA1, CA3 y CA4, folium terminal y fascia dentada, y en menor grado en la corteza parahipocampal8,15,25. De los 2 hipocampos estudiados por nosotros, solo uno fue diagnosticado como G-3 en el área CA4 y CCG.
En nuestra serie, encontramos una correlación negativa entre la edad de inicio de las crisis y la densidad de CoA en la SM, así como una correlación positiva entre la duración de las crisis y la densidad de los CoA en igual localización. Los grupos de Ribeiro et al. y Abubakr et al. comentan una asociación entre la duración de la epilepsia y la presencia de CoA, pero localizados en el hipocampo, sugiriendo que la formación de CoA se debe al proceso epileptogénico22,23. Otros autores consideran que la formación de los CoA está relacionada con los procesos celulares inducidos por un daño27, entonces las crisis pudieran contribuir también a su desarrollo, localizados estos en el hipocampo o en la neocorteza.
El grupo de Abubakr expresa que las crisis pueden ayudar a la formación de los CP (CoA) debido a que existe un incremento de la demanda en la vía del metabolismo de la glucosa y la formación posterior de conjugados estables de ubiquitina con poliglucosano, que está aumentado por la inducción de proteínas de choque térmico23. Este argumento pudiera ser también válido para la presencia de CoA en la neocorteza lateral de nuestros pacientes. Otros, por su parte, explican que la proliferación de astrocitos en respuesta a las crisis epilépticas puede conllevar la acumulación de CoA17.
Varios trabajos han referido la relación entre la presencia de CoA en el hipocampo y la evolución clínica en pacientes con ELTFR sometidos a cirugía, siendo los resultados contradictorios.
Van Paesschen et al., en su artículo, comparan las características clínicas y la evolución posquirúrgica en 26 pacientes con EH y CoA, y en 15 enfermos con EH sin CoA, no encontrando diferencias significativas entre ambos grupos. Estos autores también refieren que la correlación inversa de la densidad de CoA con la densidad neuronal apoya la hipótesis de que los CoA pueden ser el resultado de la pérdida neuronal y que estos son un epifenómeno en los procesos patogénicos que ocurren en la EH25.
El grupo de Cherian et al. no halló diferencias significativas en cuanto a la evolución de las crisis en los 58 pacientes con EH, con CoA (33 pacientes) y sin CoA (25 pacientes) en 2 años de seguimiento (15). Erdamar et al. tampoco observaron correlación entre el número de CoA y la pérdida neuronal28.
El trabajo publicado por Kawamura et al. no evidenció diferencias significativas entre el grupo con EH y CoA (18 casos) y los que no tenían CoA (11 casos) en cuanto a la edad de inicio de las crisis, duración de la enfermedad o evolución clínica26.
Radhakrishnan et al. compararon las características clínicas y el EEG, así como la evolución posquirúrgica en pacientes con ELTFR y EH con CoA (n = 129, 34,5%) y sin CoA (n = 244, 65,5%). El grupo de pacientes con ELTFR-EH-CoA+ presentaron una mayor edad al momento de la cirugía, así como una duración prolongada de la epilepsia comparado con el grupo sin CoA. A pesar de que la evolución clínica fue comparable en ambos grupos, se observó un número mayor de pacientes libres de FAE en el grupo sin CoA24.
En los 2 artículos de CoA localizados en la neocorteza, las pacientes quedaron libres de crisis posterior a la cirugía11,17. En nuestra pequeña serie no hallamos una asociación entre la presencia de CoA y la evolución clínica al año de la cirugía. Debemos tener en cuenta con este resultado que los CoA no fueron el diagnóstico histológico principal, tal como se muestra en la tabla 2, considerándolos como una consecuencia de la ELTFR.
En resumen, en pacientes con ELTFR con lesión principal (EH, tumor, malformación vascular) asociada a DCF ligeras se constata la acumulación de CoA en la neocorteza. No se encontró una asociación entre la presencia de CoA y la evolución clínica de los pacientes al año de la cirugía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.