Introducción
Los leucocitos migran de manera constante y amplia en todo el organismo como mecanismo de vigilancia inmunológica y tienen la capacidad de activar un proceso inflamatorio, responder a la presencia de un antígeno y eventualmente destruirlo en cualquier parte del cuerpo.
Al principio del proceso inflamatorio los leucocitos y las células endoteliales activadas expresan selectinas que establecen una interacción débil e inestable entre ellos. Cada selectina reconoce secuencias de carbohidratos específicos tanto en los leucocitos como en el endotelio, con lo que inician una atracción de una subunidad particular de leucocitos que ocasiona que las células circulantes reduzcan su velocidad y comiencen a rodar encima del endotelio vascular.
Los factores desencadenantes, como IL8 y MIP-1 beta, activan las moléculas de adhesión leucocitarias. Este paso es importante porque las integrinas en los leucocitos no se adhieren de modo apropiado hasta que se activan. Una fuerte adhesión es mediada a través de estas integrinas leucocitarias, que se unen a sus receptores conocidos como moléculas de adhesión intercelular (ICAM).1,2
Después de esta sólida adhesión al endotelio, los leucocitos migran al interior del tejido influidos además por factores premigratorios; muchas de las citocinas que estimulan esta adhesión pueden actuar como factores quimiotácticos.
Se cree que numerosas citocinas, moléculas de adhesión y metaloproteinasas participan en el proceso de lesión tisular; destaca la acción de las moléculas de adhesión vascular I (VCAM)/ el antígeno-4 de aparición tardía (VLA-4) en el inicio del proceso de lesión.
Los factores estimulantes de colonias son proteínas que actúan sobre tejido hematopoyético por unión a receptores específicos en la superficie celular estimulando la proliferación, diferenciación y activación celular. rHuG-CSF (filgrastim) es un factor estimulante específico de colonias de granulocitos producido por monocitos, fibroblastos y células endoteliales; sus efectos sobre la producción de células hematopoyéticas que no sean neutrófilos son mínimos.2
rHuGM-CSF (molgramostim) es un factor estimulante de colonias de granulocitos y macrófagos que pertenece a un grupo de factores que apoyan la supervivencia, la expansión clonal y la diferenciación de las células progenitoras hematopoyéticas al estimular la proliferación de granulocitos, monocitos y linfocitos T, pero no la de linfocitos B, e incrementa el número de células hematológicas maduras.
El uso de factores de crecimiento hematopoyético como filgrastim (FEC-G) o molgramostim (FEC-GM) ha supuesto un valioso avance al reducir la incidencia de neutropenia y sus complicaciones, lo que evita retrasos y reducción de la dosis de quimioterapia que se administra.1,2
Varios autores describen el incremento en los niveles séricos de diversas moléculas de adhesión endotelial secundario al efecto biológico que los factores estimulantes de colonias ejercen sobre las células hematopoyéticas.2-4
El mecanismo por el que las células endoteliales interactúan con los leucocitos durante la estimulación de los FEC-G o FEC-GM sobre las células hematopoyéticas aún no es claro; sin embargo, se sabe que las moléculas de adhesión contribuyen durante el proceso de migración de las células hematopoyéticas. En este estudio se evaluaron las moléculas de adhesión E-selectina, las cuales se expresan en las superficies endoteliales;5 las sVCAM-1, que se encuentran distribuidas en las células endoteliales dendríticas y en los fibroblastos de la médula ósea,6,7 y las s-ICAM-1, que se expresan en las superficies celulares, inclusive en las hematopoyéticas.8
La neutropenia es el descenso de neutrófilos absolutos circulantes y según su magnitud puede clasificarse de la siguiente manera: leve (de 1 000 a 1 500 neutrófilos absolutos/mm3), moderada (de 500 a 1 000/mm3), grave (< 500/mm3) y profunda (< 100/mm3).8
El presente trabajo pretende conocer tanto el incremento en los niveles de VCAM-1, sICAM-1 y E-selectina a partir de la estimulación con FEC-G, FEC-GM o ambos, como la eficacia y seguridad de estos agentes en el manejo de la neutropenia en pacientes que reciben tratamiento antineoplásico.
Material y métodos
Diseño
Estudio prospectivo, longitudinal, comparativo, experimental que incluyó a 35 pacientes menores de 70 con neutropenia después de la administración diferentes esquemas de quimioterapia o radioterapia. Se tomaron muestras basales de sangre para determinar biometría hemática completa, química sanguínea, niveles séricos de sVCAM-1, sICAM-1, sE-selectina, y pruebas de función hepática. La dosis administrada de FEC-G o FEC-GM fue de 300 mcg al día hasta alcanzar una cifra superior de 1 500 neutrófilos absolutos/mm3 por tres días consecutivos. Se determinaron biometrías hemáticas a diario para valorar los niveles de neutrófilos absolutos a fin de determinar la suspensión del tratamiento una vez alcanzados los niveles deseados. Los datos de evaluación clínica y bioquímica se registraron en el formato de reporte de caso de cada paciente.
Sujetos incluidos
Menores de 70 años de edad con diagnóstico de neutropenia leve a grave secundaria a tratamiento de quimioterapia, radioterapia o ambas; desempeño físico en la escala de gravedad de Karnofsky > 50% o de 0 a 2 en la escala de estado general de ECOG. Los pacientes fueron asignados de manera aleatoria a cualquiera de los tres grupos de tratamiento: grupo A, pacientes tratados con Filatil® (filgrastim); grupo B, pacientes tratados con Neupogen® (filgrastim), o grupo C, pacientes tratados con Gramal® (molgramostim). Se evaluaron 32 casos que cumplieron con los criterios de inclusión y ninguno de exclusión.
Aspectos éticos
El protocolo fue aprobado por los comités de investigación y ética de los centros participantes. Todos los pacientes firmaron el consentimiento informado antes de someterse a cualquier procedimiento. El estudio se condujo bajo las normas ICH y GCP.
Medicamento
Cada investigador participante resguardó y almacenó el medicamento empleado en el estudio de acuerdo con las indicaciones del fabricante. Cada entrega se documentó en la forma de control de medicamento: Filatil® (filgrastim, número de lote 5432070609 con fecha de caducidad 08-jun-09, 300 mcg), Neupogen® (filgrastim, número de lote B10707 con fecha de caducidad 02-ago-09, 300 mcg) y Gramal® (molgramostim, número de lote 8502070702 con fecha de caducidad 31-jul-09, 300 mcg).
Dosis y vía de administración
Se administraron 300 mcg al día por vía subcutánea hasta alcanzar una cifra mayor de 1500 neutrófilos absolutos/ mm3 por tres días consecutivos.
Estudios de laboratorio
En todos los pacientes se realizó biometría hemática, química sanguínea y niveles séricos de moléculas de adhesión antes del tratamiento con los factores estimulantes de colonias (día 0), biometría hemática a diario y niveles séricos de moléculas de adhesión hasta alcanzar los niveles de neutrófilos absolutos deseados (día 5 a 10) de tratamiento. La toma de muestra sanguínea y los procedimientos de química sanguínea y biometría hemática se efectuaron en laboratorios locales; las determinaciones de los niveles de moléculas de adhesión se llevaron a cabo en un laboratorio central.
Análisis estadístico
Para la descripción general de datos se utilizaron estadísticas descriptivas: promedio, máximos, mínimos y desviación estándar. La comparación del efecto biológico de los factores estimulantes de colonias sobre las moléculas de adhesión se determinó mediante la diferencia entre los valores basales (día 1 y día 5) de los niveles séricos de sVCAM-1, s-ICAM-1 y sE-selectina con la prueba de Wilcoxon. La seguridad se evaluó con base en las alteraciones en los resultados de laboratorio y los eventos adversos referidos por los pacientes. Se realizó un análisis multivariado para buscar relaciones entre efecto del medicamento y género, peso, edad, esquema de quimioterapia, grado de neutropenia y días de tratamiento. Todos los parámetros se calcularon con el programa estadístico electrónico SPSS versión 17.0.
Vigilancia de eventos adversos
Los pacientes fueron valorados por medio de historia clínica, química sanguínea y pruebas de función hepática el día 0. Los eventos adversos presentados durante el proyecto y la medicación concomitante se registraron en el formato de reporte de caso.
Determinación de los niveles séricos de sVCAM-1
En el día 0 y al final de tratamiento (hasta el tercer día de haber alcanzado la cifra mayor de 1 500 neutrófilos absolutos/mm3), a los pacientes se les tomaron muestras de sangre para determinación de sVCAM-1, sICAM-1 y sE-selectina; se centrifugaron por 15 min a 1000 rpm y las muestras de suero congelado se almacenaron a -20° C en el laboratorio central, donde permanecieron como muestras ciegas al tratamiento. Las concentraciones séricas de las tres moléculas de adhesión se determinaron con kits comerciales para ELISA (R&D Systems) siguiendo las instrucciones del productor. El análisis de las muestras para ambos grupos se mantuvo ciego al tratamiento asignado durante el proceso. El intervalo de detección lineal para la prueba fue de 2 a 2 500 ng/mL. Una alícuota de reserva se conservó a -20° C.
Resultados
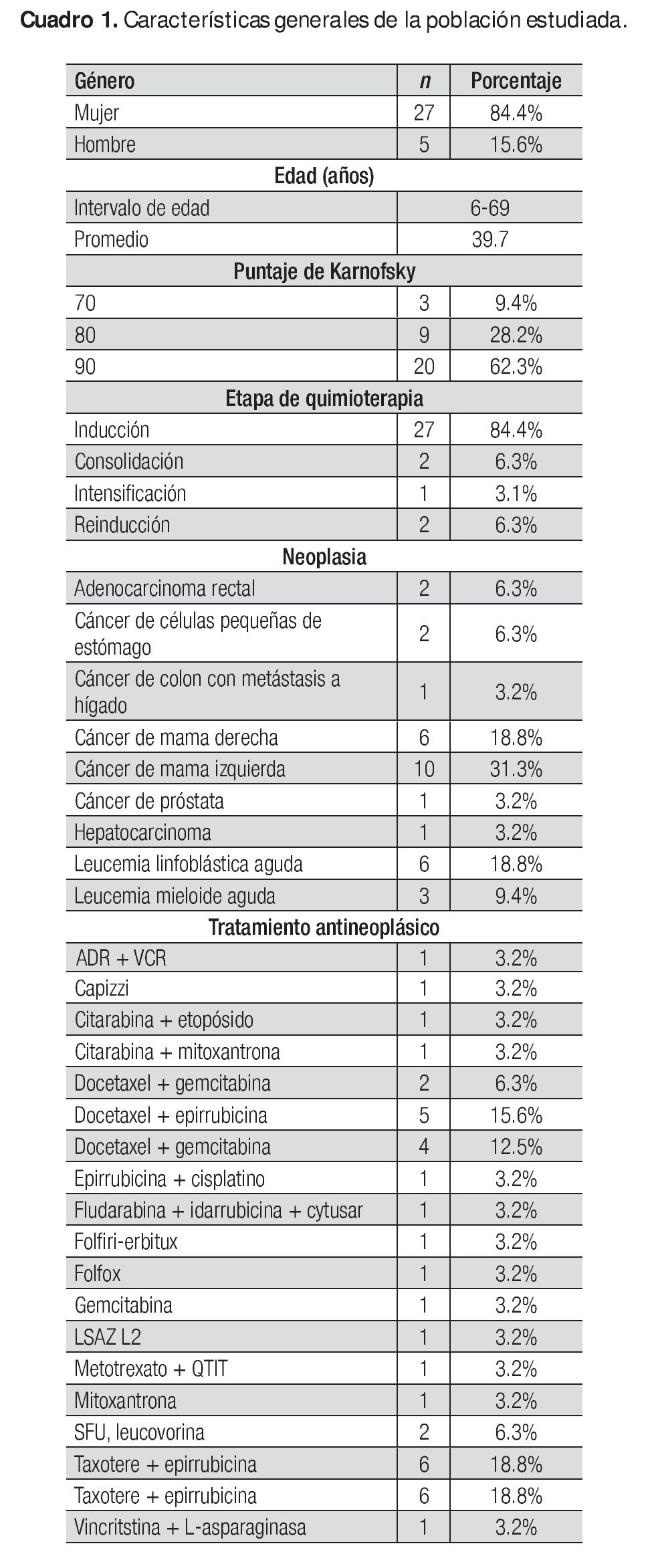
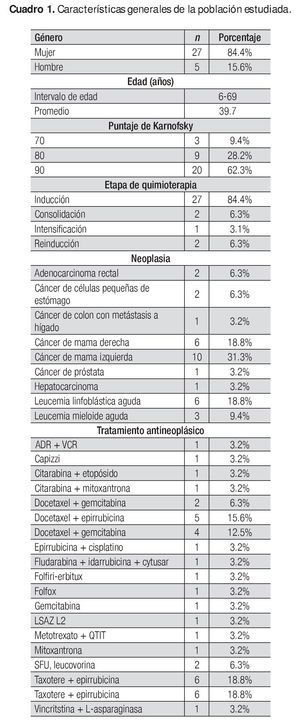
Se analizaron 35 casos; de ellos, un paciente retiró el consentimiento informado, otro no cumplió con los procedimientos del estudio y uno más falleció por motivos propios de la enfermedad no relacionados con el medicamento en estudio. Por último, se incluyeron para análisis clínico y bioestadístico 32 casos distribuidos de la siguiente manera: 10 casos en el grupo A, 11 en el grupo B y 11 en el Grupo C. El Cuadro 1 describe las características generales de la población estudiada.
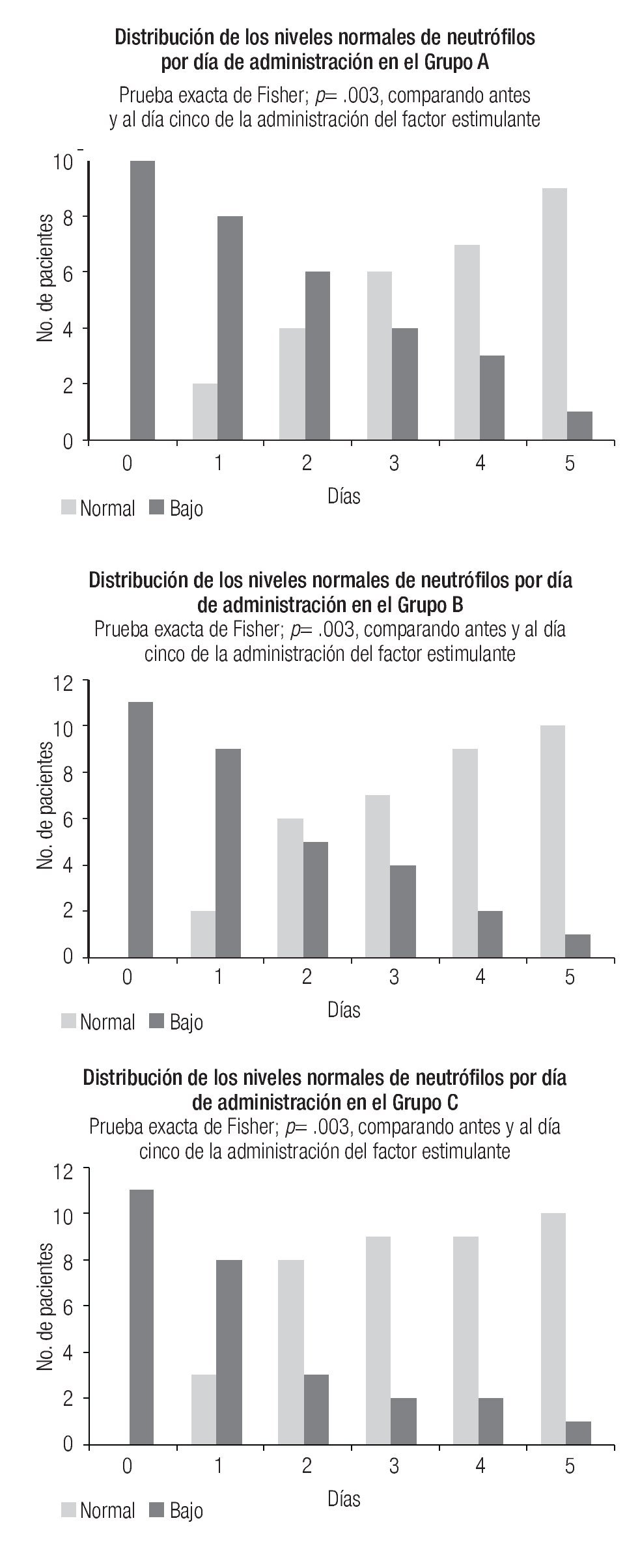
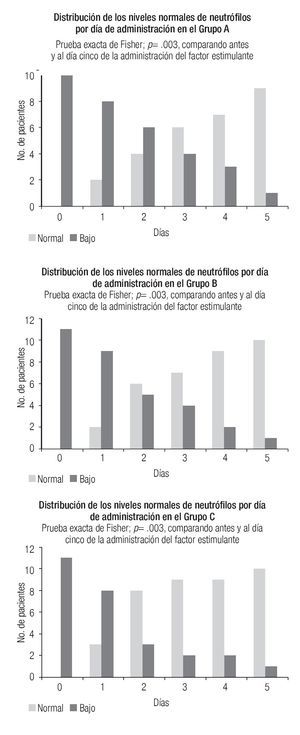
La Figura 1 ilustra, por grupos de estudio, la distribución de la recuperación de la cuenta absoluta de neutrófilos con respecto a los días de tratamiento; se observa una recuperación de 90% de los pacientes al día 5 de tratamiento. El promedio de días de tratamiento fue de 2.8 para el grupo A, 2.6 para el grupo B y 2.2 para el grupo C, diferencia que no fue significativa.
Figura 1. Recuperación de la cuenta absoluta de neutrófilos en relación con el día de tratamiento con los factores estimulantes de colonias de granulocitos y/o macrófagos.
Al comparar la distribución de la frecuencia entre el día basal y el quinto después de la administración del factor estimulante se observó una diferencia estadísticamente significativa en la cuenta absoluta de neutrófilos con la prueba de exacta de Fisher, p < 0.05.
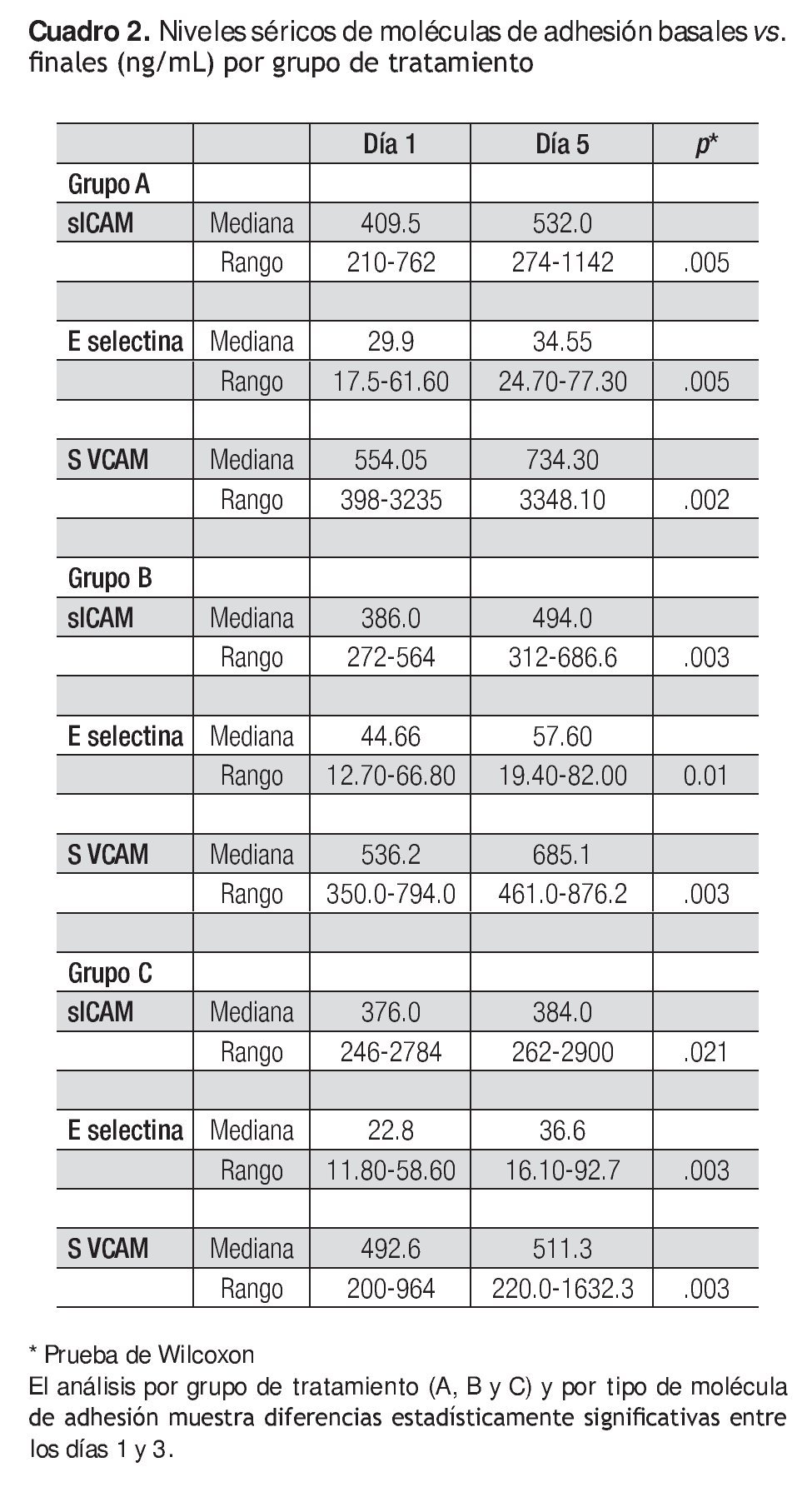
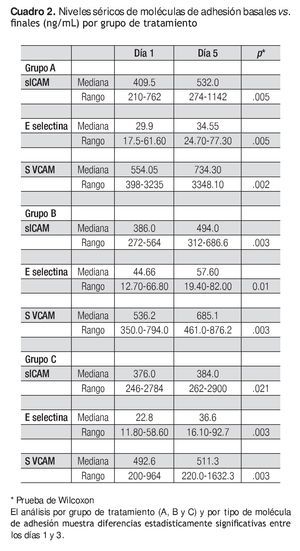
El Cuadro 2 muestra los valores séricos de las moléculas de adhesión (ng/ml) los días 1 y 5.
Los tres medicamentos en estudio mostraron capacidad para estimular las diferentes moléculas de adhesión en este grupo de pacientes oncológicos. Cuando se compararon las medianas con la prueba de Wilcoxon, entre el día 1 y el día 5, los niveles se incrementaron en forma significativa.
En términos de incremento se observó que la molécula de adhesión sVCAM-1 fue la que mostró un mayor cambio entre antes y después de la aplicación del factor estimulante.
Eventos adversos
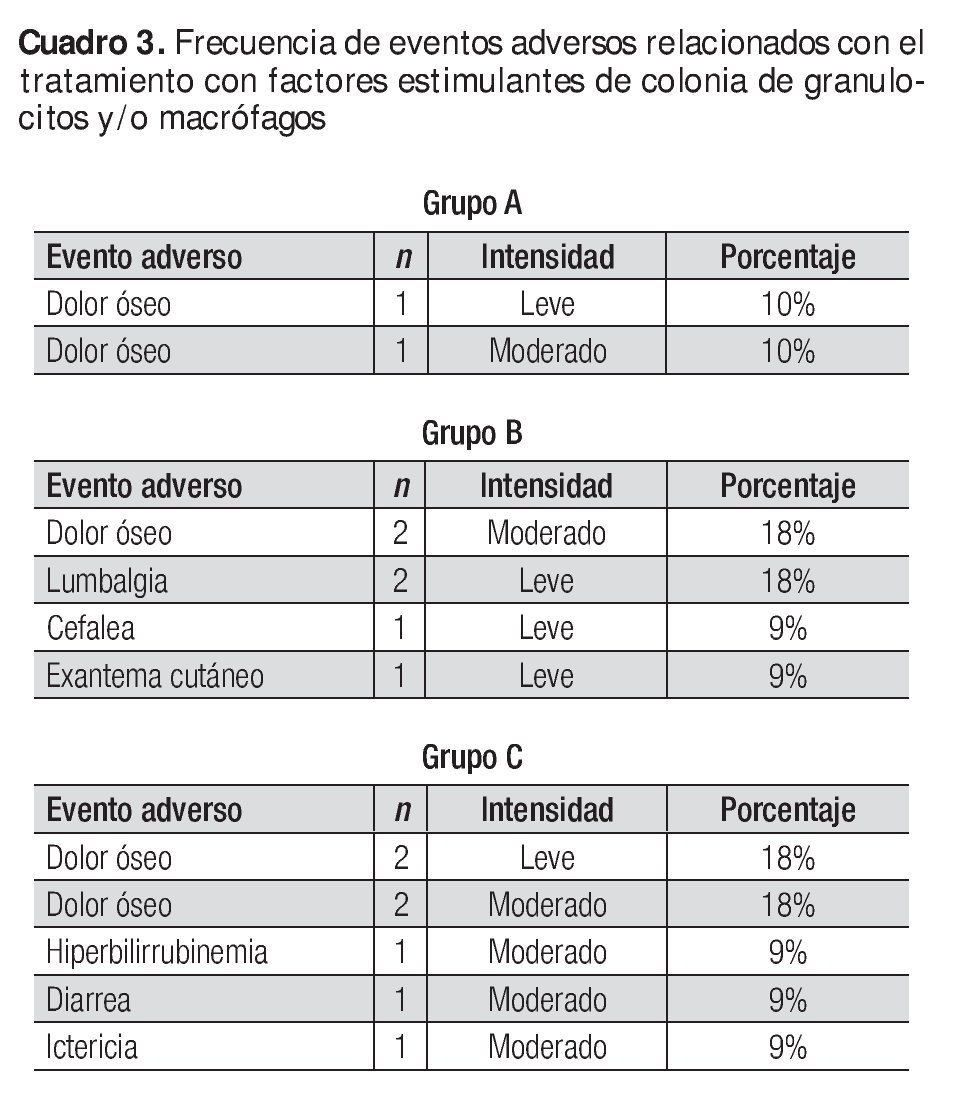
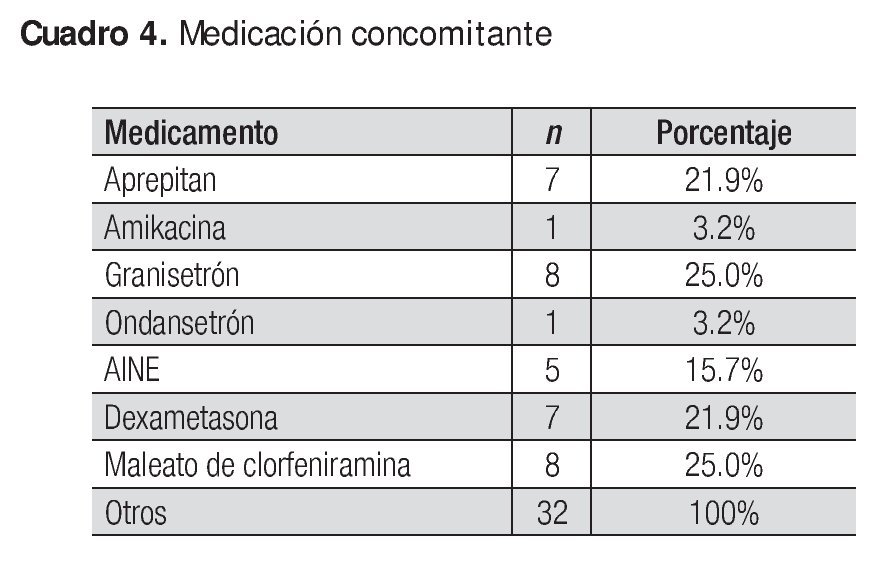
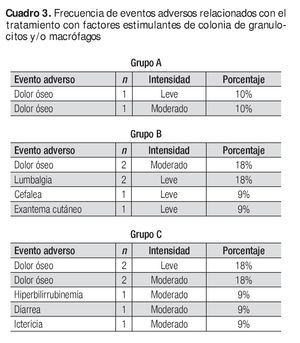
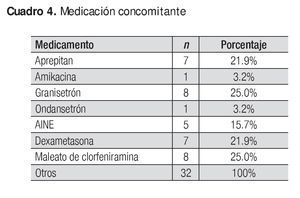
No se reportó ningún evento adverso grave; los que se presentaron se identificaron como leves y moderados, y ninguno produjo el abandono del tratamiento o impacto en la seguridad de los sujetos. El Cuadro 3 muestra los eventos adversos y el Cuadro 4, la medicación concomitante.
Discusión
Aunque contar con diferentes tipos de medicamentos para aumentar la producción de neutrófilos es importante, se requiere determinar si cada producto mantiene el mismo nivel de eficiencia. Puesto que en México se tiene muy poca información al respecto, es necesario comparar los tres productos biológicos analizados. Si bien el número de pacientes incluidos no es alto, el estudio permite conocer la efectividad de cada agente. En este grupo de pacientes pudo observarse el efecto biológico ejercido por los FEC, determinado por el incremento en los niveles séricos de las moléculas de adhesión independientemente de la marca del producto, tal y como se informó en el estudio de Südhoff y Dietmar. No se identificaron diferencias significativas cuando se comparó los niveles de las moléculas de adhesión entre los grupos de tratamiento. Asimismo se observó un incremento significativo en los niveles de la cuenta absoluta de neutrófilos en los tres grupos de estudio. Los resultados permitieron hacer una comparación de comportamiento, efecto biológico y perfil de seguridad de los tres medicamentos en estudio, en la que la respuesta no mostró una diferencia significativa en el número de días para alcanzar ≥ 1 500 neutrófilos/ mm3 ni tampoco en el número y gravedad de los efectos adversos.
PATROCINADOR: Probiomed, S.A. de C.V. Av. Ejército Nacional 499, 4° piso, Col. Granada, C. P. 11520, México, D. F.
Correspondencia:
Dr. David Gómez Almaguer.
Hospital Universitario, Dr. José Eleuterio González, Universidad Autónoma de Nuevo León, México. Avenida Gonzalitos s/n, Colonia Mitras Centro, C. P. 64460, Monterrey, N. L.
Correo electrónico:dr_gomez@infosel.net.mx.
Recibido: enero, 2010.
Aceptado: febrero, 2010.