La enfermedad por hígado graso no alcohólico (EHGNA) es una de las enfermedades hepáticas crónicas más frecuentes, con una prevalencia del 20-30% en la población general y del 60-80% en poblaciones de riesgo. En un porcentaje no despreciable de pacientes la EHGNA progresa desde la esteatosis hacia a diferentes estadios de fibrosis y cirrosis. Por su alta prevalencia, la EHGNA se ha convertido en un problema de salud relevante que requiere de acciones específicas para su detección, diagnóstico, seguimiento y tratamiento. Además, dado que la EHGNA presenta un riesgo aumentado de morbimortalidad cardiovascular requiere un enfoque multidisciplinar para su tratamiento y seguimiento. Los pacientes en estadios iniciales de la enfermedad, sin fibrosis, pueden ser evaluados y recibir tratamiento en el ámbito de Atención Primaria, mientras que aquellos con enfermedad hepática avanzada se benefician de un seguimiento especializado en el ámbito hospitalario para prevenir y tratar las complicaciones hepáticas. El presente documento de consenso, elaborado por las Sociedades Catalanas de Digestología, Atención Primaria, Endocrinología, Diabetes y Medicina Interna nace de la necesidad de diseñar estrategias que guíen los flujos de los pacientes entre el ámbito de Atención Primaria y Hospitalaria para poder ofrecer a los pacientes con EHGNA la mejor atención según el estadio de su enfermedad. En el documento de consenso se describen los métodos diagnósticos no invasivos más utilizados para el diagnóstico de los pacientes y se han diseñado dos algoritmos para el tratamiento de los pacientes tanto en ámbito de atención primaria como de atención hospitalaria.
Non-alcoholic fatty liver disease (NAFLD) is one of the most common chronic liver diseases, with a prevalence of 20-30% in the general population and 60-80% in at-risk populations. In a not negligible percentage of patients, NAFLD progresses from steatosis to different stages of fibrosis and cirrhosis. Due to its high prevalence, NAFLD has become a significant health problem that requires specific action in detection, diagnosis, follow-up and treatment. Furthermore, given that NAFLD presents an increased risk of cardiovascular morbidity and mortality, a multidisciplinary approach is required for its treatment and follow-up. Patients with early stages of the disease, without fibrosis, can be diagnosed and receive treatment in the Primary Care setting, while those with more advanced liver disease benefit from specialised follow-up in the hospital setting to prevent and treat liver complications. This consensus document, prepared by the Catalan Societies of Digestology, Primary Care, Endocrinology, Diabetes and Internal Medicine, arises from the need to design strategies to guide patient flows between Primary and Hospital Care in order to offer patients with NAFLD the best care according to the stage of their disease. The consensus document describes the most commonly used non-invasive diagnostic methods for patient diagnosis and two algorithms have been designed for patient management in both Primary Care and Hospital Care.
La enfermedad por hígado graso no alcohólico (EHGNA) se ha convertido en la enfermedad hepática crónica más prevalente en el mundo y, tanto por su frecuencia como por su potencial gravedad, empieza a ser considerada como un problema de salud de primera magnitud. La EHGNA se define por la presencia de esteatosis hepática de causa metabólica. Se estima que la prevalencia en la población adulta en nuestro medio es del 25-30%1,2 aumentando significativamente en poblaciones de riesgo (pacientes con obesidad y/o diabetes, 60-80%)3. Su incidencia crece en todo el mundo paralelamente a la obesidad y sobrepeso, diabetes tipo 2 y síndrome metabólico3. Estudios poblacionales recientes de diagnóstico sistemático estiman que la EHGNA es la principal causa de cirrosis «oculta» (es decir, no conocida previamente) en la población general. Se estima que en EE. UU. será la primera causa de trasplante hepático antes de 20204,5. Datos recientes también sugieren que en el Reino Unido ya podría ser la primera causa de carcinoma hepatocelular (CHC)6. Finalmente, la presencia de EHGNA se asocia a un aumento de morbimortalidad no solo de causa hepática, sino también de origen cardiovascular, neoplásica y de complicaciones de la diabetes3,7. La actividad científica en este campo ha crecido de manera exponencial en la última década. Por todo ello, es necesario un esfuerzo continuado para proporcionar recomendaciones de tratamiento actualizadas y dirigidas a los distintos profesionales sanitarios que atienden a pacientes afectados de EHGNA.
Objetivo y procedimientoEl objetivo del presente documento de consenso sobre la EHGNA es proporcionar unas recomendaciones actualizadas y prácticas a profesionales del ámbito hospitalario y de atención primaria sobre el diagnóstico y tratamiento de pacientes con dicha enfermedad. El documento ha sido elaborado por el grupo de trabajo de EHGNA de la Societat Catalana de Digestología (SCD). El grupo está formado por especialistas en Digestología, Medicina Interna, Endocrinología y Medicina Familiar y Comunitaria. Dicho grupo comenzó a trabajar en la elaboración del documento en enero de 2017. Las distintas versiones del documento han sido revisadas por las sociedades catalanas de Digestología, Endocrinología, Diabetes, Medicina Interna y Medicina Familiar y Comunitaria, así como por la Associació de Malalts i Trasplantats Hepàtics de Catalunya. Las sugerencias y recomendaciones de las distintas asociaciones consultadas han sido recogidas, revisadas e incorporadas en la versión final del presente documento.
Para la redacción del documento se han tenido en cuenta las recomendaciones AGREE II para la elaboración de guías clínicas y documentos de consenso8. Se ha realizado una revisión sistemática de la bibliografía, orientada fundamentalmente al diagnóstico, tratamiento y seguimiento de EHGNA. Se ha dado mayor importancia a los documentos de consenso y guías clínicas de las principales sociedades nacionales e internacionales, así como a aquellos artículos de impacto, posteriores a la publicación de dichas guías, que aportarán resultados significativos con capacidad de modificación de práctica clínica. A lo largo del documento se ha tenido especial cuidado en resaltar las limitaciones y riesgos asociados a recomendaciones específicas, y se ha justificado en todo momento la evidencia disponible (o la ausencia de la misma) al enunciar dichas recomendaciones. Finalmente, se han seguido el resto de recomendaciones en cuanto a aplicabilidad, presentación y publicación del documento recogidas en AGREE.
Factores de riesgoDeterminados factores se asocian a un incremento de 2 a 3 veces el riesgo de tener o desarrollar EHGNA y pueden ser fundamentales para el diagnóstico y el pronóstico de la enfermedad:
- -
Obesidad (IMC>30kg/m2), especialmente de distribución abdominal (perímetro cintura>102cm en varones y>88cm en mujeres).
- -
Diabetes mellitus tipo 2 y glucemia alterada en ayunas.
- -
Otros factores asociados al síndrome metabólico: hipertensión arterial, hipertrigliceridemia, disminución de colesterol HDL.
- -
Sobrecarga férrica dismetabólica (ferritina 500-1500mg/l, saturación de transferrina<40-50%, hierro intrahepático>150 mmol/g).
- -
Determinados polimorfismos genéticos (PNPLA3-I148M, TM6SF2-E167K).
- -
Otros (menor nivel de asociación): síndrome de ovario poliquístico (hiperandrogenismo funcional ovárico), diabetes mellitus tipo 1, hipotiroidismo primario, síndrome de apnea-hipopnea obstructiva del sueño, hipopituitarismo anterior, hipogonadismo, resección pancreática-duodenal.
EHGNA: esteatosis hepática diagnosticada por biopsia o por métodos no invasivos de imagen (ecografía, controlled atenuation parameter [CAP], ver más adelante, o resonancia magnética) o serológicos (Fatty Liver Index [FLI]), en ausencia de otros factores que puedan dar lugar a una esteatosis llamada «secundaria» (tabla 1). Las causas más frecuentes de esteatosis secundaria en adultos son el consumo de riesgo de alcohol y la exposición o consumo crónico de algunos fármacos. La presencia de factores de esteatosis secundaria no excluye la coexistencia de una EHGNA (pueden estar presentes más de un factor patogénico). El término EHGNA comprende distintas fases de la evolución de la enfermedad que se diferencian según la combinación en diferentes grados de esteatosis, inflamación y fibrosis hepáticas (tabla 2):
Causas más frecuentes de esteatosis hepática «secundaria» (no EHGNA)
| Esteatosis macrovesicular | Esteatosis microvesicular |
|---|---|
| Consumo excesivo de alcohol: | Síndrome de Reye |
| >40g/día en hombres | |
| >20g/día en mujeres | |
| Fármacos: amiodarona, tamoxifeno, metotrexato, corticoides, otros | Fármacos: ácido valproico, antirretrovirales |
| Hepatitis C (genotipo 3 del VHC) | Esteatosis asociada al embarazo, síndrome de HELLP |
| Enfermedad de Wilson | Errores innatos del metabolismo:déficits de lipasa ácida lisososómica (enfermedad de Wolman en niños, enfermedad por acúmulo de ésteres de colesterol en adultos), otros |
| Lipodistrofias | |
| Nutrición parenteral | |
| Deprivación calórica subaguda o crónica grave |
Marcadores serológicos para diagnosticar esteatosis y fibrosis en la EHGNA
| Score | Parámetros para su cálculo | Referencia |
|---|---|---|
| FLI | Triglicéridos, IMC, GGT, perímetro abdominal | Bedogni 200640 |
| FIB-4 | ALT, AST, edad, plaquetas | Shah 200941 |
| NFS | AST, ALT, plaquetas, albúmina, IMC, DM | Angulo 200742 |
DM: diabetes mellitus; FIB-4: Fibrosis 4 score; FLI: Fatty Liver Index; GGT: gamma-glutamil-transpeptidasa; IMC: índice de masa corporal; NFS: NAFLD fibrosis score.
a. Esteatosis simple (ES): presencia de grasa en el hígado sin fibrosis y con inflamación leve o inexistente. Es la forma más prevalente.
b. Esteatohepatitis no alcohólica (EHNA, NASH en inglés): presencia de grasa en el hígado acompañada de balonización hepatocitaria e inflamación lobulillar. El espectro de EHNA va desde casos sin fibrosis a grados variables de fibrosis y, finalmente, cirrosis.
c. Cirrosis criptogénica: dada la elevada prevalencia de EHGNA, y la peculiaridad de que las características anatomopatológicas de la EHNA (esteatosis e inflamación) tienden a desvanecerse con la progresión de la fibrosis, el diagnóstico de cirrosis criptogénica se engloba dentro de esta entidad en pacientes con factores de riesgo para la EHGNA.
DiagnósticoTanto la definición como el diagnóstico de confirmación de la EHGNA son, en última instancia, histológicos. Sin embargo, desde un punto de vista práctico, se utilizan criterios diagnósticos clínicos no invasivos que permiten simplificar el diagnóstico y tratamiento del paciente con EHGNA.
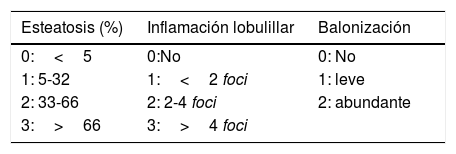
Herramientas diagnósticasDiagnóstico histológicoPara el diagnóstico histológico de EHGNA se requiere la presencia de grasa en>5% de los hepatocitos, siempre habiendo descartado causas de esteatosis secundaria. Para hacer el diagnóstico de esteatohepatitis (EHNA), además de la presencia de esteatosis, se requiere también la presencia de daño hepatocitario (balonización, cuerpos de apoptosis, necrosis lítica) y de inflamación lobulillar (típicamente en la zona 3 del acino). Una vez realizado el diagnóstico histológico de EHGNA, hay que cuantificar la actividad y la fibrosis mediante uno de los sistemas de clasificación histológica: NASH-CRN (norteamericano, el más utilizado en estudios terapéuticos, tabla 3a)9 o SAF (score europeo que evalúa la esteatosis, la actividad inflamatoria y la fibrosis)10.
La cuantificación del grado de fibrosis es la característica más importante en la evaluación de la EHGNA, ya que varios estudios han demostrado que se relaciona con la mortalidad de causa hepática así como con la mortalidad de cualquier causa en los pacientes con EHGNA, independientemente de la presencia y gravedad de otras características histológicas11,12. El uso de estos sistemas de clasificación histológica se reserva para la cuantificación de la actividad pero no para el diagnóstico de EHNA (que debe basarse en la coexistencia de esteatosis, daño hepatocitario e inflamación lobulillar)13 (tabla 3b). En la evaluación histológica de una biopsia hepática de un paciente con EHGNA se obtienen dos tipos de información, la que se refiere a la actividad de la enfermedad (NASH activity score), que es un score numérico que va de 0 a 8 (tabla 3a) y la información referente al grado de fibrosis (tabla 3b).
Estadio de la fibrosis hepática según la clasificación CRN Fibrosis Stagin
| Estadio | Grado de fibrosis |
|---|---|
| 0 | Sin fibrosis |
| 1a | Fibrosis perisinusoidal (zona 3) leve |
| 1b | Fibrosis perisinusoidal (zona 3) moderada |
| 1c | Fibrosis periportal/portal exclusivamente |
| 2 | Fibrosis zona 3 + periportal /portal |
| 3 | Puentes de fibrosis |
| 4 | Cirrosis |
a. Datos clínicos:
- -
Presencia de factores de riesgo de EHGNA (especialmente obesidad y/o diabetes tipo 2): aumentan la probabilidad de EHGNA de manera significativa (probabilidad pretest de EHGNA en obesidad o diabetes tipo 2 es del 50-75%, y del 80-90% si coexisten las dos condiciones)3.
- -
Ausencia de otras causas de esteatosis u otras hepatopatías (el diagnóstico de EHGNA en la actualidad es de exclusión) (tabla 1).
b. Métodos serológicos:
En primer lugar, cabe destacar la utilización de los denominados métodos indirectos, que pueden incluir tanto características antropométricas como analíticas, para estimar el grado de esteatosis. Entre ellos el más evaluado es el FLI (https://www.mdapp.co/fatty-liver-index-fli-calculator-356/), un índice que está constituido por el perímetro abdominal, el índice de masa corporal, niveles plasmáticos de triglicéridos y la gamma glutamiltransferasa (GGT)14. Los pacientes con un FLI≥60 tienen con mucha probabilidad una EHGNA mientras que un FLI<30 excluye este diagnóstico.
En segundo lugar, es importante destacar que, la determinación aislada de transaminasas tiene una correlación muy pobre con la intensidad y el riesgo de progresión de la enfermedad (el 70% de pacientes con transaminasas elevadas no tienen fibrosis significativa y el 30% de pacientes con fibrosis avanzada tienen transaminasas normales)15,16. Sin embargo, su uso integrado en forma de índices de puntuación («scores») con otros datos clínicos y analíticos sí se ha demostrado útil en el diagnóstico de EHGNA. Estos índices no son estrictamente necesarios para el diagnóstico (tienen una capacidad subóptima para el diagnóstico de esteatosis y/o inflamación), pero sí que son útiles para estimar el grado de fibrosis. Existen multitud de índices serológicos para evaluar el grado de fibrosis en la EHGNA (comerciales y no comerciales). Los índices serológicos NAFLD Fibrosis Score (NFS) y FIB-4 (con puntos de corte adaptados según edad)17 son los más validados en EHGNA. Ambos índices son muy útiles para descartar la presencia de fibrosis avanzada (elevado valor predictivo negativo, especialmente en poblaciones de menor prevalencia, como la población general o los pacientes de atención primaria). Por tanto, pueden ser una buena solución para el cribado de la EHGNA en poblaciones con bajo riesgo de fibrosis avanzada tanto en atención primaria como en ámbito hospitalario (p.ej. pacientes remitidos de otras especialidades), como paso previo a la elastografía de transición para excluir a los pacientes con menor riesgo de presentar fibrosis avanzada (elevado valor predictivo negativo) y disminuir la cantidad de exploraciones necesarias.
c. Pruebas de imagen:
Como en cualquier paciente con sospecha de enfermedad hepática, se recomienda disponer de una técnica de imagen al menos basalmente (en general, ecografía abdominal) para descartar la presencia de lesiones hepáticas y evaluar signos indirectos de cirrosis e hipertensión portal.
En cuanto al tratamiento específico de EHGNA:
- -
Ecografía: es útil pero no imprescindible para el diagnóstico de EHGNA sin cirrosis. La esteatosis ecográfica confirma el diagnóstico, pero su ausencia no lo descarta (requiere la presencia de esteatosis en>20-30% de los hepatocitos). Puede ayudar a identificar datos sugestivos de cirrosis (bordes nodulares, esplenomegalia, ascitis) en pacientes de riesgo.
- -
RMN, TC: pueden ayudar a la identificación de esteatosis y/o cirrosis en pacientes seleccionados o que se someten a las pruebas por otra indicación (de manera similar por lo que ocurre con otras hepatopatías), aunque son menos adecuados para el tratamiento rutinario de pacientes con EHGNA.
d. Métodos elastográficos:
Los métodos elastográficos evalúan mediante diferentes técnicas de imagen la rigidez hepática, que se ha correlacionado con la cantidad de fibrosis en el hígado. Existen varios métodos elastográficos que utilizan la elastografía por onda de cizallamiento (FibroScan®, ARFI, SWE, MRE) con una capacidad diagnóstica similar para evaluar la dureza del hígado. El método más utilizado en nuestro medio es la elastografía de transición que se realiza con el FibroScan®. En pacientes con EHGNA, la elastografía es muy útil para descartar fibrosis significativa y para confirmar cirrosis, pero es menos fiable para definir estadios intermedios. Inicialmente, la sonda original M mostró una aplicabilidad aproximada del 80%, presentando exploraciones fallidas sobre todo en pacientes obesos. Sin embargo, la experiencia del explorador y la utilización de la sonda XL en pacientes obesos, ha permitido aumentar su aplicabilidad al 95-98%, limitando mucho el número de exploraciones no válidas18–20. Para que los resultados obtenidos por la elastografía sean fiables se requiere de la realización de al menos 10 mediciones de las cuales>60% sean válidas con una variabilidad baja, medida por un IQR<0,3. En caso contrario la interpretación de los valores de FibroScan® hay que tomarlos con cautela. Los nuevos modelos de FibroScan® incorporan también la capacidad de medir y cuantificar la esteatosis (mediante el Controlled Attenuation Parameter [CAP]), aspecto que simplifica el diagnóstico de EHGNA en medio hospitalario. Un metaanálisis reciente propone un punto de corte de CAP de 250dB/m2 para identificar pacientes con esteatosis15. La capacidad diagnóstica de la elastografía para detectar fibrosis en pacientes con hígado graso ha sido ampliamente evaluada con la sonda M15. Puntos de corte<8-8,5kPa pueden servir para descartar la presencia de fibrosis avanzada (≥F3). Sin embargo, para confirmar o asumir la presencia de fibrosis avanzada se han propuesto puntos de corte elevados,>18-20kPa21, con alta especificidad y valor predictivo positivo22. Datos recientes sugieren que, en pacientes con valores de CAP>300dB/m2 los puntos de corte de la elastografía podrían ser más altos, pero se requieren más estudios al respecto23.
Por tanto, cabe destacar que la utilización de la elastografía en la EHGNA no permite clasificar con suficiente fiabilidad a un elevado porcentaje de pacientes distribuidos en este amplio rango (8-18 Kpa) o «zona de riesgo de fibrosis» en la que será difícil hacer estimaciones precisas del estadio de fibrosis. El tratamieno del paciente con valores dentro de esta zona de riesgo se debe individualizar (idealmente con la práctica de una biopsia hepática), sin poder asumir ausencia de cirrosis en los valores bajos del rango.
Valoración del paciente con sospecha de enfermedad por hígado graso no alcohólicoSe debe considerar el diagnóstico de EHGNA en cualquier paciente con esteatosis hepática y factores de riesgo de EHGNA (como los pacientes con diabetes u obesidad), tenga o no elevación de transaminasas o GGT, y en ausencia de otras hepatopatías y causas de esteatosis secundaria. El diagnóstico de EHGNA debe acompañarse siempre del estadificación del grado de fibrosis asociado a la enfermedad, ya que la fibrosis es el principal factor pronóstico en EHGNA11,12, independientemente del grado de actividad histológica.
Objetivos- 1.
Evaluación de la presencia de factores de riesgo para EHGNA.
- 2.
Exclusión de causas de esteatosis secundaria u otras hepatopatías.
- 3.
Confirmación de esteatosis (puede estar ausente en pacientes con fibrosis avanzada/cirrosis).
- 4.
Estimación del estadio de fibrosis y del riesgo de progresión acelerada.
1. Historia clínica y exploración física:
- a.
Factores de riesgo de EHGNA (ver epígrafe «Historia natural y factores de riesgo»)
- b.
Causas de esteatosis secundaria (tabla 1).
- c.
Otras hepatopatías (antecedentes personales y familiares).
- d.
Exploración física: presión arterial, peso, talla, perímetro abdominal, cálculo del índice de masa corporal, signos físicos de hepatopatía avanzada.
2. Análisis de sangre:
- a.
Descartar otras hepatopatías (perfil de estudio de elevación de transaminasas): tóxicas, víricas, autoinmunes o metabólicas. Los pacientes con EHGNA pueden tener hiperferritinemia leve-moderada (500-1500mg /l), que es un factor de riesgo de progresión acelerada en EHGNA. En caso de dudas (índice de saturación de transferrina>40-50%), descartar hemocromatosis.
- b.
Valoración metabólica: glucemia plasmática en ayunas, HbA1C, perfil lipídico.
- c.
Valoración serológica de fibrosis: especialmente en poblaciones con baja prevalencia de fibrosis avanzada. Los scores FIB-4 o NFS son los más evaluados (www.rccc.eu/calculadoras/Fib4.html, www.nafldscore.com).
3. Exploraciones complementarias:
- a.
Ecografía: es útil para el estudio de cualquier hepatopatía, pero no es imprescindible para el diagnóstico de esteatosis (especialmente en pacientes con un FLI≥60 o a los que vaya a realizarse un FibroScan®con CAP).
- b.
Elastografía: idealmente, se tiene que realizar en todos los pacientes, o al menos en aquellos en los que los marcadores serológicos no permitan descartar fibrosis avanzada. Puede servir también para diagnosticar la esteatosis (CAP>250dB /m).
- i.
ET<8kPa: descarta fibrosis avanzada (F3-4).
- ii.
ET>18kPa: muy sugestivo de fibrosis avanzada.
- iii.
ET 8-18kPa: zona de riesgo (valorar la realización de una biopsia).
Se puede considerar que un paciente tiene EHGNA en las siguientes circunstancias:
- 1.
Esteatosis objetivada mediante FLI, ecografía o CAP, en ausencia de causas de esteatosis secundaria, independientemente de los niveles de transaminasas y GGT. La presencia de factores de riesgo de EHGNA no es imprescindible pero su ausencia obliga a un estudio más completo de posibles causas de esteatosis secundaria. El diagnóstico de EHGNA debe acompañarse siempre de una estimación del estadio de fibrosis (ya sea por métodos invasivos o, más frecuentemente, no invasivos).
- 2.
Cirrosis criptogénica en presencia de factores de riesgo de HGNA y en ausencia de otras causas de cirrosis.
La biopsia hepática es útil en caso de dudas respecto al diagnóstico o el estadio (grado de fibrosis). Sin embargo, en la mayoría de los casos, el diagnóstico y la evaluación de EHGNA se basa en datos no invasivos.
Evaluación de manifestaciones extrahepáticas en EHGNATal y como se ha descrito anteriormente, la EHGNA se asocia a un gran número de comorbilidades relacionadas con el síndrome metabólico así como a otras enfermedades metabólicas infrecuentes (lipodistrofias genéticas y adquiridas, enfermedades de almacenamiento de glucógeno)24,25. La evaluación inicial de los pacientes con sospecha de EHGNA debe considerar la presencia de estas comorbilidades y se recomienda, como mínimo, una evaluación metabólica que incluya un cribado de diabetes mellitus o de estadios de prediabetes (glucemia basal alterada, en ayunas entre 100-125mg/dl, o HbA1c entre 5.7-6.4%) y un perfil lipídico (triglicéridos, colesterol total, LDL y HDL).
Actualmente, la primera causa de muerte en los pacientes con EHGNA es la enfermedad cardiovascular, seguida del cáncer, por delante incluso de la muerte por causa hepática, especialmente en las fases más iniciales de la enfermedad26,27. La EHGNA se ha identificado como un factor de riesgo independiente de numerosas enfermedades cardiovasculares (cardiopatía isquémica, miocardiopatías, arritmias, ictus)28. Además, se puede objetivar enfermedad renal crónica en el 20-50% de los pacientes con EHGNA24. Por estos motivos, se recomienda realizar en todas las personas con EHGNA una evaluación detallada que recoja los antecedentes y el cribado de los principales factores de riesgo cardiovascular y renal (HTA, dislipemia, tabaquismo, antecedentes personales y familiares, creatinina sérica o filtrado glomerular), considerando la modificación activa de estos factores de riesgo en el ámbito de la Atención Primaria o su derivación a los especialistas correspondientes en casos de tratamiento complejo.
Finalmente, la EHGNA se ha asociado también con una mayor incidencia de neoplasias extrahepáticas29. La segunda causa de muerte entre los pacientes con EHGNA se atribuye a tumores malignos localizados tanto en el tracto gastrointestinal (especialmente colon, pero también esófago, estómago y páncreas) como en localizaciones extraintestinales (riñón en hombres y mama en mujeres). En 2018 no se pueden establecer aún recomendaciones específicas en cuanto a cribado de neoplasias en EHGNA.
La evaluación de las manifestaciones extrahepáticas, especialmente la valoración del riesgo metabólico y cardiovascular, debe hacerse en coordinación con el médico de atención primaria y en según qué casos con los especialistas correspondientes, idealmente dentro de unidades multidisciplinares (ver apartado de recomendaciones del grupo de trabajo).
Tratamiento y seguimiento del paciente con enfermedad por hígado graso no alcohólicoEl tratamiento del paciente con EHGNA se fundamenta en tres pilares: i) medidas orientadas a inducir una pérdida de peso significativa (cambios del estilo de vida tanto alimentarios como de ejercicio, fármacos para el tratamiento de la obesidad y, si es necesario, cirugía bariátrica o metabólica); ii) abordaje farmacológico; y iii) cribado y prevención de complicaciones hepáticas y extrahepáticas. En cuanto al tratamiento farmacológico, hay que destacar que, en 2018, no se dispone de fármacos aprobados para el tratamiento del EHGNA, pero sí hay fármacos disponibles para otras indicaciones que podrían tener un efecto beneficioso sobre la enfermedad hepática. La actividad de investigación en terapias para EHGNA es actualmente muy intensa y hay numerosas moléculas en fases avanzadas de desarrollo. Finalmente, al igual que ocurre con otras etiologías, el trasplante hepático puede plantearse en caso de progresión de la cirrosis o aparición de carcinoma hepatocelular.
El tratamiento de la EHGNA, así como el seguimiento de los pacientes que presentan cirrosis hepática se describe en revisiones y guías clínicas que se han publicado recientemente13,30–32.
Recomendaciones del grupo de trabajoAbordaje integral del paciente con enfermedad por hígado graso no alcohólico en unidades multidisciplinaresLa evaluación, seguimiento y tratamiento de la EHGNA supone un reto para nuestro sistema sanitario debido al aumento exponencial de la incidencia de la enfermedad y a las comorbilidades asociadas33. La EHGNA engloba un abanico de estadios con pronósticos claramente diferentes, hecho que obliga a detectar de manera preferente a aquellos pacientes con fibrosis significativa, que son los que tiene mayor riesgo de progresión y un peor pronóstico34. Es por ello que los pacientes con fibrosis avanzada son los que más se beneficiarán de un seguimiento estrecho en una unidad de hepatología donde se pueda ofrecer un tratamiento dirigido a frenar la enfermedad. Por otro lado, es importante recalcar que la EHGNA avanza de manera silente y progresiva durante años, por lo que con frecuencia los pacientes con EHGNA son añosos cuando se detecta la enfermedad lo que condiciona un aumento de las comorbilidades asociadas35,36. Tal y como se ha expuesto anteriormente, la primera causa de mortalidad en los pacientes con EHGNA son la enfermedad cardiovascular y el cáncer extrahepático, por lo que en la evaluación de los pacientes con EHGNA hay que integrar acciones dirigidas al diagnóstico, prevención y tratamiento de dichas comorbilidades. Otro punto a tener en cuenta es que cuando los pacientes con EHGNA llegan a una fase de cirrosis compensada o descompensada, la evaluación y el tratamiento de estos pacientes pueden ser más complejos por la presencia de comorbilidades (nefropatía orgánica diabética o hipertensiva, cardiopatía, etc.)37. Hoy por hoy no se dispone de tratamientos farmacológicos aprobados para la EHGNA y el tratamiento se dirige fundamentalmente a realizar cambios en el estilo de vida, dieta y ejercicio para perder peso y optimizar el tratamiento de los factores de riesgo de progresión como son los componentes del síndrome metabólico. La pérdida de peso es un objetivo difícil de conseguir y mantener. Los pocos estudios que existen al respecto apuntan a que el seguimiento de pacientes con EHGNA en una unidad multidisciplinar mejora la alteración hepática y los factores de riesgo cardiovascular38,39. Desde esta perspectiva multidimensional, parece razonable pensar que la evaluación integrada de estos pacientes en unidades multidisciplinares de EHGNA es la estrategia idónea y puede ofrecer un mejor tratamiento y seguimiento, a la vez que una mayor tasa de éxito para conseguir los objetivos. Nuestro grupo de trabajo propone los siguientes objetivos y recomendaciones con respecto a las Unidades Multidisciplinares de EHGNA:
Objetivos de la Unidad Multidisciplinar de enfermedad por hígado graso no alcohólico en Atención Primaria- 1.
Diagnosticar la EHGNA y detectar a los pacientes con fibrosis significativa en las poblaciones de riesgo.
- 2.
Ofrecer tratamiento no farmacológico para evitar la progresión de la enfermedad hepática.
- 3.
Diagnosticar la presencia de factores de riesgo de progresión de la enfermedad: obesidad, diabetes mellitus tipo 2, dislipemia y HTA.
- 4.
Tratamiento intensivo y optimizado de los factores de riesgo de progresión de la enfermedad: obesidad, diabetes mellitus tipo 2, dislipemia y HTA.
- 5.
Diagnosticar y ofrecer tratamiento de las comorbilidades asociadas a peor supervivencia en los enfermos con EHGNA:
- 6.
Enfermedad cardiovascular (en todos los pacientes).
- 7.
Cribado de cáncer extrahepático (individualizar).
- 1.
Diagnosticar la EHGNA y detectar a los pacientes con fibrosis significativa.
- 2.
Ofrecer tratamiento no farmacológico y farmacológico para evitar la progresión de la enfermedad hepática.
- 3.
Tratamiento intensivo y optimizado tanto de los factores de riesgo de progresión de la enfermedad como de las comorbilidades asociadas que sean de difícil control o control subóptimo desde atención primaria: obesidad que requiera cirugía bariátrica, diabetes mellitus tipo 2 con mal control glucémico, dislipemia y HTA.
- -
Hepatóloga/o: para realizar diagnóstico y seguimiento de la enfermedad hepática y cribar y detectar comorbilidades asociadas. Ofrecer tratamientos específicos para la enfermedad hepática disponibles.
- -
Médico de Atención Primaria: para detectar la EHGNA en poblaciones de riesgo (obesidad, diabetes mellitus tipo 2), optimizar el tratamiento de las comorbilidades y hacer seguimiento para detectar precozmente la presencia de fibrosis significativa y ofrecer derivación. Otro objetivo del médico de atención primaria es el de detectar los factores de riesgo de progresión de la enfermedad en pacientes ya diagnosticados de EHGNA y optimizar el tratamiento de las comorbilidades.
- -
Médico de Medicina Interna: para detectar la EHGNA en poblaciones de riesgo (obesidad, diabetes mellitus tipo 2), optimizar el tratamiento de las comorbilidades y hacer seguimiento para detectar precozmente la presencia de fibrosis significativa y ofrecer tratamiento específico o derivar a hepatología/digestología.
- -
Endocrinóloga/o: para optimizar el tratamiento de la diabetes, de la dislipemia y de la obesidad de difícil tratamiento.
- -
Enfermera/o de Hepatología: para realizar la elastografía hepática y realizar seguimiento de la enfermedad hepática avanzada con sus recomendaciones específicas.
- -
Enfermera/o Atención Primaria: tratamiento con cambios de estilo de vida (dieta específica y programa de ejercicio), educación de pacientes con diabetes y obesidad. Seguimiento de los enfermos con EHGNA sin fibrosis significativa.
- -
Enfermera/o dietista o nutricionista: para conseguir los cambios de estilo de vida mediante dieta específica y programa de ejercicios en el ámbito hospitalario para pacientes con fibrosis avanzada.
- -
Enfermera/o de Endocrinología: para ofrecer mejor control de las comorbilidades metabólicas (especialmente la diabetes de reciente diagnóstico o aquella de difícil tratamiento) sobre todo en el ámbito hospitalario para pacientes con fibrosis avanzada.
- -
Consultora/o de cirugía general: para ofrecer tratamiento de cirugía bariátrica o metabólica cuando esté indicado.
- -
Consultora/o de cardiología: para ofrecer tratamiento y seguimiento para la enfermedad cardiovascular cuando esté indicado.
En base a todo lo expuesto previamente, el grupo de trabajo propone los siguientes algoritmos para la evolución, diagnóstico y seguimiento de los pacientes con EHGNA tanto en Atención Primaria como en Atención Hospitalaria.
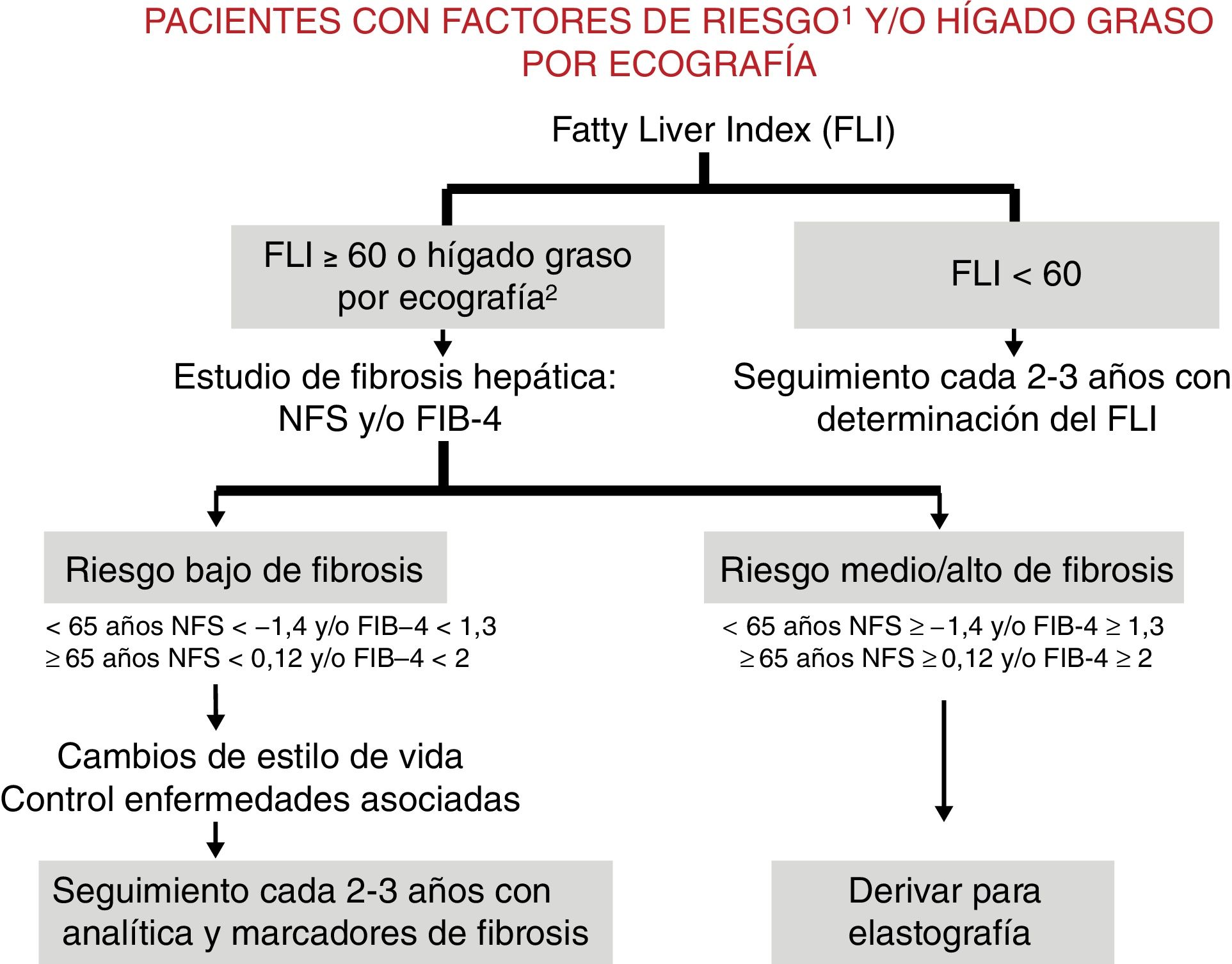
Propuesta de algoritmo de evaluación y seguimiento de enfermos con enfermedad por hígado graso no alcohólico en el ámbito de atención primariaLa propuesta del algoritmo de evaluación y seguimiento en pacientes con EHGNA en el ámbito de Atención Primaria se resume en la figura 1. Tal como se muestra en la figura, el primer paso es determinar si un paciente presenta EHGNA estimando la presencia de esteatosis mediante el uso del FLI y/o la ecografía. Como se propone en el algoritmo, el cribado de esteatosis va dirigido a pacientes con factores de riesgo para EHGNA y puede realizarse simplemente con el FLI. En caso de disponer de una ecografía con esteatosis, ya sería indicación para continuar con el algoritmo y buscar datos de fibrosis.
Algoritmo para la detección y evaluación de EHGNA en atención primaria.
1: factores de riesgo, obesidad, diabetes tipo 2, dislipidemia, hipertensión arterial, síndrome metabólico. 2: pacientes que presentan hígado graso en ecografía hecha por cualquier motivo.
FIB-4: Fibrosis 4 score; FLI: Fatty Liver Index; NFS: NAFLD fibrosis score.
Una vez diagnosticada la esteatosis (EHGNA), la decisión sobre enviar al paciente a la atención especializada en el ámbito hospitalario debe basarse en la estimación no invasiva del grado de fibrosis, que en el momento actual se propone realizar mediante los índices FIB4 o NFS. Como se muestra en el algoritmo la sospecha de fibrosis por índices serológicos es indicación de realización de una elastografía de transición (ET), para lo cual en muchos centros hay que derivar al especialista en hepatología. Aquí es donde el algoritmo de atención primaria se une con el algoritmo de atención hospitalaria. Si el valor de elastogragfía es elevado (ET>8kpa) el paciente debe realizar seguimiento en atención hospitalaria y seguirá el algoritmo que se describe más adelante. En cambio, un valor de elastografía de transición bajo (ET<8Kpa) descarta fibrosis significativa y el paciente puede realizar seguimiento por el médico de atención primaria, siguiendo las recomendaciones que se describen a continuación:
- 1.
Informar al paciente y a sus familiares de la naturaleza de la enfermedad y de su evolución en las distintas fases para implicarles en el cumplimiento de los objetivos preventivos y terapéuticos.
- 2.
Aplicar intervenciones para conseguir la pérdida de peso mediante:
- -
Intervención dietética y recomendaciones individualizadas sobre ejercicio físico.
- -
Si existe una obesidad mórbida u obesidad con diabetes mal controlada: remitir a los especialistas correspondientes (Unidad de Obesidad - Endocrinología, Cirugía Bariátrica y Metabólica) y seguimiento idealmente compartido dentro de una unidad multidisciplinar (primaria y hospitalaria).
- 3.
Realizar valoración del riesgo metabólico y cardiovascular:
- -
Cribado de diabetes mellitus y glucemia basal alterada: glucemia plasmática en ayunas, HbA1c.
- -
Cribado de otros factores de riesgo cardiovascular (HTA, dislipemia, tabaquismo, otros antecedentes personales y familiares).
- -
Si se estima un riesgo moderado o alto de riesgo metabólico, proponer las medidas preventivas indicadas en cada caso y/o derivación a los especialistas correspondientes (idealmente dentro de una unidad multidisciplinar).
- 4.
Valorar la progresión de la enfermedad hepática de forma periódica:
- -
Seguimiento cada 1-2 años (visita y analítica general) en el centro de atención primaria correspondiente.
- -
Repetir cada 3 años un test de estimación de fibrosis (preferentemente serológico –II.1.2) y proceder en función del resultado, remitiendo nuevamente al especialista en hepatología si fuera necesario para realizar nueva evaluación y elastografía de transición. En pacientes con algún factor de riesgo de progresión acelerada (diabetes mellitus, HTA, hiperferritinemia) repetir el test de estimación de fibrosis cada 1-2 años. En caso de cumplir criterios de fibrosis por scores, derivar para realizar una elastografía de transición.
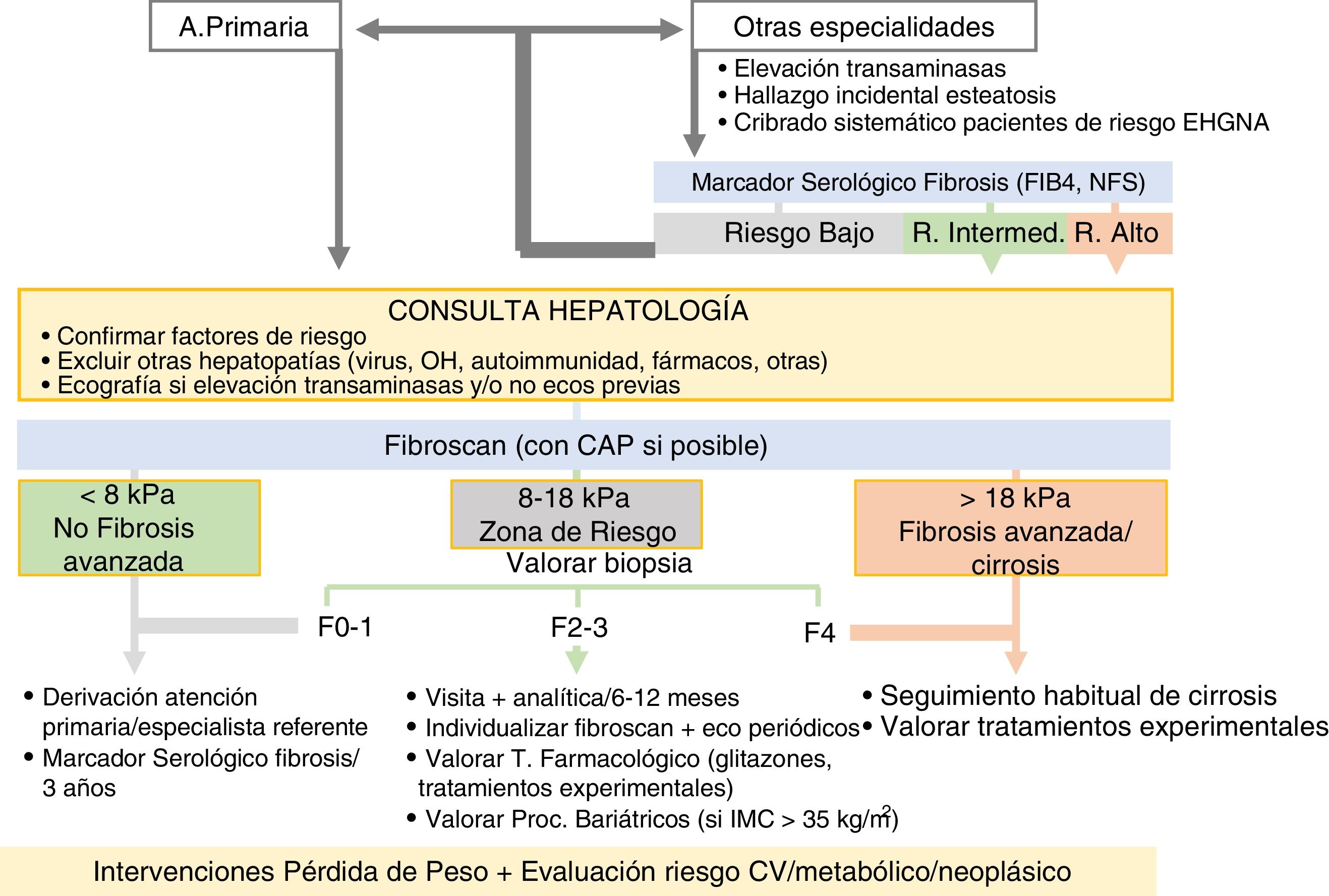
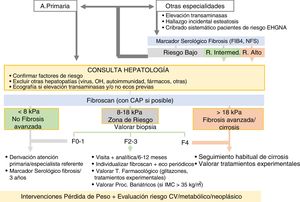
La propuesta de evaluación y seguimiento en pacientes con EHGNA se resume en la figura 2 y se desarrolla a continuación.
Los pacientes llegan a la consulta del especialista por una sospecha EHGNA con fibrosis asociada. El objetivo será confirmar el diagnóstico y evaluar el estadio de la enfermedad para ofrecer tratamiento específico para la enfermedad hepática cuando esté indicado. Se utilizarán los marcadores serológicos con un primer paso y cuando estos den valores de riesgo intermedio o alto de fibrosis se realizará una elastografía hepática. Según el resultado de la elastografía el paciente realizará un seguimiento u otro como se detalla a continuación.
Paralelamente, en todos los pacientes con EHGNA, independientemente del grado de fibrosis, se deben implementar intervenciones encaminadas a conseguir la pérdida de peso y realizar una valoración el riesgo metabólico y cardiovascular tal como se ha expuesto en el apartado anterior del algoritmo en Atención Primaria (IV.1).
Seguimiento y tratamiento según la estimación de fibrosis y riesgo de progresión:
- 1.
Riesgo bajo de fibrosis (marcadores serológicos de bajo riesgo y/o elastografía<8kPa): Se descarta razonablemente la presencia de fibrosis. El riesgo de episodios hepáticos es muy bajo en esta población, por lo que no es imprescindible un seguimiento especializado y se puede realizar en Atención Primaria. El seguimiento y las recomendaciones a realizar en este grupo de pacientes está detallado en el algoritmo de Atención Primaria (sección IV.1).
- 2.
Elastografía hepática entre 8-18kPa («zona de riesgo»): Se recomienda valorar la realización de una biopsia hepática en caso de duda diagnóstica y/o por estadificación de la fibrosis (no asumir ausencia de cirrosis en los rangos bajos del intervalo de valores de la elastografía).
- -
Si<F3 por biopsia: seguimiento anual por especialista: analítica general y elastografía. En los pacientes con F0-F1 estables y sin factores de riesgo de progresión acelerada (diabetes mellitus, HTA, hiperferritinemia) se pueden espaciar los controles y/o hacer seguimiento en Atención Primaria.
- -
Si no se hace biopsia o si se hace biopsia que confirma F3, se tiene que individualizar el tratamiento:
- i.
Visita semestral con analítica, elastografía anual. En pacientes estables y sin factores de riesgo de progresión acelerada (diabetes, HTA, hiperferritinemia) se pueden espaciar los controles de la elastografía.
- ii.
Fibrogastroscopia: no es necesaria en este estadio.
- iii.
Valorar de forma individualizada una ecografía semestral para el cribado de carcinoma hepatocelular (CHC) (no hay recomendaciones establecidas en pacientes con F3).
- -
Si F4 por biopsia, se procederá como en el punto 3.
- 3.
Elastografía hepática>18kPa y/u otros signos de cirrosis (clínicos, radiológicos, endoscópicos):
Cuando el valor de elastografía hepática es superior a 18 Kpa la probabilidad de cirrosis es muy elevada. Plantear biopsia en caso de duda diagnóstica. Proceder como en otras etiologías.
- -
Realizar una elastografía hepática basal como referencia pronóstica y para poder monitorizar intervenciones terapéuticas futuras.
- -
Fibrogastroscopia al diagnóstico según las recomendaciones de las guías clínicas para los pacientes con cirrosis. Si no hay varices, repetir la endoscopia a los 2-3 años (o antes si empeoramiento clínico). No pueden hacerse hoy en día recomendaciones en EHGNA sobre algoritmos no invasivos para descartar la necesidad de cribado endoscópico, aunque datos preliminares sugieren que, en pacientes con elastografía hepática<25kPa y plaquetas>110 x10E9/mm3, el riesgo de varices es muy bajo. Si hay varices, se procede como en cualquier otra etiología.
- -
Ecografía semestral para el cribado de CHC.
Financiado en parte a través del proyecto EIT Health 2018, número de proyecto EIT 18258.
Conflicto de interesesEl Dr. SA informa ser miembro de comités asesores de Gilead, Pfizer e IQVIA. Ha sido consultor no pagado de Genfit, Boehringer Ingelheim, OWL, Inventiva y Covance. Ha recibido honorarios por ponencias médicas y actividades educacionales de Gilead, MSD y Novartis y gastos de viaje de Gilead, MSD, Janssen, Genfit, Bayer y Ferring. Ha tenido acciones de Gilead, Genfit, Tobira, Intercept y Conatus. Ha recibido una beca competitiva internacional de investigación de Gilead y una beca competitiva nacional para el desarrollo de actividades educacionales de la misma compañía. La Dra. IG ha recibido honorarios por ponencias médicas y actividades educacionales de Gilead y Novartis. El Dr. PG ha recibido subvenciones y becas de Grifols, subvenciones y becas Gilead, beca de Mallinckrodt, subvenciones de Promethera, subvenciones de Martin Pharmaceuticals, beca de Ferring Pharmaceuticals, subvenciones y beca de Sequana.