Las tiopurinas (azatioprina y mercaptopurina) se usan frecuentemente en pacientes con enfermedad inflamatoria intestinal. En este documento, revisaremos sus principales indicaciones, así como aspectos prácticos de seguridad, eficacia y modo de empleo. Sus usos principales son el mantenimiento de la remisión en la enfermedad corticodependiente o tras el control de un brote grave de colitis ulcerosa con ciclosporina, la prevención de la recurrencia posquirúrgica en enfermedad de Crohn y el empleo en terapia combinada junto con biológicos. El 30-40% de pacientes no responderá al tratamiento y un 10-20% no tolerará el tratamiento por efectos adversos. Antes de iniciarlas, se recomienda evaluar el estado de inmunización frente a ciertas infecciones; la determinación previa de la actividad de la tiopurina·metiltransferasa (TPMT) no es imprescindible, pero permite mayor seguridad inicial. La dosis adecuada es de 2,5mg/kg/día para azatioprina y de 1,5mg/kg/día para mercaptopurina. Algunos efectos adversos son idiosincrásicos (intolerancia digestiva, pancreatitis, fiebre, artromialgias, exantema y algunos casos de hepatotoxicidad). Otros son dosis-dependientes (mielotoxicidad y otros tipos de hepatotoxicidad) y su vigilancia debe mantenerse mientras dure el tratamiento. Si son ineficaces o aparecen efectos adversos, puede recurrirse al cambio de tiopurina, la reducción de dosis, combinar dosis bajas de azatioprina con alopurinol y determinar metabolitos antes de descartar su uso. Los tumores de piel distintos al melanoma, los linfomas y los tumores del tracto urinario se han relacionado con su administración. Las tiopurinas son fármacos seguros en la concepción, gestación y lactancia.
Thiopurines (azathioprine and mercaptopurine) are widely used in patients with inflammatory bowel disease. In this paper, we review the main indications for their use, as well as practical aspects on efficacy, safety and method of administration. They are mainly used to maintain remission in steroid-dependent disease or with ciclosporin to control a severe ulcerative colitis flare-up, as well as to prevent postoperative Crohn's disease recurrence, and also in combination therapy with biologics. About 30-40% of patients will not respond to treatment and 10-20% will not tolerate it due to adverse effects. Before they are prescribed, immunisation status against certain infections should be checked. Determination of thiopurine methyltransferase activity (TPMT) is not mandatory but it increases initial safety. The appropriate dose is 2.5mg/kg/day for azathioprine and 1.5mg/kg/day for mercaptopurine. Some adverse effects are idiosyncratic (digestive intolerance, pancreatitis, fever, arthromyalgia, rash and some forms of hepatotoxicity). Others are dose-dependent (myelotoxicity and other types of hepatotoxicity), and their surveillance should never be interrupted during treatment. If therapy fails or adverse effects develop, management can include switching from one thiopurine to the other, reducing the dose, combining low doses of azathioprine with allopurinol and assessing metabolites, before their use is ruled out. Non-melanoma skin cancer, lymphomas and urinary tract tumours have been linked to thiopurine therapy. Thiopurine use is safe during conception, pregnancy and breastfeeding.
En el tratamiento de la enfermedad inflamatoria intestinal (EII) hay realmente unos pocos hitos que hayan marcado un antes y un después. Obviamente el primero fue la cirugía, pues la resección del intestino enfermo era la única opción en los casos graves, tanto de enfermedad de Crohn (EC) como de colitis ulcerosa (CU). La primera aproximación de tratamiento médico eficaz correspondió a los corticosteroides. Tras ellos, la sulfasalazina en la CU fue el primer paso para el mantenimiento de los casos leves, seguida poco después por el uso de tiopurinas en el manejo de la dependencia a esteroides. Estas aportaciones antiguas al arsenal terapéutico se hicieron en fechas previas a la regulación internacional de la investigación clínica. La evidencia de la que disponemos acerca de fármacos como los corticosteroides, la sulfasalazina y las tiopurinas procede de estudios con ciertas limitaciones en su planteamiento. En la actualidad, los diseños y la rigurosidad estadística de los estudios es mucho mayor.
Las tiopurinas (azatioprina y mercaptopurina) son fármacos que se utilizan en el tratamiento de pacientes con EII. Sabemos que su perfil de seguridad no es idóneo, pero también que son capaces de obtener una remisión duradera y además con un bajo coste económico.
En este documento revisaremos cuáles son las bases sobre las que empleamos las tiopurinas en el manejo de la EII, cuáles son su eficacia y su seguridad, e intentaremos definir si se mantiene vigente su indicación en el tratamiento de estas enfermedades.
Eficacia de las tiopurinas¿Cuál es la eficacia en la enfermedad de Crohn luminal/perianal?La monoterapia con tiopurinas no tiene papel alguno para inducir la remisión en la EC luminal. Aunque en los ensayos clínicos iniciales, hace ya más de 2 décadas, se había reconocido cierta eficacia de estos fármacos para esta indicación, los metaanálisis más actualizados ya no la avalan1,2. El más reciente (5 estudios, 380 pacientes) no encuentra diferencias entre tiopurinas (48%) y placebo (37%) al valorar la consecución de la remisión clínica. Solamente hay un estudio controlado frente a infliximab (SONIC), y en él resultan inferiores a este para inducir la remisión (32% vs. 48%)3. Por todo ello, el uso de tiopurinas como único fármaco para conseguir la remisión no está recomendado.
El mantenimiento de la remisión en pacientes con EC luminal corticodependiente es su principal indicación en monoterapia2,4,5. En la revisión sistemática más reciente, que incluye 6 estudios (n=489), el 73% de los pacientes tratados con azatioprina se mantuvieron en remisión frente al 62% de los que fueron tratados con placebo5. Estas cifras subestiman los resultados de eficacia del fármaco, pues el metaanálisis incluye estudios con dosis que se consideran infraterapéuticas (1mg/kg/día de azatioprina). El escenario clínico habitual en el que se plantea el mantenimiento de la remisión con tiopurinas en pacientes con EII es el de la enfermedad corticodependiente y en general se considera que la dosis eficaz de azatioprina es de 2,5mg/kg/día6.
Por último, las tiopurinas tienen cierta eficacia en la enfermedad perianal7, aunque no son los fármacos indicados para usarlos en monoterapia en sus formas complejas. Aunque existe escasa evidencia, los 2 estudios más recientes coinciden en que el uso precoz de tiopurinas reduce la necesidad de cirugía relacionada con la enfermedad perianal8,9.
¿Cuál es la eficacia en la colitis ulcerosa?Las tiopurinas se usan ampliamente en pacientes con CU y en diversos escenarios. Son pocos los ensayos controlados de calidad que avalan su indicación en el mantenimiento de la remisión. El metaanálisis de Gisbert et al. describe en este escenario clínico un 60% de eficacia de azatioprina en ensayos controlados (NNT 5) y un 76% en estudios no controlados10. El metaanálisis más recientemente publicado incluye 4 estudios (n=232), aunque con baja calidad de la evidencia, y concluye que los pacientes tratados con azatioprina presentan una menor tasa de recidivas en comparación con el placebo (44% vs. 65%, respectivamente)11. Es necesario mencionar el ensayo controlado y aleatorizado de Ardizzone et al., que comparaba azatioprina y mesalazina en el tratamiento de CU dependiente de esteroides, demostrando que la azatioprina es significativamente más efectiva (53% vs. 21%; OR: 4,78; IC 95%: 1,57-14,5) para inducir la remisión clínica y endoscópica y evitar los requerimientos de esteroides en este grupo de pacientes12.
Otro escenario en el que se utilizan las tiopurinas es el de los pacientes con brote grave de CU corticorrefractario controlado con ciclosporina. Disponemos de estudios observacionales en los que se analiza la eficacia de azatioprina/mercaptopurina como terapia de mantenimiento en esta situación, y de ellos se concluye que es una terapia útil para mantener la remisión13-19. No obstante, el porcentaje de colectomías descrito en dichos estudios es significativo (entre un tercio y dos tercios de los casos), por lo que parece preciso realizar una vigilancia estrecha en estos pacientes para detectar de forma precoz aquellos que precisen una subida de escalón terapéutico a fármaco biológico. La introducción de la tiopurina puede realizarse simultáneamente con el paso de ciclosporina intravenosa a oral. La Guía de GETECCU en CU recomienda administrar tratamiento de mantenimiento con azatioprina/mercaptopurina (asociada o no a ciclosporina oral los primeros 3 meses), tras la inducción de la remisión con ciclosporina en el paciente con brote grave de CU resistente a corticoides20.
Los ensayos clínicos aleatorizados no han demostrado diferencias entre infliximab y ciclosporina en CU refractaria a esteroides, por lo que la elección de uno u otro dependerá de factores clínicos como la intolerancia o el fracaso previo a azatioprina u otros aspectos como la experiencia del centro y el coste económico21,22. En aquellos pacientes que ya estaban en tratamiento con tiopurinas cuando presentaron el brote grave, el mantenimiento posterior con azatioprina en monoterapia tras la remisión es muy poco eficaz23, por lo que en este tipo de pacientes es más adecuado el uso directo de infliximab en lugar de ciclosporina como tratamiento de la situación de corticorrefractariedad, para posteriormente realizar un tratamiento de mantenimiento combinado con infliximab y tiopurina.
En un estudio español realizado sobre la base de pacientes ENEIDA, que analiza el riesgo de colectomía en pacientes con CU bajo tratamiento con tiopurina por cualquier indicación, casi una décima parte de los pacientes requirió colectomía, y uno de los factores que se asoció con un mayor riesgo fue la necesidad de terapia con ciclosporina o anti-TNF, así como la necesidad temprana de tratamiento azatioprina/mercaptopurina24. En otro análisis de esta base de pacientes, la tasa de colectomía acumulada fue mayor con ciclosporina que con infliximab, aunque en los pacientes tratados después de 2005 no hubo diferencias en las tasas de colectomía temprana y tardía entre ambos grupos25.
¿Cuál es la eficacia en la prevención de la recurrencia posquirúrgica en la enfermedad de Crohn?La resección quirúrgica es un arma eficaz en el tratamiento de la EC. Desafortunadamente, no es un procedimiento curativo y la reaparición de lesiones en el neoíleon es la norma. En la actualidad, se acepta que la resección ha de formar parte de un plan de trabajo más completo, y que el tratamiento profiláctico posquirúrgico ha de considerarse en todos los casos. A este respecto, se han publicado recientemente las recomendaciones de GETECCU en este escenario terapéutico26, a las cuales remitimos al lector para un análisis más completo.
Las tiopurinas fueron uno de los primeros fármacos evaluados en ensayos clínicos, debido a su accesibilidad y facilidad de empleo. Sin embargo, las diferencias en el diseño de los estudios publicados dificultan el análisis global y la obtención de recomendaciones claras y sólidas. La evaluación de los resultados mediante metaanálisis27 apoya la eficacia de las tiopurinas en la prevención de la recurrencia posquirúrgica, tanto endoscópica como clínica. Se admite que las tiopurinas deben usarse a dosis de 2-2,5mg/kg/día de azatioprina, y que la adición de metronidazol en los primeros 3 meses poscirugía permite optimizar los resultados28,29. Bajo estas condiciones, la tasa de recurrencia posquirúrgica endoscópica al año de la resección se sitúa en torno al 40%28-30. Solamente disponemos de un ensayo clínico controlado que haya comparado un agente anti-TNF frente a las tiopurinas en este contexto. López-Sanromán et al., en un estudio promovido por GETECCU, no observaron diferencias en la tasa de recurrencia endoscópica a las 54 semanas entre adalimumab (inducción con 160mg, 80mg y mantenimiento con 40mg cada 2 semanas) y azatioprina (2-2,5mg/kg/día), asociados ambos a un curso de metronidazol los primeros 3 meses tras la cirugía (42% vs. 59% según análisis por intención de tratar, p=0,12)30. No obstante, esta ausencia de diferencias significativas debe tomarse con cautela debido a la limitación del tamaño muestral.
Finalmente, el empleo de azatioprina en pacientes que desarrollen lesiones endoscópicas de recurrencia es capaz de hacerlas mejorar o incluso desaparecer31, si bien disponemos solamente de evidencia en pacientes que desarrollaron dichas lesiones sin estar recibiendo tratamiento activo alguno.
Momento de inicio, dosis y duración del tratamiento con tiopurinasLas tiopurinas han mostrado poseer eficacia en la EII; sin embargo, existe un 30-40% de pacientes no respondedores, incluyendo un 10-20% de casos que no las van a tolerar32, aunque no se conocen factores predictores de respuesta a estos fármacos. Además, la remisión clínica libre de esteroides se alcanza en un 30-50% de los pacientes y la curación mucosa en un tercio de ellos. Por tanto, son fármacos que no deben emplearse en todos los pacientes. No están probablemente indicados en pacientes con un curso evolutivo leve, pero sí en pacientes corticodependientes con un curso intermedio33, en quienes logran mantener la remisión, como ya hemos comentado. También están indicados en aquellos pacientes que presentan un curso grave, asociados a los fármacos biológicos33.
En la EC existe controversia acerca de si las tiopurinas se deben emplear de manera precoz, es decir, en los primeros meses después del diagnóstico. Como ya hemos comentado, sabemos que no son fármacos inductores de la remisión en monoterapia. Se ha sugerido que la introducción precoz de tiopurinas podría cambiar el curso evolutivo de la EC por los datos obtenidos en un estudio controlado con placebo en población pediátrica34. Con un planteamiento similar se llevó a cabo el estudio español AZTEC en población adulta, con el fin de evaluar la eficacia de la azatioprina en una población no seleccionada de pacientes adultos de diagnóstico reciente con EC. Los autores concluyeron que el tratamiento precoz con azatioprina no era superior al placebo en pacientes adultos con EC no complicada de reciente diagnóstico35. El estudio RAPID tampoco demostró que el tratamiento precoz con azatioprina fuera superior al manejo convencional en un grupo de pacientes con EC de reciente diagnóstico con alto riesgo de desarrollar enfermedad incapacitante, salvo en el riesgo de desarrollar enfermedad perianal compleja8. Por todo ello, el manejo convencional con rápida introducción de los inmunomoduladores cuando la enfermedad presenta criterios de corticodependencia parece resultar lo más adecuado8,35.
Tanto la dosis como la duración del tratamiento son determinantes del éxito del mismo. La dosis recomendada es de 2,5mg/kg de azatioprina o 1,5mg/kg de mercaptopurina7.
En la CU, el papel de la mesalazina en el mantenimiento es uno de los factores determinantes de la menor necesidad de terapia con inmunosupresores en esta enfermedad en comparación con la EC. La prescripción concomitante de tiopurinas y 5-aminosalicilatos (5-ASA) no es infrecuente en la CU corticodependiente, en un intento de optimizar la eficacia del tratamiento36. Cuando el curso de la enfermedad requiere la administración de tiopurinas, pueden surgir dudas acerca de la eficacia y necesidad de esta coprescripción. El papel protector potencial del 5-ASA contra el cáncer colorrectal puede resultar un argumento a favor de esta actitud37; no obstante, también las tiopurinas poseen un papel protector de la aparición de displasia en colon38, por lo que añadir 5-ASA con ese único fin no parece un argumento de peso. En el mismo sentido, se ha mencionado la posible sinergia entre los 2 fármacos, debida a la inhibición de la actividad enzimática de la tiopurina·metiltransferasa (TPMT) por el 5-ASA39 y al aumento de los niveles de los nucleótidos de la 6-tioguanina (6-TGN)40. Sin embargo, los estudios in vivo han sido incapaces de demostrar cambios significativos en los niveles de TPMT asociados al tratamiento con 5-ASA41. Por el contrario, otros autores han demostrado que la adición de 5-ASA no aumenta la eficacia de azatioprina/mercaptopurina en la CU corticodependiente y por el contrario sí puede aumentar el riesgo de mielotoxicidad42. Una revisión sistemática de la eficacia de la coprescripción de tiopurina y 5-ASA en CU concluyó que la evidencia existente obtenida de ensayos clínicos es insuficiente para demostrar si el tratamiento con 5-ASA y azatioprina simultáneos mejora los resultados de azatioprina en monoterapia43. Además, el aumento en el número de fármacos administrados como terapia de mantenimiento a largo plazo puede empeorar el cumplimiento terapéutico, y una buena adhesión es un factor clave para el éxito del tratamiento44. Con los datos disponibles, podemos afirmar que la estrategia de coprescripción no parece que sea superior a la monoterapia con azatioprina/mercaptopurina45.
Finalmente, no se conoce cuál debe ser la duración óptima del tratamiento. En el estudio del grupo francés GETAID sobre la retirada de azatioprina en EC tras un periodo prolongado de tratamiento, de los pacientes que continuaron con el tratamiento, el 80% mantuvieron remisión durante más de 5 años, en comparación con el 40% de los pacientes que lo interrumpieron46. Este aspecto se analizó también en un ensayo clínico prospectivo frente a placebo en un grupo de pacientes con EC en remisión clínica tras 3,5 años bajo tratamiento con azatioprina. La recidiva clínica a los 18 meses en pacientes que mantuvieron tratamiento con azatioprina fue del 8±4%, mientras que en el grupo placebo fue del 21±6%47. En CU, un estudio retrospectivo italiano demostró que la suspensión de azatioprina se asocia a un elevado riesgo de recaída de la enfermedad (un tercio a los 12 meses, la mitad a los 2 años y dos tercios a los 5 años)48. Por tanto, cuando consideremos la posible retirada de un tratamiento con tiopurinas, debemos tener en cuenta el alto riesgo de recidiva de los pacientes con EII, el bajo riesgo absoluto individual de desarrollar un linfoma y que la presencia de signos de inflamación persistente aumenta más la probabilidad de recidiva46,48. De forma general, no es aconsejable la retirada del tratamiento con tiopurinas; no obstante, en los casos en que la decisión final sea retirar el fármaco, si se produce una recidiva, debemos recomendar su reinicio precoz y mantenerlo ya de manera indefinida.
Curación mucosa con tiopurinasLas tiopurinas son fármacos eficaces para mantener la remisión clínica, como se ha descrito previamente, y también inducen la remisión endoscópica en un porcentaje de pacientes. Sin embargo, con los datos disponibles del estudio SONIC en EC, el tratamiento combinado con infliximab y azatioprina parece ser más eficaz a corto-medio plazo que cualquiera de estos fármacos en monoterapia. En este ensayo clínico se incluyeron 508 pacientes no expuestos previamente a estos fármacos y en la semana 26, el 56,8% de los pacientes con tratamiento combinado se encontraban en remisión clínica libre de esteroides, frente al 44,4% del grupo infliximab y al 30% del grupo azatioprina. La tasa de curación mucosa a las 26 semanas resultó también superior en el grupo de tratamiento combinado (44%) frente a los grupos infliximab y azatioprina en monoterapia (30% y 16,5%, respectivamente). Existen razones metodológicas por las que estas diferencias podrían haber sido menores si el diseño del estudio hubiese sido otro. Las tiopurinas, como ya se ha descrito, no son inductoras de la remisión y, aunque el uso de esteroides al inicio del estudio estaba permitido, más del 75% de los pacientes con azatioprina no los llevaban. Este mismo hecho también podría haber influido en la tasa de curación mucosa de la monoterapia con azatioprina3. Por otra parte, cuando se seleccionó a los pacientes de la rama azatioprina del estudio SONIC, incluyendo tan solo a los que presentaron un incremento del volumen corpuscular medio de 7fl o más (como marcador de dosis adecuada de azatioprina), la eficacia de la monoterapia con tiopurinas para conseguir la remisión mucosa fue similar a la de la monoterapia con infliximab49. No obstante, globalmente la tasa de cicatrización mucosa en EII clínicamente activa es superior con fármacos biológicos que con azatioprina en monoterapia.
El estudio SUCCESS comparó las mismas 3 pautas que el estudio SONIC, pero en pacientes con CU (n=236). La curación mucosa fue superior en los grupos con terapia combinada o en monoterapia con infliximab, con respecto al grupo de azatioprina en monoterapia, 63% vs. 55% vs. 37%50. Aunque estas tasas son algo mejores que las obtenidas para los pacientes con EC, la valoración de los objetivos tan precoz a las 16 semanas podría estar influyendo de manera negativa en la tasa final de remisión y curación mucosa del grupo de azatioprina en monoterapia.
Con los datos que disponemos podemos afirmar que las tiopurinas logran la curación mucosa en un porcentaje de pacientes, aunque su eficacia es inferior a la de los fármacos biológicos en este objetivo cuando se utiliza en EII clínicamente activa y en monoterapia.
En la tabla 1 se resumen los puntos más relevantes en relación con la eficacia del tratamiento con fármacos tiopurínicos en la EII.
Puntos más relevantes sobre la eficacia del tratamiento con fármacos tiopurínicos en la enfermedad inflamatoria intestinal
| • Las tiopurinas son fármacos eficaces para mantener la remisión clínica y también logran la remisión endoscópica en un porcentaje de pacientes |
| • El mantenimiento de la remisión de la CU o EC es la principal indicación del tratamiento con tiopurinas en monoterapia, principalmente en pacientes con enfermedad corticodependiente |
| • En pacientes con brote grave de CU resistente a corticoides, las tiopurinas son útiles como terapia de mantenimiento tras obtener la remisión con ciclosporina, solamente cuando no recibían tratamiento de mantenimiento previo con tiopurinas |
| • Las tiopurinas son fármacos eficaces en la prevención de la recurrencia posquirúrgica en la EC |
| • Aunque tienen cierta eficacia en la enfermedad perianal, no son los fármacos de elección en las fístulas complejas |
| • La estrategia de coprescripción de tiopurinas y 5-ASA en CU corticodependiente no parece que sea superior a la monoterapia con tiopurinas |
| • No es aconsejable, de forma general, la retirada del tratamiento con tiopurinas en los pacientes con buen control de la enfermedad inflamatoria intestinal con estos fármacos debido al alto riesgo de recidiva de su enfermedad |
5-ASA: 5-aminosalicilatos; CU: colitis ulcerosa; EC: enfermedad de Crohn.
En los pacientes con EII, dada la elevada probabilidad de requerir tratamientos inmunosupresores durante su evolución y el incremento en el riesgo de infecciones oportunistas que esto conlleva, se recomienda revisar el cumplimiento del calendario vacunal siempre que sea posible y, en todo caso, evaluar el estatus de inmunización frente a determinadas infecciones51-53. Esta evaluación debería realizarse en el momento del diagnóstico o, en todo caso, antes de iniciar cualquier tratamiento inmunosupresor, con la finalidad de permitir la administración de vacunas con gérmenes vivos (contraindicadas si el tratamiento se ha iniciado) si es necesario y conseguir una mejor inmunización, ya que se ha comunicado una reducción en la tasa de respuesta frente a vacunas en pacientes bajo tratamiento inmunomodulador52,53. Entre los múltiples gérmenes que pueden motivar infecciones oportunistas (infrecuentes y/o menos graves en sujetos inmunocompetentes), debería evaluarse el estatus de inmunización de las siguientes:
Virus de la hepatitis B (VHB) y de la hepatitis C (VHC). La prevalencia de infección por VHB y VHC en pacientes con EII en nuestro medio es similar a la descrita en la población general54. Se ha demostrado que en los pacientes con EII infectados por el VHB que siguen tratamiento inmunomodulador, la probabilidad y gravedad de disfunción hepática es superior que en aquellos infectados por el VHC. Además, recibir 2 o más inmunosupresores es un factor predictivo independiente de reactivación del VHB en estos pacientes54. Por todo ello, antes de iniciar el tratamiento con tiopurinas se recomienda determinar la serología del VHB. En caso de que el paciente no tenga títulos de anticuerpos anti-HBs, se recomienda proceder a la vacunación. Dado que la eficacia de la vacunación del VHB en pacientes con EII es menor que en la población general, se recomienda la utilización de pautas intensificadas de vacunación53-56. En caso de pacientes HBsAg+, debe iniciarse tratamiento antiviral 2 semanas antes de iniciar las tiopurinas independientemente del nivel de viremia, manteniéndose mientras el paciente siga bajo dicho tratamiento y hasta 6 meses tras la suspensión del inmunomodulador si se diera la circunstancia51,53. Respecto a la detección de la infección por el VHC, no existe consenso sobre la necesidad de su evaluación previa al inicio del tratamiento con tiopurinas, ya que no existe vacuna para el mismo. La positividad de marcadores (anti-VHC y RNA-VHC) no supone una contraindicación para el tratamiento con tiopurinas. Sin embargo, ante la posibilidad de aparición de hepatotoxicidad y de hiperplasia nodular regenerativa inducidas por tiopurinas parece razonable su determinación basal.
Virus varicela-zóster (VVZ). Tanto la primoinfección como la reactivación por el VVZ se han descrito con mayor frecuencia y gravedad en pacientes tratados con tiopurinas57. Un estudio israelí demostró que la anamnesis tiene un valor predictivo positivo del 93% y negativo del 0% para conocer el antecedente de varicela58. Con estas premisas parece razonable la realización de la serología de VVZ, procediéndose a la vacunación (un mínimo de 3 semanas antes de iniciar el tratamiento inmunomodulador, ya que se trata de una vacuna con virus vivos atenuados) en caso de resultar negativa51,53,57. Se encuentra en las últimas fases de ensayo clínico una vacuna inactivada para el herpes zóster, que probablemente sea útil en estos pacientes59.
Virus Epstein-Barr (VEB). Dos estudios realizados en Canadá y Portugal han demostrado tasas de seropositividad frente al VEB superiores al 95% en pacientes con EII mayores de 25 años58,60. En población pediátrica afecta de EII, se han comunicado tasas de seropositividad para VEB del 30-40% en edades inferiores a los 10 años, del 43-55% en el segmento de edad de 10 a 15 años, y del 81% en mayores de 15 años61. La primoinfección por VEB en individuos bajo tratamiento inmunosupresor (y, particularmente, con tiopurinas y anti-TNF) puede conllevar un mayor riesgo de síndrome de activación hemofagocítica (cuya mortalidad se estima en un 30%) y de síndromes linfoproliferativos postinfección62. Con estas premisas, parece razonable determinar la serología del VEB, sobre todo en pacientes en edad pediátrica, inmediatamente antes de iniciar tiopurinas y considerar otras opciones terapéuticas si esta es negativa. Sin embargo, es un error pensar que este síndrome hemofagocítico solo se presenta en pacientes sin exposición previa al VEB y por infección con el mismo. En efecto, se ha descrito su desarrollo en caso de infección por citomegalovirus y en pacientes inmunodeprimidos sin infección viral intercurrente.
Por último, es importante recordar que en caso de requerir administración de vacunas con gérmenes vivos o atenuados una vez bajo tratamiento con tiopurinas, estas deben suspenderse al menos 3 meses antes de la vacunación y reiniciarse como pronto 3 semanas después51-53.
Estudio de la capacidad de metabolizar las tiopurinas: determinación de tiopurina metiltransferasa (TMPT)La farmacocinética de las tiopurinas presenta una amplia variabilidad interindividual que se debe en gran parte a la existencia de diversos polimorfismos genéticos de la enzima TPMT63. Esta es la principal responsable de la formación de nucleótidos de 6-tioguanina (6-TGN), metabolitos responsables de la mielotoxicidad de las tiopurinas pero también de su efecto inmunomodulador64. En la población caucásica la actividad de esta enzima (determinada genéticamente) sigue una distribución trimodal; el 89% es homocigota para alelos de alta actividad, el 11% heterocigota y tan solo el 0,3% es homocigota para alelos de baja actividad65,66. Este último grupo presenta una elevada probabilidad de presentar mielotoxicidad grave (aplasia medular) y de forma precoz, por lo que debe evitarse el tratamiento con tiopurinas en estos sujetos. Así, en los pacientes con actividad baja de la TPMT se observan elevadas concentraciones de 6-TGN, mientras que en aquellos con actividad alta las concentraciones de los 6-TGN son bajas64. Para determinar la actividad de TMPT disponemos de 2 procedimientos: la medición cuantitativa o fenotípica y la determinación del genotipo. El estudio fenotípico mide la actividad de TPMT en los eritrocitos67, quedando contraindicado el tratamiento con tiopurinas en el caso de actividad TPMT eritrocitaria <5U/RBC68. No existen estudios que demuestren ventaja alguna (ni en eficacia ni en seguridad) de dosificar el fármaco según la actividad TPMT eritrocitaria69. El grado de actividad eritrocitaria de TPMT parece guardar relación directa únicamente con el intervalo de tiempo entre el inicio del tratamiento y la aparición de mielotoxicidad; este sería corto (de aproximadamente 1,5 meses) en los pacientes homocigotos para el alelo de baja actividad, mientras que sería algo más prolongado en los heterocigotos y más aún en los homocigotos para el alelo de alta actividad.
Por tanto, la utilidad de determinar la actividad de la TPMT radica en prevenir la aplasia medular precoz en el 0,3% de individuos que presenten actividad deficitaria. Sin embargo, debe recordarse que una actividad intermedia o alta no excluye en modo alguno la posibilidad de mielotoxicidad. En este sentido, la determinación de la actividad TPMT no es imprescindible para iniciar tratamiento con tiopurinas. No obstante, en caso de que se disponga de esta posibilidad, esta permitirá una mayor seguridad inicial del tratamiento. Distintos estudios han demostrado una elevada concordancia entre la determinación genotípica y la fenotípica70-72, pero no existe consenso sobre cuál es preferible. Debe recordarse, sin embargo, que la determinación fenotípica de la actividad de TMPT se puede ver limitada si el paciente ha recibido transfusiones sanguíneas en los últimos 2-3 meses (al presentar una actividad TPMT en parte debida a la sangre del donante) y que la determinación del genotipo cuenta con un elevado número de polimorfismos que pueden encarecer el coste de la determinación.
¿Cómo iniciar el tratamiento? ¿Dosis completa o progresiva? ¿Dosis única o fraccionada?Dado que el peso molecular de azatioprina es el 55% del de la mercaptopurina y que el 88% de la azatioprina se metaboliza a mercaptopurina, la dosis de tiopurinas a administrar dependerá de si optamos por una u otra. La dosis adecuada en el tratamiento de la EII es de 2,5mg/kg/día para azatioprina y de 1,5mg/kg/día para mercaptopurina, basada en los resultados de un metaanálisis7 que demostró que la eficacia en el mantenimiento de la remisión dependía de la dosis (OR de la eficacia de la azatioprina frente al placebo fue de 4,13 con 2,5mg/kg/día y de tan solo 1,2 con 1mg/kg/día). Clásicamente se recomendaba iniciar el tratamiento con dosis progresivas partiendo de 50mg/día, con incremento semanal de la dosis previo control hematológico73. La ventaja teórica de esta estrategia de tratamiento sería el identificar de forma precoz los efectos adversos; sin embargo, para aquellos efectos adversos idiosincráticos o independientes de la dosis (los más comunes en los primeros meses de tratamiento), esta estrategia no tendría sentido alguno. Por otra parte, los efectos adversos dosis-dependientes suelen aparecer con dosis superiores a 50mg/día, por lo que la dosificación progresiva no parece aportar ventajas sino tan solo una demora en alcanzar las dosis terapéuticas74. Asimismo, algunos autores recomiendan utilizar dosis inferiores en pacientes con actividad intermedia de TPMT, con una reducción de la dosis de azatioprina a 1-1,5mg/kg/día o mercaptopurina a 0,5-0,75mg/kg/día75,76. No obstante, la realización de controles analíticos habituales permite que en este grupo de enfermos se puedan administrar dosis completas desde el inicio del tratamiento y reducir la dosis de azatioprina o mercaptopurina en caso de aparición de efectos adversos dosis-dependientes.
Otro aspecto debatido es si administrar el fármaco en dosis única diaria o de forma fragmentada. La dosis fragmentada se ha descrito como un factor limitante de la adhesión a los tratamientos, particularmente en caso de medicación crónica, como sucede en la terapia con tiopurinas, lo que apoya su administración en toma única de la dosis completa desde el inicio del tratamiento. Únicamente en pacientes en quienes aparecen determinados efectos secundarios puede plantearse fraccionar la dosis. A este respecto se ha comunicado la posible utilidad de la dosis fragmentada en pacientes con intolerancia digestiva, elevación de transaminasas o leucopenia como efecto adverso de las tiopurinas77.
En la tabla 2 se resumen los puntos más relevantes en relación con la evaluación previa e inicio del tratamiento con tiopurinas.
Puntos más relevantes sobre la evaluación previa e inicio del tratamiento con tiopurinas
| • Antes de iniciar el tratamiento con tiopurinas se recomienda revisar el cumplimiento del calendario vacunal y determinar la serología del VHB y varicela-zóster. En caso de que el paciente no tenga anticuerpos contra alguna de ellas, se recomienda proceder a la vacunación |
| • En caso de pacientes HBsAg+, debe iniciarse tratamiento antiviral 2 semanas antes de iniciar las tiopurinas, manteniéndose mientras el paciente siga bajo dicho tratamiento y hasta 6 meses tras una eventual suspensión del inmunomodulador |
| • La determinación de la actividad TPMT (fenotipo o genotipo) no es imprescindible para iniciar tratamiento con tiopurinas. En caso de que se disponga de esta posibilidad, esta permitirá una mayor seguridad inicial |
| • La dosis adecuada en el tratamiento de la enfermedad inflamatoria intestinal es de 2,5mg/kg/día para azatioprina y de 1,5mg/kg/día para mercaptopurina, en toma única de la dosis completa desde el inicio |
HBsAg: antígeno de superficie del virus de la hepatitis B; TPMT: tiopurina metiltransferasa; VHB: virus de la hepatitis B.
La aparición de efectos adversos lleva a la retirada del fármaco en el 10-20% de los pacientes que reciben tiopurinas78. Su frecuencia es variable según definiciones, pero en un estudio sobre la base de datos ENEIDA (3.931 pacientes tratados), la incidencia acumulada fue del 26%, con un riesgo anual del 7% por paciente-año de tratamiento. El 17% de los pacientes tuvieron que retirar el tratamiento debido a efectos adversos79.
Los efectos adversos de las tiopurinas pueden dividirse en efectos adversos idiosincráticos (independientes de la dosis, como intolerancia digestiva, pancreatitis, fiebre, artralgias, mialgias, exantema y algunos casos de hepatotoxicidad) y efectos adversos dosis-dependientes, como la mielotoxicidad.
Los efectos adversos idiosincráticos suelen aparecer a corto plazo, al inicio del tratamiento, antes de 3 meses. La intolerancia digestiva aparece con relativa frecuencia (hasta el 8% de los casos) y motiva a veces la suspensión del tratamiento79. Las pancreatitis agudas aparecen en torno al 3% (dolor y elevación de lipasa×3 veces el límite superior de la normalidad) y suelen ser leves80. Existe una serie de síntomas mal definidos, como fiebre y cuadro pseudogripal, artralgias, eritema nudoso y dermatitis neutrofílica, que pueden aparecer como efecto adverso y que a veces cuesta reconocer como tal. Estas reacciones pueden aparecer hasta en el 1% de los pacientes, también al principio del tratamiento. Todas las reacciones idiosincrásicas cesan rápidamente (48-72h) tras la suspensión del fármaco81, hecho que facilita su diagnóstico en caso de duda.
Algunos efectos adversos dosis-dependientes (mielotoxicidad, hepatotoxicidad) pueden aparecer también al principio del tratamiento. Los controles analíticos serán más estrechos en ese momento, pudiendo luego espaciarse, pero nunca interrumpirse. La tasa de mielotoxicidad (leucopenia, leucocitos <3×109/L; neutropenia, neutrófilos <1,5×109/L; anemia, Hb <10mg/dL; trombocitopenia <100×109/L)82 es de aproximadamente el 3% por paciente y año de tratamiento, y la de mielotoxicidad grave alcanza el 0,9% (neutrófilos <0,5×109/L)83. La leucopenia/neutropenia es el efecto adverso hematológico más frecuente, y puede obligar a realizar modificaciones en la pauta de tratamiento. Otros efectos adversos hematológicos, como la linfopenia, trombocitopenia o anemia significativas, son menos frecuentes83. Existe relación entre la actividad de la TPMT y la mielotoxicidad: en pacientes homocigotos con baja o nula actividad de TPMT (0,3% de los pacientes) o en los heterocigotos, en menor grado (5-10% de los pacientes), el desarrollo de mielotoxicidad es significativamente más frecuente84. No obstante, en la mayoría de los casos, la mielotoxicidad es independiente de la TPMT y puede deberse a razones como factores genéticos o a infecciones virales.
La hepatotoxicidad aparece en al menos el 1,4% de casos por paciente y año de tratamiento85,86. Puede seguir un patrón idiosincrásico o dosis-dependiente y puede ser causa de la retirada de la terapia. El daño hepático es más frecuente en los primeros meses. Se define como incremento de transaminasas >2 veces el límite superior de la normalidad, o de la fosfatasa alcalina >2 veces el límite superior de la normalidad82. Por otra parte, no es infrecuente observar un aumento leve de bilirrubina indirecta, por mielopoyesis ineficaz. Las elevaciones leves y transitorias de transaminasas se observan con cierta frecuencia y carecen de consecuencias clínicas85.
Pueden presentarse 3 tipos fundamentales de hepatotoxicidad: 1) síndrome de hipersensibilidad, que aparece en las primeras 2-3 semanas de tratamiento y puede controlarse con la disminución de la dosis en algunos pacientes; 2) reacción colestásica idiosincrásica, en la que aumentan de forma llamativa la bilirrubina y la fosfatasa alcalina junto a las transaminasas y obliga a la suspensión del tratamiento, y 3) dosis-dependiente secundaria a lesión endotelial, tardía, que engloba la hiperplasia nodular regenerativa que se manifiesta más por la hipertensión portal con trombocitopenia que por la alteración de la bioquímica hepática que puede ser normal, la enfermedad venooclusiva y la peliosis hepática85,87,88, y que obligan a la suspensión del tratamiento. Hay diversos factores de riesgo para hiperplasia nodular regenerativa, como son el sexo masculino, tener una EC y la resección del intestino delgado >50cm89.
Otros efectos adversos potenciales del tratamiento con tiopurinas son las infecciones, algunas graves, y los tumores asociados a este tratamiento (aspecto tratado en otro apartado). La mielotoxicidad predispone a las infecciones, siendo las virales las infecciones más frecuentes (herpes zóster, herpes simple, citomegalovirus, VEB y virus del papiloma)90,91. El riesgo se incrementa cuando las cifras de neutrófilos son menores de 1×109/L. La vigilancia de este tipo de efectos adversos debe mantenerse mientras dure el tratamiento.
¿Qué controles clínico-analíticos debemos realizar y con qué periodicidad?Los controles analíticos deben incluir un hemograma y una bioquímica con perfil hepático. No es necesaria la determinación de amilasa o lipasa si no se sospecha pancreatitis. Sugerimos realizar un primer control clínico-analítico a los 15 días del inicio del tratamiento, un segundo control al mes, y el tercero a los 2 meses. A partir de este momento es posible espaciar los controles para realizarlos cada 3 meses. En pacientes estables sin efectos adversos, trascurrido más de un año de tratamiento con azatioprina/mercaptopurina, podrían ser suficientes controles analíticos cada 4-6 meses92.
Debemos aconsejar limitar la exposición solar y utilizar cremas con alto factor de protección para minimizar el riesgo de lesiones dermatológicas por fotosensibilidad.
En caso de aparición de un cuadro febril en paciente bajo tratamiento con azatioprina/mercaptopurina, el paciente deberá consultar para estudio del mismo. En función del diagnóstico y de la gravedad del cuadro, se decidirá la suspensión temporal o no del tratamiento.
¿Cómo puedo manejar los efectos adversos para lograr mantener el tratamiento con tiopurinas?En los pacientes con intolerancia digestiva a azatioprina pueden probarse alternativas como fraccionar la dosis en 2 tomas, administrar el fármaco tras la comida, y/o tomar parte de la dosis al acostarse. En caso de mantenerse el efecto adverso, existe la opción de cambiar a mercaptopurina a dosis equivalentes, con éxito en aproximadamente la mitad de los pacientes90,93-95. Por el contrario, en los restantes efectos adversos idiosincráticos (pancreatitis o síndrome febril), la reaparición del efecto adverso en caso de re-exposición al fármaco o cambio de tiopurinas es la norma. En algunos pacientes pueden producirse elevaciones de enzimas pancreáticas de bajo rango no asociadas a síntomas, que no precisan de modificaciones terapéuticas; por ello, como se ha indicado previamente, no deben realzarse estas determinaciones si no existe sospecha clínica de pancreatitis, ya que podrían resultar en una suspensión inadecuada del tratamiento.
En pacientes con hepatotoxicidad, sobre todo al inicio del tratamiento, puede ser suficiente con el descenso de dosis (al 50%), con controles estrechos en las semanas posteriores para intentar luego la tolerancia de la dosis inicial86. Aquellos con hepatotoxicidad de mayor intensidad (no existe un límite definido) o con ictericia, y aquellos en los que no se normalizan los enzimas hepáticos tras la reducción de dosis de tiopurinas, precisarán la retirada del fármaco. Si no mejora la biología hepática con la retirada del fármaco, es necesario un estudio exhaustivo. La administración de dosis divididas (cada 12h) de las tiopurinas puede ser de utilidad para controlar algunos casos de hepatotoxicidad77. En caso de aparecer hepatotoxicidad por azatioprina, se puede emplear en su lugar mercaptopurina antes de descartar las tiopurinas, con éxito en un elevado porcentaje de casos90,96,97. En algunos pacientes (shunters) hay un metabolismo preferente hacia metil-mercaptopurina y esto se manifiesta como dispepsia y hepatotoxicidad77. Si se dispone de la determinación de metabolitos de tiopurinas, puede intentarse usar una dosis menor de estas (25%) junto con 100mg de alopurinol, lo cual consigue aumentar la 6-tioguanina en sangre98, como se explica con más detalle en otro apartado de este documento. La experiencia con esta estrategia de administrar alopurinol con dosis bajas de tiopurinas es limitada a algunos centros y se ha utilizado también en indicaciones distintas de la hipermetilación, habiéndose descrito que una proporción de pacientes con efectos secundarios distintos de la hepatotoxicidad, como mialgia, artralgia y náuseas y vómitos (efectos adversos de naturaleza idiosincrática), podrían responder a la coprescripción de alopurinol99,100. En caso de optarse por esta estrategia se aconseja una monitorización más estrecha por el riesgo de mielotoxicidad. Por otra parte, en pacientes con reacciones de hepatotoxicidad colestásicas o hiperplasia nodular regenerativa, la suspensión de las tiopurinas es imprescindible.
El riesgo de mielotoxicidad significativa se relaciona con la cifra de neutrófilos: en pacientes con neutropenia leve (neutrófilos entre 1,5 y 1×109/L) se recomienda reducir la dosis de azatioprina/mercaptopurina al 50%. Una vez que el recuento celular se ha normalizado es posible volver a administrar la dosis completa del fármaco en muchos casos83,85,101. En casos de neutropenia moderada (neutrófilos <1×109/L) es necesaria la suspensión del tratamiento con tiopurinas. Tras la normalización de los neutrófilos puede intentarse nuevamente la tolerancia al tratamiento con dosis menores (50% de la dosis inicial) y si se repite la neutropenia, suspender definitivamente el fármaco102. En caso de neutropenia grave (neutrófilos <0,5×109/L) se suspende definitivamente el tratamiento.
En la tabla 3 se resumen los puntos más relevantes en relación con los efectos adversos del tratamiento con tiopurinas.
Puntos más relevantes sobre los efectos adversos del tratamiento con tiopurinas
| • Los efectos adversos idiosincráticos suelen aparecer al inicio del tratamiento con tiopurinas, siendo la intolerancia digestiva el más frecuente. Las pancreatitis agudas suelen ser leves |
| • Algunos efectos adversos dosis-dependientes, como la mielotoxicidad o la hepatotoxicidad, pueden aparecer en cualquier momento durante el tratamiento, lo que obliga a realizar controles analíticos periódicos durante el mismo, que deben incluir un hemograma y una bioquímica con perfil hepático |
| • Otros efectos adversos potenciales del tratamiento con tiopurinas son las infecciones, en ocasiones graves |
| • Algunos efectos adversos pueden manejarse con medidas como la reducción de la dosis, el fraccionamiento de la misma, o el cambio de azatioprina por mercaptopurina. Los cuadros de pancreatitis y el síndrome febril precisan la suspensión definitiva del tratamiento con tiopurinas |
Los tumores de piel diferentes al melanoma se han relacionado con el tratamiento con tiopurinas en distintos estudios103,104. En un metaanálisis publicado en 2014, incluyendo 60.351 pacientes, se observó un hazard ratio de 2,28 (IC 95%: 1,50-3,45) para el desarrollo de cáncer de piel no melanoma en pacientes expuestos a tiopurinas105. Aunque se ha observado un aumento del riesgo de melanoma en pacientes con EII, no se ha encontrado un mayor riesgo en los pacientes tratados con tiopurinas106.
Los pacientes que reciben tiopurinas para la EII tienen un mayor riesgo de desarrollar trastornos linfoproliferativos, fundamentalmente linfomas no Hodgkin. En el estudio de la cohorte francesa CESAME se observó un incremento del riesgo de linfomas en pacientes en tratamiento con tiopurinas frente a aquellos que nos las recibían (hazard ratio: 5,08; IC 95%: 2,01-13,9)107. Por otra parte, un reciente metaanálisis observó un aumento del riesgo de linfomas en pacientes tratados con tiopurinas (razón de incidencia estandarizada: 4,9; IC 95% 3,1-7,8), que aumentaba a partir del primer año de tratamiento, aunque este riesgo no persistía tras la retirada del fármaco108. En este trabajo se describe que el riesgo absoluto es más alto en los pacientes mayores de 50 años, siendo el riesgo relativo significativamente mayor en hombres menores de 30 años. La primoinfección o reactivación por el VEB se ha relacionado con este incremento del riesgo de linfomas en pacientes expuestos a tiopurinas, habiéndose descrito un riesgo de 1/10.000 de desarrollo de un síndrome linfoproliferativo posmononucleosis fatal en varones menores de 35 años en tratamiento con tiopurinas107. Se ha observado también un aumento del riesgo de síndrome mielodisplásico y leucemia mieloide aguda en pacientes con exposición previa a tiopurinas109.
En un reciente estudio de la cohorte francesa CESAME se ha observado un incremento significativo del riesgo de tumores del tracto urinario en pacientes en tratamiento con tiopurinas frente a aquellos que nos las reciben (hazard ratio: 2,82; IC 95%: 1,04-7,68), especialmente en varones mayores de 65 años110. El control de la actividad inflamatoria inducido por las tiopurinas se ha relacionado con un menor riesgo de cáncer colorrectal38,111. Si bien algunos datos sugieren un aumento del riesgo de tumores de cérvix en mujeres con EII tratadas con tiopurinas, estos no son concluyentes112.
Con los datos disponibles en la actualidad, se debe tener en cuenta el riesgo de linfomas y de tumores urinarios cuando se prescribe tratamiento con tiopurinas en pacientes de edad avanzada.
¿Qué medidas preventivas debe tomar el paciente?Dado el riesgo aumentado de tumores de piel no melanomas en pacientes con EII tratados con tiopurinas se recomienda limitar la exposición solar y utilizar protección solar de forma rutinaria. Podría ser útil incluir a los pacientes con otros factores de riesgo añadidos, como los que tienen mayor exposición solar por su profesión, pacientes con efélides múltiples o aquellos individuos con el tipo cutáneo de riesgo (fototipos 1 y 2), en un programa de seguimiento periódico por Dermatología112. Si bien no hay datos concluyentes sobre un efecto sinérgico del consumo de tabaco junto con el tratamiento con tiopurinas en el riesgo de tumores, datos del registro Eneida han mostrado un incremento del riesgo de tumores extracolónicos en pacientes fumadores, por lo que se recomienda evitar el tabaco en todos los pacientes113. Se recomienda que las mujeres con EII sigan un programa de cribado de cáncer de cérvix anual y sean vacunadas contra el virus del papiloma humano cuando proceda112,114.
¿Cuál es la actitud más adecuada ante el diagnóstico de un tumor en paciente bajo tratamiento con tiopurinas?Los tumores de piel diferentes al melanoma permiten la continuación del tratamiento con tiopurinas en casos muy concretos104. No se ha observado un aumento del riesgo de tumores en pacientes con un cáncer previo tratados con tiopurinas frente a aquellos no tratados con tiopurinas en varias series recientes115-117. No obstante, ante la aparición de un tumor en un paciente en tratamiento con tiopurinas es fundamental la opinión de Oncología sobre el potencial impacto de las tiopurinas sobre el curso evolutivo del tumor. Teniendo en cuenta el tipo de tumor y sus características, la posible relación con el tratamiento con tiopurinas, las características del paciente y de la evolución y tratamiento de la EII, se debe individualizar el manejo en cada caso.
En el caso de pacientes que desarrollan un linfoma se recomienda la suspensión definitiva del tratamiento con tiopurinas. Se recomienda la retirada temporal de las tiopurinas durante el tratamiento de un cáncer invasivo, con la salvedad de la terapia hormonal adyuvante a largo plazo a la que se podría asociar el tratamiento con tiopurinas según la recomendación individualizada de Oncología118. En pacientes con tumores con buen pronóstico o sin clara relación con tiopurinas, el mantenimiento de la terapia con tiopurinas puede ser una opción, que se debe consensuar junto con Oncología y el paciente.
En aquellos pacientes en los cuales se retiran las tiopurinas tras el diagnóstico de un tumor no está definido un tiempo específico para la reintroducción de las tiopurinas. Basándose en datos de pacientes postrasplantados se ha propuesto un periodo de entre 2 y 5 años para el reinicio de este tratamiento118. No obstante, actualmente se recomienda la evaluación individual de cada caso junto con Oncología, teniendo en cuenta el riesgo de recurrencia del tumor y las alternativas de tratamiento de la EII.
En la tabla 4 se resumen los puntos más relevantes con relación al riesgo de tumores y actitud con el tratamiento tiopurínico.
Puntos más relevantes sobre el riesgo de tumores y actitud con el tratamiento tiopurínico
| • El tratamiento con tiopurinas se ha relacionado con el incremento del riesgo de tumores de piel diferentes al melanoma, linfomas y tumores del tracto urinario |
| • La primoinfección o reactivación por el virus de Epstein-Barr se ha relacionado con la aparición de linfomas en pacientes expuestos a tiopurinas |
| • Se recomienda la retirada definitiva de las tiopurinas ante el diagnóstico de linfoma y su suspensión temporal en caso de cáncer invasivo, individualizando junto con Oncología la reintroducción de esta terapia, teniendo en cuenta el riesgo de recurrencia del tumor y las alternativas de tratamiento de la enfermedad inflamatoria intestinal |
Las tiopurinas son fármacos seguros en la concepción, la gestación y la lactancia. Esto resume todo lo que se desarrollará a continuación, pero es importante repetir esta idea central. La razón es que, por su mecanismo de acción, siguen estando incluidas en la categoría D de la FDA ya que hay evidencia de teratogenicidad en animales. Sin embargo, en el propio documento de la FDA se asume la ausencia de estudios controlados en humanos. La recomendación sería por lo tanto no emplear al menos que los beneficios superen los riesgos. El empleo creciente de la Pregnancy and Lactation Labeling Rule (PLLR), que incluye información detallada sobre riesgos y beneficios, probablemente sea más adecuado.
Esto debe ser conocido, pues para el médico no acostumbrado a usar tiopurinas que haga una consulta superficial en manuales clásicos o en Internet, el primer reflejo ante una mujer en tratamiento con tiopurinas que desea la gestación, o que ya está gestando, será suspenderlas. Debemos advertir a nuestras pacientes en edad fértil, incluso por escrito, que esta actitud es incorrecta, y que precisamente una recidiva clínica de la EII durante la gestación podría propiciar daño fetal119.
Concepción y gestaciónLa seguridad del uso de tiopurinas durante la concepción y gestación proviene de una extensa experiencia en mujeres fundamentalmente portadoras de trasplantes de órgano sólido. Esto ha llevado a que los textos de revisión o de guía clínica119,120 recomienden continuar el tratamiento con tiopurinas durante la gestación121,122. Aunque no se dará el caso con frecuencia, nada impide estrictamente iniciar tiopurinas durante este periodo. Sin embargo, dado que la mayoría de los efectos adversos se presentan al inicio del tratamiento, se recomienda diferir su inicio en la medida de lo posible.
Tampoco se ha descrito una tasa de infecciones incrementada en el primer año de vida de niños nacidos de madres tratadas con tiopurinas119.
Los datos relativos a la potencial influencia de estos fármacos en la gametogénesis masculina y en el componente paterno de posibles casos de teratogenicidad son escasos. Inicialmente se disponía de una evidencia muy fragmentada, con casos aislados y una serie en una muestra escasa de pacientes. En una serie nacional123 sobre un mayor número de gestaciones en las que los padres estaban expuestos a tiopurinas, no se detectó efecto adverso alguno sobre los recién nacidos. De forma similar, en otro estudio realizado en nuestro medio, no se observó que el tratamiento con tiopurinas se asociara a una peor calidad del esperma, ni a una disminución de la fertilidad124. Por tanto, en caso de dificultad para concebir, debemos transmitir con firmeza a los o las pacientes expuestas que es muy improbable que las tiopurinas sean la causa.
LactanciaTambién ha sido muy variable la opinión experta (siempre no controlada) sobre el uso de tiopurinas en la lactancia. Hoy en día se consideran fármacos probablemente seguros y no se recomienda su suspensión119,120, ya que el paso a la leche materna se produce en las 4h que siguen a su administración oral, en cantidades muy reducidas, inferiores a las terapéuticas.
En la tabla 5 se resumen los puntos más relevantes en relación con la seguridad de las tiopurinas en los aspectos de la reproducción.
Puntos más relevantes sobre la seguridad de las tiopurinas en los aspectos de la reproducción
| • Las tiopurinas son fármacos seguros en la concepción, la gestación y la lactancia |
| • El tratamiento con tiopurinas no se asocia a efectos adversos en el recién nacido ni a una peor calidad del esperma del varón en tratamiento |
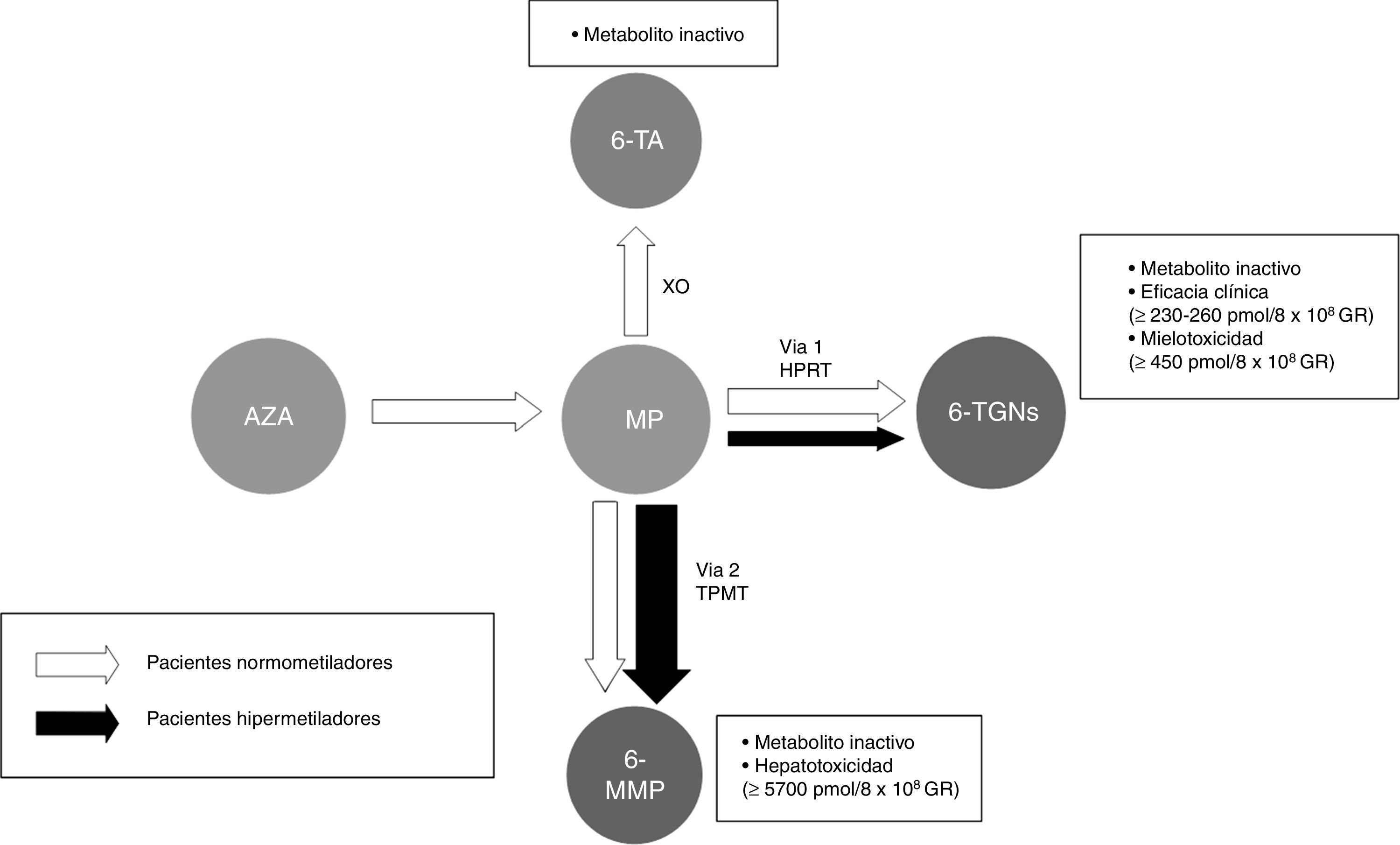
El metabolismo de las tiopurinas es complejo y de alta variabilidad entre individuos. De manera general, se puede decir que se producen fundamentalmente 2 metabolitos (fig. 1): los derivados de la 6-metilmercaptopurina (6-MMP) y los de la 6-TGN. Los primeros son responsables de buena parte de los efectos adversos, sobre todo de la hepatotoxicidad. Los segundos determinan la acción terapéutica e influyen en la aparición de mielotoxicidad.
Esquema de la metabolización de las tiopurinas. Pacientes normometiladores e hipermetiladores con metabolización preferencial a través de la TPMT (vía 2)
Tiopurinas. AZA: azatioprina; MP: mercaptopurina. Metabolitos. 6-MMP: 6-metilmercaptopurina; 6-TA: ácido 6-tioúrico; 6-TGN: nucleótidos de 6-tioguanina. HPRT: hipoxantina fosforibosil transferasa; TPMT: tiopurina metiltransferasa; XO: xantino-oxidasa.
La mayoría de las personas metaboliza preferentemente hacia 6-TGN. Sin embargo, algunos, a los que denominamos shunters o hipermetiladores, degradan las tiopurinas de manera preferencial por la otra vía, con acumulación de 6-MMP y por lo tanto menor eficacia y mayores efectos tóxicos potenciales.
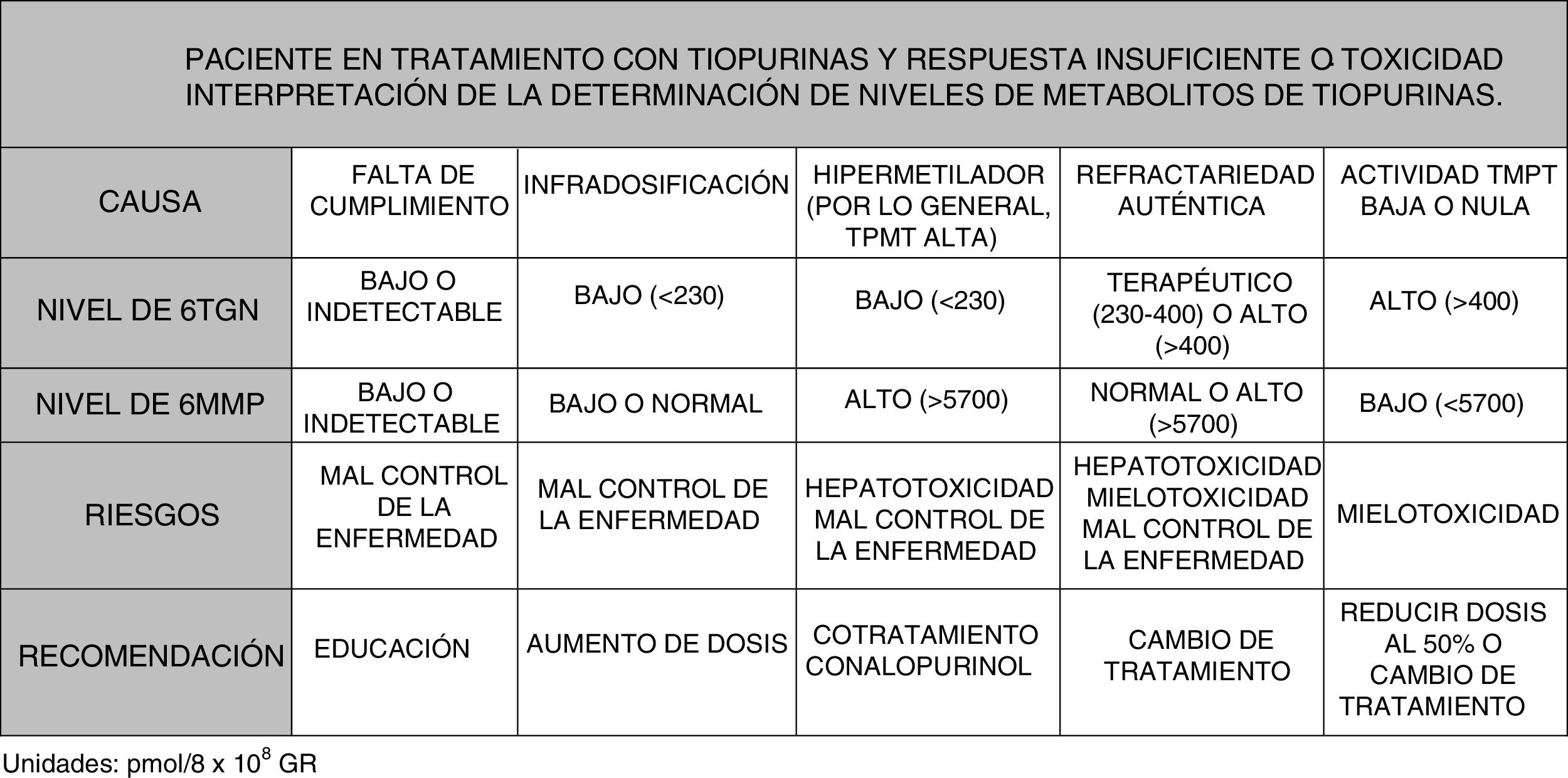
Es posible determinar la concentración de 6-TGN y 6-MMP en sangre, lo que permite identificar a los sujetos hipermetiladores, así como detectar la infradosificación y la falta de cumplimiento. Algunas sociedades científicas como la European Crohn's and Colitis Organisation (ECCO) o la American Gastroenterological Association (AGA) contemplan su utilización durante el tratamiento con tiopurinas; incluso se podría considerar antes de escalar la actitud terapéutica al etiquetar a un paciente como refractario a las tiopurinas125-127. En las guías de enfermedad pediátrica (ECCO/ESPGHAN/NASPGHAN)128,129 se considera además su utilización ante la aparición de efectos secundarios (citopenia, hepatotoxicidad). De manera más concreta, se podría decir que los niveles de TGN pueden ayudar a predecir la respuesta al tratamiento, ya que los pacientes con niveles superiores a 230pmol/8×108 GR alcanzan respuesta clínica en un 84% frente a un 18% de los casos con niveles más bajos (OR: 3,27). Un exceso de TGN (>450pmol/8×108 glóbulos rojos [GR]) se relaciona con la aparición de mielotoxicidad y citopenia. La disminución de dosis en caso de niveles de TGN >550pmol/8×108 GR no se ha seguido de pérdida de eficacia terapéutica. Por el contrario, los individuos hipermetiladores producen niveles altos de metabolitos metilados (6-MMP) y bajos de metabolitos activos (6-TGN), por lo que se ha descrito una menor efectividad terapéutica y mayor incidencia de hepatotoxicidad130-134.
¿Cuándo medir metabolitos?Los niveles de metabolitos alcanzan su estabilidad en sangre a las 4 semanas del inicio del tratamiento, lo que en teoría permitiría un ajuste de dosis precoz y una optimización previa a su respuesta clínica, más tardía. Sin embargo, la optimización precoz no puede recomendarse en la práctica clínica, ya que no se han demostrado mejores resultados en la evolución de la enfermedad con esta práctica; de hecho, los resultados del estudio METAZA diseñado y realizado en nuestro país con la finalidad de aclarar este aspecto concluían en que la determinación de metabolitos al iniciar el tratamiento con tiopurinas no ayudaba a determinar la respuesta clínica al mismo69.
En resumen, considerando lo expuesto, podría plantearse la medición de niveles en varias circunstancias130-135: pacientes con ausencia de respuesta o respuesta parcial tras 3-6 meses de tratamiento; pacientes con sospecha de mal cumplimiento, y en casos con efectos secundarios como citopenia o hepatotoxicidad (fig. 2).
Utilidad de la modulación del metabolismo de las tiopurinas mediante el cotratamiento con alopurinolLos pacientes hipermetiladores o con actividad alta de la TPMT (fig. 1) utilizan esta vía de manera preferencial, produciéndose una mayor concentración de metabolitos metilados (6-MMP) y menor cantidad de 6-TGN (cociente 6-MMP/6-TGN>11)136. Estos pacientes presentan una disminución de efectividad del tratamiento y un aumento de la posibilidad de hepatotoxicidad, sobre todo cuando el nivel de 6-MMP sobrepasa los 5.700pmol/8×108 GR.
El alopurinol es un inhibidor de la xantino-oxidasa, que en uso normal resulta tóxico al combinarse con dosis completas de tiopurinas. Sin embargo, su uso con tiopurinas a dosis bajas puede potenciar la metabolización de estas hacia la producción de metabolitos de 6-TGN, reduciéndose los metabolitos metilados, lo que resulta en un incremento de su efectividad y una disminución de su toxicidad hepática136. Es preciso señalar una vez más que la dosis de tiopurinas debe reducirse a un 25-33% de la previa, pues de lo contrario resultaría en la producción de graves efectos adversos133,136.
Esta combinación de alopurinol y tiopurinas puede emplearse en ciertas circunstancias, pero contando siempre con vigilancia estrecha y determinación de metabolitos. Quizás podría ser útil en casos de hepatotoxicidad en relación con el tratamiento tiopurínico, así como en la respuesta parcial en paciente hipermetiladores94.
La dosis de alopurinol que se suele utilizar en tratamiento combinado es baja (100mg/día), asociándose a escasos efectos secundarios. El más frecuente es el exantema, generalmente autolimitado, pero pueden presentarse otros como dispepsia, cefalea, vértigo, alteraciones del gusto y de la vista, hipertensión, alopecia, hepatotoxicidad o ginecomastia; se han descrito casos puntuales de necrólisis epidérmica tóxica, sobre todo en personas de origen chino y del sureste asiático136.
Tratamiento combinado con tiopurinas y biológicosDentro de las opciones terapéuticas en la EII, las terapias combinadas con biológicos (especialmente anti-TNF) e inmunosupresores (tiopurina, pero también metotrexato), representan una opción asociada a mayor eficacia, pero con toxicidad más significativa. Se considera que la combinación de una tiopurina y un anti-TNF, especialmente infliximab, es más efectivo que la monoterapia con infliximab en términos de respuesta clínica y curación mucosa. La razón subyacente es que la asociación de tiopurinas resulta en un incremento de la concentración sérica de infliximab y una disminución de la inmunogenicidad con menor formación de anticuerpos antiinfliximab137,138. Aunque la efectividad clínica de las tiopurinas en monoterapia se relaciona con unos niveles de TGN>230pmol/8×108 GR, en tratamiento combinado no están definidos los niveles de TGN asociados con una disminución de la inmunogenicidad (se ha sugerido niveles de TNG>125pmol/8×108 GR). Podría ser suficiente una dosis más baja de azatioprina para conseguir este efecto139. No obstante, recientes estudios con terapia combinada con adalimumab y tiopurina sugieren mayor beneficio terapéutico y menor desarrollo de anticuerpos cuando se consiguen niveles de TGN>222-235pmol/8×108 GR140,141.
Aunque es concebible que, para mantener una respuesta adecuada, los pacientes en tratamiento combinado de mantenimiento precisen tener niveles suficientes de metabolitos de tiopurinas137,138, no es posible establecer unas recomendaciones definitivas. La realización de estudios prospectivos específicos que comparen los resultados de eficacia clínica en función de los niveles de anti-TNF y TGN observados podrá ser de utilidad para dar respuesta a estas cuestiones.
En la tabla 6 se resumen los puntos más relevantes con relación al control del tratamiento mediante determinación de metabolitos de las tiopurinas.
Puntos más relevantes sobre el control del tratamiento mediante determinación de metabolitos de las tiopurinas
| • La determinación de metabolitos de tiopurinas puede ser de ayuda en algunas situaciones como la sospecha de falta de adhesión o enfermos infratratados, y en caso de hepatoxicidad o mielotoxicidad |
| • El cotratamiento de tiopurinas a dosis bajas y alopurinol, monitorizado por niveles de metabolitos, puede ser una opción en pacientes hipermetiladores que desarrollan hepatotoxicidad o presentan falta de respuesta al tratamiento |
| • La terapia combinada de tiopurinas con anti-TNF (especialmente infliximab) disminuye la inmunogenicidad y se asocia a una mayor eficacia, pero con toxicidad más significativa |
Los autores declaran no tener ningún conflicto de intereses relacionado con este manuscrito.
A Alicia Algaba, por su colaboración en el trabajo de ordenar y revisar la bibliografía del artículo.