En la actualidad, la incidencia del cáncer gástrico (CG) está disminuyendo, sin embargo, la supervivencia continúa siendo baja. El cáncer gástrico precoz (CGP) ofrece un mejor pronóstico y la posibilidad de tratamientos endoscópicos curativos.
Pacientes y métodosEstudio observacional de una cohorte retrospectiva de todos los pacientes con CG en un periodo de 5años en un área sanitaria de España. El CGP incluyó los pacientes con afectación mucosa o submucosa (T1) independientemente de la afectación ganglionar, mientras que el avanzado fueron los T2-T4.
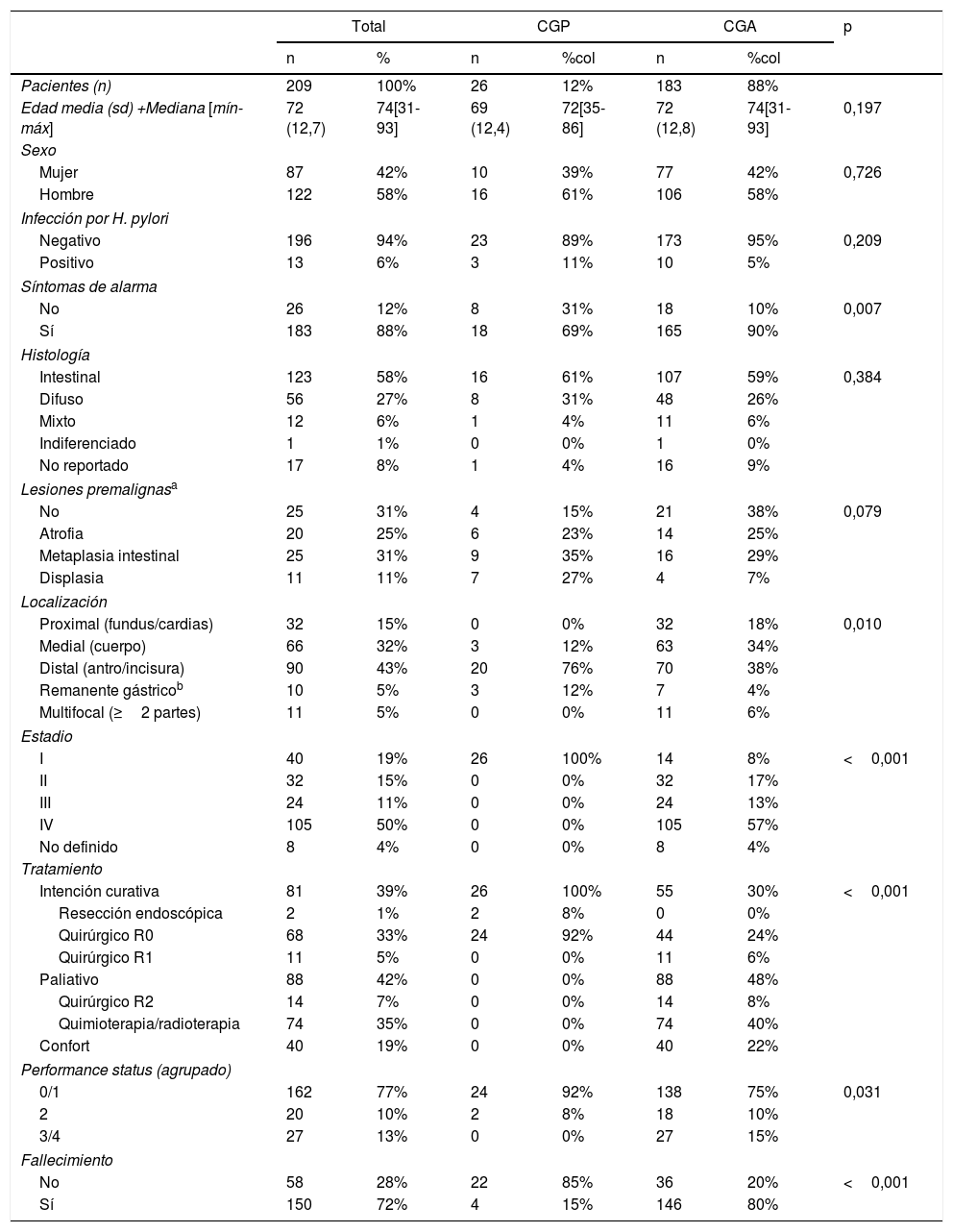
ResultadosSe incluyeron 209 pacientes de los cuales 26 (12%) fueron CGP. El CGP no tuvo diferencias en comparación con el avanzado en la edad, sexo, infección por HP, lesiones premalignas ni tipo histológico; sin embargo, tuvo diferencias significativas en la localización (antro e incisura en un 76% vs. 38%, p=0,01), síntomas de alarma (69% vs. 90%, p<0,01), tratamiento con intención curativa (100% vs. 30%, p<0,01), performance status (PS 0-1: 92% vs. 75%, p=0,03) y supervivencia (85% vs. 20%, p<0,001). Entre los pacientes tratados con intención curativa, el 98% (79/81) fueron operados y el 2% (2/81) fueron tratados con mucosectomía. Siete (27%) pacientes con CGP se hubiesen podido beneficiar de disección submucosa.
DiscusiónLa frecuencia del CGP fue baja en nuestra área sanitaria (12% de los CG). El CGP tuvo síntomas de alarma en un alto porcentaje, se localizó en el tercio distal del estómago (antro e incisura) y tuvo mejor pronóstico en relación con el CG avanzado. Se deben implementar medidas para incrementar la detección y tratamiento endoscópico del CGP.
Gastric cancer (GC) incidence is currently decreasing; however, survival is still low. Early GC (EGC) has better prognosis and it could be cured by endoscopic methods.
Patients and methodsObservational study of a retrospective cohort of all patients with GC during a five-year period in a health area of Spain. EGC diagnosis was defined as mucosal or submucosal (T1) cancers regardless of lymph node involvement, whereas the advanced GC were T2-T4.
Results209 patients were included, and 26 (12%) of them were EGC. There was no difference between EGC and advanced GC in age, sex, HP infection, precancerous lesions or histological type. Other characteristics of EGC were different from advanced GC: location (antrum and incisura in 76% vs 38%, p=0.01), alarm symptoms (69% vs 90%, p<0.01), curative treatment (100% vs 30%, p<0.01), performance status (PS 0-1: 92% vs 75%, p=0.03) and survival (85% vs 20%, p<0.001). Among patients who received curative treatment, 98% (79/81) underwent surgery and 2% (2/81) were treated by mucosectomy. Seven (27%) patients with EGC could have benefited from treatment by endoscopic submucosal resection.
DiscussionEGC frequency was low (12% of GCs) in our health area. EGC had a high percentage of alarm symptoms, and was located in the distal third of the stomach (antrum and incisura) and had better prognosis compared to advanced GC. Strategies to increase detection and endoscopic treatment of EGC should be implemented.
La incidencia del cáncer gástrico (CG) está disminuyendo en todo el mundo, pero continúa como el quinto en incidencia y tercero en letalidad1. La disminución de la incidencia del CG se debe a la implementación de estrategias de prevención primaria como son la mejor conservación de alimentos y la erradicación del Helicobacter pylori (HP)1,2. Pese a esta mejora, la supervivencia de los pacientes diagnosticados de CG sigue siendo baja a los 5años (menor del 30%), debido principalmente al diagnóstico en fases avanzadas3.
La esofagogastroduodenoscopia (EGD) es el método diagnóstico de elección porque permite la identificación y biopsia de lesiones4. Las guías de práctica clínica recomiendan una EGD en presencia de dispepsia en todo paciente mayor de 55-60años, o menor en los siguientes casos: (a) recurrencia de síntomas, (b) presencia de uno o varios síntomas de alarma (pérdida de peso, vómitos, disfagia, odinofagia, signos de sangrado digestivo alto, masa abdominal palpable, entre otros), o (c) presencia de factores de alto riesgo de malignidad (procedencia de países con alta incidencia o antecedente familiar de CG)4,5. Posteriormente al diagnóstico de CG, la estadificación clínica se realiza en base a la clasificación TNM6.
La diferenciación entre un cáncer gástrico precoz (CGP) y un cáncer gástrico avanzado (CGA) se realiza según el grado de invasión de la pared gástrica. El CGP es el carcinoma confinado a la mucosa (T1a) o submucosa (T1b) independientemente de la afectación ganglionar7. Según la clasificación TNM, el CGP se incluye como un T1, mientras que el CGA incluye a los T2-T47,8. Desde el punto de vista endoscópico, es posible predecir un CG como un CGP en función de la apariencia macroscópica, patrón mucoso y vascular9. Pruebas adicionales como la ultrasonografía endoscópica o la tomografía abdominal ayudan a diferenciar clínicamente un CGP de un CGA6.
La identificación del CGP durante una EGD es importante porque el riesgo de diseminación linfática es bajo y se asocia a una supervivencia ≥90% a los 5años tras una cirugía con linfadenectomía10. No obstante, un grupo de pacientes con CGP podría beneficiarse de un tratamiento endoscópico, menos invasivo; por ejemplo, pacientes con estadio clínico T1a tipo adenocarcinoma diferenciado sin ulceración ≤2cm (criterio clásico) o una de las siguientes características (criterios expandidos): tipo diferenciado sin ulceración >2cm, tipo diferenciado con ulceración ≤3cm o tipo indiferenciado sin ulceración ≤2cm11.
En países de riesgo alto (especialmente países orientales), dada la importancia del diagnóstico del CGP, se desarrollan programas de cribado poblacional en pacientes asintomáticos12; observándose un incremento significativo de la proporción de CGP en las últimas décadas en Japón y Corea del Sur13. En países occidentales de riesgo bajo e intermedio, como España, no se realiza este tipo de estrategia por su escasa costo-efectividad14; sin embargo, con el fin de mejorar la identificación del CGP, se han implementado medidas para el diagnóstico en fases precoces, como el acceso a una EGD desde la atención primaria15, el uso de endoscopios de alta definición y cromoendoscopia, y recientemente se han desarrollado guías de práctica clínica europeas para mejorar la calidad de la EGD como la detección y seguimiento endoscópico de las lesiones gástricas premalignas14,16. A pesar de estas medidas, no se ha logrado un incremento en la frecuencia de la detección del CGP17,18.
Los datos más recientes de la frecuencia del CGP en la población española provienen de inicios de los años noventa y estimaban entre un 2,8 y 15,3% del total de diagnósticos de CG19–24. Por este motivo, nos hemos planteado determinar la frecuencia y aspectos clínicos del CGP en relación con el CGA en un área sanitaria de España.
Pacientes y métodosEstudio observacional y retrospectivo. Se incluyeron todos los pacientes diagnosticados de CG entre enero de 2012 y diciembre de 2016 en el área sanitaria del Vallès Oriental (Barcelona), que tuvo una población media de 434.498 habitantes por año en el periodo de estudio (datos del Servei Català de la Salut, CatSalud). Los pacientes fueron reclutados de la Unidad de Anatomía Patológica del Hospital General de Granollers, en el cual está centralizado el estudio histológico de los 3 hospitales comarcales del área sanitaria. El protocolo de estudio fue aprobado por el Comité de Ética del Hospital General de Granollers.
La información fue obtenida de la historia clínica electrónica. Se recogió la siguiente información: datos demográficos (edad y sexo), infección por HP al diagnóstico, síntomas de alarma, histología, localización del tumor, estadificación TNM, tipo de tratamiento, performance status, fallecimiento (al finalizar el seguimiento: 31 de diciembre del 2017). El tratamiento fue clasificado en tres categorías: (i) intención curativa: resección endoscópica o cirugía R0/R1; (ii) paliativo: cirugía R2 o quimioterapia/radioterapia sola; y (iii) confort: no cirugía ni quimioterapia/radioterapia25. Además, se recolectó información de las lesiones premalignas (atrofia, metaplasia intestinal o displasia) asociadas en las piezas resecadas con intención curativa del CG.
El diagnóstico de CG se realizó a través de las biopsias obtenidas en la EGD. La estadificación de un CG como CGP se estableció por la afectación de la mucosa y/o submucosa independientemente de la afectación ganglionar (T0-1), mientras que el CGA lo conformaron los T2-T4 y los pacientes que su situación clínica no permitió realizar pruebas de estadificación7,8. En los casos intervenidos quirúrgicamente o endoscópicamente, se consideró la estadificación en función del análisis de la pieza gástrica resecada (pTNM o ypTNM para los que recibieron quimioterapia neoadyuvante), mientras que en los casos no operados se utilizó la estadificación clínica inicial (cTNM). Para el presente estudio se tomó en cuenta la séptima edición de la clasificación TNM de la American Joint Committee on Cancer (AJCC)6.
Finalmente, se analizaron las características de los pacientes con CGP y la posibilidad de curación si se hubiese realizado una disección submucosa. Se consideraron los siguientes criterios de curación en el análisis de la pieza quirúrgica11: (i) criterio clásico de curación: pT1a, tamaño ≤2cm y tipo diferenciado; y (ii) criterios expandidos:
(a) pT1a, tamaño >2cm, tipo diferenciado sin ulceración;
(b) pT1a, tamaño ≤3cm, tipo diferenciado con ulceración;
(c) pT1a, tamaño ≤2cm, tipo indiferenciado sin ulceración;
(d) pT1b (sm1, <500μm), tamaño ≤3cm, tipo diferenciado.
Para este subanálisis, el tipo histológico diferenciado fue el adenocarcinoma intestinal y el bien o moderadamente diferenciado, mientras que el tipo indiferenciado fue el difuso, el mal diferenciado o el que presentaba células en anillo de sello11,26. La morfología del CGP se clasificó de la siguiente manera: 0-I: lesión polipoide; 0-IIa: lesión plana sobreelevada; 0-IIb: lesión plana no sobreelevada; 0-IIc: lesión plana deprimida; 0-III: lesión excavada7.
Análisis estadísticoLas variables categóricas fueron presentadas en valores absolutos y relativos y se realizó la prueba Chi-cuadrado, el test exacto de Fisher o el test de asociación lineal por lineal (según corresponda a cada caso). Se presentó la edad como variable continua en media (±desviación estándar) o mediana (mínimo y máximo valor), se valoró la normalidad con el test de Kolmogorov-Smirnov y la comparación se realizó con el test no paramétrico U de Mann-Whitney. Para el análisis de la supervivencia se utilizó el método de regresión de Kaplan-Meier y la comparación, con el test de log-rank. Los análisis estadísticos se realizaron con el programa SPSS Statistics for Windows, versión 24.0, considerándose como estadísticamente significativo una p<0,05.
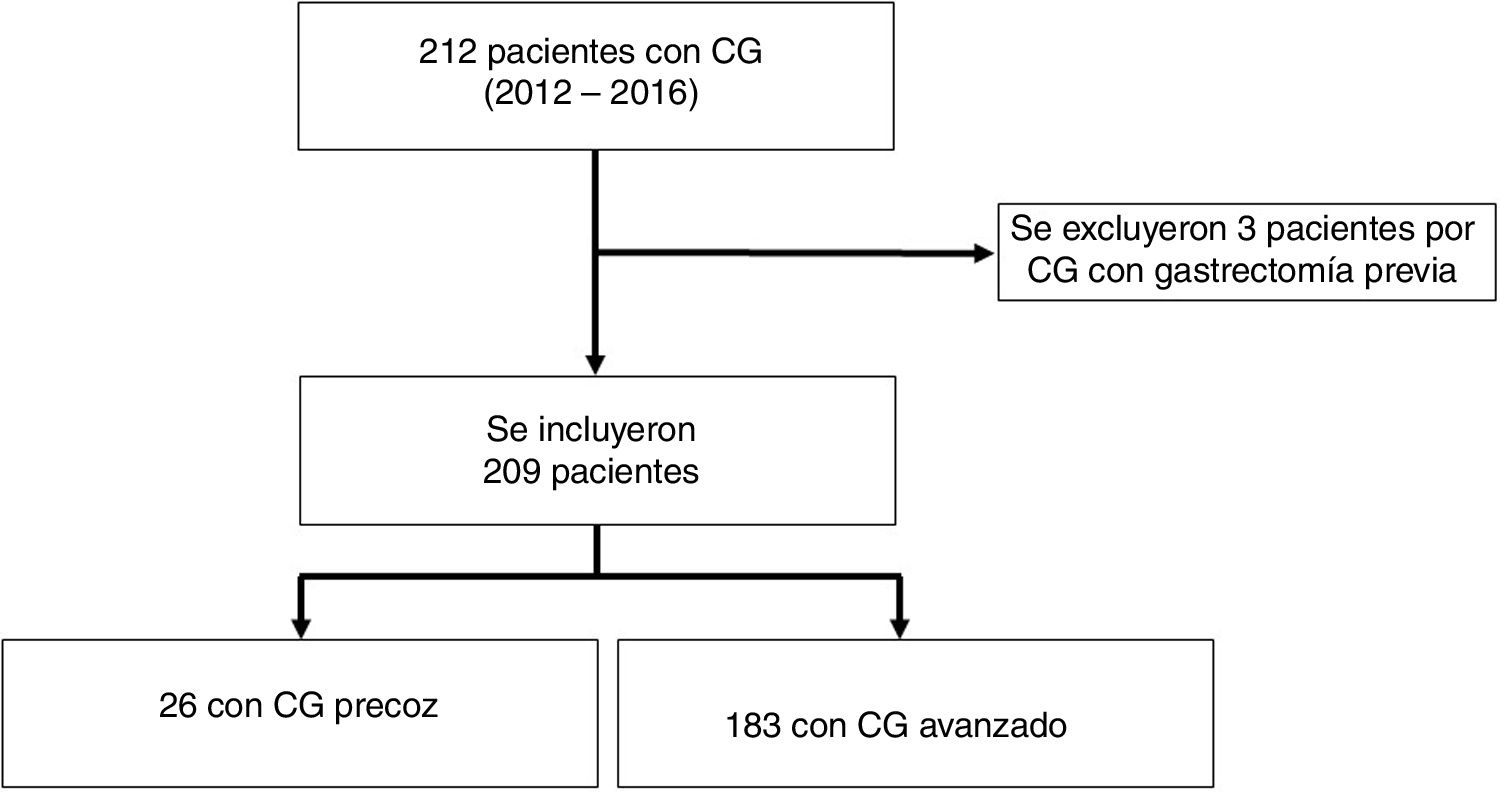
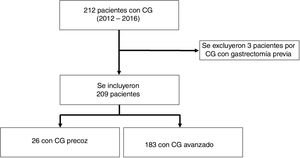
ResultadosFrecuenciaSe identificaron 212 adenocarcinomas gástricos. Se incluyeron un total de 209 pacientes y 3 pacientes fueron excluidos por antecedente de gastrectomía previa por CG (no se pudo establecer si fueron recidivas, lesiones sincrónicas o metacrónicas). Recibieron tratamiento con intención curativa 81 (38%) pacientes, de los cuales el 98% (79/81) fueron gastrectomizados; y el 2% (2/81) recibió tratamiento endoscópico tipo mucosectomía (tabla 1). Veintiséis pacientes tuvieron un CGP (12%, 26/209) entre el total de pacientes con CG (fig. 1) y el 30,4% (24/79) entre los pacientes que fueron sometidos a cirugía con intención curativa (tabla 1). No identificamos pacientes con estadificación clínica de CGP en los que se haya decidido seguimiento clínico; sin embargo, identificamos un 38% (10/26) de pacientes que tras quimioterapia neoadyuvante y cirugía posterior con intención curativa fueron clasificados como CGP (tabla 2).
Características de los pacientes con cáncer gástrico precoz y avanzado
| Total | CGP | CGA | p | ||||
|---|---|---|---|---|---|---|---|
| n | % | n | %col | n | %col | ||
| Pacientes (n) | 209 | 100% | 26 | 12% | 183 | 88% | |
| Edad media (sd) +Mediana [mín-máx] | 72 (12,7) | 74[31-93] | 69 (12,4) | 72[35-86] | 72 (12,8) | 74[31-93] | 0,197 |
| Sexo | |||||||
| Mujer | 87 | 42% | 10 | 39% | 77 | 42% | 0,726 |
| Hombre | 122 | 58% | 16 | 61% | 106 | 58% | |
| Infección por H. pylori | |||||||
| Negativo | 196 | 94% | 23 | 89% | 173 | 95% | 0,209 |
| Positivo | 13 | 6% | 3 | 11% | 10 | 5% | |
| Síntomas de alarma | |||||||
| No | 26 | 12% | 8 | 31% | 18 | 10% | 0,007 |
| Sí | 183 | 88% | 18 | 69% | 165 | 90% | |
| Histología | |||||||
| Intestinal | 123 | 58% | 16 | 61% | 107 | 59% | 0,384 |
| Difuso | 56 | 27% | 8 | 31% | 48 | 26% | |
| Mixto | 12 | 6% | 1 | 4% | 11 | 6% | |
| Indiferenciado | 1 | 1% | 0 | 0% | 1 | 0% | |
| No reportado | 17 | 8% | 1 | 4% | 16 | 9% | |
| Lesiones premalignasa | |||||||
| No | 25 | 31% | 4 | 15% | 21 | 38% | 0,079 |
| Atrofia | 20 | 25% | 6 | 23% | 14 | 25% | |
| Metaplasia intestinal | 25 | 31% | 9 | 35% | 16 | 29% | |
| Displasia | 11 | 11% | 7 | 27% | 4 | 7% | |
| Localización | |||||||
| Proximal (fundus/cardias) | 32 | 15% | 0 | 0% | 32 | 18% | 0,010 |
| Medial (cuerpo) | 66 | 32% | 3 | 12% | 63 | 34% | |
| Distal (antro/incisura) | 90 | 43% | 20 | 76% | 70 | 38% | |
| Remanente gástricob | 10 | 5% | 3 | 12% | 7 | 4% | |
| Multifocal (≥2 partes) | 11 | 5% | 0 | 0% | 11 | 6% | |
| Estadio | |||||||
| I | 40 | 19% | 26 | 100% | 14 | 8% | <0,001 |
| II | 32 | 15% | 0 | 0% | 32 | 17% | |
| III | 24 | 11% | 0 | 0% | 24 | 13% | |
| IV | 105 | 50% | 0 | 0% | 105 | 57% | |
| No definido | 8 | 4% | 0 | 0% | 8 | 4% | |
| Tratamiento | |||||||
| Intención curativa | 81 | 39% | 26 | 100% | 55 | 30% | <0,001 |
| Resección endoscópica | 2 | 1% | 2 | 8% | 0 | 0% | |
| Quirúrgico R0 | 68 | 33% | 24 | 92% | 44 | 24% | |
| Quirúrgico R1 | 11 | 5% | 0 | 0% | 11 | 6% | |
| Paliativo | 88 | 42% | 0 | 0% | 88 | 48% | |
| Quirúrgico R2 | 14 | 7% | 0 | 0% | 14 | 8% | |
| Quimioterapia/radioterapia | 74 | 35% | 0 | 0% | 74 | 40% | |
| Confort | 40 | 19% | 0 | 0% | 40 | 22% | |
| Performance status (agrupado) | |||||||
| 0/1 | 162 | 77% | 24 | 92% | 138 | 75% | 0,031 |
| 2 | 20 | 10% | 2 | 8% | 18 | 10% | |
| 3/4 | 27 | 13% | 0 | 0% | 27 | 15% | |
| Fallecimiento | |||||||
| No | 58 | 28% | 22 | 85% | 36 | 20% | <0,001 |
| Sí | 150 | 72% | 4 | 15% | 146 | 80% | |
CG: cáncer gástrico; CGA: cáncer gástrico avanzado; CGP: cáncer gástrico precoz.
Características de los pacientes con CGP y potencial curación si se hubiese realizado DSE
| N | Localización | Síntoma alarma | cTNM | Tipo de resección | Morfología | Tamaño | Histología | Diferenciación | Profundidad | Afectación | Criterios de curación si DSE | Seguimiento (meses) | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Linfática | Vascular | Ganglios | ||||||||||||
| 1 | Tercio medio | No | T1N0M0 | Quirúrgico | 0-IIb | 4cm | Intestinal | Diferenciado | pT1b (504μm) | No | No | 0/9 | No | 46,2 |
| 2 | Tercio medio | Sí | T1N0M0 | Quirúrgico | 0-I | 4cm | Intestinal | Diferenciado | pTis | No | No | 0/12 | Sí (cc) | 69,4 |
| 3 | Tercio medio | No | T2N0M0 | Quirúrgico | 0-IIb | NA | Difuso | Mal diferenciado | ypT1b (NA) | NA | NA | 0/7 | NA | 43,3 |
| 4 | Tercio distal | Sí | T0-1N0M0 | Mucosectomía | 0-IIc | 1cm | Intestinal | Diferenciado | pT1is | No | No | NA | Sí (cc) | 31,3a |
| 5 | Tercio distal | Sí | T1N0M0 | Quirúrgico | 0-IIc | 2,5cm | Mixto | Mal diferenciado | pT1a | No | No | 0/4 | No | 2,2a |
| 6 | Tercio distal | Sí | T1-2N0M0 | Quirúrgico | 0-I | 3cm | Intestinal | Diferenciado | pT1a | No | No | 0/11 | Sí (ce: a) | 28,6 |
| 7 | Tercio distal | Sí | T1-2N0M0 | Quirúrgico | 0-IIc | 1,5cm | Intestinal | Diferenciado | pT1b (381μm) | No | No | 0/23 | Sí (ce: d) | 51,3 |
| 8 | Tercio distal | Sí | T1N0M0 | Quirúrgico | 0-III | 1,7cm | Intestinal | Diferenciado | pT1b (ND) | No | No | 0/x | Sí (ce: d) | 15,8 |
| 9 | Tercio distal | Sí | T2N0M0 | Quirúrgico | 0-IIc | 3cm | Intestinal | Diferenciado | pT1b (3689μm) | No | No | 0/28 | No | 31,6 |
| 10 | Tercio distal | No | T1N0M0 | Quirúrgico | 0-IIb | 2,5cm | Intestinal | Diferenciado | pT1b (4667μm) | No | No | 0/20 | No | 61,8 |
| 11 | Tercio distal | No | T1N0M0 | Quirúrgico | 0-III | 1cm | Difuso | C. anillo de sello | pT1b (ND) | No | No | 0/x | No | 68,8 |
| 12 | Tercio distal | Sí | T1-2N0M0 | Quirúrgico | 0-IIc | 1,2cm | Intestinal | Diferenciado | pTis | No | No | 0/9 | Sí (cc) | 58,2 |
| 13 | Tercio distal | No | T1N0M0 | Quirúrgico | 0-IIc | 1,5cm | Intestinal | Diferenciado | pTis | No | No | 0/x | Sí (cc) | 68,1 |
| 14 | Tercio distal | Sí | T0-1N0M0 | Mucosectomía | 0-IIc | 1cm | ND | Diferenciado | pTis | No | No | NA | Sí (cc) | 20,9a |
| 15 | Tercio distal | Sí | T2N+M0 | Quirúrgico | 0-IIb | NA | Difuso | C. anillo de sello | ypT1b (NA) | NA | NA | 0/28 | NA | 17,7 |
| 16 | Tercio distal | Sí | T2N+M0 | Quirúrgico | 0-IIb | NA | Difuso | Mal diferenciado | ypT0 | NA | NA | 0/24 | NA | 41,6 |
| 17 | Tercio distal | Sí | T3N+M0 | Quirúrgico | 0-III | NA | Intestinal | Diferenciado | ypT0 | NA | NA | 0/x | NA | 63,7 |
| 18 | Tercio distal | No | T2-3N+M0 | Quirúrgico | 0-III | NA | Difuso | C. anillo de sello | ypT0 | NA | NA | 0/8 | NA | 70,6 |
| 19 | Tercio distal | No | T2-3N+M0 | Quirúrgico | 0-IIb | NA | Intestinal | Mal diferenciado | ypT1a | NA | NA | 0/13 | NA | 42,6 |
| 20 | Tercio distal | Sí | T2N0M0 | Quirúrgico | 0-IIb | NA | Difuso | C. anillo de sello | ypT1a | NA | NA | 0/17 | NA | 44,0 |
| 21 | Tercio distal | Sí | T3N+M0 | Quirúrgico | 0-IIb | NA | Intestinal | Diferenciado | ypT1b (NA) | NA | NA | 0/37 | NA | 22,7 |
| 22 | Tercio distal | No | T2-3N0M0 | Quirúrgico | 0-IIb | NA | Difuso | Mal diferenciado | ypT1b (NA) | NA | NA | 0/33 | NA | 43,3 |
| 23 | Tercio distal | Sí | T2N+M0 | Quirúrgico | 0-IIb | NA | Difuso | Mal diferenciado | ypT1b (NA) | NA | NA | 0/23 | NA | 38,4 |
| 24 | Remanente | Sí | T0-1N0M0 | Quirúrgico | 0-IIa | 2cm | Intestinal | Diferenciado | pT1b (2850μm) | Sí | No | 0/4 | No | 22,3a |
| 25 | Remanente | Sí | T0-1N0M0 | Quirúrgico | 0-III | 1,5cm | Intestinal | Diferenciado | pT1b (229μm) | No | No | 0/10 | Sí (ce: d) | 28,8 |
| 26 | Remanente | Sí | T2N0M0 | Quirúrgico | 0-I | 2,4cm | Intestinal | Diferenciado | pT1b (8000μm) | No | No | 0/13 | No | 16,7 |
CGP: cáncer gástrico precoz; cc: criterio clásico; ce: criterio expandido; cTNM: estadio clínico; DSE: disección submucosa endoscópica; NA: no aplica; ND: no disponible. El nivel de afectación submucosa en los pT1b no disponibles hemos asumido infiltración de la submucosa <500μm.
Al comparar el CGP con el avanzado, no hubo diferencias significativas respecto a la edad media (69años vs. 72años, p=0,19), al sexo (hombres 61% vs. 58%, p=0,72), infección por HP (11% vs. 5%, p=0,21), presencia de lesiones premalignas (85% vs. 62%, p=0,07), ni tipo histológico intestinal (61% vs. 59%, p=0,38). Al comparar el CGP con el avanzado, hubo diferencias significativas respecto a la localización (se localizó en el tercio distal en un 76% vs. 38%, p=0,01), síntomas de alarma (69% vs. 90%, p<0,01), tratamiento con intención curativa (100% vs. 30%, p<0,01) y performance status (PS 0-1: 92% vs. 75%, p=0,03). Además, todos los pacientes con CGP se clasificaron como estadios I y solo un 8% de los CGA entraron en esta categoría (p<0,01) (tabla 1).
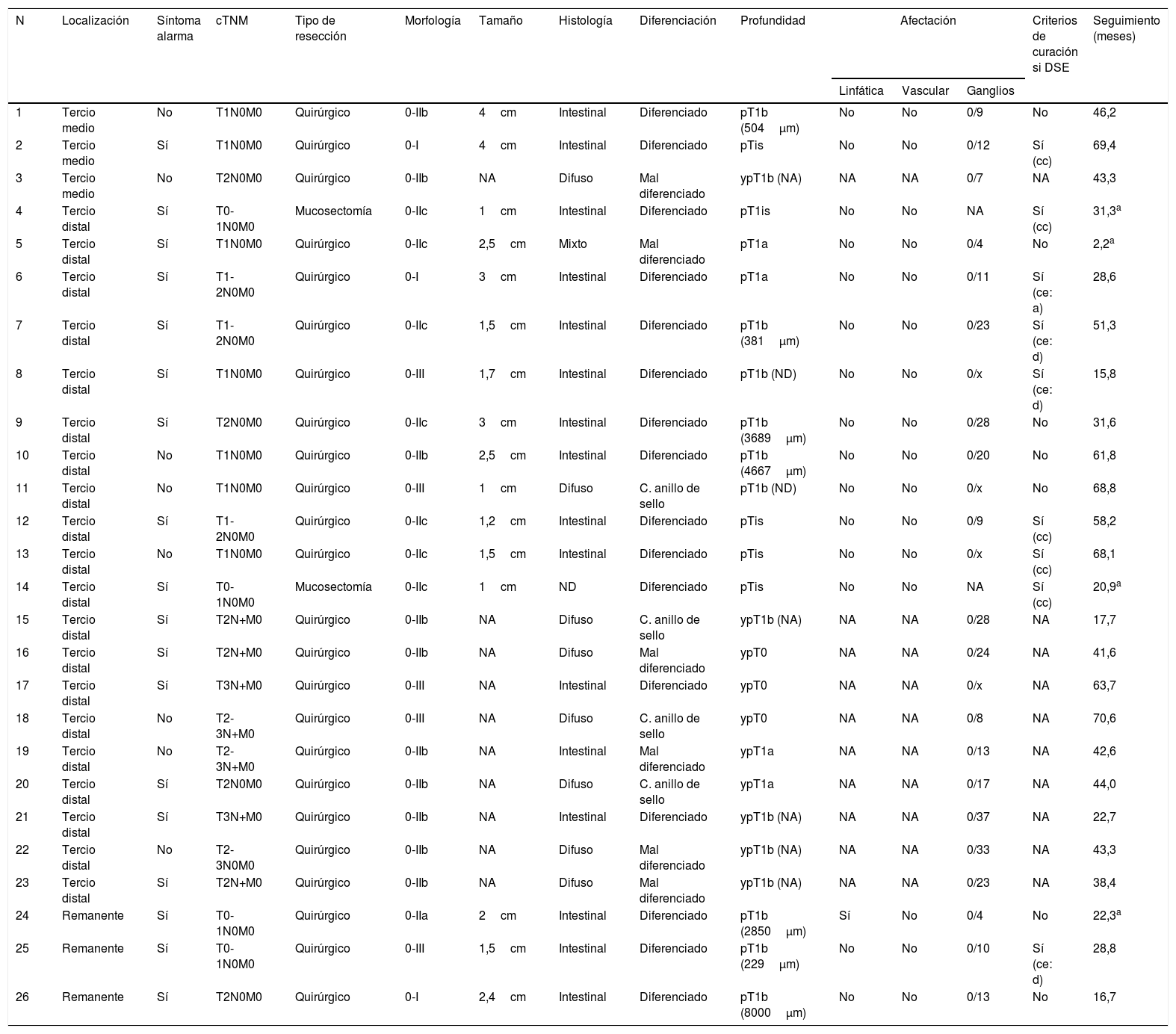
Al valorar los pacientes con CGP, identificamos que el 27% (7/26) de los pacientes podrían haber evitado el tratamiento quirúrgico si se hubiese realizado un tratamiento menos invasivo, como la disección endoscópica submucosa: 3 casos cumplían el criterio clásico de curación y 4 casos el criterio expandido de curación (un caso el criterio expandido «a» y 3 casos el criterio expandido «d») (tabla 2).
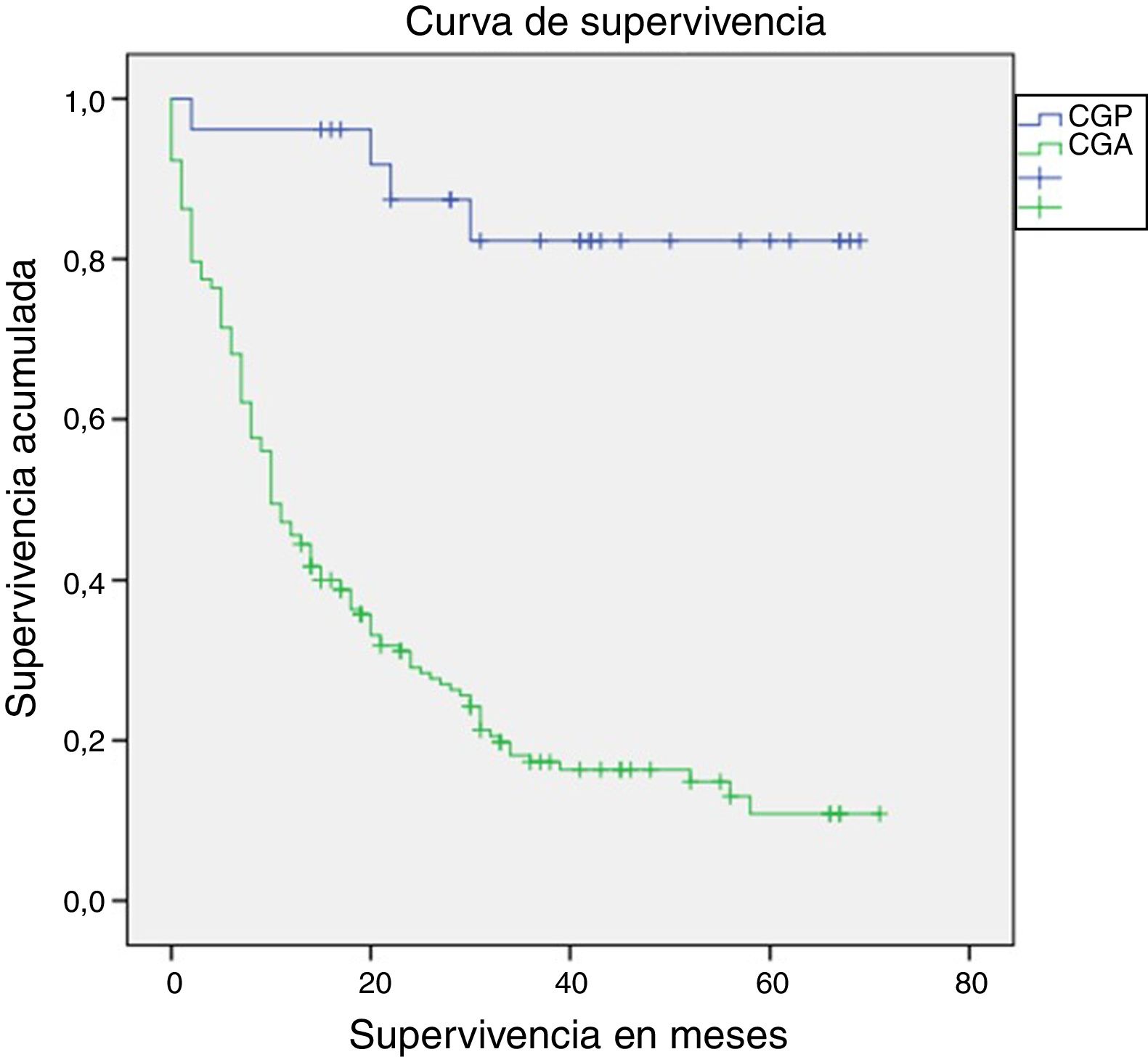
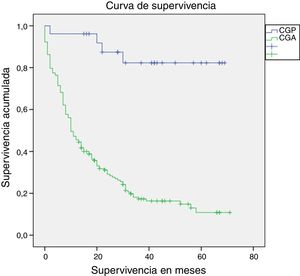
La mediana de seguimiento fue de 14 meses (rango intercuartílico: 0-71 meses). La supervivencia a un año fue estadísticamente superior en los pacientes con CGP en comparación con los pacientes con CGA (96,2% vs. 45,9%; long-rank p<0,01) (fig. 2). La supervivencia de los pacientes que completaron 5años de seguimiento (91 pacientes), también fue superior en los pacientes con CGP (72,7% vs. 11,3%, log-rank p<0,01). La mortalidad en los pacientes con CGP fue del 15% (4 pacientes). Un paciente falleció en el primer año debido a una complicación relacionada con la cirugía (peritonitis secundaria a dehiscencia de la anastomosis duodenal), y los otros 3 fallecimientos ocurrieron después del primer año, secundarios a causas no relacionadas con el periodo perioperatorio (un paciente por recidiva del CG con metástasis hepáticas, un paciente por colangiocarcinoma del hepático común, y un paciente por neumonía bilateral).
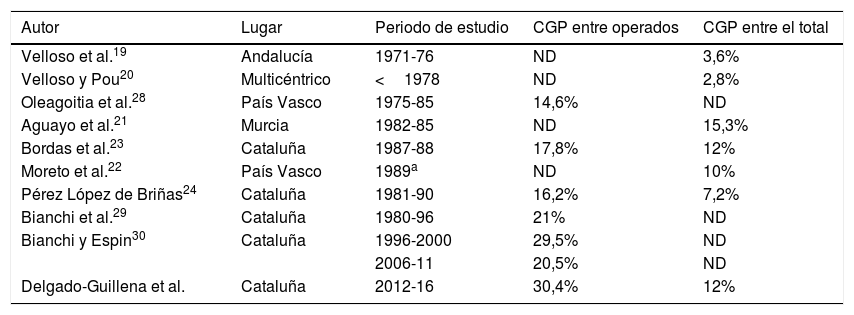
DiscusiónLa incidencia del CG está disminuyendo progresivamente en todo el mundo debido a medidas de prevención primaria como son la mejor conservación de alimentos y la erradicación del HP1,2. Además, en Japón se ha conseguido mejorar la proporción del CGP hasta en un 50% gracias a la implementación de un programa de cribado poblacional como medida de prevención secundaria13. En un país europeo, como Francia, la proporción de CGP se ha mantenido baja (6,7%) en las últimas décadas17. En nuestra serie fue de un 12% de todos los CG y se encuentra en el rango reportado previamente en diferentes series españolas19–24. Por otro lado, la proporción de CGP puede ser sobreestimada cuando se calcula sólo entre los pacientes operados17,27. En nuestro estudio la proporción de CGP entre los operados fue del 30,4%, observando una mejoría en la selección de los pacientes candidatos a cirugía cuando se compara con estudios publicados en los últimos años en España (tabla 3)23,24,28–30. Además, esta mejora se explica por el progreso de los tratamientos neoadyuvantes30. En nuestro estudio identificamos 10 pacientes que recibieron quimioterapia neoadyuvante, y en el estudio de la pieza quirúrgica fueron clasificados como CGP (tabla 2).
Frecuencia del CGP en series publicadas en España
| Autor | Lugar | Periodo de estudio | CGP entre operados | CGP entre el total |
|---|---|---|---|---|
| Velloso et al.19 | Andalucía | 1971-76 | ND | 3,6% |
| Velloso y Pou20 | Multicéntrico | <1978 | ND | 2,8% |
| Oleagoitia et al.28 | País Vasco | 1975-85 | 14,6% | ND |
| Aguayo et al.21 | Murcia | 1982-85 | ND | 15,3% |
| Bordas et al.23 | Cataluña | 1987-88 | 17,8% | 12% |
| Moreto et al.22 | País Vasco | 1989a | ND | 10% |
| Pérez López de Briñas24 | Cataluña | 1981-90 | 16,2% | 7,2% |
| Bianchi et al.29 | Cataluña | 1980-96 | 21% | ND |
| Bianchi y Espin30 | Cataluña | 1996-2000 | 29,5% | ND |
| 2006-11 | 20,5% | ND | ||
| Delgado-Guillena et al. | Cataluña | 2012-16 | 30,4% | 12% |
CGP: cáncer gástrico precoz; ND: no disponible.
El CGP es más frecuente en hombres y en pacientes en torno a los 60años27. En nuestra serie, tanto el CGP como el CGA fueron más frecuentes en hombres, sin diferencias en la distribución entre ambos grupos. Tampoco se observó diferencias en la edad media de los pacientes con CGP (69años) y CGA (72años). La edad de diagnóstico del CGP en nuestra serie fue mayor que en las series reportadas previamente en países europeos (59,9años) y en pacientes japoneses (57,8años)27.
El principal factor de riesgo del CG es la infección por el HP; sin embargo, en nuestra cohorte solo el 6% tenía infección por HP al momento del diagnóstico de CG, lo que hace suponer la erradicación previa en un porcentaje desconocido de pacientes. Se ha reportado que tras la erradicación del HP y haberse producido cambios como atrofia o metaplasia intestinal, el riesgo de CG no desaparece; debido a esto, se recomienda la vigilancia endoscópica14,31.
En España, el cribado poblacional de CG (en pacientes asintomáticos) no es costo-efectivo14, por lo que un método diagnóstico como una EGD se suele realizar en presencia de síntomas4. Los pacientes con CGP suelen presentar síntomas inespecíficos como dispepsia, en algunos casos asociado a síntomas de alarma como anemia, hemorragia digestiva (menos del 25%) o pérdida de peso (menos de un 40%), mientras que los CGA se asocian con mayor frecuencia a síntomas de alarma8,27. En nuestro estudio, los síntomas de alarma se presentaron en 18/26 (69%) de los pacientes con CGP, siendo los más frecuentes la anemia en 9/26 (35%) casos, la pérdida de peso en 4/26 (15%) casos y la hemorragia digestiva en 3/26 (12%) casos. La alta frecuencia de síntomas de alarma puede deberse a las características morfológicas de las lesiones; por ejemplo, en 12 casos, esta fue plana deprimida (0-IIc) o excavada (0-III); o a la presencia de varios síntomas de alarma en 6 de los 10 pacientes clasificados como CGP posteriormente a la quimioterapia neoadyuvante (tabla 2).
El CG es un adenocarcinoma en más del 90% de los casos y suele ser predominantemente de tipo intestinal. Actualmente se acepta que el CG es el resultado final de una serie de cambios como son la gastritis crónica atrófica, metaplasia intestinal, displasia y finalmente el adenocarcinoma. Este proceso es multifocal y suele empezar en la incisura y posteriormente extenderse hacia las paredes del estómago8. En nuestro estudio, el 69% de los pacientes tratados con intención curativa (mucosectomía o quirúrgico R0/R1) tenían lesiones premalignas sin observarse diferencias entre el CGP y el CGA. De todos los adenocarcinomas gástricos, el tipo intestinal fue el más frecuente en ambos grupos (61% en el CGP y 59% en el CGA).
La localización del CG fue similar a lo reportado por Miguélez-Ferreiro et al.32, un 43% de los casos en el tercio distal (antro e incisura) seguido de un 32% de casos en el tercio medio (cuerpo); sin embargo, la distribución del CGP en comparación con el CGA fue más frecuente en el tercio distal (76% vs. 38%) seguido del tercio medio (12% vs. 34%). Todos los casos de CGP y solo el 8% de los CGA se clasificaron en el estadio I; pese a ello, el total de pacientes en estadio I fue menor del 20%, similar a lo reportado previamente en un hospital español32.
La resección endoscópica del CGP (mucosectomía o disección submucosa) sirve como método diagnóstico, y cuando la lesión resecada cumple los criterios de curación, se puede evitar el tratamiento quirúrgico en un alto porcentaje de pacientes33. Para considerar a un paciente curado, la resección de la lesión tiene que ser en bloque, no tener márgenes afectos ni invasión linfovascular. Se considera un paciente curado si cumple el criterio clásico de curación (un adenocarcinoma intramucoso bien diferenciado ≤2cm) o alguno de los criterios expandidos11. Los criterios expandidos tienen un bajo riesgo de afectación ganglionar33,34, sin embargo, el riesgo no es nulo, por lo que deben ser evaluados en un comité multidisciplinar, especialmente el adenocarcinoma de histología indiferenciada que comporta una biología más agresiva (criterios expandido «c») o el adenocarcinoma que invade la submucosa (criterio expandido «d»). La incorporación de los criterios expandidos de curación ha demostrado mantener un bajo riesgo de diseminación linfática, un alto porcentaje de curación y resultados similares a la cirugía33,34. A pesar de estos adelantos en el tratamiento endoscópico del CGP, nosotros solamente detectamos 2 casos de mucosectomía y ningún caso de disección submucosa. Al valorar las piezas quirúrgicas de los pacientes con CGP identificamos que adicionalmente un 27% (7/26) de pacientes se hubiesen podido beneficiar de un tratamiento endoscópico curativo menos invasivo y con iguales resultados que la cirugía con linfadenectomía. Aunque los CGP distales son los más susceptibles de un abordaje endoscópico, en España, la implementación de la disección submucosa está limitada por la baja frecuencia con que se diagnostica un CGP y los costes asociados al procedimiento35.
Todos los casos de CGP recibieron un tratamiento con intención curativa (2 casos tratamiento endoscópico y 24 casos tratamiento quirúrgico). No identificamos ningún CGP en el que se haya decidido no realizar tratamiento. Desde la introducción del concepto de CGP en Japón (1962), se ha observado que estos pacientes tienen una supervivencia ≥90% a los 5años tras una cirugía con linfadenectomía10; sin embargo, en países occidentales la supervivencia tiende a ser discretamente menor (entre 84-92%)27. Nosotros también observamos una menor supervivencia a 5años (72,7%). Se ha atribuido la diferencia a aspectos relacionados con la técnica quirúrgica27. En nuestro estudio, uno (3,8%) de los pacientes con CGP falleció debido a una complicación perioperatoria. Guadagni et al., estimaron la mortalidad operatoria en CGP en un 4,1% (incluyendo la dehiscencia anastomótica y otras complicaciones perioperatorias); y en el seguimiento a largo plazo (5 o 10años), la neumonía fue una causa frecuente36. Dado el limitado número de pacientes con CGP, estos 4 casos pueden tener un impacto mayor en el análisis de supervivencia.
Nuestro estudio no tuvo como fin evaluar la técnica quirúrgica o el tipo de quimioterapia. Sin embargo, en nuestro trabajo definimos el CGP en base al estudio de la pieza quirúrgica independientemente de si recibieron o no quimioterapia neoadyuvante. La guía europea establece como tratamiento estándar la quimioterapia neoadyuvante en un grupo seleccionado de pacientes (CG clínicamente operable >T1N0), mientras que la guía japonesa no6,11. La estadificación en base a la anatomía patológica es el mejor factor pronóstico, y según esto es conocido que la estadificación clínica puede sobre- o infraestadificar el CG (hasta un 23%)37 y, en consecuencia, en el grupo de pacientes con CGP que recibieron quimioterapia neoadyuvante podríamos estar introduciendo un sesgo al incluir pacientes sobreestadificados inicialmente (verdaderos CGP) o respondedores al tratamiento neoadyuvante (afectación inicial más profunda a la submucosa). No obstante, debido a la introducción de la neoadyuvancia en los últimos años, se están realizando estudios que intentan valorar el pronóstico de la estadificación ypTNM y pTNM38. Sobre la base de esto, es recomendable que en estudios futuros se tenga en cuenta este factor y se valore el pronóstico entre los pacientes ypT1 y pT1.
Nuestros datos no provienen de un registro poblacional, pero se trata de pacientes atendidos en un área sanitaria bien definida cuya atención se realizó en 3 hospitales comarcales con unidades de Endoscopia, y la atención quirúrgica del CG (CG no cardial) así como la unidad de Anatomía Patológica está centralizada en uno de ellos.
La principal debilidad de nuestro estudio es su diseño retrospectivo que dificultó la recolección de datos como el tratamiento del HP antes del diagnóstico de CG, y la toma de inhibidores de la bomba de protones que en algunos casos puede enmascarar o retrasar el diagnóstico de un CG. La ausencia de un registro informatizado en años previos nos ha imposibilitado comparar la frecuencia actual de CGP con datos anteriores de nuestra misma área sanitaria. Además, no hemos tenido acceso a los certificados de defunción, por lo que se ha considerado el estado vital al finalizar el estudio para el análisis de supervivencia.
La guía de práctica clínica española recomienda una EGD en los pacientes mayores de 55años con dispepsia, o ante la recurrencia de síntomas o la presencia de cualquier síntoma de alarma4; sin embargo, el diagnóstico del CGP en pacientes con edad similar al avanzado y con una alta frecuencia de síntomas de alarma nos deben hacer sospechar una falta de adherencia a la misma. Así mismo, en España se ha reportado que el diagnóstico de CG puede pasar desapercibido, siendo en muchos casos por falta de reconocimiento de lesiones sutiles de la mucosa durante la EGD39,40. Para mejorar la detección del CGP es importante aprender a detectar el CGP y mejorar la calidad de la EGD. La guía de práctica clínica europea sobre calidad en la EGD16 recomienda una inspección minuciosa de la mucosa gástrica (al menos 7 minutos), fotodocumentación adecuada (al menos 10 fotos en total, y al menos 5 fotos de cavidad gástrica) y la realización de biopsias según protocolos (2 biopsias de antro y 2 biopsias de cuerpo gástrico) en pacientes con alto riesgo de CG. La calidad de una EGD se puede mejorar a través de un programa de formación sencillo41. Por otro lado, la frecuencia del CGP es fácil de medir (pacientes T0-1 entre el total de CG en un periodo determinado) y su definición se ha mantenido invariable en el tiempo, por lo que podría servir como indicador en las unidades de Endoscopia para evaluar las estrategias en la prevención secundaria del CG.
ConclusiónLa frecuencia del CGP fue baja en nuestra área sanitaria (12% de los CG) y fue similar a lo reportado previamente en España. El CGP se presentó asociado a síntomas de alarma en un alto porcentaje, se localizó principalmente en el tercio distal del estómago (antro e incisura) y tuvo mejor pronóstico en relación con el CGA. Se deben implementar medidas para incrementar la proporción del CGP. Dado el mejor pronóstico del estadio precoz del CG y la posibilidad de tratamiento vía endoscópica, el endoscopista debe estar capacitado para reconocer estas lesiones y realizar una EGD con los criterios de calidad recomendados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.