Evaluar la eficacia y seguridad de la terapia de vacío endoscópica (TVE) en perforaciones y dehiscencias del tracto digestivo superior.
Pacientes y métodosEstudio retrospectivo observacional donde se incluyeron todos los pacientes que presentaron algún defecto del tracto gastrointestinal superior y que fueron sometidos a TVE en el período comprendido entre abril de 2017 y febrero de 2019 en 3 centros españoles. Para ello se utilizó el único sistema de terapia de vacío aprobado para uso endoscópico hasta la fecha (Eso-SPONGEr; B. Braun Melsungen AG, Melsungen, Alemania).
ResultadosUn total de 11 pacientes fueron sometidos a TVE como tratamiento de una dehiscencia de sutura anastomótica tras esofaguectomía (n=7), gastrectomía (n=2), como tratamiento de una perforación esofágica tras septomiotomía endoscópica de Zenker (n=1) y tras una perforación esofágica espontánea o síndrome de Boerhaave (n=1). La mediana del tamaño de la cavidad fue de 8×3cm. De mediana, la TVE se inició a los 7días de la cirugía inicial. La mediana de duración de la TVE fue de 28días. La mediana de esponjas colocadas fue de 7 y el intervalo de recambio de las esponjas, de 3,7días. En 10 casos (91%) se consiguió el cierre del defecto y en 9 casos (82%) la resolución clínica del cuadro infeccioso asociado. Cinco pacientes presentaron algún evento adverso: 3 estenosis anastomóticas, un episodio de dolor retrofaríngeo y un caso de neumonía de nueva aparición. La mediana de estancia hospitalaria desde el inicio de la TVE fue de 45días. Un paciente falleció debido a complicaciones sépticas secundarias a la dehiscencia de sutura.
ConclusiónLa TVE tiene una eficacia superior al 90% en las perforaciones y fugas anastomóticas del tracto digestivo superior. Adicionalmente es una terapia segura, siendo los eventos adversos leves.
To evaluate the efficacy and safety of endoscopic vacuum therapy (EVT) in the management of perforations and anastomotic leaks of the upper gastrointestinal tract.
Patients and methodsThis is a retrospective observational study which included patients who underwent EVT due to any upper gastrointestinal defect between April 2017 and February 2019 in three Spanish Hospitals. To this end, we used the only medical device approved to date for endoscopic use (Eso-SPONGEr; B. Braun Melsungen AG, Melsungen, Germany).
Results11 patients were referred for EVT of an anastomotic leak after esophagectomy (n=7), gastrectomy (n=2), esophageal perforation secondary to endoscopic Zenker's septomiotomy (n=1) and Boerhaave syndrome (n=1). The median size of the cavity was 8×3cm. The median delay between surgery and EVT was 7 days. The median of EVT duration was 28 days. The median number of sponges used was 7 and the mean period replacement was 3.7 days. In 10 cases (91%), the defect was successfully closed. In 9 cases (82%) clinical resolution of the septic condition was achieved. 5 patients presented some adverse event: 3 anastomotic strictures, 1 retropharyngeal pain and 1 case of new-onset pneumonia. The median hospital stay from the start of EVT was 45 days. 1 patient died owing to septic complications secondary to the anastomotic leak.
ConclusionEVT was successful in over 90% of perforations and anastomotic leaks of the upper gastrointestinal tract. Moreover, this is a safe therapy with only mild adverse events associated.
Las perforaciones esofágicas y las dehiscencias de sutura tras cirugía de esófago o de estómago son complicaciones asociadas a una elevada morbimortalidad debido a la aparición de mediastinitis/peritonitis y sepsis asociada1–6.
La terapia de vacío endoscópica (TVE) es un tratamiento novedoso para el cierre de los defectos del tracto digestivo superior que se está demostrando muy eficaz y con una baja tasa de eventos adversos7. Recogemos aquí la primera experiencia en 3 centros españoles del uso de TVE en pacientes con dehiscencias de sutura tras cirugía esófago-gástrica o perforaciones esofágicas.
Material y métodosSe incluyeron todos los pacientes que presentaron algún defecto del tracto gastrointestinal superior y que fueron remitidos a TVE en el período de tiempo comprendido entre abril de 2017 y febrero de 2019 en 3 centros españoles: Hospital Clínic de Barcelona, Hospital Mútua de Terrassa y Clínica Teknon de Barcelona.
Los defectos fueron confirmados mediante la realización de una gastroscopia y una tomografía computarizada (TC) con administración de contraste oral. En caso de que el paciente presentara concomitantemente un derrame pleural, un absceso mediastínico o neumotórax, se colocó un drenaje pleural como parte del tratamiento.
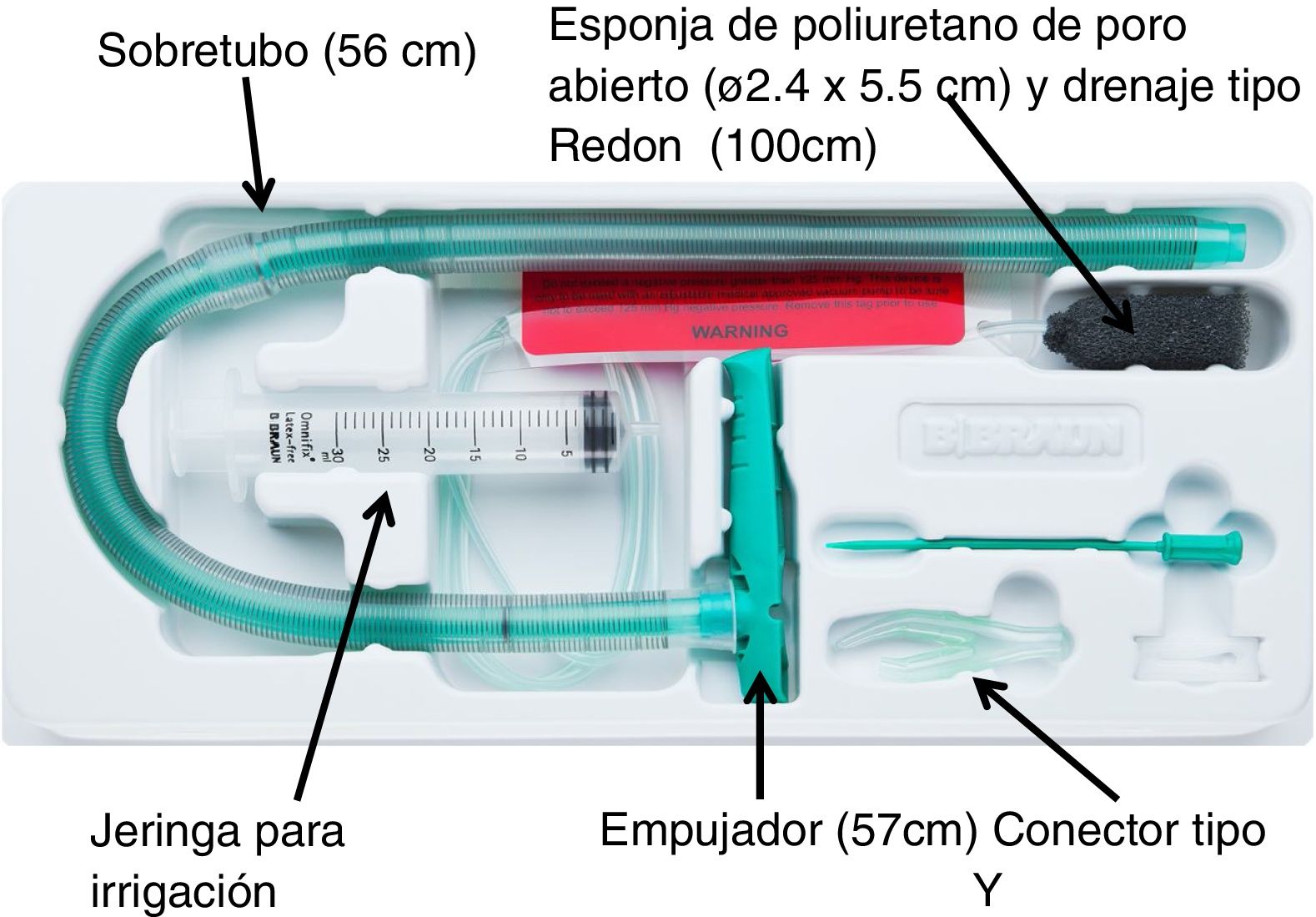
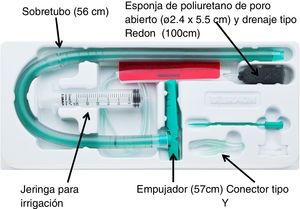
Para realizar la terapia de vacío se utilizó el único sistema de terapia de vacío aprobado para uso endoscópico hasta la fecha (Eso-SPONGEr; B. Braun Melsungen AG, Melsungen, Alemania). Dicho sistema está compuesto por una esponja de poliuretano de poro abierto de 5,5cm de longitud por 2,4cm de diámetro insertada en el extremo de un drenaje tipo Redón de 12CH y 100cm de longitud. Para facilitar la colocación endoscópica de la esponja, se utiliza un sobretubo de silicona de 56cm de largo y 13 o 15mm de diámetro interno y un empujador de 57cm de largo (fig. 1).
El procedimiento se llevó a cabo bajo sedación profunda o bajo anestesia general en aquellos pacientes que recibían ventilación mecánica. Se utilizó un gastroscopio convencional e insuflación con CO2 siempre que fue posible. En la endoscopia inicial, se identificó el defecto, se midió la distancia a la arcada dentaria, el porcentaje de la circunferencia esofágica o anastomótica afecto y el tamaño de la cavidad. Una vez realizada una primera valoración endoscópica se retiró el gastroscopio y se introdujo a través del sobretubo fuera del paciente. Se volvió a introducir el gastroscopio hasta la cavidad, utilizándolo como una guía para deslizar el sobretubo mediante control visual hasta el interior de la cavidad (terapia intracavitaria) o junto a la cavidad, en el lumen del tracto gastrointestinal (terapia intraluminal). En algunos casos en los que el orificio de la dehiscencia era de pequeño tamaño, se optó por llevar a cabo una dilatación con balón hasta 12-15mm para poder realizar un tratamiento intracavitario. Una vez colocado el sobretubo, se retiró el endoscopio y por dentro del sobretubo se avanzó la esponja utilizando el empujador hasta introducirla en el lugar escogido. Posteriormente se retiró conjuntamente el sobretubo y el empujador y se comprobó endoscópicamente la adecuada colocación de la esponja. Tras esto, se introdujo una sonda por la nariz del paciente para realizar un intercambio y acabar externalizando el drenaje tipo Redón de la esponja por la nariz. Acto seguido, se conectó el drenaje con una bomba electrónica de vacío a una presión negativa constante de entre 100 y 125mmHg. En caso de que alguna de las cavidades drenadas mediante TVE tuviera en su interior algún drenaje externo se procedió a su retirada. Las esponjas se recambiaron mediante endoscopia con sedación cada 2-5días, para evitar la adhesión del tejido sobre las mismas que dificultaría el recambio. Para ello se desconectó el drenaje de la bomba de aspiración continua, se irrigó la esponja con 10-20cm3 de suero fisiológico a través del drenaje tipo Redón y se procedió a su retirada cuidadosa mediante tracción suave. En los casos en que se observó resistencia en la retirada de la esponja se utilizó una pinza endoscópica para despegarla del tejido adherido y facilitar la retirada. Cuando la cavidad presentó un aspecto limpio y estaba recubierta por tejido de granulación, se procedió a disminuir progresivamente el tamaño de la esponja recortándola manualmente. Una vez la cavidad presentó un tamaño aproximado de unos 2×1cm, se procedió al cese de la TVE (fig. 2). En algunos casos se decidió el uso de una terapia endoscópica adyuvante una vez finalizada la TVE para ayudar al cierre completo de la cavidad. Se definió la resolución de la dehiscencia o de la perforación como el restablecimiento macroscópico de la mucosa junto a la ausencia de tejido de granulación. En todos los casos, se realizó una endoscopia y una TC con contraste oral o un tránsito esófago-gastroduodenal en la primera semana tras la retirada de la última esponja para verificar el cierre de la fuga. Tras comprobar el cierre del defecto con estas pruebas se inició la ingesta oral. Los pacientes fueron seguidos ambulatoriamente tras recibir el alta hospitalaria.
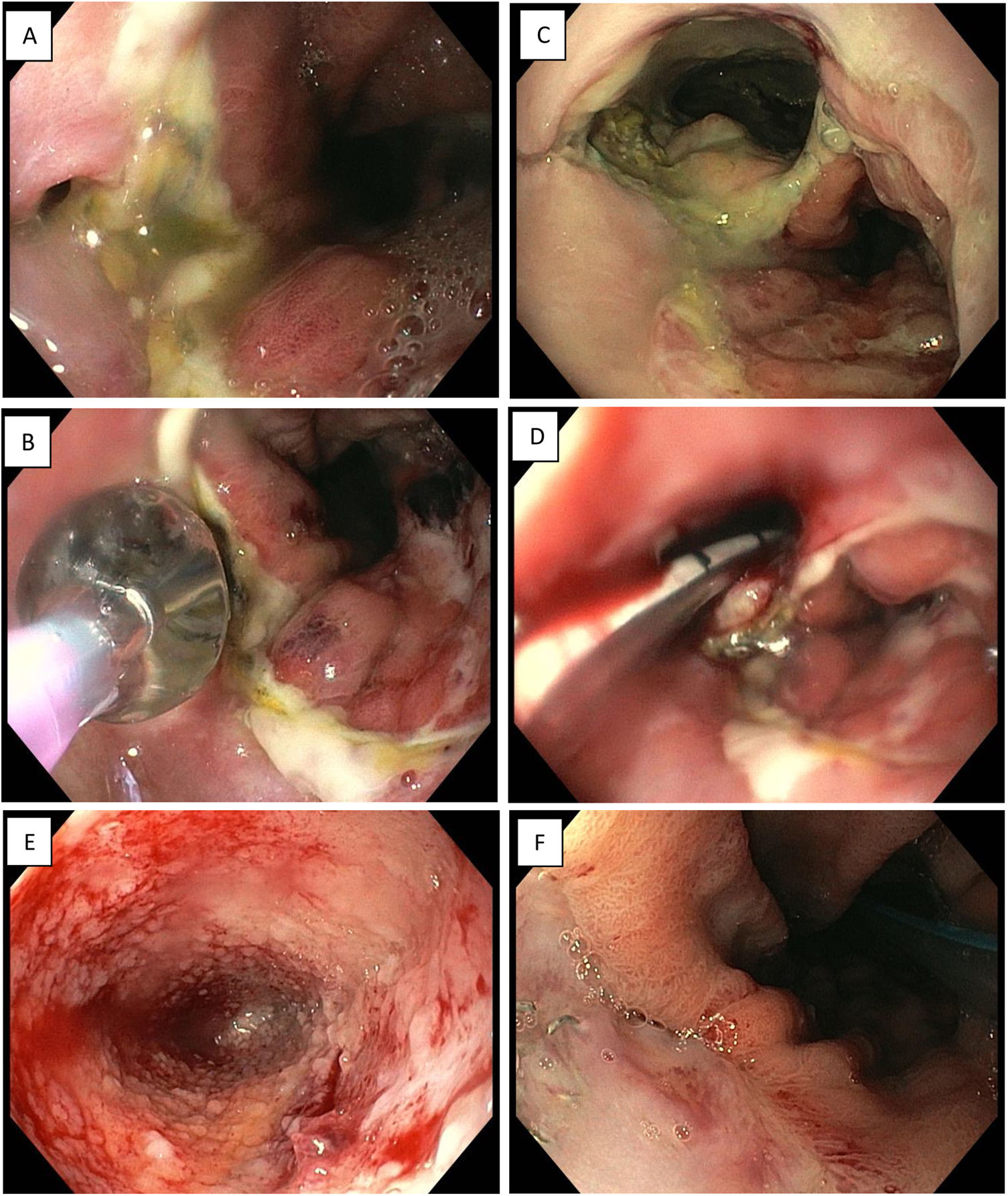
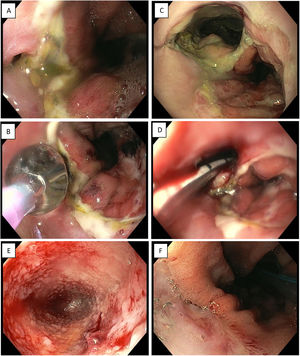
Terapia de vacío endoscópica en dehiscencia de sutura anastomótica tras cirugía tipo Ivor-Lewis. A) Pequeño defecto a nivel anastomótico. B) Dilatación con balón del orificio de la dehiscencia. C) Acceso a cavidad infectada. D) Inserción de Eso-SPONGE. E) Limpieza de la cavidad y formación de tejido de granulación (imagen tras recambio de 3.a esponja). F) Resolución de la dehiscencia anastomótica (después de 6 esponjas).
Los datos están expresados como recuento (porcentaje) para las variables categóricas. Para las variables continuas se expresan mediante la media±desviación típica si la distribución asume normalidad y mediante la mediana (rango, mínimo-máximo) si no cumple dicha hipótesis. El software usado fue el SPSS Statitistical Package 2020.
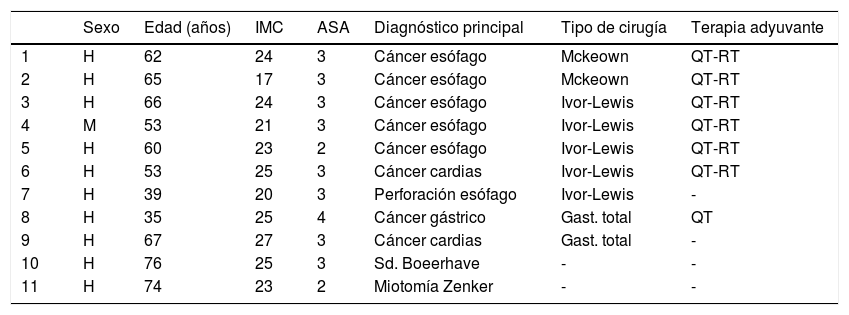
ResultadosEntre abril de 2017 y febrero de 2019, 11 pacientes (10 hombres y una mujer) con una edad media±desviación estándar de 59±13años fueron sometidos a TVE como tratamiento de una dehiscencia de sutura anastomótica tras esofaguectomía (n=7), gastrectomía (n=2), como tratamiento de una perforación esofágica tras septomiotomía endoscópica por un divertículo de Zenker (n=1) y tras una perforación esofágica espontánea o síndrome de Boerhaave (n=1). Siete de los pacientes habían recibido tratamiento neoadyuvante con quimioterapia o quimio-radioterapia antes de la resección quirúrgica. Las características individuales de los pacientes quedan reflejadas en la tabla 1.
Características de los pacientes incluidos en el estudio
| Sexo | Edad (años) | IMC | ASA | Diagnóstico principal | Tipo de cirugía | Terapia adyuvante | |
|---|---|---|---|---|---|---|---|
| 1 | H | 62 | 24 | 3 | Cáncer esófago | Mckeown | QT-RT |
| 2 | H | 65 | 17 | 3 | Cáncer esófago | Mckeown | QT-RT |
| 3 | H | 66 | 24 | 3 | Cáncer esófago | Ivor-Lewis | QT-RT |
| 4 | M | 53 | 21 | 3 | Cáncer esófago | Ivor-Lewis | QT-RT |
| 5 | H | 60 | 23 | 2 | Cáncer esófago | Ivor-Lewis | QT-RT |
| 6 | H | 53 | 25 | 3 | Cáncer cardias | Ivor-Lewis | QT-RT |
| 7 | H | 39 | 20 | 3 | Perforación esófago | Ivor-Lewis | - |
| 8 | H | 35 | 25 | 4 | Cáncer gástrico | Gast. total | QT |
| 9 | H | 67 | 27 | 3 | Cáncer cardias | Gast. total | - |
| 10 | H | 76 | 25 | 3 | Sd. Boeerhave | - | - |
| 11 | H | 74 | 23 | 2 | Miotomía Zenker | - | - |
ASA: clasificación de riesgo anestésico; Gast: gastrectomía; H: hombre; IMC: índice de masa corporal; M: mujer; QT: quimioterapia; RT: radioterapia.
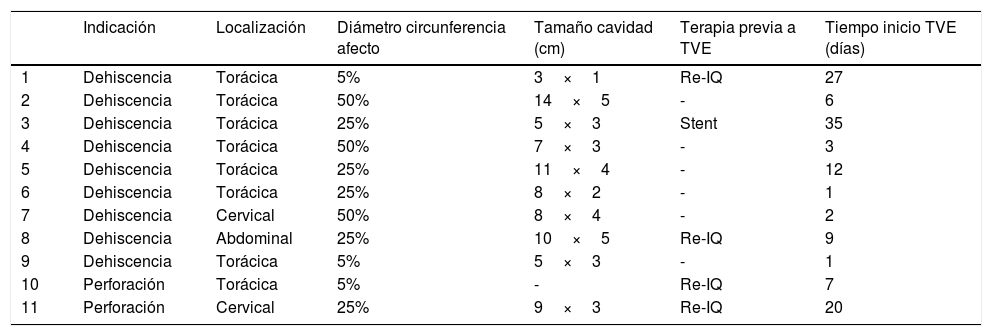
La dehiscencia anastomótica fue diagnosticada una mediana (mínimo-máximo) de 5 (1-28) días tras la cirugía. Cuatro (36%) pacientes fueron reintervenidos y en otro se colocó un stent esofágico antes de ser sometidos a TVE por falta de eficacia de dichos tratamientos. Las características de los defectos y los hallazgos endoscópicos quedan reflejados en la tabla 2.
Tipo de defecto y hallazgos endoscópicos
| Indicación | Localización | Diámetro circunferencia afecto | Tamaño cavidad (cm) | Terapia previa a TVE | Tiempo inicio TVE (días) | |
|---|---|---|---|---|---|---|
| 1 | Dehiscencia | Torácica | 5% | 3×1 | Re-IQ | 27 |
| 2 | Dehiscencia | Torácica | 50% | 14×5 | - | 6 |
| 3 | Dehiscencia | Torácica | 25% | 5×3 | Stent | 35 |
| 4 | Dehiscencia | Torácica | 50% | 7×3 | - | 3 |
| 5 | Dehiscencia | Torácica | 25% | 11×4 | - | 12 |
| 6 | Dehiscencia | Torácica | 25% | 8×2 | - | 1 |
| 7 | Dehiscencia | Cervical | 50% | 8×4 | - | 2 |
| 8 | Dehiscencia | Abdominal | 25% | 10×5 | Re-IQ | 9 |
| 9 | Dehiscencia | Torácica | 5% | 5×3 | - | 1 |
| 10 | Perforación | Torácica | 5% | - | Re-IQ | 7 |
| 11 | Perforación | Cervical | 25% | 9×3 | Re-IQ | 20 |
Re-IQ: reintervención quirúrgica; TVE: terapia de vacío endoscópica.
De mediana, la TVE se inició a los 7 (1-35) días de la cirugía inicial, 20 (7-35) días en aquellos casos en los que se realizó un tratamiento previo a TVE, y 2 (1-12) días en los que la TVE fue la terapia inicial. En 10 casos se realizó terapia intracavitaria y en un caso terapia intraluminal. La mediana de esponjas colocadas fue de 7 (1-14) y el intervalo de recambio de las esponjas fue de 3,7 (2-5) días. La mediana de duración de la TVE fue de 28 (5-48) días para las dehiscencias de sutura, 5 días para el síndrome de Boerhaave y 26 días para la perforación tras septomiotomía endoscópica de Zenker (tabla 3).
Características de la TVE, eficacia y eventos adversos
| Tipo TVE | N.o esponjas | Duración TVE (días) | Estancia hospitalaria (días) | Cierre defecto | Éxito clínico | Eventos adversos | |
|---|---|---|---|---|---|---|---|
| 1 | IC | 2 | 12 | 59 | Sí | Sí | - |
| 2 | IC | 7 | 34 | 90 | Sí | Sí | Estenosis |
| 3 | IC | 13 | 46 | 49 | Sí | No | - |
| 4 | IC | 6 | 30 | 41 | Sí | Sí | Estenosis |
| 5 | IC | 9 | 29 | 31 | Sí | Sí | - |
| 6 | IC | 6 | 20 | 34 | Sí | Sí | - |
| 7 | IC | 14 | 35 | 45 | No | No | Estenosis |
| 8 | IC | 14 | 49 | 75 | Sí | Sí | - |
| 9 | IC | 3 | 10 | 26 | Sí | Sí | Empiema |
| 10 | IL | 1 | 5 | 10 | Sí | Sí | - |
| 11 | IC | 7 | 26 | 54 | Sí | Sí | Dolor |
IC: intracavitaria; IL: intraluminal; TVE: terapia de vacío endoscópica.
De los 11 pacientes, 3 recibieron nutrición parenteral, 7 nutrición a través de yeyunostomía y uno fue nutrido mediante una sonda enteral. Cuatro pacientes tuvieron que ser ingresados en la unidad de cuidados intensivos (UCI) durante el tratamiento y 3 de ellos requirieron ventilación mecánica. Nueve (81%) pacientes requirieron la colocación de un drenaje pleural como tratamiento adicional de un empiema.
La mediana de estancia hospitalaria desde el inicio de la TVE fue de 45 (10-90) días para el global de los pacientes. De forma desglosada, fue de 45 (26-90) días en los casos de dehiscencia anastomótica, de 10 días en el caso de síndrome de Boerhaave y de 54 días en el caso de la perforación tras septomiotomía de divertículo de Zenker (tabla 3).
En 10 casos (91%) se consiguió el cierre del defecto; en 7 (63%) casos tras tratamiento únicamente con TVE y en 2 (18%) casos añadiendo un tratamiento al final de la TVE. En estos 2 pacientes, una vez realizado el tratamiento con TVE y presentando la cavidad un aspecto limpio y tejido de granulación, pero todavía unas dimensiones considerables y un orificio de entrada a la cavidad de pequeño tamaño que no permitía la colocación intracavitaria de la esponja, se decidió colocar un stent plástico tipo doble pigtail junto a un clip tipo OVESCO y una sonda nasogástrica, respectivamente, para mantener el drenaje interno hasta el cierre completo de la cavidad.
En un (9%) paciente la TVE no consiguió la resolución de la dehiscencia. Este paciente fue sometido a terapia intracavitaria colocándose un total de 14 esponjas en un período de 35días, con práctica resolución de la dehiscencia quedando una cavidad residual de unos 2×1cm y con buena evolución clínica. Sin embargo, a la semana de haber terminado la TVE, se realizó una endoscopia que objetivó un crecimiento de la cavidad y un tránsito que objetivó una fuga de pequeño calibre. En este paciente se consiguió el cierre de la fuga tras la colocación de 2 stents esofágicos consecutivos.
ComplicacionesCinco (45%) pacientes presentaron algún tipo de evento adverso, ninguno de ellos grave o fatal; 3 (27%) pacientes presentaron una estenosis a nivel de la anastomosis una mediana de 116 (50-207) días después de haber terminado la TVE. En 2 casos las estenosis se resolvieron tras una única sesión de dilatación, mientras que el tercer paciente se encuentra actualmente bajo régimen de dilataciones periódicas. El paciente con septomiotomía endoscópica de Zenker presentó dolor retrofaríngeo moderado durante el tratamiento que se resolvió con analgésicos y que probablemente estuviera en relación con la propia perforación. Otro paciente presentó neumonía y empiema pleural 10días después de iniciada la TVE, que se controló con antibióticos y colocación de un drenaje pleural (tabla 3).
La mortalidad hospitalaria fue de 17% (n=2). Un paciente presentó resolución de la cavidad tras la colocación de 13 esponjas durante 46días, comprobada mediante gastroscopia y TC con contraste oral. Sin embargo, presentó una mala evolución clínica y falleció a las 48h de la retirada de la última esponja como consecuencia de las complicaciones sépticas (neumonía e insuficiencia respiratoria) relacionadas con la dehiscencia de sutura. En este caso, se evidenció además progresión local de la neoplasia diagnosticada por biopsia endoscópica. Otro paciente con historia médica de coronariopatía murió como resultado de un evento isquémico cardíaco agudo 9días después de haber terminado la TVE. La necropsia identificó un cierre completo de la dehiscencia de sutura esofágica sin signos locales o sistémicos inflamatorios.
En el seguimiento a largo plazo, 2 pacientes fallecieron debido a la progresión de su enfermedad neoplásica 156 y 345días tras ser dados de alta, respectivamente. El seguimiento global medio de la muestra fue de 87días (3-455 días).
DiscusiónLas perforaciones esofágicas ya sean espontáneas o de causa iatrogénica están relacionadas con una alta mortalidad que puede llegar hasta un 20%1. Por otro lado, la incidencia de fugas anastomóticas tras cirugía esofágica o gástrica varía entre un 3-30% y un 3-11% respectivamente2–4 y se asocia con una elevada mortalidad postoperatoria que puede alcanzar hasta un 50% según las series5,6. El tratamiento de las mismas continúa siendo un reto, teniendo en cuenta que la reintervención quirúrgica conlleva una alta morbimortalidad (20-30%)5,6. Con el avance de la endoscopia digestiva, múltiples tratamientos endoscópicos menos invasivos han sido utilizados para tratar a estos pacientes. Los clips endoscópicos que se utilizan a través del canal de trabajo (TTS) son útiles para el cierre de perforaciones agudas de pequeño tamaño, mientras que los clips premontados sobre un capuchón (tipo OVESCO) se utilizan en perforaciones con márgenes evertidos o en fugas anastomóticas de pequeño tamaño. Los sistemas de sutura endoscópicos son técnicamente complejos y solamente han sido utilizados en casos seleccionados7. La colocación de prótesis (stents) metálicas total o parcialmente recubiertas es la terapia endoscópica que ha alcanzado una mayor eficacia y aplicabilidad para el cierre de los defectos anastomóticos del tracto digestivo superior y se considera el tratamiento endoscópico de elección en estos pacientes. Sin embargo, la eficacia de las prótesis continúa siendo limitada, con un índice de cierre de la fuga anastomótica que varía entre un 44 y un 80%8,9. Además, se asocian con una tasa no despreciable de eventos adversos (15-50%) tales como la migración, la estenosis, el sangrado y de manera más rara la perforación secundaria a necrosis inducida por la propia prótesis8–10.
La TVE para el cierre de defectos del tracto gastrointestinal superior se publicó por primera vez con éxito en el año 200811. Consiste en la colocación por vía endoscópica de una esponja insertada en el extremo de un drenaje multiperforado que a su vez se conecta a una bomba de presión negativa con aspiración continua. La TVE ofrece como ventaja teórica principal sobre las prótesis endoscópicas que además de «sellar» la cavidad también la drena, de manera que consigue limpiar la infección, estimula la aparición de tejido de granulación y cierra por segunda intención el defecto gastrointestinal. Otra ventaja respecto de las prótesis es que puede utilizarse en defectos localizados en el esófago cervical. Además no requiere el uso de fluoroscopia, lo que la hace más accesible a pacientes que están en una unidad de cuidados intensivos. Una reciente revisión12 que incluye todos los estudios observacionales con más de 5 pacientes demostró una eficacia global del 87% (60-100%) en un total de 422 pacientes sometidos a TVE de defectos del tracto gastrointestinal superior. La mayor parte de los pacientes presentaron dehiscencias de sutura o perforaciones esofágicas, mientras que una pequeña parte recibieron TVE para tratamiento de perforaciones o dehiscencias de sutura localizadas en el estómago o duodeno. Por otro lado, también se ha utilizado recientemente con éxito de manera preventiva en casos en los que la anastomosis presenta algún factor de riesgo como por ejemplo isquemia o incluso para promover la correcta cicatrización durante el propio acto quirúrgico13.
En nuestro estudio conseguimos el cierre del defecto en 10 de los 11 pacientes incluidos. Uno de estos 10 pacientes falleció 48h después de finalizar la TVE como consecuencia de las complicaciones sépticas relacionadas con la dehiscencia de sutura, por lo que aunque se consiguió el cierre del defecto, podríamos concluir que el éxito clínico se consiguió en 9 de los 11 casos incluidos (82%), lo que está en consonancia con los datos publicados. Cabe resaltar que en 2 casos se realizó un drenaje interno mediante la colocación de una sonda nasogástrica y una prótesis plástica tipo pigtail junto a un clip tipo OVESCO una vez finalizada la TVE. Algunos estudios describen el uso de clips o colocación de drenajes internos como tratamiento de primera línea de cierre de defectos o complementario una vez se ha finalizado el tratamiento con TVE14–16. La utilidad de añadir estas terapias una vez la cavidad ha sido drenada completamente y se ha conseguido la formación de tejido de granulación no queda bien establecida y en la mayoría de los casos publicados se consigue el cierre por segunda intención de la cavidad, independientemente del tamaño de la misma, solamente con la TVE sin necesidad de añadir otras terapias endoscópicas.
En nuestro estudio todos los pacientes excepto uno recibieron terapia intracavitaria. En 2 de los 3 pacientes que presentaron orificios de pequeño tamaño se optó por dilatar el defecto con un balón para luego llevar a cabo terapia intracavitaria, mientras que en el otro paciente se realizó terapia intraluminal. El beneficio teórico de la terapia intracavitaria sería un mejor drenaje de la colección y mejor estimulación de la formación del tejido de granulación, de manera que estaría especialmente indicada en aquellos casos en los que se evidencia una cavidad extraluminal infectada. De todas maneras, no hay datos suficientes para afirmar que la terapia intracavitaria sea superior a la terapia intraluminal11,12,17. Por otro lado, cabe destacar que en muchos de los casos publicados donde se realizó terapia intraluminal se utilizaron unas esponjas «self made» de hasta 12cm de longitud, lo que podría determinar una mayor facilidad de aplicación y mayor eficacia en caso de terapia intraluminal que mediante el uso de Eso-SPONGEr (B-Braun) que presenta una longitud de menor tamaño (5,5cm). Recientemente una publicación que incluye un total de 16 pacientes reporta el uso de nuevos materiales de drenaje de poro abierto más finos y de pequeño calibre que podría facilitar la TVE mediante su colocación a través de orificios de pequeño tamaño sin necesidad de dilatar el orificio18.
La mediana de duración de la TVE en nuestro estudio fue de 28 días, ligeramente superior a lo recogido en la literatura, que es de 17 días, pero dentro de los rangos publicados (11-36 días)12,17. Como en toda técnica, existe una curva de aprendizaje que podría explicar este hecho. Entre los factores que se han asociado a mayor eficacia de la TVE está el inicio temprano de la terapia7,19. Esto también se observa en nuestro estudio, donde la media de retraso de la aplicación de TVE en los pacientes en los que la terapia no fue exitosa fue de 18 días, mientras que en los pacientes en los que se consiguió el cierre fue de 9 días.
La tasa global de eventos adversos publicada en relación con TVE es del 0-14%16,20–25. De todos ellos el más frecuente es la estenosis, con una frecuencia media del 7,6% (3-14%)16,21,25. La relación de causalidad del tratamiento con TVE y la aparición de la estenosis no está bien establecida, dado que también está descrita en otros pacientes que desarrollan una dehiscencia anastomótica resuelta mediante cirugía u otras técnicas endoscópicas21. En nuestro estudio, 3 (27%) pacientes presentaron estenosis a nivel de la anastomosis. Es interesante resaltar que estos 3 pacientes fueron los que presentaron un mayor porcentaje afecto (50%) de la circunferencia anastomótica. Dos de los casos se resolvieron tras una única sesión de dilatación y el otro presentó una estenosis refractaria. Este último paciente fue el que no respondió a TVE y que resolvió la fuga tras la colocación de 2 stents, a pesar del teórico efecto preventivo de los stents sobre la aparición de estenosis. Por lo tanto, parece bastante probable que exista un componente individual y otros factores no bien establecidos que puedan predisponer a la aparición de esta complicación en pacientes con fuga anastomótica más allá de la terapia endoscópica utilizada.
Se ha publicado hasta la fecha una tasa global de hemorragia grave y/o fatal de alrededor del 1% secundaria a tratamiento con TVE16,24,26. Esto ocurriría debido a la reacción inflamatoria local de la esponja que conllevaría la erosión y finalmente rotura de la pared de alguna estructura vascular de pequeño o incluso de gran calibre como la aorta o el corazón. Ninguno de nuestros 11 pacientes presentó ningún episodio de hemorragia en el total de 82 esponjas colocadas. Aunque no existe una manera completamente segura de prevenir esta complicación, algunos autores recomiendan la realización de una TC tras la colocación de la primera esponja para descartar el posicionamiento del extremo de la misma cercano o adyacente a alguna de las estructuras vasculares mediastínicas. Además, se considera una contraindicación llevar a cabo la TVE en pacientes con alteración de la coagulación, trombocitopenia severa y que estén bajo tratamiento con anticoagulantes y/o antiagregantes. En este sentido, la aparición reciente de nuevos materiales de drenaje de poro abierto más finos y de pequeño calibre18 podría disminuir los eventos adversos como la hemorragia secundaria al daño de estructuras vasculares vecinas, si bien se necesita realizar estudios para verificar esta hipótesis.
No hay datos suficientes acerca de cómo hay que nutrir a estos pacientes durante la TVE. Parece razonable pensar que la nutrición enteral mediante una sonda nasal debería ser de elección. Sin embargo, cabe resaltar que esto puede aumentar el malestar producido por la propia sonda de TVE y por ello muchos de los casos publicados, así como ocurre en los pacientes de nuestra serie, se nutrían a través de una yeyunostomía o nutrición parenteral. Algunos autores integran una sonda de nutrición enteral en la sonda de la esponja o utilizan sondas de 3 luces para facilitar la nutrición27,28. Por otro lado, tampoco sabemos si sería posible llevar a cabo nutrición oral en estos pacientes dado que la TVE podría prevenir la entrada de saliva o alimentos en el interior de la cavidad, por lo que este aspecto concreto debería evaluarse en próximos estudios.
Hasta la fecha solamente 4 estudios15,20,22,23 que incluyen un total de 163 pacientes (71 en el grupo TVE y 92 en el grupo de prótesis endoscópicas) han comparado de manera retrospectiva la TVE y la colocación de prótesis endoscópicas para el cierre de fugas anastomóticas tras cirugía de esófago o estómago, siendo el éxito clínico significativamente superior en el grupo sometido a TVE (89% vs. 59%). Estos estudios también demostraron una menor tasa de eventos adversos graves e incluso de mortalidad intrahospitalaria a favor de la TVE en una reciente revisión sistemática y metaanálisis29. Sin embargo, estos datos deben ser tomados con cautela debido a que se trata de estudios retrospectivos, observacionales, no controlados, con marcada heterogeneidad y que incluyen pocos pacientes. Sin duda, es necesaria la realización de ensayos clínicos aleatorizados para determinar el verdadero papel de la TVE en comparación con la implantación de prótesis metálicas.
ConclusiónLa TVE es un tratamiento eficaz y seguro de las perforaciones y fugas anastomóticas del tracto digestivo superior y especialmente del esófago. La aplicación temprana de la TVE podría mejorar su eficacia. Es necesario realizar ensayos clínicos para determinar el verdadero papel de esta terapia en comparación con otras terapias y especialmente con la terapia endoscópica de referencia hasta la fecha que es la implantación de prótesis metálicas.
Conflicto de interesesDr. Oriol Sendino es consultor para la compañía B. Braun.
Dr. Dulce Momblán es consultora para la compañía B. Braun.
No hay otros conflictos de interés.