El incremento en las infecciones de transmisión sexual por Chlamydia trachomatis, incluyendo el linfogranuloma venéreo, y Mycoplasma genitalium registrado en la última década plantea nuevos retos para mejorar su control y reforzar su prevención. El diagnóstico clínico habitual (uretritis/cervicitis) debe completarse con una búsqueda activa de la infección en varones con disuria o proctitis, mujeres con enfermedad inflamatoria pélvica y contactos asintomáticos. El diagnóstico microbiológico debe basarse en técnicas moleculares, capaces de detectar Chlamydia trachomatis (diferenciando el genotipo L para linfogranuloma venéreo) y Mycoplasma genitalium (incluyendo idealmente la detección de cepas resistentes a macrólidos). Un diagnóstico más rápido y específico permitirá un tratamiento dirigido con la pauta antibiótica idónea. El manejo de estas infecciones de transmisión sexual debe incluir un estudio de los contactos sexuales y en ocasiones un test de cura. Finalmente, deben ser valorados los cribados de infección en grupos de población con mayor prevalencia.
Sexually transmitted infections caused by Chlamydia trachomatis, including lymphogranuloma venereum and Mycoplasma genitalium have increased in last decade. This epidemiological scenario presents new challenges in order to improve and strengthen our control and prevention strategies. The routine clinical diagnosis of urethritis and cervicitis must be combined with the active search for the causal agent in men with symptoms of dysuria or proctitis, and in women with pelvic inflammatory disease. We should also include sexually transmitted infections screening in asymptomatic patients with sexual risk behaviours or sexual contact with patients diagnosed with an sexually transmitted infection. The microbiological diagnosis must be based on molecular techniques capable of detecting Chlamydia trachomatis (discriminating between L genotypes associated with lymphogranuloma venereum and other genotypes) and Mycoplasma genitalium (ideally including the identification of macrolide-resistant strains). A faster and specific diagnosis will allow for a targeted treatment with a suitable antibiotic regimen. We also recommend including contact tracing of sexual partners and, occasionally, a cure test. Finally, sexually transmitted infection screening must be widely implemented in those population groups with a high prevalence of sexually transmitted infections.
Durante la última década, el manejo de las infecciones de transmisión sexual (ITS) por Chlamydia trachomatis (C. trachomatis) y Mycoplasma genitalium (M. genitalium) está experimentando un creciente protagonismo por diversos motivos, entre los que destacan: a) aumento de su incidencia; b) incremento en la demanda diagnóstica; c) nuevas manifestaciones clínicas relacionadas con estas ITS; d) mejora de los métodos diagnósticos; e) descripción de resistencias antibióticas en M. genitalium; f) cribados de infección por C. trachomatis.
Desde principios del presente siglo, el aumento registrado en la incidencia de las ITS ha sido debido en parte a una relajación de los aspectos preventivos durante las relaciones sexuales como consecuencia del éxito en la terapia antiviral frente al VIH. Esta relajación se constata en el incremento en las conductas sexuales de riesgo (sexo sin preservativo) en algunos sectores de la población como jóvenes o determinados grupos de hombres que tienen sexo con hombres (HSH). Este aumento de las ITS también se ha visto favorecido por el amplio uso de las redes sociales que facilitan los contactos sexuales y por el uso de drogas recreativas durante el acto sexual (chemsex). Por lo tanto, es fundamental reforzar la prevención primaria (educación sexual y divulgación de campañas de utilización del preservativo) y valorar la introducción de cribados de ITS en función de su prevalencia según grupos de edad, sexo y/o conducta sexual.
El diagnóstico de una ITS puede ser abordado desde distintas especialidades médicas (Atención Primaria, Dermatología, Ginecología, Urología, Oftalmología, Pediatría, Urgencias, además de Enfermedades infecciosas y Microbiología), en función de sus manifestaciones clínicas, sexo y edad. Es conveniente recordar la importancia de una búsqueda activa de la infección en casos de disuria en hombres jóvenes con leucocituria y urocultivo negativo, mujeres jóvenes con dolor abdominal de probable origen ginecológico, proctitis en HSH, etc. Una consideración general en el diagnóstico de las ITS por C. trachomatis y M. genitalium es que su sintomatología puede ser indistinguible de otras ITS. Por ello es recomendable la implementación de plataformas diagnósticas que permitan la detección simultánea de otros patógenos como Neisseria gonorrhoeae (N. gonorrhoeae), Ureaplasma urealyticum y Trichomonas vaginalis, entre otras. También es aconsejable obtener una muestra de suero para descartar otras ITS (VIH, sífilis…).
En los casos sintomáticos, la ausencia en la tinción de Gram de diplococos gramnegativos permite con alta probabilidad excluir una ITS gonocócica, e iniciar tratamiento empírico con doxiciclina o azitromicina según recomendaciones de las principales guías1,2. La descripción en M. genitalium de tasas variables y crecientes de resistencia a los macrólidos ha cuestionado el empleo de azitromicina como tratamiento empírico en las uretritis no gonocócicas, si bien las tasas de respuesta clínica a la doxiciclina descritas para este microorganismo son también bajas. El desarrollo de técnicas de amplificación de ácidos nucleicos (TAAN) ha supuesto una mejora diagnóstica importante en sensibilidad y tiempo de respuesta respecto de las técnicas de cultivo y técnicas inmunológicas empleadas anteriormente. Las TAAN comerciales están disponibles en distintos formatos que permiten detectar, en una sola reacción, dianas de ADN de varios microorganismos (C. trachomatis, M. genitalium, N. gonorrhoeae, Ureaplasma urealyticum, etc.). Las TAAN permiten también identificar el genotipo L de C. trachomatis en pacientes con factores de riesgo y adecuar la pauta antibiótica con doxiciclina. Además, pueden ser de gran utilidad en la detección rápida de mutaciones asociadas con resistencia a macrólidos en M. genitalium, permitiendo un tratamiento dirigido con la pauta más adecuada que mejore la respuesta clínica y reduzca la posibilidad de transmisión.
Finalmente, una parte fundamental del manejo de estas ITS es el control de contactos para cortar la cadena de transmisión y evitar nuevas infecciones. Deben ser diagnosticadas y tratadas todas las parejas sexuales en los 2-3 meses previos al inicio de los síntomas del caso índice. Cuando se considere que la asistencia a las parejas sexuales va a ser poco probable, se puede optar por la «terapia de pareja facilitada», que consiste en proporcionar el tratamiento al paciente índice para que este se lo entregue/facilite a su(s) pareja(s).
En el presente capítulo, se revisarán separadamente los diferentes matices que pueden presentar las ITS por C. trachomatis, incluido el linfogranuloma venéreo (LGV), y M. genitalium en su epidemiología, clínica, diagnóstico, tratamiento y prevención necesarios para su conocimiento general, procurando hacer hincapié en aquellos aspectos prácticos que nos parecen más importantes para mejorar el manejo y control de las ITS en España.
Chlamydia trachomatisEpidemiologíaC. trachomatis es la primera causa bacteriana de ITS y se estima que cada año se producen más de 130 millones de nuevas infecciones en el mundo3. En Europa, en 2016, se declararon 403.807 casos de esta infección, con una tasa global de 185/100.000 habitantes, siendo la incidencia mayor en heterosexuales y mujeres, especialmente en las de 20-24 años (1.745/100.000)4. En los últimos años se observa una tendencia estable en la incidencia global, si bien existen marcadas diferencias en su declaración (más de 5.000 veces entre la máxima y mínima) entre los distintos sistemas nacionales de vigilancia, por lo que la incidencia global puede estar subestimada.
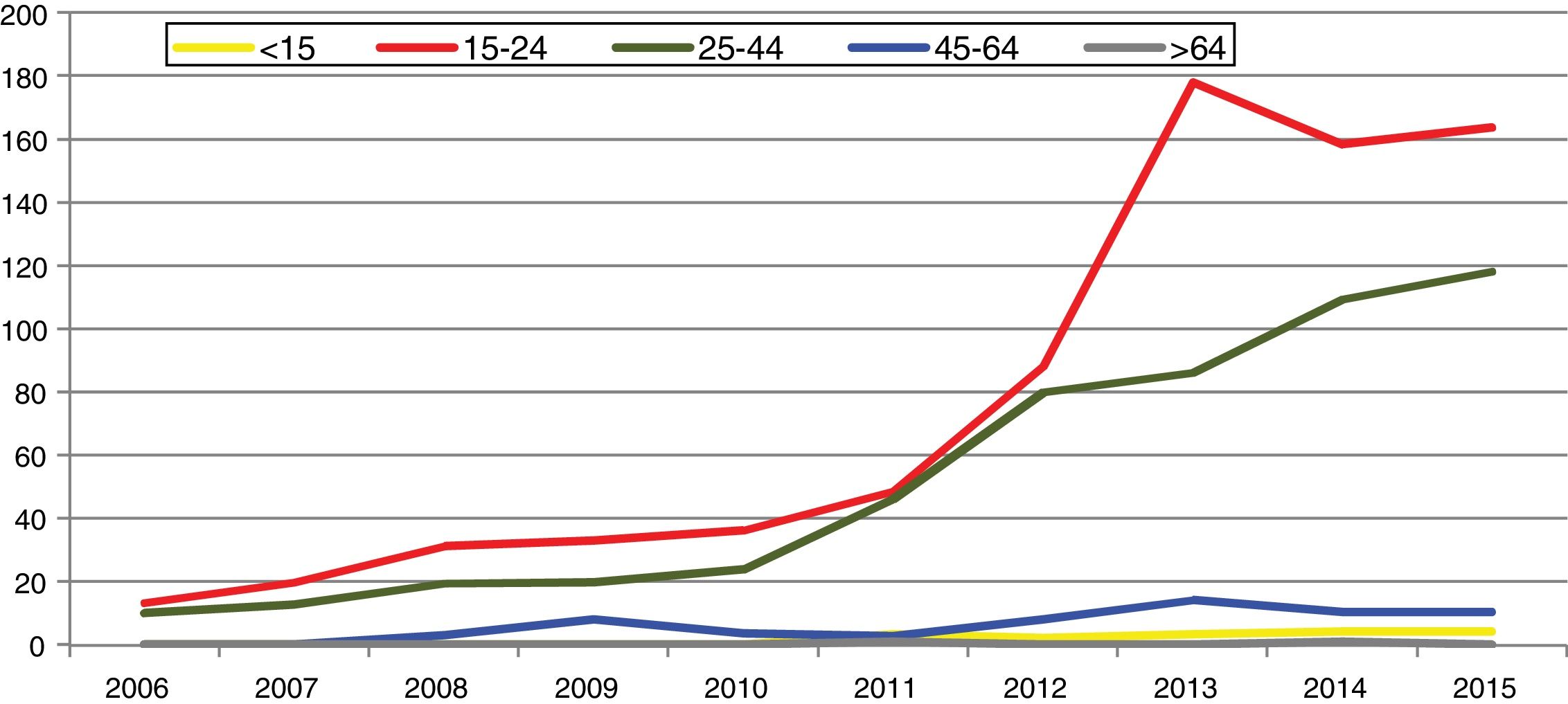
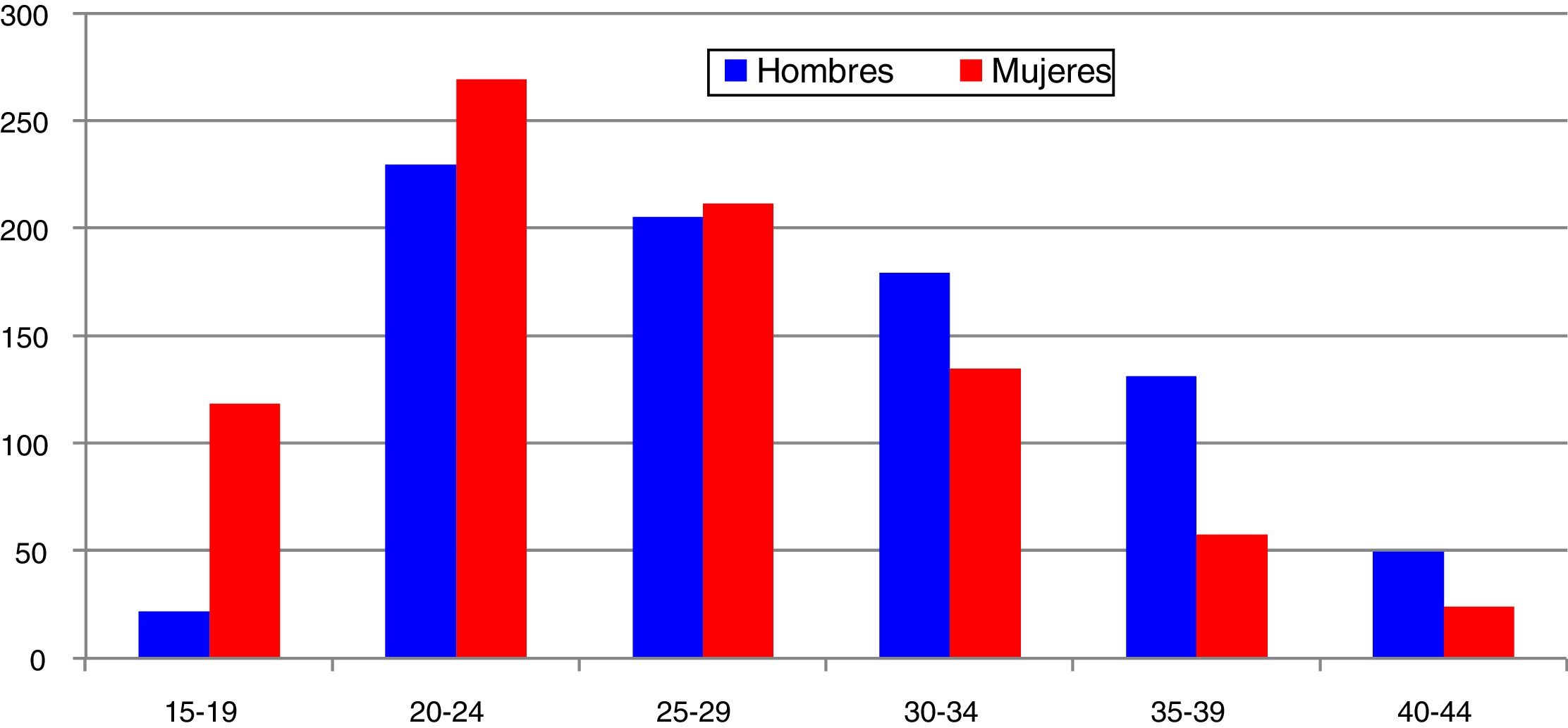
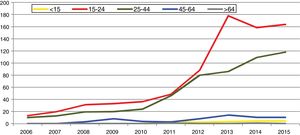
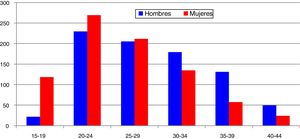
En España, desde 2016 la infección por C. trachomatis es una enfermedad de declaración obligatoria. Esta primera declaración, recientemente publicada, muestra la ausencia de datos en alguna comunidad autónoma y una baja tasa global (15,48/100.000) con importantes diferencias entre las comunidades declarantes debido a la subdeclaración (≤ 1/100.000) en varias de ellas5. El cumplimiento y la mejora de la vigilancia epidemiológica de esta infección facilitará analizar la evolución de su incidencia y que la información obtenida sea comparable entre comunidades autónomas y diferentes países. Los datos de incidencia registrados en Gipuzkoa en los últimos años indican una tendencia ascendente, especialmente en los grupos de edad jóvenes, siendo máxima en las mujeres de 20 a 24 años (269/100.000) (https://addi.ehu.es/handle/10810/20049, figuras 1 y 2).
Conocer la prevalencia de la infección por C. trachomatis en la población general, con especial interés en gestantes, personas jóvenes y grupos con prácticas de riesgo, es un paso esencial para el diseño de programas de control de la infección en cada área geográfica. La prevalencia obtenida en estudios realizados en diferentes países oscila entre el 1 y 10%, encontrándose la más alta entre mujeres jóvenes sexualmente activas (>10% en menores de 20-22 años). En España, la prevalencia en puérperas de Gipuzkoa (2011-2015) fue globalmente del 1%, siendo del 6,4% en las menores de 25 años y del 1,9% en las de origen inmigrante6. En otro estudio realizado en Asturias (noviembre/2010-diciembre/2011), la prevalencia en jóvenes de 20-24 años fue también elevada: del 4,8% en mujeres y del 4,5% en hombres7.
Otros datos de interés en la epidemiología de la infección por C. trachomatis son su estacionalidad (mayor demanda diagnóstica y casos positivos en periodos posvacacionales) y la distribución de sus genotipos en función de la conducta sexual. Coincidiendo con otros estudios europeos, en España ha sido referido que los genotipos E y F son más frecuentes en mujeres y hombres heterosexuales, y los genotipos D, G, J y L2 en HSH8. A pesar de ser el genotipo E el más frecuente (41%), la detección de la nueva variante de C. trachomatis, nvCt (cepa del genotipo E con una deleción de 377pb en el plásmido críptico que emergió en Suecia en 2006) en nuestro país ha sido anecdótica.
ClínicaDebido a las especiales características de este microorganismo intracelular (ciclo de división bifásico, metabolismo lento) y a su interacción con la respuesta inmune del huésped, su infección pasa frecuentemente desapercibida (hasta un 50% de los casos en hombres y un 70-80% en mujeres)9. Las principales manifestaciones clínicas de la infección son cervicitis en mujeres y uretritis en hombres, y los síntomas comienzan habitualmente 2-6 semanas después de la infección. La secreción normalmente es mucosa y menos abundante y purulenta que en la infección por N. gonorrhoeae. En mujeres, disuria y polaquiuria son infrecuentes, pero en hombres pueden estar presentes hasta en un 50% de los casos. En estos puede aparecer un dolor irradiado a epidídimo, y en mujeres un dolor hipogástrico que puede deberse a enfermedad inflamatoria pélvica (EIP). Dependiendo de las prácticas sexuales, pueden estar presentes otros síntomas locales (faríngeos, rectales, conjuntivales). Los genotipos A, B, y C son la causa del tracoma (conjuntivitis folicular crónica), aunque han sido referidos ocasionalmente en infecciones genitales10.
Sin un diagnóstico preciso y rápido, las infecciones no tratadas (asintomáticas o sintomáticas), se diseminan con facilidad entre la población sexualmente activa. Además, en un 50% de los casos las infecciones persisten durante meses, lo que favorece el desarrollo de complicaciones para la salud reproductiva y secuelas como consecuencia de la respuesta inmune9. En el varón pueden ocasionar prostatitis, vesiculitis, orquiepididimitis y finalmente esterilidad. En la mujer endometritis, salpingitis o EIP. El riesgo de EIP en mujeres infectadas por C. trachomatis y no tratadas se ha estimado en torno a un 15%11. La inespecificidad de la sintomatología de esta enfermedad hace que puedan ser necesarias varias consultas hasta alcanzar su diagnóstico y que algunos casos puedan quedar sin él. La EIP puede conducir a secuelas en un 10-20% de las pacientes, principalmente infertilidad y embarazo ectópico12.
Por otra parte, C. trachomatis puede causar ocasionalmente artritis reactiva asociada a HLA-B27 (acompañada a veces de sintomatología ocular y/o dérmica) y perihepatitis. Finalmente, durante la gestación, estas infecciones se han asociado con rotura prematura de membranas, parto prematuro, bajo peso del recién nacido y aborto. Las mujeres pueden infectar al neonato a través del canal del parto, causando conjuntivitis, nasofaringitis y neumonía13. La endometritis posparto también puede estar asociada con la infección por C. trachomatis.
En nuestra experiencia, en muchas ocasiones la infección puede no ser sospechada por presentar poca sintomatología o manifestaciones compartidas por otras infecciones. Por ello, queremos destacar que la rentabilidad de su diagnóstico puede mejorar mucho si, además de su investigación en los casos habituales de sospecha de una ITS, se realiza una búsqueda activa de la infección en pacientes sexualmente activos que presenten disuria con leucocituria y urocultivo negativo (varones), dolor abdominal de probable origen ginecológico (probables EIP subdiagnosticadas), y conjuntivitis que no curan tras tratamiento antibiótico habitual (además de adultos, conjuntivitis neonatal). En estudios realizados en población sexualmente activa de Gipuzkoa, C. trachomatis se detectó en un 44% de varones con sospecha clínica inicial de infección urinaria y leucocituria con urocultivo negativo, y en un 17% de mujeres con sospecha clínica de EIP (https://addi.ehu.es/handle/10810/20049).
DiagnósticoAunque existe una amplia variedad de métodos para la detección de C. trachomatis, las TAAN son las técnicas actualmente recomendadas, por su mayor sensibilidad, especificidad y rapidez diagnóstica, y deben sustituir en los laboratorios clínicos a las anteriormente empleadas basadas en la detección de antígenos o el cultivo celular. Existen diferentes TAAN comerciales, generalmente basadas en métodos de PCR multiplex y en tiempo real, lo que permite el diagnóstico rápido y simultáneo de varios microorganismos causantes de ITS. El diagnóstico se puede realizar a partir de diferentes tipos de muestras en función de la localización de la infección (exudados uretrales, cervicales, conjuntivales, faríngeos, rectales, etc.), si bien algunas no están validadas en todas las técnicas comerciales. Gracias a la elevada sensibilidad de las TAAN, en casos en que no se puedan obtener exudados uretrales o cervicales, o para la realización de cribados, pueden emplearse otras muestras de fácil obtención por el propio paciente, como autotomas vaginales u orina (10-30 primeros ml sin haber orinado el paciente en las 2h previas), sin que se hayan observado diferencias importantes en la sensibilidad o especificidad14. Las TAAN más recientes emplean cebadores y sondas específicos frente a 2 dianas diferentes, lo que permite detectar tanto la cepa salvaje como la variante sueca, nvCt, y la mayor parte de ellas también las cepas carentes de plásmido críptico (alguna plataforma tiene diseñada las 2 dianas en el plásmido críptico, por lo que no podría identificar el 1% de cepas carentes de él).
La conveniencia de un diagnóstico rápido de la infección por C. trachomatis, para solucionar el caso individual y evitar la diseminación de la infección, hace necesario que en los lugares que atienden a estos pacientes se disponga de un laboratorio de respuesta rápida equipado con TAAN donde enviar las muestras o de alguna prueba «point-of-care» (POC) para poder responder cuanto antes de la forma más adecuada al menos a los casos más sintomáticos. Las pruebas POC anteriormente disponibles, basadas en métodos inmunológicos (detección del lipopolisacárido), tenían sensibilidad y especificidad insuficientes. Actualmente existen pruebas POC basadas en métodos moleculares que detectan C. trachomatis y N. gonorrhoeae, pero con un coste elevado. El beneficio y costo-efectividad del adecuado empleo de estas técnicas motivará el desarrollo de nuevas POC que incluyan otras causas de ITS15.
Por último, otras técnicas moleculares más específicas como el genotipado mediante secuenciación del gen ompA que codifica la proteína principal de membrana externa (MOMP) o el «multi-locus sequence typing» que aporta una mayor discriminación y diferenciación entre cepas, pueden permitir profundizar en el conocimiento de la epidemiología molecular de la infección por C. trachomatis8,10.
TratamientoLas pautas estándar de tratamiento para infecciones no complicadas del tracto genital inferior consisten en una dosis de azitromicina o 2 dosis diarias de doxiciclina durante 7 días (los tratamientos recomendados en otras situaciones se muestran también en la tabla 1). Ambos regímenes han mostrado una eficacia superior al 95% en la cura microbiana de C. trachomatis, y aunque la pauta con doxiciclina puede ser algo más eficaz, su cumplimiento es menor. El tratamiento con doxiciclina durante 7 días (una dosis/día de 200mg) podría tener eficacia y seguridad comparables a la pauta habitual (100mg/12horas), y mejorar el cumplimiento del tratamiento2. Otras alternativas como eritromicina y levofloxacina están asociadas con una mayor tasa de efectos adversos.
Pautas de tratamiento antibiótico recomendadas en infecciones por C. trachomatis
| Infección | Tratamiento antibiótico |
|---|---|
| Uretritis/cervicitis | Azitromicina 1g vo 1 dosisoDoxiciclina 100mg/12h vo 7 días |
| Enfermedad inflamatoria pélvica | Cefoxitina 2g/6h iv+doxiciclina 100mg/12h vooClindamicina 900mg/8h iv+gentamicina 1,5mg/kg/8h im/iv |
| Embarazo | Azitromicina 1g vo 1 dosis |
| Ophthalmia neonatorum y neumonía infantil | Eritromicina base o etilsuccinato 50mg/kg/día (4 dosis) vo 14 días |
Fuente: Workowski et al.2.
Tras iniciar el tratamiento, los pacientes deben abstenerse de mantener contactos sexuales durante 7 días. Los test de cura no están rutinariamente recomendados si el tratamiento del caso índice ha sido adecuado, pero sí se recomiendan en gestantes y cuando existan dudas sobre el cumplimiento del tratamiento, sospechas de reinfección o persistencia de síntomas. Cuando se realice un test de cura, se deben emplear TAAN 3-5 semanas después de finalizar el tratamiento, ya que los ácidos nucleicos de C. trachomatis pueden persistir en las células hasta 3 semanas. Sin embargo, como la reinfección es frecuente en personas con infección previa por C. trachomatis, se recomienda un nuevo test de control aproximadamente 3 meses tras finalizar el tratamiento2.
La reinfección es la principal causa de los fallos clínicos al tratamiento, no habiéndose documentado cambios genéticos que confieran un fenotipo estable de resistencia antibiótica. Al ser una bacteria intracelular obligada, es improbable que C. trachomatis adquiera genes de resistencia de otras bacterias mediante transmisión horizontal. Hay pocos estudios sobre susceptibilidad antimicrobiana en C. trachomatis, con escasos aislamientos de cepas resistentes: se han descrito cepas (n=8 aislamientos clínicos) con susceptibilidad antibiótica disminuida a azitromicina y doxiciclina en pacientes con infecciones recurrentes16, así como identificado mutaciones en el gen 23S del ARNr de cepas con resistencia fenotípica a macrólidos (n=4 aislamientos clínicos)17 y en cepas sometidas en condiciones de laboratorio a concentraciones subinhibitorias de macrólidos18. En su mayor parte estas cepas presentan características de resistencia heterotípica, afectando a <1-10% de la población bacteriana potencialmente resistente (probablemente a parte de los cuerpos reticulados, su forma intracelular), y a menudo desaparece con la propagación de las bacterias (posible menor fitness), pero podría favorecer un fallo de tratamiento en pacientes con alta carga de Chlamydia19.
La conveniencia de monitorizar el desarrollo de resistencias en C. trachomatis se ve obstaculizada por la falta de pruebas estandarizadas de susceptibilidad antimicrobiana, que en la actualidad requieren cultivos celulares. Serían necesarios nuevos estudios en casos seleccionados con fallo clínico que investiguen conjuntamente la susceptibilidad antibiótica fenotípica mediante técnicas de cultivo celular y, en caso de encontrarse resistencias, posibles mutaciones genotípicas asociadas identificables mediante técnicas moleculares a partir de la muestra directa.
PrevenciónAdemás de ser fácilmente tratable con antibióticos, la infección por C. trachomatis es prevenible. Puesto que todavía no se ha desarrollado una vacuna eficaz y ante el incremento comentado en las conductas sexuales de riesgo en determinados grupos de la población, para controlar la incidencia de infección es necesario intensificar la prevención primaria a través de campañas de información y educación sanitaria en prácticas de sexo seguro (uso habitual y correcto de preservativos), esenciales para aumentar la conciencia de las ITS entre la población sexualmente activa.
La prevención secundaria mediante el cribado oportunista o sistemático continúa siendo de momento la intervención más importante para limitar los efectos adversos de la infección por C. trachomatis en la salud reproductiva20. Los Centers for Disease Control and Prevention en EE. UU. recomiendan un cribado de Chlamydia en todas las mujeres sexualmente activas<25 años y en mayores de esa edad con factores de riesgo anualmente (en gestantes durante el primer y tercer trimestre)2. El cribado en hombres no ha demostrado ser costo-eficaz y, aunque esta práctica podría prevenir muchas infecciones en mujeres, su impacto en la carga de la enfermedad en mujeres mediante el análisis en hombres jóvenes o grupos específicos de riesgo es controvertido.
Para poder reducir la transmisión entre la población, la cobertura de estos programas de cribado debería alcanzar el 80%, siendo aceptables cifras>70%21. Lamentablemente, la cobertura no suele superar el 60%, por lo que son necesarias estrategias que conjuguen confidencialidad, sencillez y percepción de beneficio en la salud para mejorar la aceptación entre su población diana. Estudios con modelos matemáticos muestran que el cribado reduce la prevalencia de la infección22. Sin embargo, la eficacia de un cribado no se puede medir solo en la reducción de la prevalencia de la infección (incluso puede subir con una adecuada cobertura al detectar nuevos casos), sino en el resultado en la prevención de complicaciones a más largo plazo23. Así, los programas de cribado han demostrado reducir las tasas de EIP en mujeres2,9. Actualmente se estima que la frecuencia óptima para realizar la prueba es al menos una vez al año o con cada cambio de pareja. En este sentido, un adecuado diagnóstico y tratamiento (prevención terciaria) permiten acortar la duración de la infección.
En varios países como EE. UU., Canadá, Australia, Japón, Taiwán, Corea del Sur, Reino Unido, Bélgica, Luxemburgo, Dinamarca, Estonia, Islandia, Letonia, Lituania, Noruega y Suecia se han realizado puntualmente o están en marcha diferentes políticas y estrategias de cribados, en parte debido a diferencias en la epidemiología local y la carga de enfermedad, aunque en algún caso no tienen carácter nacional y solo están implantados en determinadas regiones. El cribado en mujeres gestantes aumenta el control de la infección, ya que incluye una proporción sustancial de la población diana, permite alcanzar una mayor cobertura por ser percibido como beneficioso, puede evitar las complicaciones de la infección relacionadas con la gestación (así como en su posterior salud reproductiva), y previene la transmisión perinatal al neonato2.
Linfogranuloma venéreoLos genotipos L1-L3 de C. trachomatis producen una enfermedad, conocida como LGV, caracterizada por invasión e inflamación del tejido linfático a diferencia del resto de genotipos, en los cuales la inflamación está limitada, casi exclusivamente, al lugar de la infección. Desde el año 2003, como consecuencia del brote descrito en Holanda en población HSH y causado por la nueva variante L2b, existe una revisión permanente de la epidemiología, sintomatología y tratamiento de los casos de LGV.
EpidemiologíaCon anterioridad a 2003, la epidemiología de LGV indicaba que esta enfermedad era infrecuente en países desarrollados, pero prevalente en países tropicales en vías de desarrollo; por ello, la mayoría de los casos descritos en Europa se referían a casos esporádicos e importados. Sin embargo, en el siglo pasado ya se describieron epidemias importadas relacionadas con los movimientos de tropas procedentes de áreas donde los casos de LGV eran frecuentes24. En 2003, se describe un nuevo caso esporádico de LGV en varón bisexual25, pero en tan solo 17 meses se diagnosticaron 92 casos más, convirtiéndose en el mayor brote registrado en Europa por LGV26. Rápidamente se comunican casos similares en otros países europeos como Alemania, Francia o Reino Unido, y progresivamente en prácticamente todos los países europeos. En el último informe del ECDC se comunican más de 2.000 casos en 22 países27. Los países que detectaron los primeros casos de LGV (Holanda, Francia y Reino Unido) son actualmente responsables del 86% de los casos. Pero las cifras del ECDC están subestimadas ya que, en algunos países como España, no hay contabilizados ningún caso. La epidemia actual está lejos de ser controlada y la infección por LGV podría establecerse definitivamente en la población europea. Varios factores epidemiológicos instan a pensar en las dificultades para su erradicación. En primer lugar, se ha observado una mayor diversificación bacteriana a lo largo de los años. La actual epidemia se asoció inicialmente a una única variante denominada L2b. En España se describió por primera vez la cocirculación de 2 variantes L2 y L2b28, y progresivamente a medida que la epidemia ha perdurado se han seleccionado nuevas variantes que se trasmiten muy bien, dando lugar a un escenario epidemiológico complejo29. En segundo lugar, la actual epidemia se asociaba inicialmente con un patrón epidemiológico bien definido, como población HSH y detección rectal. Si bien este patrón sigue siendo el perfil mayoritario, progresivamente se identificó las variantes LGV en otras localizaciones como uretra, faringe y cuello de útero. En tercer lugar, la epidemia limitada a Europa ha continuado extendiéndose a otras regiones geográficas.
¿Que ha favorecido la dispersión de esta epidemia y no otras que ocurrieron en el pasado? Los argumentos que se han propuesto son la presentación atípica de la infección, el mimetismo de la infección por otros cuadros no infecciosos, como enfermedad de Crohn o el alto porcentaje de infecciones asintomáticas30,31. Todos estos argumentos tienen en común que facilitan el retraso diagnóstico y por tanto mayores oportunidades de transmisión. La mayoría de los casos descritos en varones son infecciones rectales con proctitis, mientras que la presentación más clásica de la infección son las adenopatías inguinales (bubones); si bien con anterioridad a 2003 los casos rectales se describían en>25% pero en mujeres24. Por otra parte, el mimetismo diagnóstico al confundir una infección por LGV con otras patologías intestinales también se describieron con anterioridad al brote epidémico actual30,32. Finalmente, el alto porcentaje de detección de LGV en individuos asintomáticos llegó a cuestionar si las nuevas plataformas diagnósticas eran lo suficientemente específicas para identificar LGV33, ya que la infección debía de responder a una sintomatología. Sin embargo, el 40% de los casos ya eran asintomáticos antes de la implementación de las técnicas moleculares24. Las causas que pueden explicar el éxito adaptativo del genotipo asociado con la epidemia actual no son conocidas, pero no parecen estar relacionadas con características biológicas y genéticas de la bacteria, más bien con cambios en las prácticas sexuales, redes de conectividad entre individuos más densas y en mayores capacidades diagnósticas por la generalización de las técnicas moleculares.
ClínicaSe identifican 3 etapas en la infección por genotipos asociados a LGV. La infección primaria que suele aparecer entre 3-15 días después de la exposición a la fuente, se caracteriza por úlcera genital indolora que remite espontáneamente, cuya presentación puede ser compatible con otras ITS, como sífilis o VHS-2. La segunda etapa, entre 2-6 semanas después, se caracteriza por la extensión invasiva del microorganismo a los ganglios linfáticos próximos al lugar de la infección primaria (generalmente ganglios inguinales o femorales). La afectación de los ganglios inguinales se asocia a la característica presentación clásica de los bubones en varones, generalmente unilaterales y dolorosos, mientras que un síndrome anorrectal se caracteriza por una masa inflamatoria en recto, con un abanico de síntomas, desde ausencia de estos a úlceras rectales, dolor en la parte inferior del abdomen, sangrado y tenesmo, acompañado de fiebre, malestar y pérdida de peso. Si la infección se prolonga aparece proctocolitis hemopurulenta, por lo que se ha confundido otras veces con enfermedad inflamatoria intestinal. La cronificación de la infección por LGV produce fibrosis que puede generar una obstrucción linfática (estenosis) del tracto anogenital o genital (elefantiasis).
Como se comentaba en el apartado anterior, existen descripciones de infecciones por genotipos asociados a LGV en localizaciones extragenitales, como infección orofaríngea con glositis ulcerativa y linfadenitis cervical secundaria, relacionado con la práctica de sexo oral34, si bien la mayoría de los casos son asintomáticos. Se ha descrito también un caso de adenopatía supraclavicular secundario a un caso de neumonitis. La poliartropatía reactiva, con o sin conjuntivitis, se ha observado en varios casos, siendo las articulaciones más afectadas la muñeca, la rodilla, el tobillo o el codo.
DiagnósticoEn las secciones anteriores se han descrito las limitaciones clínicas que favorecen un retraso diagnóstico (alto porcentaje de población asintomática, confusión con otras enfermedades inflamatorias, presentación atípica…). Ahora comentamos las limitaciones de laboratorio para la detección molecular de los genotipos asociados a LGV.
En primer lugar, no existe un sistema validado por la FDA para la detección molecular específica de los genotipos asociados a LGV. Si hay una plataforma con marcado CE para la detección específica de los genotipos LGV, estos se limitan solo a úlceras, dentro de estrategias en multidianas que no incluyen C. trachomatis. Con la excepción descrita, el genotipado de C. trachomatis para identificar los genotipos invasivos (L1-L3) se realiza siempre como una acción posterior a la detección inicial de C. trachomatis en la muestra analizada. Solo algunos grupos de investigación han desarrollado sistemas propios para la detección de los genotipos invasivos, en muestras con amplificación positiva para C. trachomatis. Esta limitada disponibilidad de TAAN retrasa aún más el diagnóstico de LGV. Estas estrategias de diagnóstico se basan en la deleción intragénica de 36pb del gen pmpH35. La estrategia basada en una deleción de 9bp en pmpH para diferenciar entre las variantes L2/L2b ha fracasado33.
¿Es conveniente identificar los genotipos LGV en todas las C. trachomatis positivas? En el momento actual, entre 10-20% de las detecciones positivas de C. trachomatis en individuos HSH, y/o con prácticas de sexo anal, corresponden a genotipos asociados a LGV; por lo que debería ser recomendable el genotipado en todas las muestras en las que se detecte presencia de C. trachomatis. En este escenario, diferentes tipos de muestras pueden ser usadas: la lesión anogenital primaria (exudado de úlcera), hisopo de muestra rectal (cuando el LGV anorrectal es sospechado), aspirado de bubones (cuando se sospecha de LGV inguinal), orina cuando la linfoadenopatía inguinal es sospechada. Por el contrario, la escasa prevalencia de infecciones en otras localizaciones no es coste-efectiva actualmente y esto quedaría limitado a centros especializados. Por otra parte, la discriminación entre las diferentes variantes L2/L2b u otras L-variantes altamente transmisibles no tiene impacto clínico, pues no afecta a la decisión terapéutica y la discriminación solo tiene interés epidemiológico.
TratamientoExisten varias opciones terapéuticas para eliminar los genotipos asociados a LGV. Generalmente el tratamiento con 100mg de doxiciclina cada 12h durante 21 días es el de elección. La segunda opción ampliamente aceptada es azitromicina (primera elección en embarazadas) 1g semanalmente durante 21 días. En los escasos ejemplos de no aclaramiento bacteriano, se ha recurrido a moxifloxacino (400mg/día durante 21 días) con buenos resultados. La recomendación de 21 días, comparado con 7 días que es el tratamiento estándar en las infecciones por genotipos no-LGV está basada en un metaanálisis publicado en 200736, pero ratificado en un trabajo experimental en 200937. Sin embargo, en 2015 se cuestiona el tratamiento de 3 semanas para erradicar LGV38 y en 2018 se realiza un ensayo de tratamientos a 7-14 días con doxiciclina que alcanzan unos porcentajes de aclaramiento bacteriano similares al tratamiento convencional39. La implementación de tratamientos más cortos basados en doxiciclina podría mitigar los efectos gastrointestinales adversos, tales como la dispepsia o las náuseas. Otros trabajos han comparado la eficiencia de doxiciclina y azitromicina para aclarar el microorganismo. En infecciones rectales la doxiciclina tiene mejores porcentajes de aclaramiento que azitromicina (95,5 y 78,5% respectivamente), mientras que en muestra genitales el éxito de ambos antibióticos es similar (95,5 y 93,5% respectivamente). La experiencia con moxifloxacino es menor que con los otros 2 fármacos. Si bien tiene muy buena actividad intrínseca, los genotipos asociados a LGV pueden desarrollar resistencia in vitro a quinolonas.
La resistencia antibiótica en los genotipos invasivos de C. trachomatis ha sido varias veces descrita40; sin embargo, no hay evidencia genética de esos fracasos, y recientes trabajos indican que ese potencial fracaso estaría más relacionado con cargas bacterianas altas y un más lento aclaramiento bacteriano41.
PrevenciónEn estas infecciones con un alto porcentaje de individuos asintomáticos existe una relación directa entre el modelo de cribado implementado y la tasa de infección poblacional. Aquellos países con cribado oportunista y basado en sintomatología tienen bajas o muy bajas tasas de infecciones por clamidia (15 casos/100.000), mientras que países con cribados sistemáticos (bien por selección de grupos de riesgo o universal) tienen unas tasas de infección alrededor de 300-400 casos/100.00042. En segundo lugar, sería conveniente establecer protocolos para identificar las infecciones que por su carácter asintomático pueden contribuir a perpetuar la epidemia. Estos casos serían las infecciones rectales en HSH o las infecciones faríngeas (aunque el aclaramiento espontáneo sea alto). Ambos modelos son excelentes ejemplos de reservorio bacteriano. Por tanto, cuanto más se generalice el cribado y la detección de los genotipos invasivos, más próximos estaremos a la visión real de la epidemia de LGV.
Algunas unidades de ITS están optando por el cribado en muestras agrupadas (muestra faríngea, uretral/cervical y rectal de un mismo paciente) en individuos de prácticas sexuales compatibles.
Mycoplasma genitaliumEpidemiologíaM. genitalium es un patógeno de transmisión sexual emergente descrito por primera vez en 1980, claramente relacionado con uretritis no gonocócica-no clamidia en hombres y que también se ha asociado con uretritis, cervicitis, endometritis y EIP en mujeres43. La infección por M. genitalium no es una enfermedad de declaración obligatoria, lo cual limita, hasta cierto punto, el conocimiento de su epidemiología. La información sobre prevalencia de M. genitalium puede estar condicionada por la introducción y la mejora de las técnicas de diagnóstico, incluyendo la incorporación de múltiples dianas en TAAN. El uso continuado de azitromicina para tratar las infecciones por C. trachomatis y N. gonorrhoeae también puede haber influido en la evolución epidemiológica de M. genitalium. Según datos agrupados, publicados en la guía europea sobre M. genitalium, se estima que en hombres es la causa del 10-35% de las uretritis no gonocócicas-no clamidias44. La prevalencia de M. genitalium está aumentando especialmente entre grupos de riesgo como HSH con o sin VIH. En un estudio en HSH infectados con el VIH en EE. UU. publicado en 2018, la prevalencia de M. genitalium uretral y rectal fue del 10,8% y 6,4% respectivamente45. Existen pocos estudios poblacionales y con algunas limitaciones metodológicas, en los que M. genitalium se detecta en el 1-3% de la población general44. Si bien este dato podría estar artefactado, ya que las infecciones asintomáticas (personas que son portadoras) serían más comunes en usuario/as de centros de ITS. En España se han publicado estudios basados en series de casos diagnosticados en centros de ITS y de Urgencias. Se han comunicado, en 2014, prevalencias del 9% y del 13% en varones y mujeres respectivamente en la ciudad de Barcelona46. Por el contrario en Madrid, las prevalencias fueron del 6,6-0,96% en varones y mujeres respectivamente en 201547. Un estudio realizado con muestras de diferentes servicios en Donostia entre 2014-2017 encontró una frecuencia del 3,9%48. Por otra parte llama la atención la alta frecuencia encontrada en población asintomática atendida en un centro de ITS en Barcelona en 2017: entre un total de 1.403 muestras estudiadas de diferentes localizaciones anatómicas dentro de un proyecto piloto se detectó una prevalencia de 7,4%49. Estos datos, aunque influenciados por la selección de los casos, orientan del posible impacto de M. genitalium en nuestro entorno.
Además de su patogenicidad, M. genitalium presenta un reto terapéutico debido al desarrollo de resistencias antimicrobianas. Las tasas de resistencia a los macrólidos varían significativamente entre diferentes áreas geográficas. En aquellas regiones donde se usa azitromicina 1g en dosis única para el tratamiento de las uretritis no gonocócicas, por lo general se encuentran porcentajes de resistencia entre 30-45% de los aislados44. En nuestro entorno comunicaron tasas de resistencia a macrólidos entre el 16% y el 35%46–48. La resistencia es mayor en hombres que en mujeres (22,2 vs. 4,6%) y en HSH comparados con hombres heterosexuales (32,5 vs. 17,6%)48. En relación con las tasas de resistencia a fluoroquinolonas se han comunicado valores del 8% en nuestro entorno46,48.
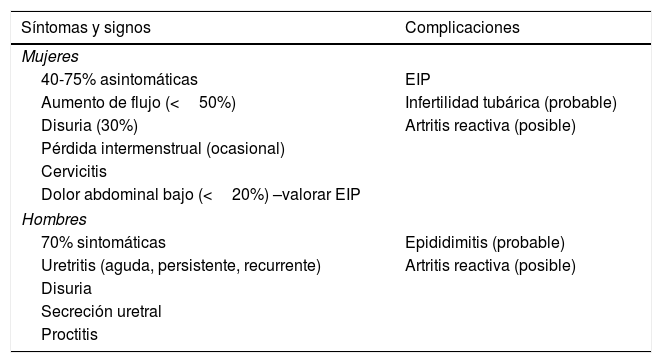
ClínicaLa vía de transmisión principal es por contacto mucoso directo genital-genital y también genito-anal. Las manifestaciones clínicas en mujeres y en hombres se resumen en la tabla 2. Se estima que las infecciones por M. genitalium son menos sintomáticas en mujeres que en hombres. En mujeres, debido a la afectación uretral y cervical las principales manifestaciones son leucorrea, disuria y sangrado intermenstrual o poscoital. Debe sospecharse una EIP en caso de dolor abdominal bajo. En hombres la manifestación clínica principal es la uretritis de evolución más bien subaguda con disuria, molestia y secreción uretral mucosa o mucopurulenta, más raramente purulenta, como síntomas más frecuentes. Probablemente M. genitalium es el agente causal implicado con más frecuencia en las uretritis persistentes (>21 días) y recurrentes, lo cual está relacionado con la ausencia de su detección sistemática y con el tratamiento basal empírico de la uretritis sobre todo cuando se usa azitromicina1. Aunque su asociación con la proctitis no está establecida, se detectó M. genitalium en el 12% de HSH con clínica de proctitis50.
Manifestaciones clínicas de la infección por M. genitalium en mujeres y en hombres
| Síntomas y signos | Complicaciones |
|---|---|
| Mujeres | |
| 40-75% asintomáticas | EIP |
| Aumento de flujo (<50%) | Infertilidad tubárica (probable) |
| Disuria (30%) | Artritis reactiva (posible) |
| Pérdida intermenstrual (ocasional) | |
| Cervicitis | |
| Dolor abdominal bajo (<20%) –valorar EIP | |
| Hombres | |
| 70% sintomáticas | Epididimitis (probable) |
| Uretritis (aguda, persistente, recurrente) | Artritis reactiva (posible) |
| Disuria | |
| Secreción uretral | |
| Proctitis | |
Adaptada de Jensen et al.44.
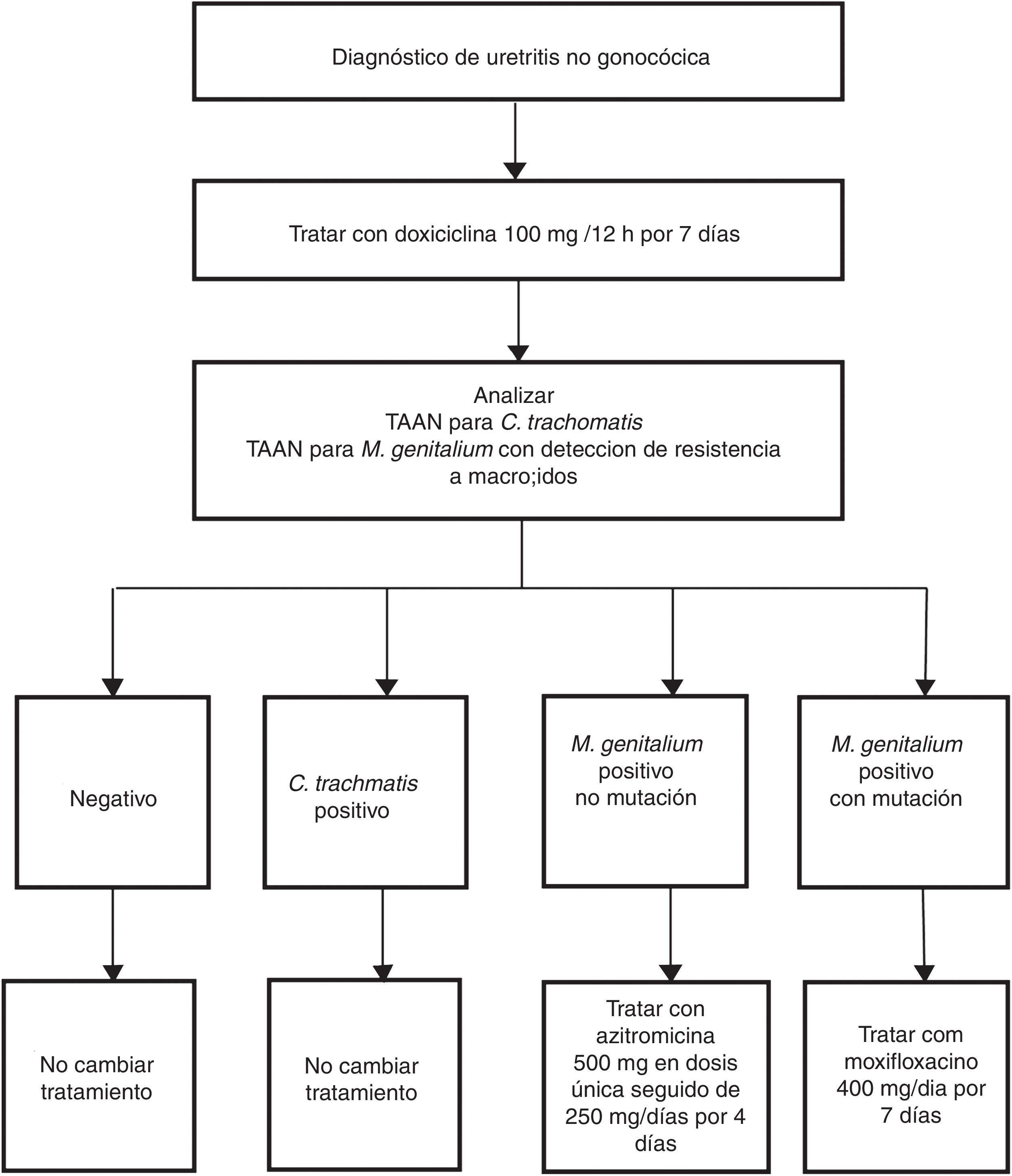
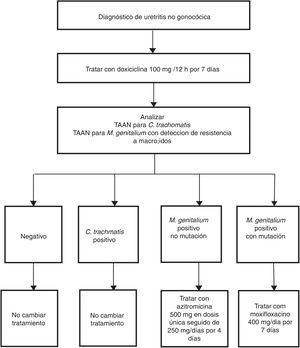
Las indicaciones para la detección de M. genitalium se refieren a aquellos pacientes con los síntomas mencionados en la tabla 2 y sus contactos sexuales44. En estos casos, con sospecha clínica de ITS, hay que resaltar la importancia de la detección sistemática de M. genitalium y especialmente en casos de persistencia o recidiva de síntomas. El tipo de muestra y los procedimientos son los mismos que los utilizados para la detección de C. trachomatis. Las características de esta bacteria, sin pared celular y pequeño genoma, influyen en la dificultad y lentitud (semanas) de su aislamiento en medios de cultivo. Por este motivo las TAAN que identifican ADN de M. genitalium son las únicas técnicas útiles para su diagnóstico. Es recomendable consultar con el laboratorio los aspectos relacionados con el procesamiento de las muestras y las características de la técnica utilizada, ya sea comercial o casera. Además, debido a las elevadas tasas de resistencia antimicrobiana descritas, se recomienda realizar análisis genotípico rápido de la susceptibilidad a macrólidos para pautar un tratamiento dirigido en casos positivos44. Para ello existen técnicas caseras48 y comerciales51 cuya implementación sobre el terreno está condicionada por la sensibilidad de la técnica y por los aspectos asistenciales del laboratorio. Australia es un ejemplo donde se ha adoptado de forma rutinaria esta estrategia (fig. 3)52.
Ejemplo de algoritmo diagnóstico para el manejo de la uretritis no gonocócica incluyendo el tratamiento dirigido de M. genitalium según susceptibilidad a macrólidos. Adaptado de Australian STI Management guidelines.52.
Azitromicina es altamente efectiva para el tratamiento de M. genitalium susceptible a macrólidos. No obstante, el uso masivo de 1g de azitromicina en dosis única para el manejo de las uretritis no gonocócicas ha contribuido a la creciente descripción de fracasos terapéuticos en M. genitalium, asociada al desarrollo de mutaciones en las posiciones 2058 y 2059 de la región V del gen 23S del ARNr. Aunque la tasa de curación de M. genitalium con doxiciclina es del 35% este tratamiento puede contribuir a disminuir la carga bacteriana y hacer más efectivo el tratamiento posterior con la pauta recomendada de azitromicina una vez detectado M. genitalium. La pauta de tratamiento recomendada2,44 adoptada por la SEIMC53 es azitromicina por vía oral 500mg en dosis única el primer día ampliada con 250mg/día durante 4 días consecutivos, empleándose moxifloxacino por vía oral 400mg al día durante 7-14 días como alternativa o en casos de recidiva o infección complicada. Pristinamicina es el antibiótico de tercera línea a dosis de 1g/6h durante 10 días, o doxiciclina 100mg/12h durante 14 días44. Además de macrólidos, M. genitalium puede presentar resistencia a otros antibióticos con lo cual el manejo de cepas multirresistentes podría volverse muy complejo. El control postratamiento a las 3 semanas está indicado en todos los casos.
PrevenciónLos pacientes tratados deben mantener reposo sexual durante el tratamiento hasta que sus contactos hayan sido estudiados, los síntomas hayan desaparecido y el control postratamiento sea negativo. Deben estudiarse los contactos sexuales del caso índice de los últimos 3 meses. Además de prevenir la transmisión, todo ello va dirigido a evitar reinfecciones y detectar infecciones persistentes (por el posible desarrollo de resistencias durante el tratamiento o por selección de cepas minoritarias inicialmente portadoras de mutaciones asociadas con resistencia). Asimismo, debe incluirse la detección de otras ITS en los casos diagnosticados de infección por M. genitalium.
A diferencia de otras ITS, no está establecido el fundamento del cribado sistemático de M. genitalium en personas asintomáticas como estrategia preventiva. Aunque M. genitalium tiene una prevalencia similar a la de C. trachomatis, su cribado no se puede recomendar de forma rutinaria. La historia natural de M. genitalium aún es poco conocida, lo cual genera dudas sobre la efectividad de su cribado además de representar un problema debido al incremento de resistencias, y a la toxicidad del tratamiento46,54,55. En esta misma línea, no es recomendable identificar a personas asintomáticas por el imperativo que supone tratarlas y estudiar sus contactos56.
Contribución de los autoresIntroducción: Luis Piñeiro, Juan Carlos Galán y Martí Vall-Mayans; Chlamydia trachomatis: L. Piñeiro; linfogranuloma venéreo: J.C. Galán; Mycoplasma genitalium: M. Vall-Mayans.
FinanciaciónAlgunos de los datos descritos en el apartado de C. trachomatis proceden de una investigación parcialmente financiada con una beca del Fondo de Investigación Sanitaria (FIS PI10/02191).
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-formacion