El tratamiento de la enfermedad tuberculosa busca un doble beneficio: un beneficio individual, centrado en la curación del paciente afecto de tuberculosis, y un beneficio colectivo, de la comunidad en la cual reside el paciente. Se exponen los diferentes regímenes de tratamiento tanto de la tuberculosis sensible a fármacos antituberculosos de primera línea como de la tuberculosis resistente. Se comentan las peculiaridades en cuanto al manejo de la tuberculosis pulmonar y extrapulmonar.
The purpose of tuberculosis treatment is twofold: to provide an individual benefit centred on healing the patient with TB, and to provide a collective benefit to the community in which the patient resides. The different treatment regimens for tuberculosis sensitive to first-line antituberculosis drugs as well as resistant tuberculosis are examined and the peculiarities in the management of pulmonary and extrapulmonary tuberculosis are discussed.
En primer lugar, dejar claro que en el presente artículo hablamos de tratamiento de tuberculosis (TB) refiriéndonos al tratamiento de la enfermedad por TB en adultos.
En segundo lugar, definir las diferentes terminologías empleadas en la TB resistente. La TB monorresistente es la producida por una cepa resistente a un solo fármaco de primera línea. La polirresistencia se define por la presencia de resistencia a más de un fármaco, diferente a la asociación de isoniazida (H) y rifampicina (R). La TB multirresistente (TB-MR) se define como aquella que es resistente a H y a R. Se considera que una TB es extremadamente resistente (TB-XR) cuando, además de resistencia a H y R, es resistente al menos a una fluoroquinolona (FQ) así como a un aminoglucósido (amikacina, kanamicina) o capreomicina.
Cuando tratamos a un paciente con enfermedad tuberculosa buscamos un doble beneficio: un beneficio individual (clínico), centrado en la curación del paciente afecto de TB, y un beneficio colectivo (salud pública), de la comunidad en la cual reside el paciente.
Hay 3 objetivos fundamentales en el tratamiento de la TB: 1)disminuir rápidamente el número de bacilos de la TB para reducir la morbilidad y evitar la muerte del paciente, y para disminuir la capacidad de contagio a otras personas; 2)prevenir el desarrollo o empeoramiento de TB resistente, y 3)evitar las recaídas después de completar el tratamiento.
El tratamiento de la TB tiene 2 fases: una fase intensiva inicial y una segunda fase de continuación. La fase intensiva inicial busca los objetivos1 y2. Para conseguir estos objetivos es muy importante la asociación de múltiples fármacos, sobre todo con capacidad bactericida que reduzcan rápidamente la multiplicación de los bacilos. Los fármacos antituberculosos con mayor capacidad bactericida son la H y las FQ. Los bacilos tuberculosos están sufriendo continuamente mutaciones espontáneas que pueden crear resistencias a un determinado fármaco antituberculoso. Si existe un clon resistente a un fármaco específico tendrá una ventaja relativa respecto a las cepas susceptibles si lo enfrentamos a este único fármaco, de ahí la importancia de asociar varias drogas. Cuando la carga bacilar es más elevada hay más riesgo de que aparezcan resistencias, por lo que en la fase intensiva de tratamiento se deben asociar más fármacos. Para conseguir el objetivo3 se debe prolongar el tratamiento en el tiempo y utilizar fármacos con efecto esterilizante, capaces de eliminar los bacilos persistentes que parecen restringir su actividad metabólica y que son los causantes de las recaídas que suceden tras el tratamiento antituberculoso. El fármaco que tiene un papel más importante a este nivel y el que ha demostrado mayor eficacia a la hora de prevenir recaídas es R. La pirazinamida tiene también una acción esterilizante importante, aunque se considera que esta actividad se limita a microambientes especiales de acidez relativamente incrementada1-4.
El tratamiento antituberculoso debe de ser iniciado sin demora en pacientes con alta probabilidad de tener TB, sobre todo en aquellos con enfermedad grave que comprometa su vida, incluso antes de tener los resultados de baciloscopia, estudios moleculares o cultivos.
Los estudios de resistencia, tanto los métodos convencionales fenotípicos (antibiograma) como los genotípicos, son claves a la hora de diseñar un tratamiento eficaz. Actualmente se recomienda el uso de test rápidos moleculares (genotípicos) aplicados directamente sobre las muestras, ya que acortan el tiempo del diagnóstico y algunos de estos estudios dan información adicional sobre la susceptibilidad a fármacos al detectar, por técnicas de amplificación genética, mutaciones en los genes que codifican la resistencia a los fármacos antituberculosos. Se deben utilizar test rápidos moleculares para el estudio de resistencia al menos en los pacientes que tienen más riesgo de padecer una TB resistente3: tratamiento previo de TB, sobre todo si ha habido mala adherencia; contacto con pacientes con TB resistente, y procedencia de países con alta incidencia de TB-MR (5% o mayor). También es de suma importancia la historia de los fármacos que ha tomado el paciente previamente; cuando un fármaco se ha tomado incorrectamente durante un mes, debemos sospechar la posibilidad de que se hayan producido resistencias a dicho fármaco.
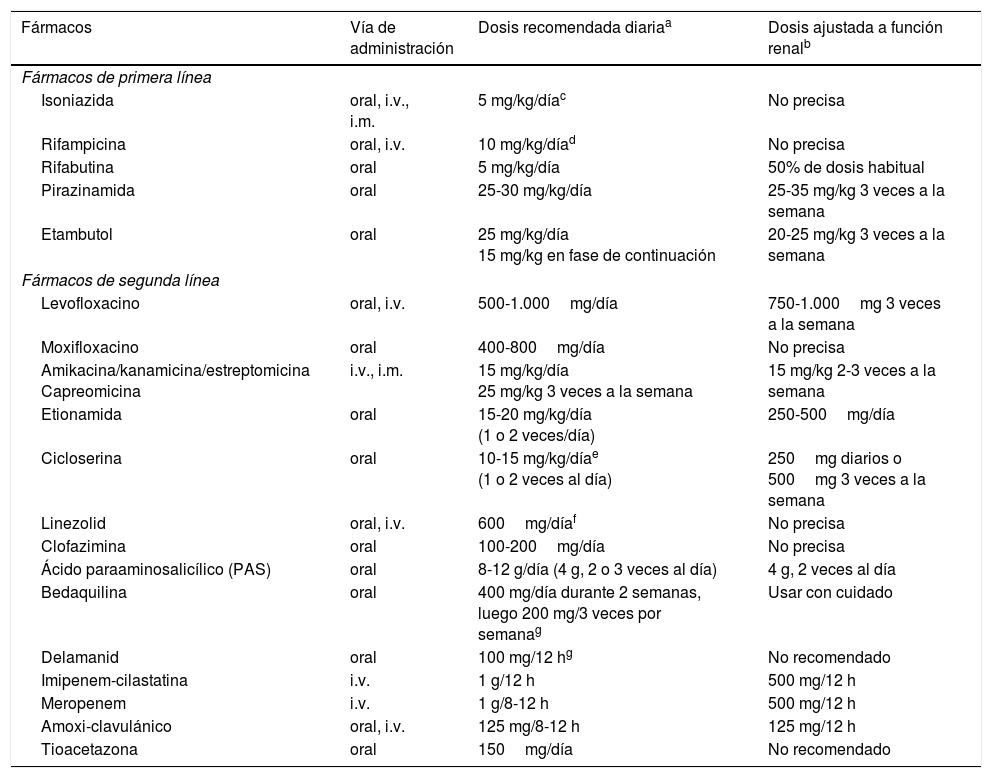
Fármacos con actividad frente a Mycobacterium tuberculosisLos fármacos antituberculosos (tabla 1) de primera línea son rifampicina (R), isoniazida (H), etambutol (E) y pirazinamida (Z). La R, considerada el fármaco clave en el manejo de la TB, pertenece al grupo de las rifamicinas. La rifabutina pertenece también a este grupo y tiene la ventaja de ser menos inductora del citocromo P450, produciendo menos interacciones medicamentosas. La rifapentina es similar a la R pero tiene una vida media más larga que permite la administración semanal; no está comercializada en España.
Vía de administración, dosis recomendada diaria y ajuste a la función renal de los fármacos antituberculosos
| Fármacos | Vía de administración | Dosis recomendada diariaa | Dosis ajustada a función renalb |
|---|---|---|---|
| Fármacos de primera línea | |||
| Isoniazida | oral, i.v., i.m. | 5 mg/kg/díac | No precisa |
| Rifampicina | oral, i.v. | 10 mg/kg/díad | No precisa |
| Rifabutina | oral | 5 mg/kg/día | 50% de dosis habitual |
| Pirazinamida | oral | 25-30 mg/kg/día | 25-35 mg/kg 3 veces a la semana |
| Etambutol | oral | 25 mg/kg/día 15 mg/kg en fase de continuación | 20-25 mg/kg 3 veces a la semana |
| Fármacos de segunda línea | |||
| Levofloxacino | oral, i.v. | 500-1.000mg/día | 750-1.000mg 3 veces a la semana |
| Moxifloxacino | oral | 400-800mg/día | No precisa |
| Amikacina/kanamicina/estreptomicina Capreomicina | i.v., i.m. | 15 mg/kg/día 25 mg/kg 3 veces a la semana | 15 mg/kg 2-3 veces a la semana |
| Etionamida | oral | 15-20 mg/kg/día (1 o 2 veces/día) | 250-500mg/día |
| Cicloserina | oral | 10-15 mg/kg/díae (1 o 2 veces al día) | 250mg diarios o 500mg 3 veces a la semana |
| Linezolid | oral, i.v. | 600mg/díaf | No precisa |
| Clofazimina | oral | 100-200mg/día | No precisa |
| Ácido paraaminosalicílico (PAS) | oral | 8-12 g/día (4 g, 2 o 3 veces al día) | 4 g, 2 veces al día |
| Bedaquilina | oral | 400 mg/día durante 2 semanas, luego 200 mg/3 veces por semanag | Usar con cuidado |
| Delamanid | oral | 100 mg/12 hg | No recomendado |
| Imipenem-cilastatina | i.v. | 1 g/12 h | 500 mg/12 h |
| Meropenem | i.v. | 1 g/8-12 h | 500 mg/12 h |
| Amoxi-clavulánico | oral, i.v. | 125 mg/8-12 h | 125 mg/12 h |
| Tioacetazona | oral | 150mg/día | No recomendado |
No hay estudios que establezcan las dosis ideales en pacientes obesos (>20% de su peso ideal), por lo que habría que considerar la determinaciones de niveles sanguíneos en estos pacientes.
Dosis recomendada y frecuencia para pacientes con aclaramiento de creatinina <30ml/min o pacientes en hemodiálisis.
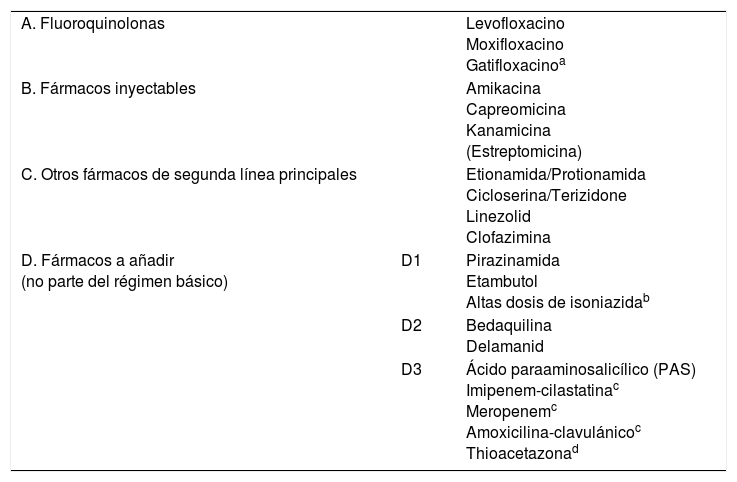
Recientemente, la OMS5 ha reclasificado los fármacos antituberculosos de segunda línea en una tabla funcional encaminada al diseño de tratamiento de la TB-MR (tabla 2). La estreptomicina, aunque se debe considerar de primera línea, está metida en el grupo de los inyectables de segunda línea, por la posibilidad de uso como agente inyectable del régimen de la TB-MR si no se puede utilizar ninguno de los otros 3 agentes y si es poco probable que la cepa sea resistente a ella. La resistencia a la estreptomicina por sí misma no califica para definir la TB-XR, y por otro lado, los métodos de estudio de resistencia de este fármaco no se consideran del todo fiables. Los inyectables son fármacos con capacidad bactericida pero sin apenas capacidad esterilizante, por lo que tienen su papel únicamente en la fase intensiva; también hay que tener en cuenta que presentan una toxicidad acumulativa que limita su uso prolongado. Las FQ son fármacos claves y marcan el pronóstico en el tratamiento de la TB-MR por su efecto bactericida y esterilizante y su escasa toxicidad. En los últimos años se ha relanzado el uso de clofazimina (fármaco utilizado para la lepra) por su probable acción esterilizante, sobre todo en los casos en los que la Z no es eficaz. En el mismo grupo que clofazimina están otros fármacos clásicos, como la cicloserina o las tioamidas (etionamida/protionamida), estas últimas más eficaces que la cicloserina, pero presentan resistencia cruzada con H cuando está producida por la mutación del gen inhA. El linezolid es un buen fármaco antituberculoso con capacidad bactericida y esterilizante, pero que tiene las limitaciones del elevado precio y la importante toxicidad con la administración prolongada5,6. Bedaquilina y delamanid han sido los últimos fármacos en incorporarse al arsenal terapéutico, demostrando su eficacia en pacientes con TB-MR y TB-XR6. Es controvertido que estos fármacos no estén clasificados en el grupo de fármacos principales de segunda línea en la clasificación de la OMS5, como sugieren otros autores6,7, pero quizás obedece más a un tema económico —son fármacos caros— que de eficacia; aunque hay estudios que demuestran que la incorporación de estos fármacos es rentable económicamente8. Puede haber resistencias cruzadas entre bedaquilina y clofazimina. La asociación de carbapenems con clavulánico probablemente tenga cada vez un papel más relevante, al contrario que el ácido paraaminosalicílico (PAS), que ha caído prácticamente en desuso por su mala tolerancia y poca eficacia.
Fármacos recomendados para el tratamiento de tuberculosis multirresistente (OMS, 2016)
| A. Fluoroquinolonas | Levofloxacino Moxifloxacino Gatifloxacinoa | |
| B. Fármacos inyectables | Amikacina Capreomicina Kanamicina (Estreptomicina) | |
| C. Otros fármacos de segunda línea principales | Etionamida/Protionamida Cicloserina/Terizidone Linezolid Clofazimina | |
| D. Fármacos a añadir (no parte del régimen básico) | D1 | Pirazinamida Etambutol Altas dosis de isoniazidab |
| D2 | Bedaquilina Delamanid | |
| D3 | Ácido paraaminosalicílico (PAS) Imipenem-cilastatinac Meropenemc Amoxicilina-clavulánicoc Thioacetazonad |
Dado que el tratamiento de la TB requiere la administración de múltiples fármacos durante varios meses, es crucial que el paciente participe de manera significativa en la toma de decisiones sobre la supervisión del tratamiento y la atención general. Debemos educar al paciente acerca de la TB y su tratamiento, incluyendo posibles efectos adversos; explicar cómo va a ser el seguimiento y discutir las medidas de control para evitar nuevos contagios utilizando una terminología apropiada para la cultura, el idioma y la edad del paciente9. Asegurar la adherencia al régimen de tratamiento es clave. El tratamiento directamente observado (TDO), la práctica de observar al paciente tragar sus medicamentos antituberculosos, ha sido ampliamente utilizado como el estándar de práctica en muchos programas de TB. Una revisión sistemática10 no encontró diferencias significativas entre el tratamiento autoadministrado (TAA) y el TDO al evaluar varios resultados de interés, incluyendo mortalidad, terminación del tratamiento y recaída. Sin embargo, el TDO se asoció significativamente con el éxito del tratamiento global (suma de los pacientes curados y de los que completaron el tratamiento) y con una mayor conversión de esputo durante el tratamiento, en comparación con el TAA. Por otro lado, la participación en el TDO puede ser ventajosa para el reconocimiento precoz de reacciones adversas y de irregularidades en el tratamiento, así como para establecer un mayor vínculo con el paciente. El TDO sigue siendo el estándar de práctica en la mayoría de los programas de TB y continúa siendo recomendado por la OMS4. En la tabla 3 se describen las situaciones en las que puede aportar más beneficio.
Situaciones en las que hay que contemplar el tratamiento directamente observado
| Factores en relación con la tuberculosis y el tratamiento |
| Tratamiento previo de tuberculosis activa o infección latente |
| Recaída o fracaso de tratamiento |
| Antecedentes de no adherencia al tratamiento |
| Tuberculosis resistente |
| Utilización de regímenes de tratamiento intermitentes |
| Factores en relación con las características del paciente |
| Adolescentes |
| Indigencia |
| Antecedentes o uso de drogas de abuso. Etilismo crónico |
| Infección por VIH |
| Enfermedades psiquiátricas |
| Deterioro cognitivo o pacientes frágiles o con pérdida de visión importante |
| Residentes en instituciones (residencias, prisiones…) |
El régimen de tratamiento recomendado para la TB, sin sospecha o descartada la resistencia a fármacos antituberculosos de primera línea, continúa siendo la asociación de H, R, E y Z durante 2meses, seguida de H y R durante 4meses más1-4. Cuando la probabilidad de monorresistencia a H es mayor del 4%, se añade E. El E podría retirarse si se confirma la sensibilidad del resto de tuberculostáticos al inicio o durante el tratamiento. Uno de los objetivos deseables en los estudios de investigación sobre el tratamiento de la TB es intentar afianzar regímenes de tratamiento más cortos en el tiempo. Debido a la gran actividad bactericida de las FQ frente al bacilo de la TB en los últimos años, se han realizado estudios en pacientes con TB sensible comparando el régimen convencional con otro de 4meses en el que se incluían FQ11-13. Los regímenes de 4meses que incorporaban FQ demostraron una conversión más rápida en los esputos pero presentaron una mayor incidencia de recaídas a los 18meses de seguimiento.
Dosis diarias o pautas intermitentesLa pauta más recomendable es la de una vez al día durante 7días a la semana tanto en la fase intensiva como en la fase de continuación1-4. Hay una buena y extensa experiencia con las pautas de tratamiento intermitente de 5días a la semana bajo régimen de TDO. Los expertos consideran que las pautas de 5días pueden ser una alternativa aceptable en determinadas situaciones clínicas o de salud pública, pero siempre en régimen de TDO. La OMS no recomienda las pautas intermitentes de 3dosis semanales ni en la fase intensiva ni en la de continuación4. Las guías de Estados Unidos1 sí contemplan, cuando no es posible la pauta diaria y siempre con TDO, la administración intermitente de 3veces a la semana en la fase de continuación, e incluso en la fase intensiva, en pacientes sin infección VIH, sin lesiones cavitadas y con baciloscopias negativas.
Uso de fármacos combinados a dosis fijas o fármacos por separadoDiversos estudios han observado que el uso de fármacos combinados a dosis fijas no es más eficaz que la administración de fármacos por separado en términos de fallo de tratamiento, mortalidad, adherencia al tratamiento y efectos adversos. Sin embargo, la satisfacción del paciente es mayor con el uso de fármacos combinados a dosis fijas, al tomar menos comprimidos, por lo que la OMS recomienda su uso4. El hecho de reducir el número de comprimidos también podría ser de especial valor en pacientes con comorbilidades como la infección por VIH. No obstante, hay que tener en cuenta que pacientes con intolerancia a fármacos o con disfunción renal o hepática requieren ajuste de dosis que solo puede realizarse con el uso de fármacos por separado. Destacar por último que hay que conocer bien los nombres de los preparados de los fármacos combinados a dosis fijas, pues son parecidos y un error en la prescripción podría tener graves consecuencias, produciéndose resistencias o aumentando la toxicidad.
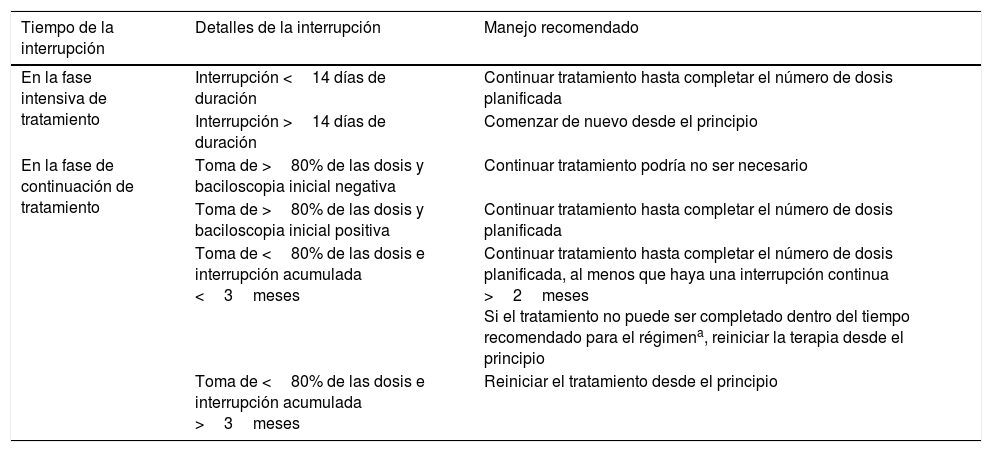
Interrupciones de tratamientoLas interrupciones de tratamiento son frecuentes en los pacientes con TB. Cuando sucede una interrupción del tratamiento debemos decidir si hay que comenzar de nuevo desde el principio o si se puede continuar hasta completarlo. Esta decisión depende de si la interrupción sucede en la fase intensiva de tratamiento o en la fase de continuación, de la duración de la interrupción y de las características de la TB. En los pacientes que se pierden durante el seguimiento, antes de comenzar de nuevo el tratamiento, se deben recoger nuevas muestras de esputo para estudio. Las interrupciones de tratamiento durante la fase intensiva son más peligrosas, ya que la población bacilar es mayor y existe más riesgo de desarrollar resistencias. En la tabla 4 se exponen las recomendaciones en cuanto al manejo de las interrupciones de tratamiento expuestas en las guías estadounidenses de 20161.
Manejo de las interrupciones de tratamiento expuestas en las guías de Estados Unidos (ATS, CDC e IDSA) del 20161
| Tiempo de la interrupción | Detalles de la interrupción | Manejo recomendado |
|---|---|---|
| En la fase intensiva de tratamiento | Interrupción <14 días de duración | Continuar tratamiento hasta completar el número de dosis planificada |
| Interrupción >14 días de duración | Comenzar de nuevo desde el principio | |
| En la fase de continuación de tratamiento | Toma de >80% de las dosis y baciloscopia inicial negativa | Continuar tratamiento podría no ser necesario |
| Toma de >80% de las dosis y baciloscopia inicial positiva | Continuar tratamiento hasta completar el número de dosis planificada | |
| Toma de <80% de las dosis e interrupción acumulada <3meses | Continuar tratamiento hasta completar el número de dosis planificada, al menos que haya una interrupción continua >2meses Si el tratamiento no puede ser completado dentro del tiempo recomendado para el régimena, reiniciar la terapia desde el principio | |
| Toma de <80% de las dosis e interrupción acumulada >3meses | Reiniciar el tratamiento desde el principio |
Los pacientes con diagnóstico de TB pulmonar con cultivos negativos deben tener un seguimiento clínico y radiográfico después de 2-3meses de tratamiento. Si hay mejoría clínica o radiográfica y no se identifica ninguna otra etiología, se debe continuar el tratamiento antituberculoso. Si la recogida de esputos fue adecuada al inicio del tratamiento, debemos interpretarlo como una forma de TB paucibacilar y, en ese caso, se podría tratar únicamente durante 4meses (2meses de fase intensiva con R, H, E y Z, y otros 2meses de fase de continuación con R e H). Si tenemos dudas sobre la recogida adecuada de las muestras de esputo, deberíamos tratar durante los 6 meses1.
Prolongar la fase de continuación en la tuberculosis pulmonarUn metaanálisis demostró que las recaídas de TB en pacientes con cepas sensibles eran menos del 1% cuando se empleaban regímenes con R prolongados durante al menos 8meses, frente al 4% de recaídas cuando se trataba durante 6meses2. Varios estudios han identificado diversos factores de riesgo para tener mayor porcentaje de recaídas; en estos casos los pacientes podrían beneficiarse de prolongar el tratamiento14-17. En la tabla 5 se exponen los escenarios en los que deberíamos prolongar el tratamiento de TB sensible a 9meses.
Indicaciones de prolongar el tratamiento de tuberculosis pulmonar sensible a 9 meses
| Presencia de cavidad en radiografía de tórax inicial y cultivo positivo a los 2 meses. | |
|---|---|
| Presencia de cavidad en radiografía de tórax inicial o cultivo positivo a los 2 meses | Y tener alguno de estos factores asociados: |
| • bajo peso (>10% por debajo del peso ideal) | |
| • fumador activo | |
| • tener diabetes | |
| • infección por VIH u otra inmunosupresión | |
| • enfermedad extensa en la radiografía de tórax | |
| Pacientes infectados por el VIH y que no toman tratamiento antirretroviral | |
| Diabetes mal controladaa. Silicotuberculosisa. Trasplantado de órganos sólidosa | |
En la tabla 6 se exponen los esquemas terapéuticos recomendados en caso de monorresistencia o polirresistencia. Estos esquemas serán aplicables también a pacientes en los que no se pueda utilizar algún fármaco por efectos adversos severos. Aunque las FQ no han demostrado eficacia a la hora de acortar el tratamiento de la TB sensible, en un ensayo clínico13 se demostró que moxifloxacino podía sustituir a H en un régimen terapéutico de 6meses. Por tanto, las FQ son fármacos que podrían tener su papel en caso de monorresistencia o intolerancia a H.
Regímenes de tratamiento propuestos para la resistencia a tuberculosis de primera línea (exceptuando rifampicina)
| Resistente | Fase intensiva | Fase de continuación |
|---|---|---|
| Za | R/H/E 2 meses | R/H 7 meses |
| E | R/H/Z 2 meses | R/H 4 meses |
| H | R/Z/E 2 meses | RE 10 meses |
| R/Z/E/FQb 2 meses | R/E/FQ 7 meses | |
| H/R/Z/Ec 9 meses | ||
| H y E | R/Z/FQ 6-9 meses | |
| H y Z | R/E/FQ 9-12 meses | |
| H, E y Z | R/FQ/FOSL/FISL 2-3 meses | R/FQ/FOSL 12-18 meses en total |
E: etambutol; FISL: fármaco inyectable de segunda línea; FOSL: fármaco oral de segunda línea; FQ: fluorquinolona; H: isoniazida; R: rifampicina; Z: pirazinamida.
La resistencia aislada a R (sin resistencia a H) es muy poco frecuente; además, la resistencia a R es la que condiciona el pronóstico de la TB-MR, de ahí que los pacientes con resistencia aislada a R deben de ser manejados igual que si se tratara de una TB-MR5, con la salvedad de que H se debe considerar como un fármaco a tener muy en cuenta a la hora de diseñar el esquema terapéutico.
Según las recomendaciones de la OMS de 20165, el tratamiento convencional de la TB-MR o resistencia aislada a R consiste en un régimen de al menos 5fármacos eficaces durante la fase intensiva inicial de tratamiento. Esta ha de incluir Z y 4 fármacos de segunda línea: uno seleccionado del grupoA, uno del grupoB y al menos 2 del grupoC (tabla 1). Si el número mínimo de medicamentos eficaces contra la TB no puede ser compuesto como se indicó anteriormente, se puede agregar un agente del grupoD2 y otros agentes del grupoD3 para llegar al total de 5. También se podría valorar añadir a este régimen altas dosis de H y/o E, pero nunca se deberían contabilizar dentro de los 5 fármacos recomendados. La Z se debe agregar rutinariamente a menos que haya resistencia confirmada o riesgo de toxicidad. Se recomienda una fase intensiva (con inyectable) de 8meses (6meses desde la conversión del esputo) para la mayoría de los pacientes con TB-MR y una duración total del tratamiento de unos 20meses en pacientes que no habían sido tratados previamente. La duración puede modificarse según la respuesta al tratamiento. La asociación entre el éxito del tratamiento y su duración es menos clara en los pacientes que han sido tratados, aunque la probabilidad de éxito del tratamiento parecía alcanzar un pico entre 27,6 y 30,5meses.
La OMS, en las recomendaciones de 20165, propugnó un régimen más corto para el paciente con TB-MR en base al éxito reportado con un «régimen de Bangladesh de nueve meses»18. Este régimen consta de una fase inicial intensiva de 4meses (prolongable si la baciloscopia de esputo es positiva) con kanamicina (pudiendo utilizarse amikacina o capreomicina), moxifloxacino a dosis altas, clofazimina, etionamida (o protionamida), Z, E y altas dosis de H. La fase de continuación sería de 5meses con moxifloxacino a altas dosis, clofazimina, E y Z. Este régimen corto (duración total de 9 a 12meses) puede ser apropiado para pacientes con TB-MR que cumplan los siguientes criterios: ausencia de enfermedad extrapulmonar o embarazo, acceso a todos los fármacos antituberculosos del régimen y no tener resistencia (excepto a H) o exposición previa a estos fármacos durante más de un mes. Este régimen corto puede no ser aplicable en ciertas regiones del mundo (como diversos países de Europa) por el patrón de resistencias prevalente en dichas áreas19. En Estados Unidos, algunos expertos recomiendan el uso del régimen acortado para los pacientes con enfermedad radiográfica mínima o baja carga bacilar.
El manejo de casos de TB-MR, y sobretodo TB-XR, debe ser realizado por personal médico con experiencia en la administración de regímenes antituberculosos complicados. El diseño de los esquemas de TB-XR seguirá la clasificación racional empleada en la TB-MR, intentando emplear el máximo número de fármacos nuevos20.
En pacientes con TB-MR o TB-XR puede estar indicada una resección pulmonar parcial electiva (lobectomía o resección de cuña) junto con el tratamiento médico cuando la lesión sea bastante localizada, haya una buena reserva respiratoria que permita tolerar la cirugía y se considere que el tratamiento médico pueda ser insuficiente por el patrón de resistencia5.
Nuevos regímenes de tratamientoSe están realizando múltiples ensayos clínicos (https://www.tballiance.org/portfolio) con nuevos fármacos y regímenes para la TB tanto sensible como resistente que permitan acortar la duración del tratamiento. Esto incluye modificaciones de fármacos clásicos (por ejemplo, dosificaciones más altas de R o quinolonas) y la utilización de los últimos fármacos comercializados (bedaquiline o delamanid) u otros como predominad (derivado del metronidazol como delamanid).
Tuberculosis extrapulmonarLos principios subyacentes al tratamiento de la TB pulmonar también se aplican a la extrapulmonar. En las TB extrapulmonares resistentes se aplican los anteriores regímenes descritos. Para la TB extrapulmonar sin sospecha o confirmación de resistencia a fármacos antituberculosos de primera línea se recomienda el mismo régimen que en la pulmonar.
La excepción es la meningitis tuberculosa, donde, a falta de ensayos clínicos concluyentes, la mayoría de los expertos y sociedades recomienda prolongar el tratamiento a 12meses (2meses de R, H, Z y E para continuar con 10meses de R y H). Dado que E21 atraviesa mal la barrera hematoencefálica incluso con las meninges inflamadas, hay clínicos que sugieren utilizar como cuarta droga una FQ en vez de E. En la TB-MR también son de utilidad los aminoglucósidos, al tener buena penetración durante la inflamación aguda. En los pacientes con TB-MR se recomiendan pautas largas de 18-24meses. Según opinión de expertos1, se debe considerar la realización de punciones lumbares para monitorizar los cambios en el recuento celular, glucosa y proteínas. Se debe asociar siempre tratamiento con corticoides, ya que el no utilizarlos aumenta la mortalidad. En la tabla 7 se expone la pauta recomendada por la guía NICE de Reino Unido de 20163. Se debe valorar la cirugía en el caso de elevación de presión intracraneal y presencia de complicaciones como hidrocefalia o abscesos cerebrales tuberculosos22. El tratamiento antituberculoso temprano y el tratamiento adyuvante con glucocorticoides mejoran la supervivencia, pero aun así casi un tercio de los pacientes con meningitis tuberculosa mueren. Se ha estudiado si la intensificación del tratamiento antituberculoso durante los 2 primeros meses con dosis altas de R (15mg/kg/día) y levofloxacino (20mg/kg/día) disminuiría la tasa de muerte entre los pacientes, pero esta estrategia no se asoció con una mayor tasa de supervivencia23.
Propuesta de pauta de corticoides en pacientes con tuberculosis del sistema nervioso central (NICE, 2016)
| Estadio | ||
|---|---|---|
| Dosis de dexametasona por semana | 1 | 2 o 3 |
| 1 | 0,3 mg/kg/día i.v. | 0,4 mg/kg/día i.v. |
| 2 | 0,2 mg/kg/día i.v. | 0,3 mg/kg/día i.v. |
| 3 | 0,1 mg/kg/día oral | 0,2 mg/kg/día i.v. |
| 4 | 3 mg/día oral | 0,1 mg/kg/día i.v. |
| 5 | 2 mg/día oral | 4 mg/día oral |
| 6 | 1 mg/día oral | 3 mg/día oral |
| 7 | – | 2 mg/día oral |
| 8 | – | 1 mg/día oral |
Estadio 1: escala de Glasgow de 15 sin focalidad neurológica y paciente en alerta y orientado.
Estadio 2: escala de Glasgow de 11 a 14 o 15 con focalidad neurológica.
Estadio 3: escala de Glasgow de 3 a 10 con o sin focalidad neurológica.
Se recomienda explorar signos o síntomas que sugieran afectación del sistema nerviosos central en pacientes diagnosticados de TB diseminada3.
Los pacientes con TB en columna vertebral se deben tratar con una pauta de 6meses, a no ser que haya una afectación directa de la médula espinal, circunstancia en la que se debería prolongar hasta los 12meses3. En estos pacientes no se ha demostrado que el desbridamiento quirúrgico aporte beneficio al tratamiento médico, a no ser que haya una pobre respuesta al tratamiento médico con persistencia de la infección, inestabilidad de la columna o evidencia de compresión de médula espinal3.
La TB ganglionar sensible se trata igualmente durante 6meses. Hay que tener en cuenta que los ganglios afectados pueden aumentar durante el tratamiento o aparecer nuevos, durante o después del tratamiento, sin que signifique fracaso del tratamiento o recaída24. Si, de forma ocasional, en un ganglio retirado en una cirugía se estableciera el diagnóstico de TB activa, se debería tratar con el régimen estándar de 6meses3.
La TB pleural sensible se trata igualmente con un régimen de 6meses. No está indicado de rutina el uso de corticoides. El empiema tuberculoso es una complicación rara en la que se produce una infección activa en el espacio pleural con un gran número de bacilos; la mayoría de las veces sucede por rotura de una caverna en el espacio pleural, y en este caso estaría indicado el drenaje25.
En cuanto a la pericarditis tuberculosa sensible, se debe tratar también con una pauta de 6meses. Siempre se ha recomendado el uso de corticoides combinado con el tratamiento tuberculoso. No obstante, estudios recientes no apoyan el uso rutinario de corticoides y es tema de controversia en las diferentes guías1,3. La guía NICE inglesa3 recomienda siempre el uso de corticoides en la pericarditis tuberculosa, y las guías de Estados Unidos1, solo en pacientes con derrame pericárdico importante, altos niveles de marcadores y células de inflamación o signos precoces de constricción. En el caso de necesitar corticoides, se recomienda iniciar con 60mg/día de prednisolona, con un descenso gradual hasta retirarlo en 2 o 3semanas.
La TB renal sensible se debe tratar con el régimen convencional de 6meses. En ocasiones se requieren intervenciones mediante catéteres intraureterales o nefrostomías para resolver procesos obstructivos de la vía urinaria. Se debe considerar la nefrostomía en riñones no funcionales o pobremente funcionales, sobre todo en caso de hipertensión arterial o dolor persistente. La TB genital se maneja igualmente con el tratamiento estándar, aunque en ocasiones sería necesaria la cirugía por la presencia de grandes abscesos residuales tubo-ováricos26.
Ante la falta de estudios, no se recomiendan las pautas intermitentes en las TB extrapulmonares.
Situaciones especialesInfección por VIHEl tratamiento antirretroviral (TAR) plantea interacciones sobre todo con el tratamiento con R, pudiendo ser válido en algunas ocasiones el tratamiento con rifabutina. Si no estamos familiarizados con las interacciones del TAR, conviene siempre visitar una de las webs disponibles sobre interacciones (https://www.cdc.gov/tb/publications/guidelines/tb_hiv_drugs/default.htm, http://www.hiv-druginteractions.org, http://www.interaccionesvih.com). La duración del tratamiento de la TB pulmonar sensible en los pacientes que toman TAR será de 6meses, recomendándose la prolongación de 3meses en la fase de continuación en los casos extraordinarios en los que el paciente no reciba TAR. El uso de regímenes de tratamiento intermitente en el paciente con VIH tiene un mayor número de recaídas y de aparición de resistencias, sobre todo en los pacientes más inmunodeprimidos, por lo que no se recomiendan.
Todos los pacientes con TB e infección por VIH deben tomar TAR, independientemente de los valores de CD41-4. Si el paciente no tomaba anteriormente TAR, debería ser iniciado en las 2 primeras semanas de tratamiento tuberculoso en los pacientes con CD4<50células/μl1,3,4. En aquellos con recuento de CD4≥50células/μl hay cierta discrepancia: las guías estadounidenses de 20161 recomiendan iniciar el TAR entre las 8 y las 12semanas, y en las guías de la OMS de 20174 se recomienda que se haga dentro de las primeras 8 semanas. En los pacientes con meningitis tuberculosa el TAR no debería ser iniciado en las primeras 8semanas del tratamiento de la TB, al aumentar la mortalidad1,3,4.
Debido al denominado síndrome inflamatorio de reconstitución inmune (SIRI), los pacientes con infección por VIH y TB pueden tener una respuesta paradójica con el inicio del tratamiento, presentando un empeoramiento de las manifestaciones de la TB o la aparición de nuevas complicaciones como el desarrollo de derrame pleural, abscesos intraabdominales o retroperitoneales o expansión de lesiones del sistema nervioso central diagnosticadas o no previamente. El SIRI plantea el diagnóstico diferencial con un fracaso de tratamiento de la TB por resistencia a fármacos antituberculosos u otras enfermedades oportunistas. El manejo del SIRI es sintomático. En las formas leves se utiliza antiinflamatorios como el ibuprofeno, en las formas moderadas y severas está indicado el tratamiento con corticoides, utilizándose prednisona a dosis de 1,25mg/kg/día durante 2-4semanas, con descenso progresivo en las 6-12semanas siguientes1.
Edad avanzadaAlgunos expertos y sociedades1,2 recomiendan no emplear Z en pacientes mayores de 65 o de 75años por ser una población con más riesgo de hepatotoxicidad. En ese caso, la fase de continuación con H y R se debería prolongar a los 7meses.
Embarazo y lactanciaTodos los tuberculostáticos de primera línea atraviesan la placenta, pero no parecen tener efecto teratógeno. Aunque tanto R como H, Z y E están clasificados en la categoría C de la FDA27, la inclusión de Z en las pacientes embarazadas es objeto de controversia en Estados Unidos1. La OMS recomienda el empleo de los 4 tuberculostáticos de primera línea en las embarazadas4.
Los efectos fetales de los fármacos antituberculosos de segunda línea no están bien establecidos, pero no se consideran seguros los agentes inyectables y la etionamida o proteonamida. Hay serie de casos de mujeres embarazadas multirresistentes que han presentado buena evolución con los regímenes habituales28,29.
No hay contraindicación para la lactancia si la madre está siendo tratada, e incluso hay que promoverla cuando la paciente ha dejado de ser contagiosa. El lactante debe tomar piridoxina (1-2mg/kg/día), ya que H se detecta en la leche materna, aunque en pequeñas concentraciones1.
Enfermedad renalCon algunos fármacos se requiere ajuste de dosis en pacientes con insuficiencia renal (tabla 5). El intervalo entre las dosis debería incrementarse en pacientes con aclaramiento de creatinina <30ml/min o en los que están en hemodiálisis (tabla 1). Las dosis recomendadas se basan en opinión de expertos, pero en determinadas ocasiones sería necesario medir los niveles de los fármacos en sangre después de 2-6h de administrarlos. En los pacientes en hemodiálisis se recomienda administrar los fármacos antituberculosos bajo TDO después de las sesiones de diálisis para evitar el aclaramiento prematuro de los fármacos antituberculosos. Los pacientes en diálisis peritoneal pueden requerir una monitorización estrecha por el riesgo de toxicidad con medidas de las concentraciones séricas de los fármacos antes y después de las sesiones de diálisis peritoneal1.
Enfermedad hepáticaLa probabilidad de desarrollar una hepatitis farmacológica es mayor en los pacientes con enfermedad hepática avanzada, hepatitisB yC, y trasplante hepático. Como Z es uno de los fármacos que produce más hepatitis, se puede plantear un régimen terapéutico para la TB sensible manteniendo los otros 3 fármacos de primera línea. Igualmente, se podría plantear un régimen terapéutico sin H (tabla 6). En pacientes con enfermedad hepática más avanzada se puede utilizar un régimen terapéutico sin H ni Z, utilizando R y E con una FQ, un fármaco inyectable o cicloserina durante 12-18meses, dependiendo de la extensión de la enfermedad y respuesta. En situaciones de enfermedad grave a veces es necesario utilizar regímenes con baja hepatotoxicidad similares a los que se utilizan en la TB-MR al suspender la toma de R, H y Z.
Tratamiento con inhibidores de TNF-αLa opinión de expertos es que se debe mantener el tratamiento con inhibidores de TNF-α cuando se diagnostica una TB activa, siempre y cuando la situación clínica lo permita. En el caso de que se haya suspendido, no hay consenso sobre cuándo se puede reanudar. Sin embargo, pequeñas series de casos sugieren que es seguro reanudar el tratamiento con inhibidores de TNF-α en pacientes con buena respuesta clínica al completarse al menos 2meses de tratamiento antituberculoso30.
Seguimiento de pacientes con tuberculosisEfectos secundarios de los fármacos antituberculososLos efectos secundarios de los fármacos antituberculosos son frecuentes, por lo que hay que estar familiarizados con ellos. Muchas veces son leves y se pueden resolver con algunas recomendaciones sencillas o tratamientos sintomáticos. Por ejemplo, los pacientes que toman H pueden presentar enrojecimiento con o sin sofocos, palpitaciones o dolor de cabeza de 2 a 3h después de consumir alimentos que contienen tiramina (como queso, vino, carnes curadas y salsa de soja). Esto generalmente se resuelve evitando los alimentos precipitantes.
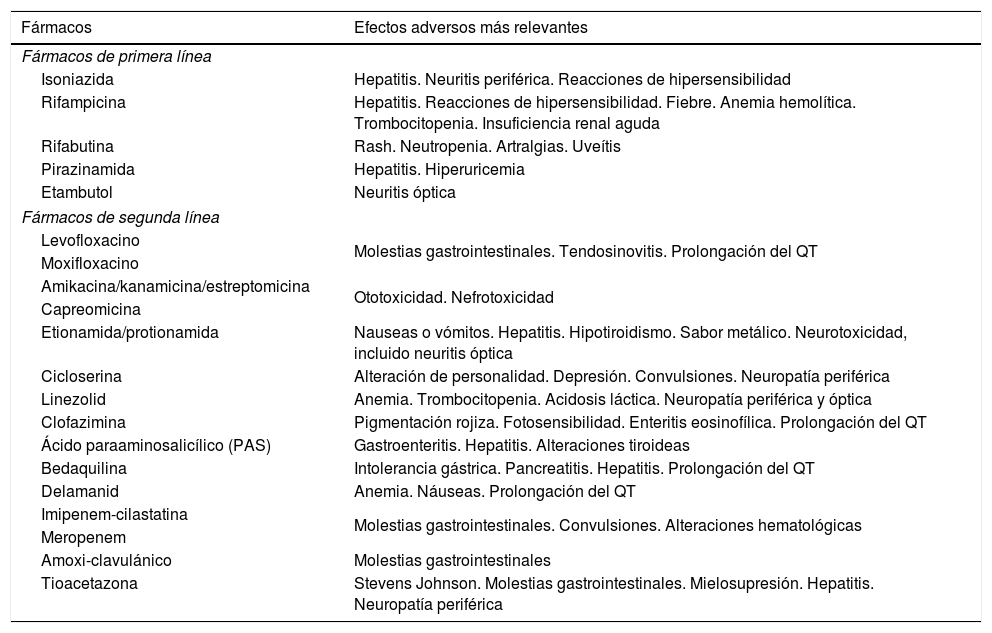
Otras veces son efectos secundarios graves que obligan a la suspensión de determinados fármacos y a realizar nuevos regímenes de tratamiento. En la tabla 8 se exponen los efectos secundarios más relevantes de los fármacos antituberculosos actualmente disponibles.
Principales efectos adversos de los fármacos antituberculosos
| Fármacos | Efectos adversos más relevantes |
|---|---|
| Fármacos de primera línea | |
| Isoniazida | Hepatitis. Neuritis periférica. Reacciones de hipersensibilidad |
| Rifampicina | Hepatitis. Reacciones de hipersensibilidad. Fiebre. Anemia hemolítica. Trombocitopenia. Insuficiencia renal aguda |
| Rifabutina | Rash. Neutropenia. Artralgias. Uveítis |
| Pirazinamida | Hepatitis. Hiperuricemia |
| Etambutol | Neuritis óptica |
| Fármacos de segunda línea | |
| Levofloxacino | Molestias gastrointestinales. Tendosinovitis. Prolongación del QT |
| Moxifloxacino | |
| Amikacina/kanamicina/estreptomicina | Ototoxicidad. Nefrotoxicidad |
| Capreomicina | |
| Etionamida/protionamida | Nauseas o vómitos. Hepatitis. Hipotiroidismo. Sabor metálico. Neurotoxicidad, incluido neuritis óptica |
| Cicloserina | Alteración de personalidad. Depresión. Convulsiones. Neuropatía periférica |
| Linezolid | Anemia. Trombocitopenia. Acidosis láctica. Neuropatía periférica y óptica |
| Clofazimina | Pigmentación rojiza. Fotosensibilidad. Enteritis eosinofílica. Prolongación del QT |
| Ácido paraaminosalicílico (PAS) | Gastroenteritis. Hepatitis. Alteraciones tiroideas |
| Bedaquilina | Intolerancia gástrica. Pancreatitis. Hepatitis. Prolongación del QT |
| Delamanid | Anemia. Náuseas. Prolongación del QT |
| Imipenem-cilastatina | Molestias gastrointestinales. Convulsiones. Alteraciones hematológicas |
| Meropenem | |
| Amoxi-clavulánico | Molestias gastrointestinales |
| Tioacetazona | Stevens Johnson. Molestias gastrointestinales. Mielosupresión. Hepatitis. Neuropatía periférica |
Las alteraciones gastrointestinales son frecuentes y muchas veces se controlan con antiácidos o la utilización de inhibidores de la bomba de protones. Varios fármacos antituberculosos1,4 podrían producir molestias gastrointestinales: R, H, etionamida, PAS, linezolid, FQ, clofazimina y bedaquilina. La mayoría de los antituberculosos se absorben mejor en ayunas, pero a veces no hay más remedio que tomarlos con algún alimento. En ese caso se recomienda que sean pequeñas ingestas de alimentos sin grasas ni azúcares (la glucosa o la lactosa disminuyen la absorción de H). Las absorción de las FQ también desciende marcadamente con la toma de medicamentos que contengan cationes bivalentes (calcio, hierro o zinc)31.
Ante la persistencia de náuseas y vómitos, y sobre todo si se añade dolor abdominal, hay que descartar hepatotoxicidad. La hepatitis farmacológica es el efecto secundario grave más frecuente de los fármacos antituberculosos de primera línea. Si se elevan las cifras de GPT más de 5veces el límite superior de los valores normales o más de 3veces en presencia de síntomas, se deben suspender los fármacos antituberculosos hepatotóxicos. Una vez que los valores de GPT desciendan por debajo del doble del límite superior de los valores normales, podemos ir reintroduciendo los fármacos de manera individualizada. Los fármacos se deben reintroducir en un tiempo espaciado de una semana, para observar si se produce elevación de nuevo de las cifras de GPT. Mientras se produce la reintroducción de los fármacos, en ocasiones se pauta un régimen terapéutico con bajas probabilidades de hepatotoxicidad. Se recomienda reintroducir primero R, ya que produce menos hepatotoxicidad que H o Z. No obstante, hay que tener en cuenta que con el régimen estándar hasta en un 20% de los pacientes se produce una elevación asintomática de las transaminasas que la mayoría de las veces se resuelve espontáneamente1,32.
Todos los fármacos antituberculosos pueden producir rash. La mayoría de las veces es leve y se acompaña de prurito sin afectar las mucosas o presentar síntomas sistémicos como fiebre, y puede tratarse sintomáticamente con antihistamínicos. Si se produce un rash eritematoso grave y sobre todo con afectación de mucosas o fiebre, hay que parar el tratamiento antituberculoso, pues podemos estar ante un síndrome de Stevens-Johnson o ante un síndrome de hipersensibilidad asociado a fármacos (DRESS). Los corticosteroides sistémicos se pueden utilizar para tratar reacciones sistémicas severas, no empeorando la evolución de la TB33. La mayoría de las veces es difícil saber cuál ha sido el agente causante34. Cuando la erupción ha mejorado sustancialmente, los medicamentos se pueden reiniciar individualmente en intervalos de 2-3días para estudiar qué fármaco está implicado.
Varios fármacos antituberculosos pueden estar asociados a neuropatía periférica: H, etionamida, cicloserina y linezolid. Se debe administrar piridoxina (vitaminaB6) en los pacientes que tengan más riesgo para padecer neuropatía: embarazadas, infectados por el VIH, diabéticos, alcohólicos, malnutridos, pacientes con insuficiencia renal crónica y pacientes de edad avanzada1,3. La dosis recomendada es de 25-50mg/día y de 100mg/día para pacientes con neuropatía periférica establecida o pacientes con TB-MR que tengan asociados varios fármacos que puedan provocar neuropatía. Los fármacos antituberculosos asociados con la toxicidad del nervio óptico incluyen E, linezolid, etionamida y H. La toxicidad de clofazimina produce maculopatía pigmentaria y degeneración retiniana1,5.
Por último, comentar que linezolid no debe administrarse junto con inhibidores selectivos de la recaptación de serotonina o antidepresivos tricíclicos o una dieta rica en alimentos que contengan tiramina por riesgo de desarrollar un síndrome serotoninérgico35.
Estudios microbiológicosEn la TB sensible se recomienda realizar baciloscopia y cultivo de esputo mensualmente hasta obtener cultivos negativos de 2 muestras consecutivas. Es de gran importancia, como hemos comentado anteriormente, el estudio, al finalizar la fase intensiva en la TB pulmonar sensible, para determinar la duración del tratamiento. No debemos suspender el tratamiento con E y Z tras finalizar la fase intensiva de tratamiento de la TB sensible hasta que conozcamos el resultado de los estudios de resistencia, para evitar la monoterapia con R en caso de resistencia a H. En la TB-MR se recomienda realizar baciloscopia y cultivo de esputo mensualmente hasta obtener cultivos negativos de 2 muestras consecutivas; posteriormente se podría realizar cada 2meses.
En ocasiones sucede que durante el tratamiento un paciente tiene baciloscopias positivas, siendo los cultivos posteriores negativos, debido a que existen bacilos muertos, lo que suele suceder en pacientes con grandes cavernas. Por la misma razón no se debe monitorizar durante el seguimiento con test moleculares repetidos, pues detectarán el material genético de los bacilos muertos1-4.
Estudios analíticos en el seguimientoEn el estudio inicial se recomienda realizar una serología de VIH, hepatitisB yC. No es necesario realizar una monitorización de las transaminasas y bilirrubina, a no ser que el paciente tenga valores anormales basales, síntomas de hepatotoxicidad, consumo abusivo de alcohol o de otros fármacos hepatotóxicos, o tenga antecedentes de enfermedad hepática o hepatitis vírica o infección por VIH. En los pacientes con TB-MR se recomienda realizar estudios analíticos con periodicidad mensual (al inicio semanal), variable según la situación clínica, de función renal si están recibiendo tratamiento con inyectables y hemograma si están tomando linezolid. Se realizarán controles de función tiroidea con una periodicidad de 3meses si recibe tratamiento con etionamida o PAS1-5.
Otros controles durante el seguimientoLos pacientes que están en tratamiento con fármacos inyectables deben someterse a audiometrías de control con una periodicidad mensual. Varios fármacos prolongan el QT, por lo que, dependiendo de la dosis y de la asociación de fármacos, se hará un seguimiento más estrecho. Si reciben dosis normales de moxifloxacino se recomienda hacer un ECG cada 2-3meses7, y si se trata con bedaquilina, hay que realizar un ECG al menos en las semanas 2, 12 y 24. A los pacientes que tengan tratamiento mantenido con E, linezolid y clofazimina se recomienda control oftalmológico mensual de agudeza visual y discriminación de color5. En las visitas médicas hay que hacer anamnesis dirigida en busca de efectos secundarios como acufenos, parestesias…, que muchas veces no son relacionados con la mediación por el paciente. También hay que estar alerta sobre alteraciones psiquiátricas que puedan aparecer durante el tratamiento con cicloserina, aunque no solo, pues también se han descrito este tipo de alteraciones tras la toma de H, E y etionamida.
Tuberculosis recurrente y fracasos del tratamientoSe habla de TB recurrente cuando un paciente que había tenido una respuesta clínica favorable y cultivos negativos mientras recibía tratamiento antituberculoso, al completar el tratamiento presenta un deterioro clínico, radiológico o tiene cultivos positivos. En estos casos hay que distinguir entre una recaída, desarrollo de TB resistente o reinfección en contextos de alta incidencia o donde el control de las infecciones es deficiente. Se considera que las verdaderas recaídas son TB recurrentes, causadas por la misma cepa que se identificó previamente, y se deben al fracaso de la quimioterapia para esterilizar los tejidos del huésped, permitiendo así el recrudecimiento endógeno de la infección original1. La mayoría de las recaídas ocurren dentro de los primeros 6-12meses tras la finalización de la terapia36. En la mayoría de los pacientes con TB sensible a fármacos de primera línea y tratados con TDO con regímenes que contienen rifamicinas, las recaídas se producen con organismos susceptibles y se pueden tratar de nuevo con el régimen estándar. Sin embargo, el riesgo de resistencia adquirida es sustancial en los pacientes que no tuvieron TDO o recibieron un régimen intermitente, sobre todo en los pacientes con infección por VIH o que recibieron un régimen que no contenía rifamicinas. Hay que tener en cuenta que, si no se realizó una prueba inicial de susceptibilidad a los fármacos antituberculosos, existe una alta probabilidad de que los organismos fueran resistentes desde el principio37-39. Algunos expertos sugieren precaución al interpretar los resultados de las pruebas moleculares utilizadas en el momento de la sospecha de las recurrencias, pues se han descrito falsos positivos en los estudios moleculares de resistencia en pacientes previamente tratados40.
En Europa y en la OMS el fracaso del tratamiento se define como la presencia de cultivos positivos a los 5meses (4meses en Estados Unidos) de tratamiento en un paciente que recibe quimioterapia apropiada1,3,4. Hay que tener en cuenta que el 90-95% de los pacientes con TB pulmonar sensible a fármacos, incluso con cavitación pulmonar extensa, tendrán los cultivos negativos después de 3meses de tratamiento con un régimen estándar. Por lo tanto, se debe evaluar cuidadosamente a los pacientes con cultivos persistentemente positivos después de 3meses de tratamiento. Existen múltiples razones para que se produzca un fracaso terapéutico: mala adherencia al tratamiento, errores en la prescripción, resistencia a fármacos antituberculosos no detectada previamente, malabsorción de los fármacos (diarrea, resección previa de estómago o de intestino delgado, gastroparesia diabética…). Tanto en las recaídas con sospecha de resistencia a fármacos como en los fracasos terapéuticos hay que tener cuidado a la hora de diseñar tratamientos empíricos, en espera de los nuevos estudios de resistencia que se deben realizar. Podemos generar más resistencias a fármacos si los resultados de los estudios de resistencia se retrasan. Nunca se debe añadir un único fármaco a un régimen de tratamiento que ha fallado5. Estos tratamientos empíricos han de basarse en los regímenes de TB multirresistente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion.