Se analizó la evolución de la resistencia a cefalosporinas de 3.a generación, imipenem y otros antibióticos en aislamientos invasivos de Klebsiella pneumoniae (K. pneumoniae) según resultados de EARS-Net entre 2010 y 2014 en España.
MétodosParticiparon 42 hospitales de 16 Comunidades Autónomas, con una cobertura poblacional aproximada del 33%.
ResultadosSe aislaron 7.140 cepas de K. pneumoniae de un mismo número de pacientes. Las resistencias globales (I+R) fueron: cefotaxima 15,8%, ceftazidima 13,7%, imipenem 1,7%, ciprofloxacina 20,1%, tobramicina 14,1%, gentamicina 10,4% y amikacina 1,9%.
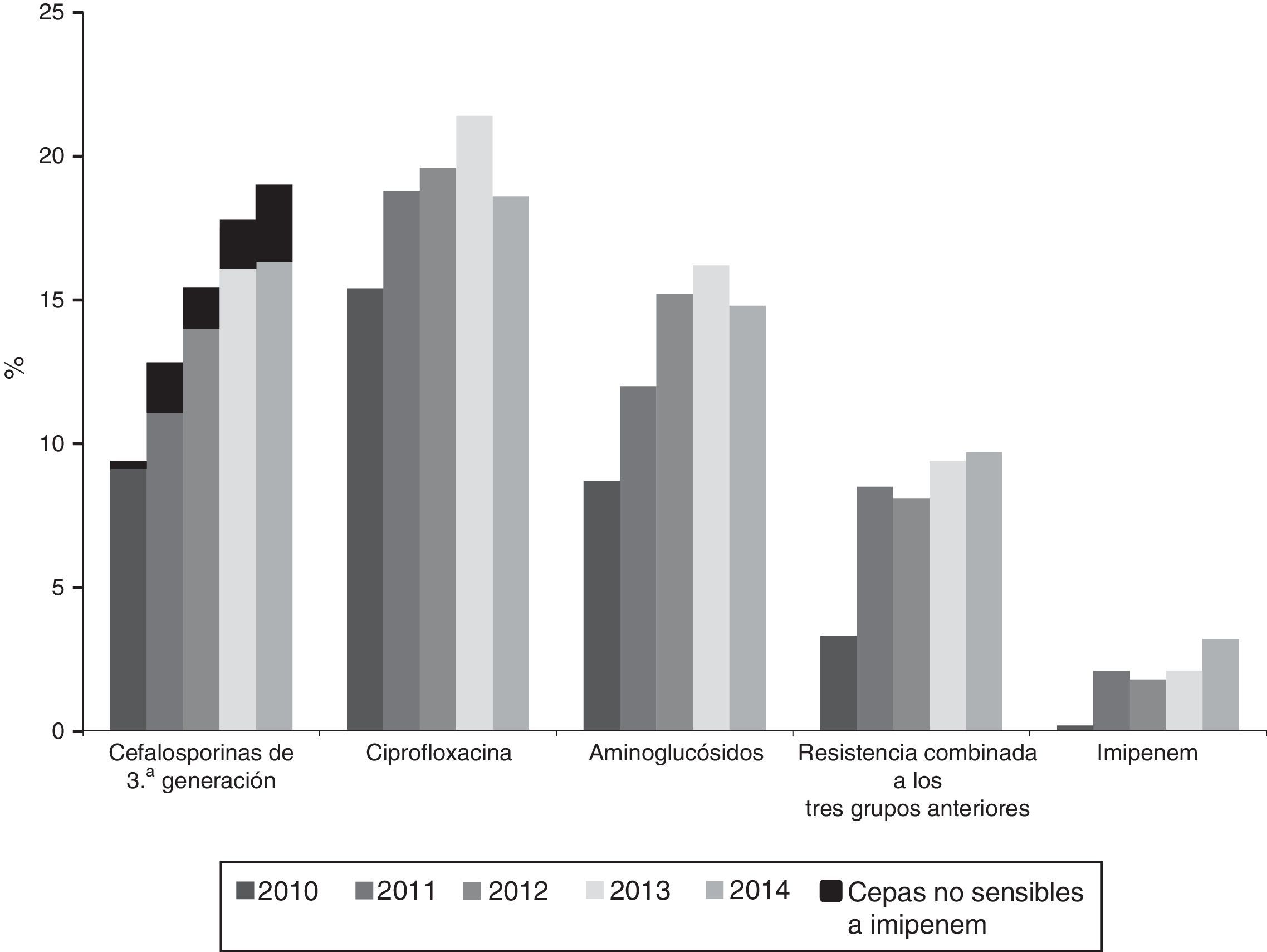
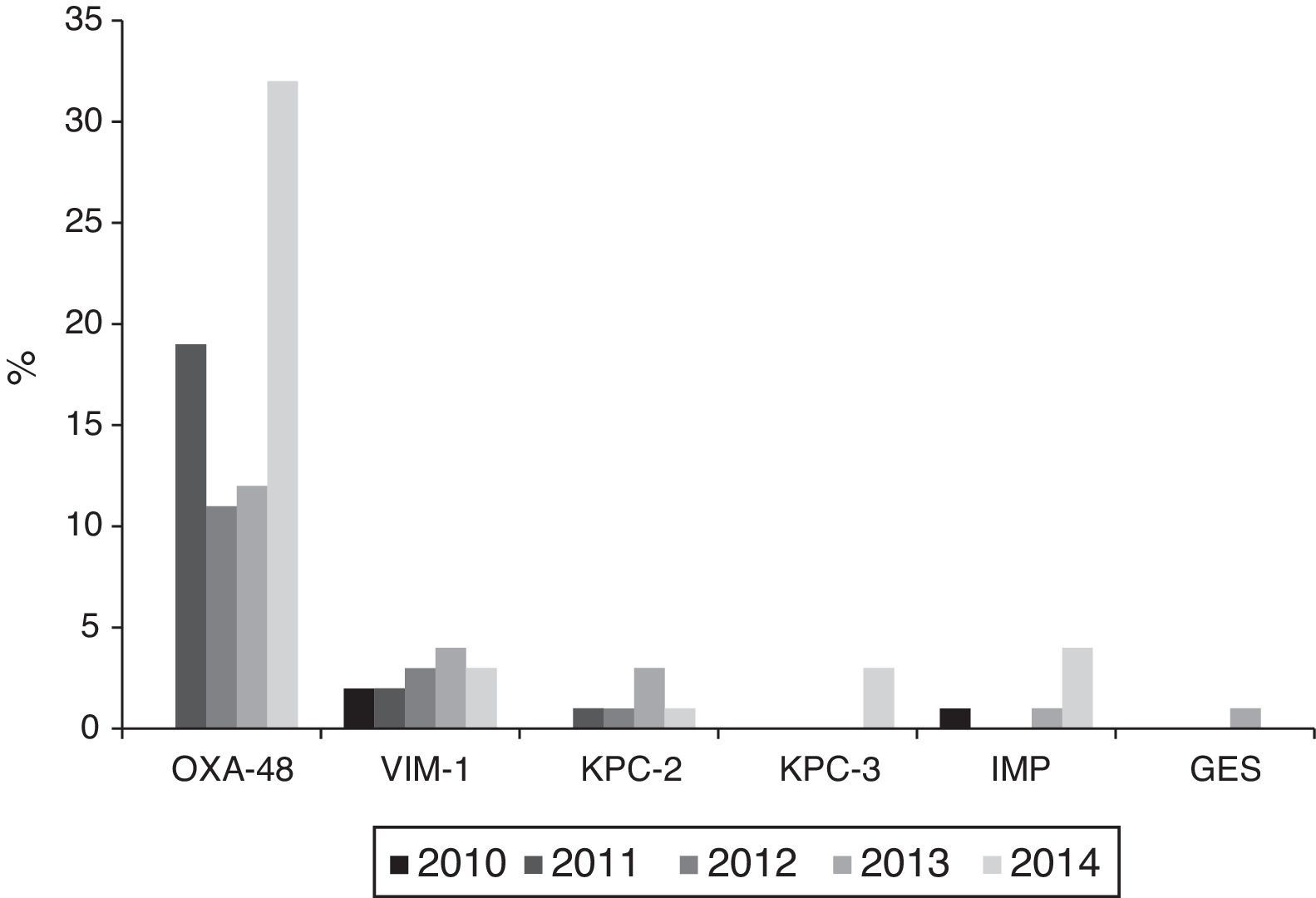
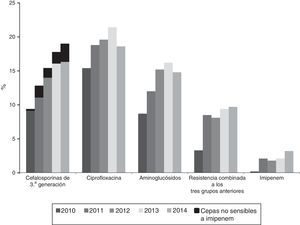
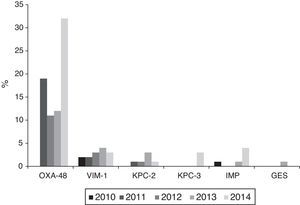
La resistencia a cefalosporinas de 3.a generación aumentó desde el 9,8% (2010) al 19% (2014); la de ciprofloxacina desde el 15,4% (2010) al 19,6% (2014); la de gentamicina desde el 6,2% (2010) al 10,3% (2014) y la de tobramicina desde el 7,1% (2010) al 14,2% (2014) (p< 0,001 en todos los casos). Las cepas resistentes a la vez a cefalosporinas de 3.a generación, ciprofloxacina y aminoglucósidos aumentaron desde el 3,3% (2010) al 9,7% (2014) (p<0,001). La resistencia a imipenem aumentó desde el 0,27% (2010) al 3,46% (2014) (p< 0,001); 121 aislados fueron resistentes a imipenem, de los cuales 104 (86%) produjeron carbapenemasas: 74 OXA-48, 14 VIM, 9 KPC (6 KPC-2 y 3 KPC-3), 6 IMP y 1 GES.
ConclusionesEn un periodo de 5 años (2010-2014), la resistencia a cefalosporinas de 3.a generación en K. pneumoniae invasivas en España se ha duplicado; la resistencia combinada a cefalosporinas de 3.a generación, ciprofloxacina y aminoglucósidos se ha triplicado; la resistencia a imipenem ha aumentado casi 13 veces, principalmente por la diseminación de aislados productores de carbapenemasas.
An analysis was made about the evolution of resistance to 3rd generation cephalosporins, imipenem, and other antibiotics in invasive isolates of Klebsiella pneumoniae (K. pneumoniae) according to the Spanish EARS-Net database (2010-2014).
MethodsForty-two hospitals from 16 Autonomous Communities with an approximate population coverage of 33% participated.
ResultsA total 7,140 pneumoniae corresponding to the same number of patients were studied. Overall resistance percentages (I+R) were: cefotaxime 15.8%, ceftazidime 13.7%, imipenem 1.7%, ciprofloxacin 20.1%, tobramycin 14.1%, gentamicin 10.4%, and amikacin 1.9%.
Resistance to 3rd generation cephalosporins increased from 9.8% (2010) to 19% (2014); to ciprofloxacin from 15.4% (2010) to 19.6% (2014); to gentamicin from 6.2% (2010) to 10.3% (2014) and to tobramycin from 7.1% (2010) to 14.2% (2014) (p<.001 in all cases). Combined resistance to 3rd generation cephalosporins, ciprofloxacin, and aminoglycosides increased from 3.3% (2010) to 9.7% (2014) (p<.001). Resistance to imipenem also increased from 0.27% (2010) to 3.46% (2014) (p<.001). A total of 121 isolates were resistant to imipenem, of which 104 (86%) produced carbapenemases: 74 OXA-48, 14 VIM, 9 KPC (6 KPC-2 and 3 KPC-3), 6 IMP, and 1 GES.
ConclusionsOver the 5 year period (2010-2014), resistance to 3rd generation cephalosporins in invasive K. pneumoniae in Spain has doubled. The combined resistance to 3rd generation cephalosporins, ciprofloxacin, and aminoglycosides has tripled, and imipenem resistance has increased almost 13 times, mostly due to the spread of carbapenemase-producing isolates.
La resistencia a antibióticos constituye una de las principales amenazas a la salud pública y a la salud individual de los pacientes en todo el mundo (1-3). La mayor prioridad ante esta situación es la vigilancia de los patógenos resistentes con un alto impacto clínico y epidemiológico, capaces de ocasionar brotes y epidemias y con pocas opciones terapéuticas1–3.
Klebsiella pneumoniae (K. pneumoniae) es uno de estos patógenos, capaz de generar importantes brotes nosocomiales en unidades de riesgo como UCI, oncohematología o neonatología4. Entre las principales opciones terapéuticas para el tratamiento de infecciones invasivas producidas por K. pneumoniae se encuentran las cefalosporinas de 3.a generación (cefotaxima, ceftazidima); sin embargo la reciente diseminación de cepas de K. pneumoniae resistentes a estos antibióticos ha generado un importante problema clínico y epidemiológico debido a que: i) se reducen las opciones terapéuticas debido a la corresistencia, ii) aumenta el consumo de antibióticos carbapenémicos considerados antibióticos de última línea, es decir los que se utilizan cuando la bacteria es resistente al resto de los antibióticos.
EARS-Net es la red oficial europea de vigilancia de la resistencia a antibióticos en patógenos invasivos. Coordinada por el Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC, http://ecdc.europa.eu/en/Pages/home.aspx) desde 2010, en la actualidad recoge información de 31 países, 460 laboratorios y 1.300 hospitales5. El sistema de vigilancia es continuo, no basado en cortes de prevalencia.
EARS-Net es una red formada por la suma de las redes nacionales establecidas en los diferentes países europeos. La red española funciona de acuerdo con las recomendaciones generales de EARS-Net y está constituida por una red de hospitales centinela, representativos de la geografía española, que recogen datos de infecciones invasivas (sangre y LCR) causadas por bacterias con un alto impacto clínico y una gran capacidad de desarrollar resistencia a antibióticos. Dicha información se envía con una periodicidad cuatrimestral al Centro Nacional de Microbiología (CNM) del Instituto de Salud Carlos III (ISCIII) para su análisis y posterior envío al ECDC. Los patógenos sometidos a vigilancia por EARS-Net en la actualidad son: Escherichia coli, K. pneumoniae, Pseudomonas aeruginosa, Acinetobacter ssp., Staphylococcus aureus, Streptococcus pneumoniae, Enterococcus faecalis y Enterococcus facium. La cobertura poblacional de EARS-Net en España es de 14.600.000 habitantes, en torno al 33% de la población en 2014, y a nivel europeo es alrededor de 100 millones de personas.
El objetivo de este estudio es analizar la evolución de la resistencia a cefalosporinas de 3.a generación y otros antibióticos, en aislados de hemocultivo de K. pneumoniae en un periodo de 5 años (2010-2014) según datos recogidos por la red EARS-Net en España. Además en los aislados con sensibilidad reducida a imipenem (resistentes e intermedios) se identificó la producción de carbapenemasas y la clase a la que pertenecían.
Material y métodosSe analizaron todos los aislados de K. pneumoniae recogidos de sangre por los hospitales españoles participantes en EARS-Net durante los años 2010-2014. Participaron 42 hospitales pertenecientes a 16 CC. AA.; 38 (90,5%) de ellos (15 CC. AA.) aportaron información durante los cinco años. Solo se incluyó el primer aislamiento por paciente y año.
Los hospitales participantes fueron: 2 primarios, 12 secundarios y 28 terciarios. Quince hospitales tenían entre 200 y 500 camas, 20 entre 500 y 1.000 y 7 con más de 1.000. Dos hospitales terciarios recogieron datos de otros hospitales asociados de menos de 100 camas.
Los antibióticos que se someten a vigilancia en K. pneumoniae son: cefotaxima, ceftazidima, gentamicina, tobramicina, amikacina, ciprofloxacina e imipenem. EARS-Net España también incluye: amoxicilina-ácido clavulánico, piperacilina-tazobactam y cotrimoxazol.
La recogida y el análisis de datos de sensibilidad a antibióticos se realizaron de acuerdo con los procedimientos generales de EARS-Net (http://ecdc.europa.eu/en/activities/surveillance/EARS-Net/Documents/2015-EARS-Net-reporting-protocol.pdf). Cada laboratorio determinó la sensibilidad a antibióticos e interpretó sus resultados con los métodos y criterios de interpretación que habitualmente utiliza. El estudio de sensibilidad de K. pneumoniae fue realizado en todos los casos mediante la microdilución comercial. Los datos fueron remitidos prospectivamente al CNM del Instituto de Salud Carlos III donde se incorporaron a una base de datos común mediante la aplicación del programa de uso libre Whonet de la Organización Mundial de la Salud,6; asimismo se procedió a su validación y al análisis de los resultados según las utilidades al efecto del mismo programa. Los resultados de sensibilidad fueron interpretados según criterios del Clinical Laboratory Standards Institute (CLSI)7. Los criterios del European Committee on Antimicrobial Susceptibility Testing (EUCAST) no se aplicaron de forma general debido a que algunos de los sistemas comerciales utilizados por los hospitales participantes durante el periodo de estudio no incluyeron un rango de concentraciones adecuado para su aplicación; sin embargo, sí se utilizaron para realizar un análisis comparativo de la evolución de la resistencia a cefalosporinas de 3.a generación8,9.
En este trabajo se ha considerado sensibilidad reducida a un antibiótico como la ausencia de sensibilidad (sensibilidad intermedia y resistencia) a dicho antibiótico.
Durante los cinco años del estudio, todos los laboratorios participantes se sometieron a un control de calidad externo organizado anualmente por NEQAS (http://www.ukneqasmicro.org.uk/).
Aunque no es una información registrada por EARS-Net de rutina, en los aislados con sensibilidad reducida a imipenem (CMI >1mg/l) se estudió la producción de carbapenemasas y, en caso positivo, se identificó la clase de carbapenemasas por métodos fenotípicos y genotípicos previamente descritos10.
La comparación de la prevalencia de resistencia a antibióticos entre los distintos grupos y las medidas de asociación se calculó mediante la prueba de χ2 aplicada a tendencias evolutivas, con un intervalo de confianza (IC) del 95%. En todas las comparaciones se rechazó la hipótesis nula con una p <=0,05. El análisis estadístico se realizó con el programa informático GraphPad Prism 6 (Graph Pad Prism Sofware Inc. 7825 Fay Avenue, Suite 230 La Jolla, CA 92037 EE. UU.).
ResultadosResultados generalesEntre 2010 y 2014 EARS-Net España registró en total 7.140 aislados de K. pneumoniae procedentes de hemocultivo (media anual: 1.428; rango: 1.198-1.604; mediana: 1.161). La distribución anual fue: 1.198 aislados en 2010, 1.251 en 2011, 1.509 en 2012, 1.578 en 2013 y 1.604 en 2014. El aumento de aislados de los dos últimos años fue debido a la incorporación de dos grandes hospitales universitarios que aportaron un número elevado de aislamientos.
Globalmente la distribución por edades fue: 534 (7,5%) aislados se obtuvieron de pacientes de 0 a 14 años de edad; 2.545 (35,6%) en pacientes de 15 a 64 años y 4.061(56,9%) en pacientes de 65 años o más. Por servicios hospitalarios, 2.579 (36,1%) aislados procedieron de servicios médicos, 1.880 (26,3%) de urgencias, 1.238 (17,3%) de UCI, 839 (11,8%) de servicios quirúrgicos y 604 (8,5%) de otros servicios.
La resistencia a antibióticos β-lactámicos en los 7.140 aislamientos fue: amoxicilina-ácido clavulánico 23,3%, cefotaxima 15,8%, ceftazidima 13,7%, piperacilina-tazobactam 13,1% e imipenem 1,7%.
El antibiótico no β-lactámico que presentó una mayor resistencia fue cotrimoxazol (22,4%), seguido de ciprofloxacina (20,1%), tobramicina (14,1%), gentamicina (10,4%) y amikacina (1,9%).
Evolución temporal de la resistenciaLos análisis de tendencias evolutivas de la resistencia antibiótica y todos los análisis posteriores se calcularon solo a partir de los resultados de los 38 hospitales que participaron durante todo el periodo de estudio; se estudiaron 6.076 aislamientos de K. pneumoniae entre 2010 y 2014 (media anual: 1.215,2; rango: 1.072-1.416); de ellos, 1.072 se aislaron en 2010, 1.047 en 2011, 1.215 en 2012, 1.326 en 2013 y 1.416 en 2014.
Por edades, 421 aislamientos (6,9%) procedieron de pacientes de 0 a 14 años de edad, 1.864 (30,7%) de pacientes de 15 a 64 años y 3.791 (62,4%) de 65 años o más. Por servicios, 2.189 aislamientos (36%) procedieron de servicios médicos, 1.621 (26,7%) de urgencias, 1.055 (17,3%) de UCI, 736 (12,1%) de servicios quirúrgicos y 475 (7,8%) de otros servicios.
La evolución anual de la resistencia a antibióticos según criterios CLSI se muestra en las figuras 1 y 2. El porcentaje de resistencia a cefalosporinas de 3.a generación aumentó desde el 9,8% (IC95%: 8,0-11,6%) (101 aislamientos con sensibilidad reducida) en 2010 al 19% (IC95%: 16,9-21,1%) en 2014 (269 aislamientos) (Ӽ2de la tendencia: 50,5; p<0,0001) (fig. 1). Esta tendencia evolutiva también se observó al estudiar por separado cefotaxima y ceftazidima como sigue: del 9,8% (95%: 8,0-11,6%) al 19,4% (IC95%: 17,3-21,5%) para cefotaxima (Ӽ2de la tendencia: 50,9; p<0,0001) y del 8,4% (IC95%: 6,8-10%) al 19% (IC95%: 16,9-21,1%) (Ӽ2de la tendencia: 46; p<0,0001) para ceftazidima. El incremento significativo de la resistencia detectado con criterios CLSI también se mantuvo al calcular la tendencia mediante los puntos de corte recomendados por EUCAST; la resistencia a cefalosporinas de 3.a generación según criterios EUCAST aumentó desde el 10,2% en 2010 al 20% en 2014 (Ӽ2de la tendencia:47; p<0,0001).
La resistencia a ciprofloxacina aumentó desde el 15,4% (IC95%: 13,3-17,5%) en 2010 (138 aislamientos con sensibilidad reducida) al 19,6% (IC95%: 17,5-21,7%) en 2014 (263 aislamientos) (Ӽ2de la tendencia: 13,3; p: 0,0002) (fig. 1).
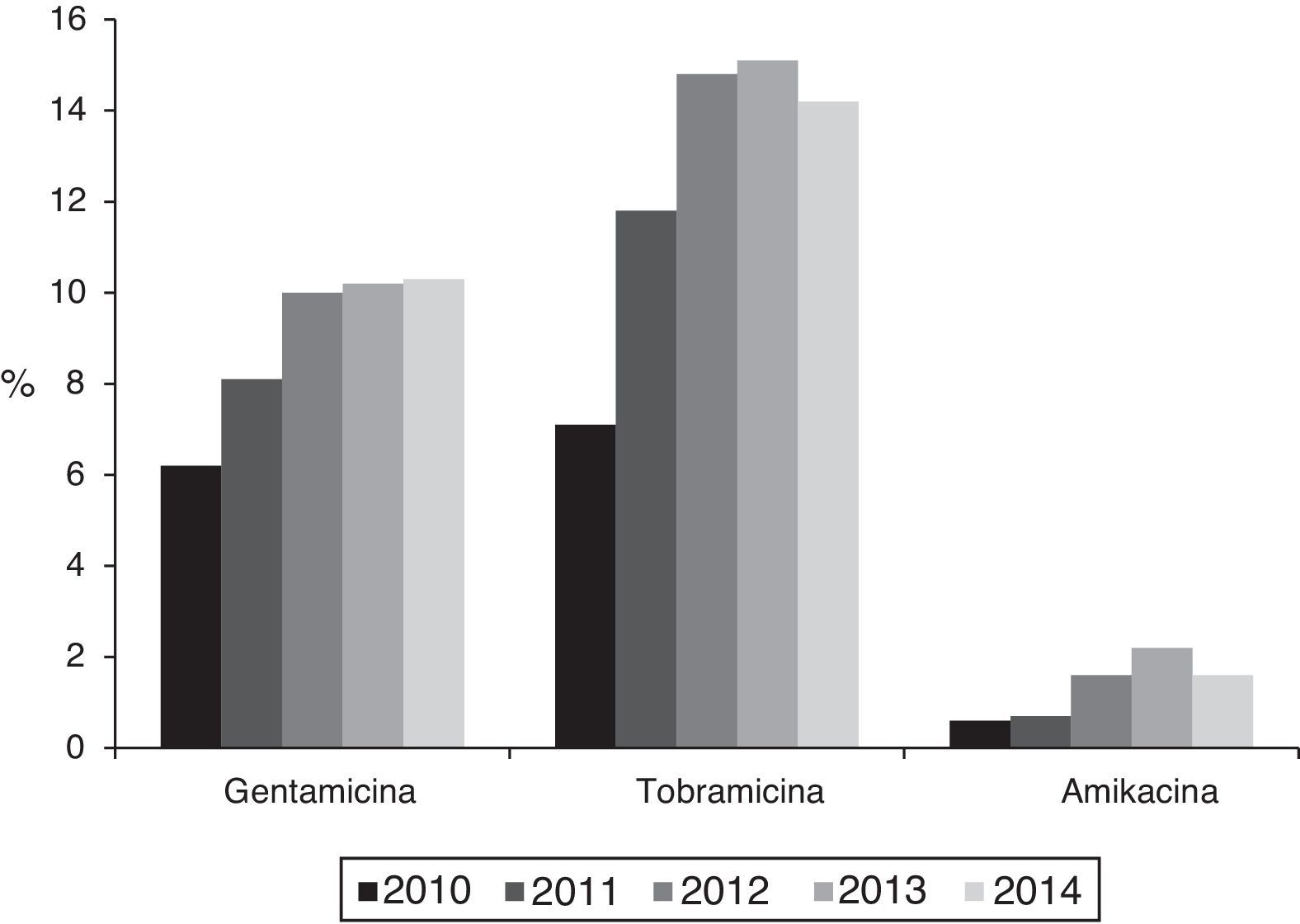
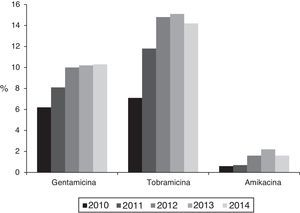
El porcentaje de aislamientos con sensibilidad reducida a al menos uno de los antibióticos aminoglucósidos probados (gentamicina, tobramicina y amikacina) aumentó desde el 8,8% (IC95%: 7,2-10,4%) al 14,8% (IC95%: 12,8-16,8%) entre 2010 y 2014 (Ӽ2de la tendencia: 24,9; p<0,0001) (fig. 1). Analizados individualmente, el mayor aumento se detectó en la resistencia a tobramicina que aumentó desde el 7,1% (IC95%: 5,9-8,6%) en 2010 (76 aislamientos con sensibilidad reducida) al 14,2% (IC95%:12,2-16,2%) en 2014 (201 aislamientos) (Ӽ2de la tendencia:49; p<0,0001). Por su parte, la resistencia a gentamicina aumentó desde el 6,2% (IC95%: 4,7-7,7%) en 2010 (67 aislamientos con sensibilidad reducida) al 10,3% (IC95%: 8,7-11,9%) en 2014 (146 aislamientos) (Ӽ2de la tendencia:14,2; p: 0,0002), y la resistencia a amikacina fue del 0,6% (IC95%: 0-1,2%) en 2010 (6 aislamientos) y del 1,6% (IC95%: 1-2,2%) en 2014 (23 aislamientos) (Ӽ2de la tendencia: 7,2; p=0,007) (fig. 2).
La resistencia a imipenem aumentó desde el 0,27% (IC95%: 0-0,6%) en 2010 (3 aislamientos) al 3,46% (IC95%: 2,5-4,5%) en 2014 (49 aislados) (x 12,8 veces; Ӽ2de la tendencia: 24,1; p<0,0001). En total se identificaron 121 aislamientos con sensibilidad reducida a imipenem, 42 (32,5%) con sensibilidad intermedia (CMI=2mg/l) y 79 (67,5%) con alto nivel de resistencia (CMI> 2mg/l).
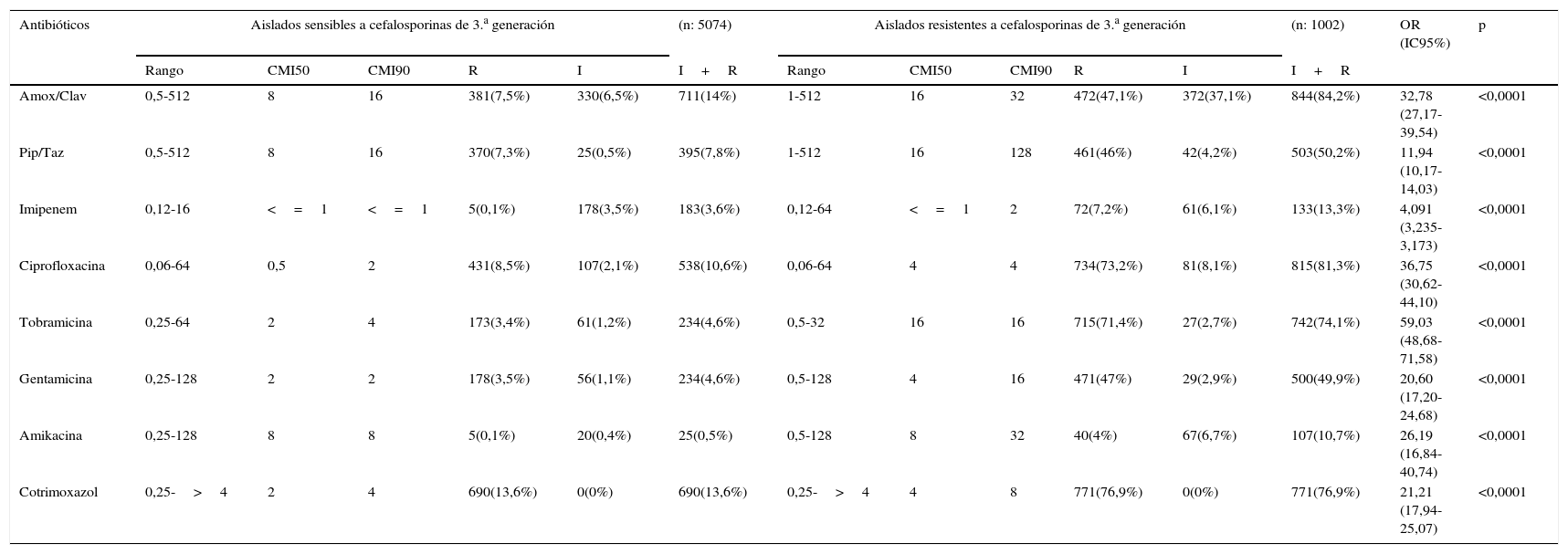
En los 1.002 aislados con sensibilidad reducida a cefalosporinas de 3.a generación se observó una alta corresistencia a otros antibióticos tales como amoxicilina/ácido clavulánico, piperacilina/tazobactam, imipenem, ciprofloxacina, tobramicina, gentamicina, amikacina y cotrimoxazol, que fue significativamente superior a la observada en los aislamientos sensibles a estos antibióticos (tabla 1).
Sensibilidad a otros antibióticos de Klebsiella pneumoniae sensibles y resistentes a cefalosporinas de 3.a generación según datos de la red EARS-Net en España (2010-2014)
| Antibióticos | Aislados sensibles a cefalosporinas de 3.a generación | (n: 5074) | Aislados resistentes a cefalosporinas de 3.a generación | (n: 1002) | OR (IC95%) | p | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rango | CMI50 | CMI90 | R | I | I+R | Rango | CMI50 | CMI90 | R | I | I+R | |||
| Amox/Clav | 0,5-512 | 8 | 16 | 381(7,5%) | 330(6,5%) | 711(14%) | 1-512 | 16 | 32 | 472(47,1%) | 372(37,1%) | 844(84,2%) | 32,78 (27,17-39,54) | <0,0001 |
| Pip/Taz | 0,5-512 | 8 | 16 | 370(7,3%) | 25(0,5%) | 395(7,8%) | 1-512 | 16 | 128 | 461(46%) | 42(4,2%) | 503(50,2%) | 11,94 (10,17-14,03) | <0,0001 |
| Imipenem | 0,12-16 | <=1 | <=1 | 5(0,1%) | 178(3,5%) | 183(3,6%) | 0,12-64 | <=1 | 2 | 72(7,2%) | 61(6,1%) | 133(13,3%) | 4,091 (3,235-3,173) | <0,0001 |
| Ciprofloxacina | 0,06-64 | 0,5 | 2 | 431(8,5%) | 107(2,1%) | 538(10,6%) | 0,06-64 | 4 | 4 | 734(73,2%) | 81(8,1%) | 815(81,3%) | 36,75 (30,62-44,10) | <0,0001 |
| Tobramicina | 0,25-64 | 2 | 4 | 173(3,4%) | 61(1,2%) | 234(4,6%) | 0,5-32 | 16 | 16 | 715(71,4%) | 27(2,7%) | 742(74,1%) | 59,03 (48,68-71,58) | <0,0001 |
| Gentamicina | 0,25-128 | 2 | 2 | 178(3,5%) | 56(1,1%) | 234(4,6%) | 0,5-128 | 4 | 16 | 471(47%) | 29(2,9%) | 500(49,9%) | 20,60 (17,20-24,68) | <0,0001 |
| Amikacina | 0,25-128 | 8 | 8 | 5(0,1%) | 20(0,4%) | 25(0,5%) | 0,5-128 | 8 | 32 | 40(4%) | 67(6,7%) | 107(10,7%) | 26,19 (16,84-40,74) | <0,0001 |
| Cotrimoxazol | 0,25->4 | 2 | 4 | 690(13,6%) | 0(0%) | 690(13,6%) | 0,25->4 | 4 | 8 | 771(76,9%) | 0(0%) | 771(76,9%) | 21,21 (17,94-25,07) | <0,0001 |
La tabla 1 solo incluye los aislamientos recogidos en los 38 centros que participaron durante el periodo de estudio completo. Los criterios de interpretación utilizados han sido los del CLSI.
La resistencia combinada a cefalosporinas de tercera generación, ciprofloxacina y aminoglucósidos aumentó desde el 3,3% (IC95%: 2,5-4,1%) en 2010 (35 aislados con sensibilidad reducida) al 9,7% (IC95%: 7,9-11,5%) en 2014 (137 aislados con sensibilidad reducida) (Ӽ2de la tendencia: 33,4; p<0,0001) (fig. 1).
Dentro de la población resistente a cefalosporinas de 3.a generación, la evolución anual de la resistencia a otros antibióticos fue del 64,8% en 2010 al 70,9% en 2014 para aminoglucósidos (p: 0,7), del 71 al 80% para ciprofloxacina (Ӽ2de la tendencia: 5,4; p:0,01) y del 0,27% en 2010 (3 aislamientos) al 3,46% en 2014 (49 aislados) para imipenem (x 12,8 veces; Ӽ2de la tendencia: 20,3; p<0,0001), ya que el 90,7% de los aislados con sensibilidad reducida a imipenem también lo fueron a cefalosporinas de 3.a generación. El impacto del incremento de la resistencia a imipenem sobre la resistencia a cefalosporinas de 3.a generación, se muestra en la figura 1 (en negro en el primer grupo de columnas). Aunque todavía minoritario, dicho impacto es sobre todo notable entre 2012 y 2014 (fig. 1).
Producción de carbapenemasasLos 121 aislamientos detectados a lo largo del periodo de estudio, con sensibilidad reducida a imipenem según puntos de corte de CLSI, procedieron de 28 (68,3%) de los 42 hospitales participantes. De ellos 104 (86%) fueron productores de carbapenemasas: 74 OXA-48, 14 VIM, 9 KPC (6 KPC-2 y 3 KPC-3), 6 IMP y 1 GES. Sin embargo, aplicando los puntos de corte de EUCAST para imipenem, solo 73 de los 121 aislados (60,3%) se habrían categorizado como con sensibilidad reducida, 40 (54,8%) con sensibilidad intermedia (CMI=4-8mg/l) y 33 (45,2%) resistentes (CMI >8mg/l).
La evolución anual de los aislados no sensibles a imipenem según criterios del CLSI fue la siguiente: 3 aislados en 2010 (2 VIM-1 y 1 IMP) procedentes de 3 hospitales; 22 en 2011 (19 OXA-48, 2 VIM-1 y 1 KPC-2) procedentes de 8 hospitales; 22 en 2012 (11 OXA-48, 3 VIM-1 y 1 KPC-2 y 7 aislados no sensibles, no productoras de carbapenemasas) procedentes de 9 hospitales; 25 en 2013 (12 OXA-48, 4 VIM, 3 KPC-2, 1 IMP y 1 GES y 4 aislados no sensibles, no productoras de carbapenemasas) procedentes de 11 hospitales y 49 en 2014 (32 OXA-48, 3 VIM-1, 4 IMP, 3 KPC-3 y 1 KPC-2 y 6 aislados no sensibles, no productoras de carbapenemasas) procedentes de 18 hospitales.
Se detectaron brotes o endemias producidas por K. pneumoniae productora de OXA-48 en 10 hospitales diferentes; siendo estos los responsables de 34 de los aislados, mientras que los 40 restantes se debieron a casos esporádicos. Los aislados productores de VIM-1 se aislaron en 9 hospitales, los de KPC-2 en 3, los de IMP en 3 y por último, los de KPC-3 y GES, en un hospital cada una (fig. 3).
Los aislados con sensibilidad reducida a imipenem presentaron además una alta prevalencia de resistencia a cefotaxima (90,7%), ciprofloxacina (82,5%), gentamicina (50,8%), tobramicina (75,7%) y amikacina (12,7%).
DiscusiónEl aumento de la resistencia a cefalosporinas de 3.a generación en K. pneumoniae aisladas de hemocultivo en Europa es un hecho bastante generalizado en los últimos años, según datos de EARS-Net (http://ecdc.europa.eu/en/healthtopics/antimicrobial_resistance/pages/index.aspx); en 2014, 17 (58,6%) de los 29 países que reportaron información a EARS-Net tuvieron cifras de resistencia iguales o superiores al 20%. No obstante los porcentajes varían ampliamente desde los países nórdicos y centroeuropeos, con niveles bajos de resistencia, tales como Suecia (4,5% en 2014) y Holanda (5,5% en 2014), a otros con niveles intermedios tales como Reino Unido (9,3% en 2014) y Alemania (12,7% en 2014). Otros países del sur de Europa presentan cifras muy superiores tales como Francia (30,7% en 2014), Italia (56, 5% en 2014) y Grecia (72,5% en 2014). Como hemos visto en España el porcentaje fue del 19% en 2014 similar al de Bélgica que fue del 19,2%, sumando cepas intermedias y resistentes (http://ecdc.europa.eu/en/publications/Publications/antimicrobial-resistance-europe-2014.pdf, último acceso 11/1/2016).
En el informe de EARS-Net de 2014, 15 de 20 países europeos reportaron en EARS-Net que la producción de ESBLs fue el principal mecanismo de resistencia a cefalosporinas de 3.a generación en K. pneumoniae con porcentajes entre el el 85% y el 100% de los aislados5. El incremento de la producción de ESBLs en K. pneumoniae se debe fundamentalmente a las familia CTX-M y SHV y en menor medida a la producción de las β-lactamasas AmpC-plasmídicas, principalmente de las familias CIT y DHA, tanto en Europa, incluyendo España9,11–15, como en otros países16–18. En Francia, en un estudio recopilatorio de cepas de Escherichia coli y K. pneumoniae recogidas entre 2009 y 2013, el 20% de los aislamientos de K. pneumoniae fueron productores de BLEE15. En Canadá, el ascenso también ha sido evidente y se ha pasado de un 1,5% de K. pneumoniae productoras de BLEE en 2007 a un 4% en 201116.
En Corea entre 2005 y 2008 se informó de un 26,2% (294/1.121) de cepas de K. pneumoniae resistentes a cefalosporinas de 3.a generación por producción de BLEE; el tipo más prevalente fue SHV (73,2%), concretamente SHV-12 seguida de CTX-M (93,5%), sobre todo CTX-M-14-like y CTX-M-15-like, en ese orden17. En Irán, la prevalencia de BLEE y AmpC era del 28% para ambas, y la prevalencia del gen blaCTX-M del 13,3% para cepas estudiadas de 2007 y 200818.
En general, según datos de EARS-Net, el aumento de las resistencias a cefalosporinas de 3.a generación se relaciona con aumentos de la resistencia asociada a fluoroquinolonas y aminoglucósidos. En 2014, 13 (44,8%) de 29 países europeos tuvieron porcentajes de resistencia combinada a cefalosporina de 3.a generación, fluoroquinolonas y aminoglucósidos iguales o superiores al 20%. Algunos de los países con porcentajes más elevados fueron Francia (23,8% en 2014), Italia (44,4% en 2014) y Grecia (56,8% en 2014). En el caso de España, como hemos visto dicho porcentaje fue del 9,7% en 2014, algo superior al de Bélgica que fue del 7,9% en 2014.
Es importante también resaltar la rápida progresión de la resistencia a cefalosporinas de 3.a generación en periodos de tiempo bastante breves, así ha ocurrido por ejemplo en Francia (19,2% en 2010 y 30,7% en 2014) e Italia (47,2% en 2010 y 57,9% en 2014); sin embargo en otros países los porcentajes de resistencia son mucho más estables e incluso con tendencias negativas como por ejemplo Holanda (7,2% en 2010 y 5,9% en 2014), Alemania (13,4% en 2010 y 13,3% en 2014), Suecia (3,1% en 2010 y 5,8% en 2014) y Reino Unido (11,2% en 2010 y 10,2% en 2014). (http://ecdc.europa.eu/en/publications/Publications/antimicrobial-resistance-europe-2014.pdf, último acceso 11/1/2016). Como hemos visto, en España la progresión de la resistencia también ha sido rápida, más del doble en cinco años, desde el 9,4% en 2010 al 19% en 2014.
Se ha descrito la coselección de los mecanismos de resistencia favorecida por la transmisión conjunta tanto vertical como horizontal de esos mecanismos19–23. Se trata de un problema de alcance mundial y el pasado mes de noviembre, el CDC ha publicado una guía de actuación ante infecciones por Enterobacterias con resistencia múltiple a los antibióticos usados habitualmente en el tratamiento. http://www.cdc.gov/hai/pdfs/cre/CRE-guidance-508.pdf.
Respecto a la resistencia a imipenem, según EARS-Net, 3 de 28 países europeos tuvieron porcentajes de resistencia superiores al 30% en 2014 (Rumanía 34,5%, Italia 36,2% y Grecia 62,7%). Sin embargo, en la mayoría de los países europeos los porcentajes de resistencia son todavía <5%. Recientemente se ha descrito la dispersión de aislados de K. pneumoniae productora de carbapenemasas, entre otras Enterobacterias, en España en al menos el 68% de las provincias, con posibilidad de dispersión interregional10. El hallazgo sugiere un incremento inminente en los años venideros. En este estudio multicéntrico publicado en 2015, únicamente el 9,3% de 379 cepas de Enterobacterias (74,4% K. pneumoniae) productoras de carbapenemasas se aislaron de hemocultivo10. Sin embargo, aunque la prevalencia de aislados de sangre es aún baja en España (3,46% en 2014 según este estudio), ha progresado rápidamente desde el 0,27% de 2010, multiplicándose por 12,8.
En este trabajo, se observó que los puntos de corte clínicos para imipenem de EUCAST presentaron una menor sensibilidad para la detección de producción de carbapenemasa que los del CLSI. Sin embargo, EUCAST recomienda también el estudio de la sensibilidad a meropenem, datos de los que no se disponían en este estudio, así como la aplicación de los puntos de corte epidemiológicos24.
Como posible limitación de los resultados, la red EARS-Net del ECDC, en cuanto a carbapenémicos se refiere, solo vigiló la sensibilidad a imipenem durante el periodo de estudio; asimismo la red utiliza datos de sensibilidad generados por los laboratorios clínicos basados en los métodos propios de cada laboratorio, habitualmente utilizados para el tratamiento de los pacientes. EARS-Net tampoco recoge información sobre tipado molecular; sin embargo existe un Laboratorio Nacional de Referencia en el Centro Nacional de Microbiología, del Instituto de Salud Carlos III, que sí realiza este tipo de determinaciones a disposición del Sistema Nacional de Salud.
El aumento de la resistencia a las cefalosporinas de 3.a generación y a los carbapenémicos (debidos fundamentalmente a la producción de las carbapenemasas) constituyen dos de los hallazgos más importantes de este estudio, con importantes repercusiones clínicas, epidemiológicas y de salud pública.
FinanciaciónLos autores no han recibido ninguna financiación para la realización del trabajo
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
European Centre for Disease Prevention and Control (ECDC); RD 12/0015, Instituto de Salud Carlos III, Subdirección General de Redes y de Investigación Cooperativa, Ministerio de Economía y Competitividad. Convenio de colaboración con la Agencia Española del Medicamento y Productos Sanitarios (Referencia: MEG 1281/14). Red Española de Investigación en Enfermedades Infecciosas (REIPI)
Alejandro González Praetorius (H.G.U. de Guadalajara), María Teresa Cabezas (H. de Poniente, El Ejido, Almería), Isabel Paz Vidal (Comp. Hopit. de Ourense), Gloria Royo (H.G.U. de Elche, Alicante), Beatriz Orden (H. Universitario Puerta de Hierro-Majadahonda, Majadahonda, Madrid), Isabel Wilhelmi (H. Severo Ochoa, Leganés, Madrid), Pilar Berdonces (H. Galdakao, Bizkaia), M. Ángeles Mantecón (H. General Yagüe, Burgos), Jesús Viñuelas y Rosario Sánchez-Benito (H. San Pedro de Alcántara, Cáceres), Carmen Amores (H. San Agustín, Linares, Jaén), Francisco José Vasallo (H. Universitario de Vigo, Vigo, Pontevedra), Carmen Raya (H. del Bierzo, Ponferrada, León), María Fe Brezmes (H. Virgen de la Concha, Zamora), Elena Loza (H. Ramón y Cajal, Madrid), M. José González (H. Infantil del Niño Jesús, Madrid), Victoria Pulián y Marta García-Campello (Complejo Hospitalario de Pontevedra), Eugenio Garduño (H. Infanta Cristina, Badajoz), Ángel Campos (H. de Soria), Ana M. Fleites (H.C. Asturias, Oviedo), Mar Olga Pérez-Moreno y M. José Centelles Serrano (H. Verge de la Cinta, Tortosa, Tarragona), María Dolores Pérez-Ramírez (H.U. Virgen de la Nieves, Granada), Susana Sabater (H.G. de Castellón), Dionisia Fontanals (Corporació Sanitaria Parc Taulí, Barcelona), Natalia Montiel (H. Costa del Sol, Marbella, Málaga), M. Victoria García-López (H. Virgen de la Victoria, Málaga), Juan Carlos Alados y Francisco José Ramírez (H. de Jerez, Cádiz), Carolina Freyre (H. Puerto Real, Cádiz), Ana Isabel Aller (H. Valme, Sevilla), Inocente Cuesta y Carolina Roldán (H. Ciudad de Jaén), Nieves Gonzalo (H. Vega Baja, Orihuela, Alicante), M. Cruz Villuendas (H. Miguel Servet, Zaragoza), Elena Escribano (Complejo Hospitalario de Albacete), Alberto Delgado-Iribarren (Fundación Hospital Alcorcón, Madrid), Alberto Yagüe (H. La Plana, Villareal, Castellón), Jorge Calvo (H. Marqués de Valdecilla, Santander), Carmen Aspiroz (H. Royo Villanova, Zaragoza), María Antonia Miguel (H.U. Canarias), José Antonio Lepe (H. G. U. Virgen del Rocío, Sevilla), Antonio Oliver (H. Universitario Son Espases, Palma de Mallorca), Manuel Antonio Rodríguez-Iglesias (H. Universitario Puerta del Mar, Cádiz), Xabier Beristain (Comp. Hosp. de Navarra. Pamplona, Navarra), Isabel Fernández-Natal (Comp. Asist. Universitario de León-SACYL).