La prescripción de tratamiento antirretroviral (TAR) que contiene potenciadores farmacocinéticos como ritonavir y cobicistat es frecuente. El objetivo de este estudio fue analizar las interacciones potenciales del TAR que incluyen estas moléculas en su formulación con la medicación domiciliaria del paciente, así como el manejo clínico de aquellas potencialmente graves.
MétodosEstudio prospectivo en la consulta de atención farmacéutica de un hospital de tercer nivel entre enero y diciembre de 2018. Se incluyeron en el estudio aquellos pacientes VIH+ con un TAR que contuviera cobicistat o ritonavir. Se analizaron las interacciones potenciales entre el TAR y la medicación concomitante en tres bases de datos (Micromedex®, Drugs.com y Liverpool), se detallaron las intervenciones realizadas, y se analizaron las reacciones adversas encontradas.
ResultadosSe incluyeron 968 pacientes con un total de 2.148 prescripciones (274 principios activos diferentes). Se realizaron un total de 86 intervenciones relativas a interacciones potenciales en los pacientes. Las más frecuentes fueron sustituciones de tratamientos corticoideos, supensiones de tratamiento y monitorizaciones más estrechas. Se analizaron un total de doce sospechas de reacción adversa. El grado de concordancia en la clasificación de la gravedad de las interacciones para cobicistat y ritonavir fue buena entre las tres bases de datos. Resultó destacable Micromedex® como la más completa por tener más principios activos registrados.
ConclusiónLas interacciones entre el TAR con potenciadores farmacocinéticos en su composición y la medicación concomitante es frecuente y requiere de una importante variedad de intervenciones. El chequeo de interacciones en distintas bases de datos es recomendable ya que pueden ocasionar reacciones adversas a medicamentos.
The prescription of antiretroviral treatment (ART) that contains pharmacokinetic enhancers such as ritonavir and cobicistat is frequent. The objective of this stdy was to analyze the potential interactions of ART that include these molecules in their formulation with the patient's home medication, as well as the clinical management of those potentially serious.
MethodsProspective study conducted in the pharmacy care clinic of a third level hospital between January and December of 2018. Those HIV+patients with an ART containing cobicistat or ritonavir were included in the study. Potential interactions between ART and concomitant medication were analysed in three databases (Micromedex®, Drugs.com and Liverpool), the interventions carried out were detailed, and adverse drug reactions analysed.
Results968 patients were included with a total of 2,148 prescriptions (274 different medications). A total of 86 interventions were performed regarding potential interactions in patients. The most frequent were substitutions of corticoid treatments, treatment suspensions and closer monitoring of treatments. A total of possible adverse drug reactions were analysed. The degree of agreement in the severity classification of the interactions for cobicistat and ritonavir was good among the three databases. It was remarkable Micromedex® as the most complete because it has more registered medications.
ConclusionThe interactions between ART with pharmacokinetic enhancers in its composition and concomitant medication is frequent and requires a significant variety of interventions. The check of interactions in different databases is recommended since they can cause adverse drug reactions.
Hoy en día, la esperanza de vida de los pacientes con VIH se acerca mucho a la de las personas no infectadas1. Sin duda, esto es resultado de la alta eficacia de los tratamientos antirretrovirales (TAR) disponibles en la actualidad2. Con una elevadísima cantidad de combinaciones de medicamentos disponibles en el mercado, la mayoría de las guías priorizan aquellas combinaciones que se formulan en un solo comprimido, lo que se denomina combo o en inglés single tablet-regimen (STR). Sin embargo, aunque todos los STR muestran eficacias muy similares, su perfil de seguridad no es el mismo, ya que algunos incluyen en su formulación potenciadores farmacocinéticos también conocidos como boosters, cuyo perfil de interacción es más desfavorable. Esta es una de las principales razones que ha supuesto que, en las actualizaciones más recientes de las Guías europeas y americanas, estos regímenes hayan dejado de estar en primera línea y se hayan posicionado como líneas de tratamiento alternativas2–5.
Los potenciadores farmacocinéticos son medicamentos que aumentan la concentración de otros principios activos en sangre. En el VIH en particular se utilizan desde hace mucho tiempo como potenciadores de los inhibidores de proteasa, y más recientemente de los inhibidores de integrasa. Su uso permite disminuir la dosis y frecuencia de administración. Ritonavir fue el primer potenciador comercializado, y más tarde fue introducido cobicistat, que tiene dos ventajas teóricas sobre el primero; una falta de actividad antirretroviral (lo que le concede una ausencia de riesgo en el desarrollo de resistencias), y un espectro un poco más reducido de interacciones, sobre todo en lo referido a la inducción de determinados enzimas6.
El principal problema de los regímenes que contienen potenciadores es la inhibición inespecífica del citocromo P450 así como de diversos transportadores implicados en el metabolismo, distribución y eliminación de numerosos fármacos. Esto puede resultar en toxicidad de determinados tratamientos a dosis normalmente seguras, como por ejemplo determinadas estatinas, cuyo uso con estos potenciadores puede aumentar el riesgo de rabdomiólisis debido al aumento de su concentración plasmática7, o el riesgo de síndrome de Cushing yatrogénico al alterar el metabolismo de los tratamientos con corticoides y consecuentemente desregular el sistema endocrino8. Por otra parte, al inhibir el metabolismo también puede causar la inhibición de la bioactivación de determinados profármacos como el clopidogrel, y que por tanto no alcancen concentraciones terapéuticas. Si bien es cierto que muchos otros antirretrovirales también se han relacionado con importantes interacciones potenciales (por ejemplo, la inducción enzimática que producen efavirenz o nevirapina, o la interacción entre metformina y dolutegravir) lo cierto es que los regímenes que contienen potenciadores farmacocinéticos han demostrado ser un factor independiente en el aumento del riesgo de interacciones con otros fármacos9. Una herramienta que puede resultar de notable utilidad a la hora de identificar la causalidad de una reacción adversa a un medicamento (RAM) es el algoritmo de Naranjo10. A su vez, para identificar la probabilidad de que dos medicamentos hayan tenido una interacción en un paciente se puede usar de manera complementaria el alogoritmo DIPS11.
Desde este punto de vista, cabe destacar la importancia del papel del farmacéutico en el tratamiento y seguimiento de los pacientes VIH ya que su intervención demuestra reducir las prescripciones potencialmente inapropiadas así como los medicamentos contraindicados12. En la actualidad, el farmacéutico clínico comienza a tener un papel cada vez más definido en el cuidado y seguimiento de estos pacientes, y sus funciones se detallan en guías de prestigio internacional13. En el caso particular de las interacciones entre medicamentos, los farmacéuticos son expertos en la consulta de bases de datos así como en la resolución de interacciones potencialmente graves en colaboración con los médicos14.
Como objetivo principal de este trabajo decidimos analizar las interacciones potenciales del TAR que incluyen potenciadores farmacocinéticos en su formulación con la medicación domiciliaria del paciente, así como el manejo clínico de aquellas potencialmente graves. Como objetivos secundarios: determinar la causalidad de la interacción en la aparición de RAM detectadas en la consulta de atención farmacéutica, y analizar la concordancia entre las bases de datos más comúnmente empleadas por los clínicos para resolver dichas interacciones.
MétodosSe realizó un estudio prospectivo en la consulta de atención farmacéutica de un hospital de tercer nivel de la Comunidad de Madrid entre enero y diciembre de 2018. Durante este periodo los pacientes acudieron a la consulta una media de 6 veces (visitas cada 2 meses) y en todas las ocasiones fueron atendidos por un farmacéutico especialista en una consulta monográfica de VIH. Se incluyeron en el estudio aquellos pacientes VIH+con un TAR que contuviera cobicistat o ritonavir. Se registró el sexo, edad y medicación concomitante (incluyendo complementos nutricionales y productos de herbolario) mediante entrevista con el farmacéutico y consulta del programa de atención primaria Horus®.
Durante la visita con el farmacéutico este realizó una anamnesis con el fin de detectar posibles RAM derivadas de la interacción entre el potenciador y el tratamiento domiciliario. Con el objetivo de determinar la causalidad de la RAM se empleó el algoritmo de Naranjo10. Con el fin de averiguar la probabilidad de que la interacción hubiese existido en ese paciente en concreto se empleó el algoritmo de DIPS11.
Los pacientes se dividieron en dos grupos según el potenciador de su TAR, cobicistat o ritonavir. Se analizaron las interacciones con el resto del tratamiento usando tres bases de datos: HIV Drug Interactions de la Universidad de Liverpool15, Drug Information Database (Drugs.com)16 y Micromedex®17. Las interacciones se clasificaron en cinco grupos: interacción grave, interacción moderada, interacción leve, sin interacción conocida, y principio activo no registrado. Puesto que Micromedex® clasifica las interacciones de una manera diferente a las otras dos bases de datos, se estableció que contraindicado equivalía a grave, importante a moderada, y las que clasificaba como leves o moderadas se equipararon con las leves, ya que la clasificación leve se emplea para menos de un 1% de todos los principios activos incluidos en esta base de datos. En todos los casos en los que el farmacéutico consideró que la interacción podía tener relevancia clínica o poner en riesgo al paciente se realizó una intervención farmacéutica y contactó con su médico prescriptor. Las intervenciones farmacéuticas realizadas se clasificaron en 5 grupos: suspensión del fármaco domiciliario, sustitución del fármaco domiciliario, cambio de dosis del fármaco domiciliario (aumento o disminución de la misma), monitorización del tratamiento más estrecha y cambio del TAR.
Para el análisis de los datos demográficos y de las prescripciones se utilizaron frecuencias, medianas y rangos. Para el análisis de la concordancia entre las bases de datos se empleó el coeficiente kappa ponderado mediante el empleo de pesos bicuadrados para datos ordinales categóricos, observadores múltiples y diseños incompletos utilizando el software STATA® versión 12 (Stata Corp). El valor del coeficiente kappa (k) fue interpretado según los índices de concordancia de Landis y Koch, considerando 0-0,2 «insignificante», 0,21-0,4 «discreto», 0,41-0,6 «moderado», 0,61-0,8 «sustancial» y 0,81-1 «casi perfecto»18.
El estudio no requirió recoger el consentimiento informado de los pacientes puesto que la actividad realizada por los farmacéuticos para el estudio se engloba dentro de su actividad asistencial habitual.
ResultadosSe incluyeron 968 pacientes (81,4% hombres, con una mediana de edad de 50 años [rango intercuartílico: 34-66]) con un total de 2.148 prescripciones (mediana de 2 medicamentos por paciente). La mediana de edad para el grupo de pacientes en tratamiento con cobicistat (897 pacientes) fue de 50 años (rango intercuartílico: 40-56), con una mediana de un medicamento por paciente, mientras que para ritonavir (71 pacientes) la mediana fue de 55 años (rango intercuartílico: 49-58) con 3 medicamentos por paciente. Sin contar el tratamiento ARV se consideraron como polimedicados (5 medicamentos o más) un 20,7% de los pacientes (14,1% para el grupo de cobicistat y 33,8% para el de ritonavir).
Las prescripciones correspondieron a 274 principios activos diferentes. Los medicamentos más prescritos en la población de estudio fueron calcifediol (n=338 prescripciones), atorvastatina (n=153) y omeprazol (n=98). El grupo farmacológico más prescrito fue el N (sistema nervioso central) (n=63 principios activos), seguido del A (sistema digestivo y metabolismo) (n=43) y del C (sistema cardiovascular) (n=41).
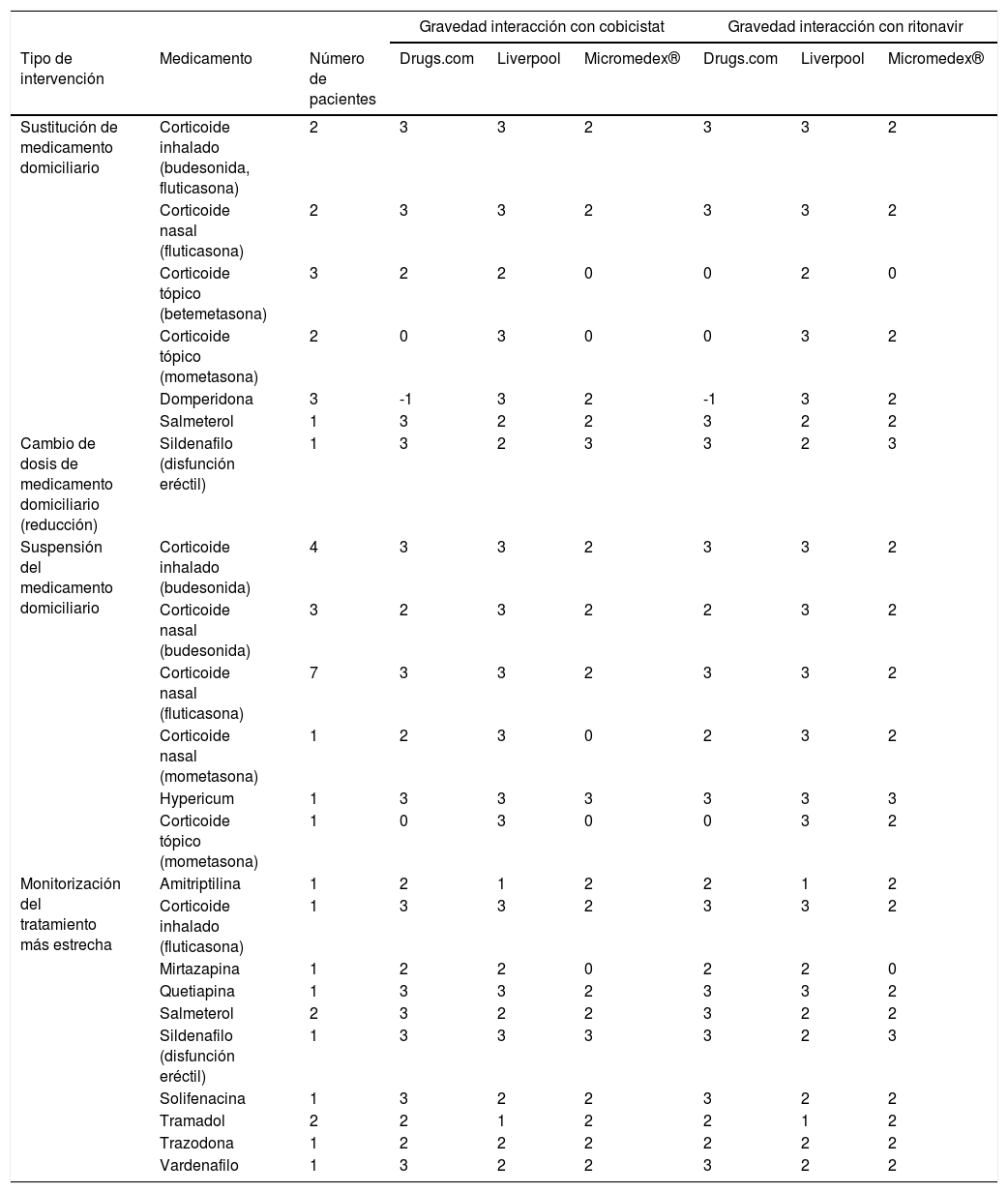
Se realizaron un total de 86 intervenciones relativas a interacciones potenciales en 80 pacientes (6 pacientes tuvieron dos intervenciones). En la tabla 1 se resumen las intervenciones realizadas por los farmacéuticos sin necesidad de la aprobación por parte del médico prescriptor. La mayor parte de ellas consistieron en suspensiones de fármacos para patologías menores, como los sprays nasales a base de corticoides. En el caso de sustituciones de fármacos domiciliarios destacaron aquellas especialidades que incluían cremas con corticoides potentes por otros de menor potencia, o procinéticos como la domperidona por otros con menor potencial de interacción como la metoclopramida.
Intervenciones farmacéuticas que no precisaron de la aprobación de su médico responsable
| Gravedad interacción con cobicistat | Gravedad interacción con ritonavir | |||||||
|---|---|---|---|---|---|---|---|---|
| Tipo de intervención | Medicamento | Número de pacientes | Drugs.com | Liverpool | Micromedex® | Drugs.com | Liverpool | Micromedex® |
| Sustitución de medicamento domiciliario | Corticoide inhalado (budesonida, fluticasona) | 2 | 3 | 3 | 2 | 3 | 3 | 2 |
| Corticoide nasal (fluticasona) | 2 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Corticoide tópico (betemetasona) | 3 | 2 | 2 | 0 | 0 | 2 | 0 | |
| Corticoide tópico (mometasona) | 2 | 0 | 3 | 0 | 0 | 3 | 2 | |
| Domperidona | 3 | -1 | 3 | 2 | -1 | 3 | 2 | |
| Salmeterol | 1 | 3 | 2 | 2 | 3 | 2 | 2 | |
| Cambio de dosis de medicamento domiciliario (reducción) | Sildenafilo (disfunción eréctil) | 1 | 3 | 2 | 3 | 3 | 2 | 3 |
| Suspensión del medicamento domiciliario | Corticoide inhalado (budesonida) | 4 | 3 | 3 | 2 | 3 | 3 | 2 |
| Corticoide nasal (budesonida) | 3 | 2 | 3 | 2 | 2 | 3 | 2 | |
| Corticoide nasal (fluticasona) | 7 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Corticoide nasal (mometasona) | 1 | 2 | 3 | 0 | 2 | 3 | 2 | |
| Hypericum | 1 | 3 | 3 | 3 | 3 | 3 | 3 | |
| Corticoide tópico (mometasona) | 1 | 0 | 3 | 0 | 0 | 3 | 2 | |
| Monitorización del tratamiento más estrecha | Amitriptilina | 1 | 2 | 1 | 2 | 2 | 1 | 2 |
| Corticoide inhalado (fluticasona) | 1 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Mirtazapina | 1 | 2 | 2 | 0 | 2 | 2 | 0 | |
| Quetiapina | 1 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Salmeterol | 2 | 3 | 2 | 2 | 3 | 2 | 2 | |
| Sildenafilo (disfunción eréctil) | 1 | 3 | 3 | 3 | 3 | 2 | 3 | |
| Solifenacina | 1 | 3 | 2 | 2 | 3 | 2 | 2 | |
| Tramadol | 2 | 2 | 1 | 2 | 2 | 1 | 2 | |
| Trazodona | 1 | 2 | 2 | 2 | 2 | 2 | 2 | |
| Vardenafilo | 1 | 3 | 2 | 2 | 3 | 2 | 2 | |
3: interacción grave; 2: interacción moderada; 1: interacción leve; 0: sin interacción conocida; -1: principio activo no registrado.
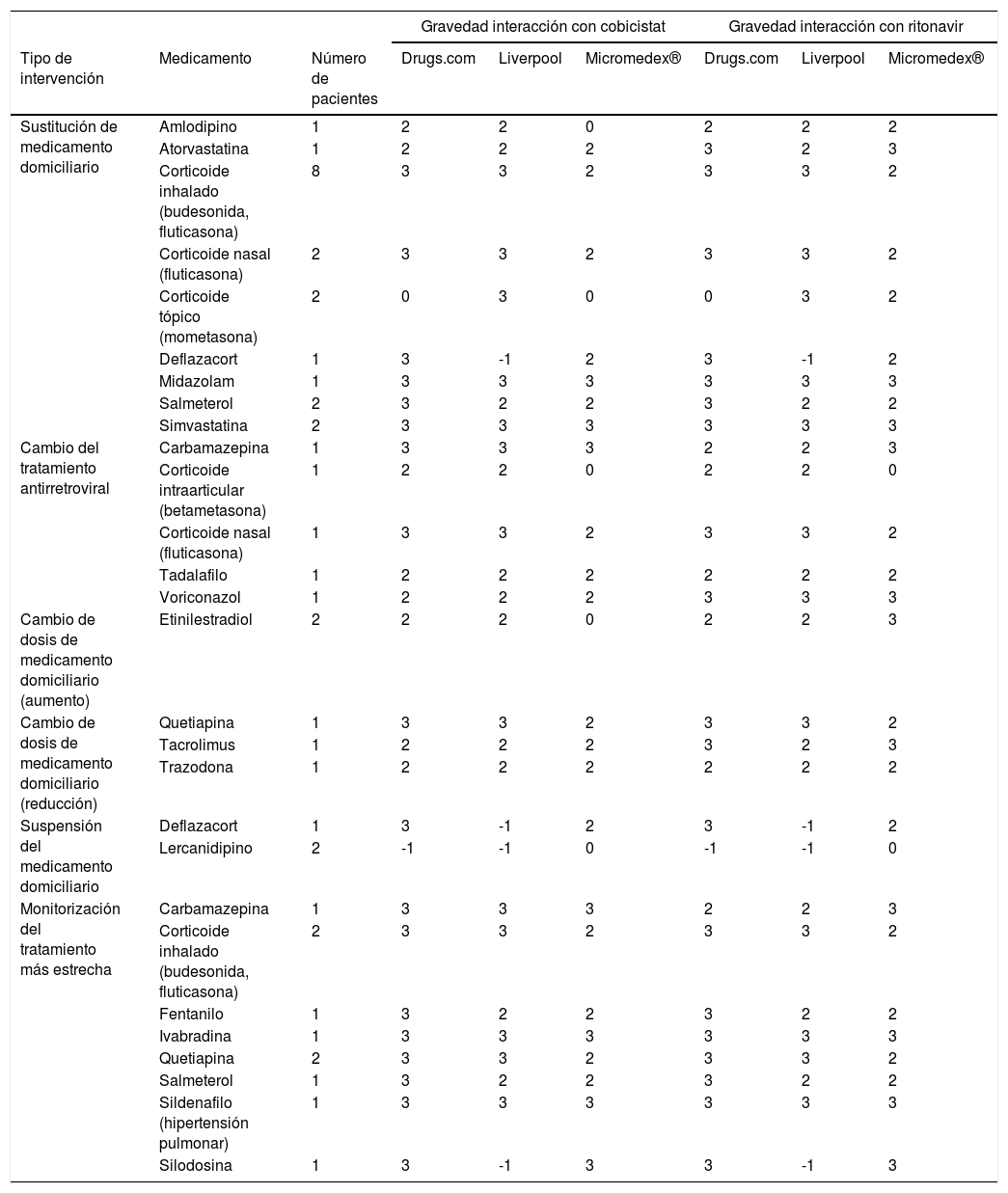
Las intervenciones realizadas por los médicos se muestran en la tabla 2. La mayoría fueron sustituciones por equivalentes terapéuticos, principalmente de corticoides inhalados para enfermedades pulmonares por algunos no dependientes del citocromo P450 como la beclometasona. Además, se realizaron cambios de TAR en 5 pacientes en los que eliminaron los potenciadores al no poder cambiar el resto de medicación. En el primer paciente el cambio fue debido al diagnóstico reciente de epilepsia y a la necesidad de introducción de carbamazepina. El segundo paciente tuvo que someterse a unas infiltraciones a base de corticoides. Otro paciente debía tratarse con tadalafilo para su hipertensión pulmonar. El cuarto paciente fue diagnosticado de una aspergilosis y tuvo que mantener un tratamiento prolongado a base de voriconazol. Y el último paciente tuvo que mantener su tratamiento a base de corticoides para tratar su rinitis alérgica crónica.
Intervenciones farmacéuticas que sí precisaron de la aprobación de su médico responsable
| Gravedad interacción con cobicistat | Gravedad interacción con ritonavir | |||||||
|---|---|---|---|---|---|---|---|---|
| Tipo de intervención | Medicamento | Número de pacientes | Drugs.com | Liverpool | Micromedex® | Drugs.com | Liverpool | Micromedex® |
| Sustitución de medicamento domiciliario | Amlodipino | 1 | 2 | 2 | 0 | 2 | 2 | 2 |
| Atorvastatina | 1 | 2 | 2 | 2 | 3 | 2 | 3 | |
| Corticoide inhalado (budesonida, fluticasona) | 8 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Corticoide nasal (fluticasona) | 2 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Corticoide tópico (mometasona) | 2 | 0 | 3 | 0 | 0 | 3 | 2 | |
| Deflazacort | 1 | 3 | -1 | 2 | 3 | -1 | 2 | |
| Midazolam | 1 | 3 | 3 | 3 | 3 | 3 | 3 | |
| Salmeterol | 2 | 3 | 2 | 2 | 3 | 2 | 2 | |
| Simvastatina | 2 | 3 | 3 | 3 | 3 | 3 | 3 | |
| Cambio del tratamiento antirretroviral | Carbamazepina | 1 | 3 | 3 | 3 | 2 | 2 | 3 |
| Corticoide intraarticular (betametasona) | 1 | 2 | 2 | 0 | 2 | 2 | 0 | |
| Corticoide nasal (fluticasona) | 1 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Tadalafilo | 1 | 2 | 2 | 2 | 2 | 2 | 2 | |
| Voriconazol | 1 | 2 | 2 | 2 | 3 | 3 | 3 | |
| Cambio de dosis de medicamento domiciliario (aumento) | Etinilestradiol | 2 | 2 | 2 | 0 | 2 | 2 | 3 |
| Cambio de dosis de medicamento domiciliario (reducción) | Quetiapina | 1 | 3 | 3 | 2 | 3 | 3 | 2 |
| Tacrolimus | 1 | 2 | 2 | 2 | 3 | 2 | 3 | |
| Trazodona | 1 | 2 | 2 | 2 | 2 | 2 | 2 | |
| Suspensión del medicamento domiciliario | Deflazacort | 1 | 3 | -1 | 2 | 3 | -1 | 2 |
| Lercanidipino | 2 | -1 | -1 | 0 | -1 | -1 | 0 | |
| Monitorización del tratamiento más estrecha | Carbamazepina | 1 | 3 | 3 | 3 | 2 | 2 | 3 |
| Corticoide inhalado (budesonida, fluticasona) | 2 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Fentanilo | 1 | 3 | 2 | 2 | 3 | 2 | 2 | |
| Ivabradina | 1 | 3 | 3 | 3 | 3 | 3 | 3 | |
| Quetiapina | 2 | 3 | 3 | 2 | 3 | 3 | 2 | |
| Salmeterol | 1 | 3 | 2 | 2 | 3 | 2 | 2 | |
| Sildenafilo (hipertensión pulmonar) | 1 | 3 | 3 | 3 | 3 | 3 | 3 | |
| Silodosina | 1 | 3 | -1 | 3 | 3 | -1 | 3 | |
3: interacción grave; 2: interacción moderada; 1: interacción leve; 0: sin interacción conocida; -1: principio activo no registrado.
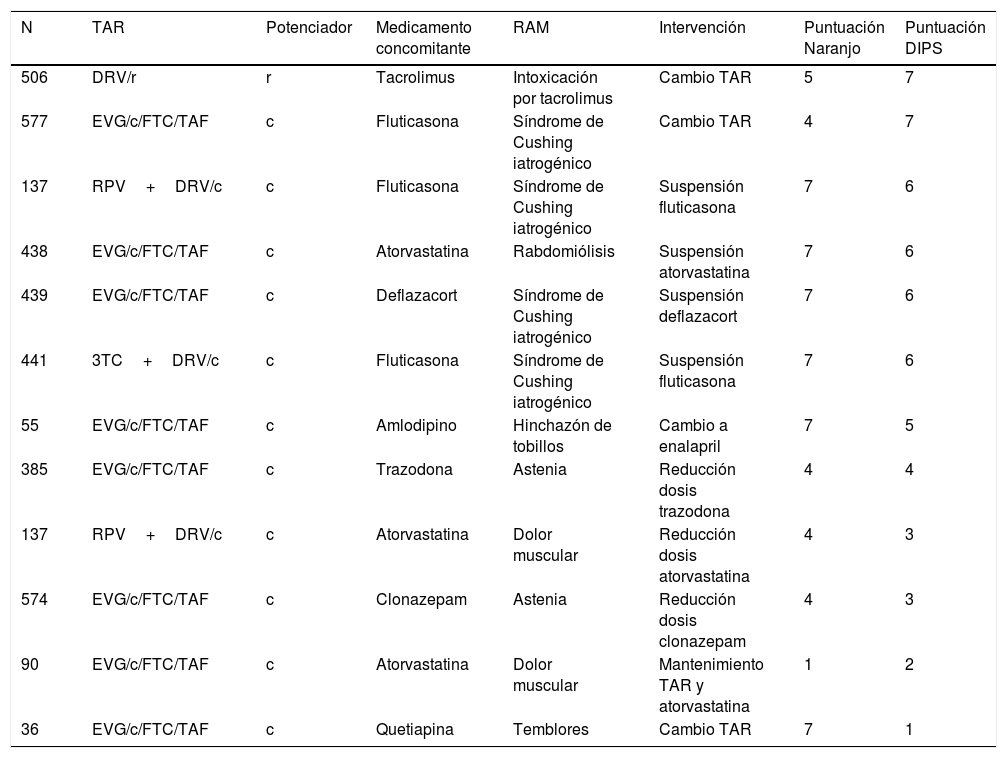
Se detectaron 12 sospechas de RAM causadas por la interacción con el potenciador farmacocinético en 11 pacientes. Los medicamentos implicados en la interacción y su grado de causalidad se detallan en la tabla 3. Más de la mitad de las interacciones fueron clasificadas con causalidad «probable» por la interacción y en 3 de ellas el médico tuvo que hacer un cambio en el TAR del paciente.
Causalidad de las reacciones adversas identificadas
| N | TAR | Potenciador | Medicamento concomitante | RAM | Intervención | Puntuación Naranjo | Puntuación DIPS |
|---|---|---|---|---|---|---|---|
| 506 | DRV/r | r | Tacrolimus | Intoxicación por tacrolimus | Cambio TAR | 5 | 7 |
| 577 | EVG/c/FTC/TAF | c | Fluticasona | Síndrome de Cushing iatrogénico | Cambio TAR | 4 | 7 |
| 137 | RPV+DRV/c | c | Fluticasona | Síndrome de Cushing iatrogénico | Suspensión fluticasona | 7 | 6 |
| 438 | EVG/c/FTC/TAF | c | Atorvastatina | Rabdomiólisis | Suspensión atorvastatina | 7 | 6 |
| 439 | EVG/c/FTC/TAF | c | Deflazacort | Síndrome de Cushing iatrogénico | Suspensión deflazacort | 7 | 6 |
| 441 | 3TC+DRV/c | c | Fluticasona | Síndrome de Cushing iatrogénico | Suspensión fluticasona | 7 | 6 |
| 55 | EVG/c/FTC/TAF | c | Amlodipino | Hinchazón de tobillos | Cambio a enalapril | 7 | 5 |
| 385 | EVG/c/FTC/TAF | c | Trazodona | Astenia | Reducción dosis trazodona | 4 | 4 |
| 137 | RPV+DRV/c | c | Atorvastatina | Dolor muscular | Reducción dosis atorvastatina | 4 | 3 |
| 574 | EVG/c/FTC/TAF | c | Clonazepam | Astenia | Reducción dosis clonazepam | 4 | 3 |
| 90 | EVG/c/FTC/TAF | c | Atorvastatina | Dolor muscular | Mantenimiento TAR y atorvastatina | 1 | 2 |
| 36 | EVG/c/FTC/TAF | c | Quetiapina | Temblores | Cambio TAR | 7 | 1 |
c: cobicistat; DIPS: Drug Interaction Probability Scale (<2 puntos: dudosa; 2-4 puntos: posible; 5-8 puntos: probable;>8 puntos: muy probable); DRV: darunavir; EVG: elvitegravir; FTC: emtricitabina; N: número de paciente; r: ritonavir; RAM: reacción adversa a medicamento; RPV: rilpivirina; TAF: tenofovir alafenamida; TAR: tratamiento antirretroviral; 3TC: lamivudina.
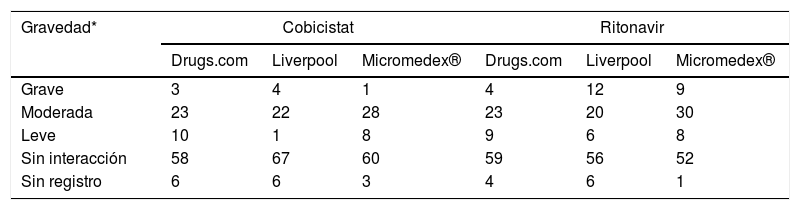
En lo referente a la clasificación de las interacciones según gravedad en las distintas bases de datos destacó Micromedex® como la más completa, con más de un 97% de los principios activos registrados. Además, dicha base de datos fue la que asignó menores índices de gravedad a los principios activos analizados. El análisis completo se muestra en la tabla 4.
Clasificación de gravedad de la interacción de los principios activos de los medicamentos domiciliarios con los potenciadores farmacocinéticos
| Gravedad* | Cobicistat | Ritonavir | ||||
|---|---|---|---|---|---|---|
| Drugs.com | Liverpool | Micromedex® | Drugs.com | Liverpool | Micromedex® | |
| Grave | 3 | 4 | 1 | 4 | 12 | 9 |
| Moderada | 23 | 22 | 28 | 23 | 20 | 30 |
| Leve | 10 | 1 | 8 | 9 | 6 | 8 |
| Sin interacción | 58 | 67 | 60 | 59 | 56 | 52 |
| Sin registro | 6 | 6 | 3 | 4 | 6 | 1 |
El grado de concordancia en la clasificación de la gravedad de las interacciones para cobicistat y ritonavir fue buena (k=0,65 y k=0,62 respectivamente entre las tres bases de datos). Comparando las bases de datos dos a dos se comprobó que la pareja más discordante fue Micromedex® frente a Liverpool, con una concordancia para cobicistat y ritonavir moderada, k=0,53 y k=0,59 respectivamente, y las que más concordaban eran Liverpool y Drugs.com con k=0,74 tanto para cobicistat como para ritonavir.
DiscusiónEl número de interacciones medicamentosas entre la medicación domiciliaria y el TAR con potenciadores es elevado. A pesar de ello, solamente se precisó de una intervención farmacéutica en 8 de cada 100 pacientes. Además, destacó que en uno de cada 7 de estos pacientes en los que se intervino se detectó una sospecha de RAM.
La mayoría de las intervenciones estuvo relacionada con el uso de corticoides para distintas indicaciones (44 intervenciones de un total de 86). Son relativamente numerosos los casos clínicos y revisiones publicados relativos a este tipo de interacción y sus consecuencias graves en pacientes8,17–19, y de ahí que las 3 bases de datos consultadas clasifiquen a la mayoría de los corticoides con un potencial de interacción moderado-grave. En el caso de patologías menores (como la rinitis), el farmacéutico recomendó la suspensión del fármaco o su sustitución, contribuyendo así al uso seguro de los medicamentos y aliviando la carga asistencial del médico. En casos más complejos el farmacéutico contactó con el médico, quien normalmente cambió el corticoide por uno de menor potencia o cuya metabolización no se viera afectada por el citocromo P450 como la beclometasona tal y como se recoge en la Guía de GESIDA3. En los casos en los que el médico prefirió mantener el corticoide original lo que hizo fue cambiar el TAR por otro sin potenciador. Esto ocurrió en un paciente que requirió de la administración intraarticular de corticoides, ya que está descrito que la interacción puede ocurrir también por esta vía8. Además, durante la consulta de atención farmacéutica, los farmacéuticos sospecharon de síndrome de Cushing iatrogénico en cuatro casos y lo pusieron en conocimiento de sus médicos prescriptores, hecho ya muy descrito en la bibliografía, incluso por vía inhalada19–21.
De elevada prevalencia también fue la prescripción de estatinas en estos pacientes. Es destacable que los pacientes con VIH tienen un mayor riesgo de accidente cardiovascular debido a causas multifactoriales y por tanto es importante mantener sus niveles de colesterol y triglicéridos controlados. El problema de las estatinas es que aquellas más usadas en la práctica clínica como son simvastatina y atorvastatina tienen un elevado perfil de interacciones con estos potenciadores. En el caso de simvastatina y lovastatina las guías contraindican su uso4, y recomiendan su cambio por otras22,23. Normalmente los médicos suelen optar por atorvastatina y rosuvastatina, estatinas de elevada potencia que se clasifican como de interacción grave o moderada en las tres bases de datos consultadas. En este sentido, es destacable como en dos de las bases de datos (Drugs.com y Micromedex®) la interacción entre atorvastatina y ritonavir se sitúa en el máximo nivel de gravedad, mientras que para atorvastatina y cobicistat ninguna de las bases de datos contraindica su uso asociado. La diferencia estriba en que a pesar de que ambos potenciadores inhiben el citocromo P450 y el transportador OATP1B1, cobicistat no inhibe el trasportador P-gp y por tanto bloquea en menor medida el metabolismo de esta estatina, muy dependiente de estos tres elementos para su metabolismo y eliminación. En conclusión, es necesario aun así vigilar el uso de estos fármacos en estos pacientes y vigilar dolores musculares, y monitorización de la CPK7, y en determinados casos puede estar justificado un cambio de potenciador por otro si no se puede cambiar la estatina.
Otras intervenciones destacables fueron aquellas que tuvieron que ver con medicación psiquiátrica, como la quetiapina (5 pacientes), que aumenta su exposición sistémica en más de 6 veces al administrarse junto con inhibidores potentes del citocromo P45024, y además aumenta la semivida plasmática, haciendo más peligrosa todavía la intoxicación intencionada con este tipo de fármacos25. Este fármaco fue también para Molas et al. el más prescrito de los fármacos con interacciones potencialmente graves en un estudio con una población muy similar a la nuestra9. También cabe destacar la prescripción de inhibidores de la fosfodiesterasa como sildenafilo (3 pacientes), tadalafilo (un paciente) o vardenafilo (un paciente). En aquellos casos en los que el medicamento fue usado de forma recreacional el farmacéutico aconsejó sobre los ajustes de dosis necesarios, ya que figuran recomendaciones específicas en las fichas técnicas a este respecto, y en los casos de hipertensión pulmonar las dosis fueron revisadas por sus neumólogos y médicos de enfermedades infecciosas. Dicha interacción aparece como moderada o grave en las tres bases de datos consultadas. En la bibliografía existe un caso en que dicha interacción probablemente influyó en la muerte de un paciente26.
También es importante señalar las diferencias halladas en la clasificación de la gravedad de la interacción entre las tres bases de datos. Resultó destacable Micromedex® como la más completa por tener más principios activos incluidos en su base de datos, incluidas las plantas, así como la que menor gravedad otorgaba a las interacciones. En este sentido, hay que subrayar la importancia de comprobar las interacciones de plantas y productos de herbolario ya que falsamente se cree que son inocuas y no siempre lo son27. Asimismo, es destacable Drugs.com por clasificar la gravedad de la interacción de un principio activo según la vía de administración empleada, y Liverpool por completar la consulta con drogas de abuso. En nuestro caso encontramos que varios pacientes tomaban levadura de arroz rojo para regular su colesterol. Tanto Liverpool como Drugs.com clasifican la interacción de este suplemento con ritonavir o cobicistat como potencialmente grave al tratarse de un producto con alto contenido en lovastatina, directamente implicada en la vía de metabolismo inhibida por los potenciadores. Micromedex®, aunque tiene registrado el suplemento, no ofrece información sobre la potencial interacción. Asimismo, también es reseñable el caso de la domperidona, clasificada como interacción grave en Micromedex® y Liverpool, mientras que en Drugs.com no está registrada, o la silodosina, clasificada también como grave en Micromedex® y Drugs.com, mientras que en Liverpool no está registrada. En la bibliografía consultada hay otros estudios parecidos al nuestro en los que se comparan bases de datos en pacientes VIH+. Ramos et al. encuentran una kappa ponderada de 0,61 entre Micromedex® y Drugs.com28. Por su parte, Monteith et al. chequean la concordancia entre 6 bases de datos (entre las que se encuentran Micromedex® y Drugs.com) para medicación psiquiátrica y encuentran la mejor concordancia para interacciones severas (0,695)29. Estas discrepancias ponen de manifiesto la necesidad de consultar varias bases de datos.
La revisión cuidadosa de las interacciones es una parte fundamental del seguimiento farmacoterapéutico que realizan los farmacéuticos en una consulta de atención farmacéutica para pacientes VIH+, pues además se trata de una población en la que la frecuencia de estas es muy elevada por la naturaleza de los fármacos empleados30, cada vez más polimedicada y envejecida31. No se trata únicamente de incorporar los fármacos que el paciente toma en uno de los múltiples softwares o páginas web disponibles, sino además de interpretar esos resultados y aplicarlos a cada paciente en concreto, pues en numerosas ocasiones estas alertas pueden carecer de significación clínica32. Además, el exceso de alertas y de avisos a los médicos puede provocar lo que se denomina como «fatiga» y que no se sigan las recomendaciones realizadas33.
Como limitaciones cabe destacar que solo se han analizado las interacciones en pacientes en tratamiento con potenciadores farmacocinéticos y la medicación concomitante pero no entre la medicación concomitante entre sí, por lo que solo se estudió una pequeña proporción de todos los pacientes en tratamiento ARV y no todas las interacciones posibles en estos pacientes seleccionados. Además, tampoco preguntamos específicamente por el uso de sustancias de abuso a pesar de tener estas un elevado potencial de interacción y ser uso frecuente en la población actual34. A pesar de haber identificado a pacientes con RAM, no hemos hecho un estudio de costes de las RAM evitadas, que podrían tener un impacto considerable30.
Como puntos fuertes nos gustaría destacar que a pesar de ser un estudio unicéntrico la muestra ha sido elevada, con casi mil pacientes incluidos. Además, hemos revisado las interacciones con suplementos alimenticios y productos de herbolario, sustancias que muchas veces no se contemplan en los procesos de conciliación de la medicación y que pueden tener unas interacciones potencialmente fatales27. Hollywood et al. en un estudio muy similar al nuestro encuentran que hasta un 43% de los medicamentos que toma su población de estudio son del tipo OTC (del inglés over the counter) y que por tanto no necesitan receta y pueden pasar desapercibidas si no se realiza una correcta conciliación35.
También cabe destacar que hemos hecho la consulta en más de una base de datos, cuando el resto de los estudios suelen escoger una única para realizar sus estudios. Por último, es importante reseñar que no solo hemos analizado la potencialidad de las interacciones, sino que además hemos averiguado la causalidad de aquellas RAM relacionadas con las interacciones.
Podemos concluir que las interacciones entre el TAR con potenciadores farmacocinéticos en su composición y la medicación concomitante son frecuentes y requieren de una importante variedad de intervenciones que pueden ir desde monitorizar tratamientos de una forma más estrecha, a sustituciones por equivalentes terapéuticos, hasta cambios en el propio TAR. Además, muchas veces estas interacciones son la causa de RAM por lo que la vigilancia activa por parte de médicos y farmacéuticos y su estrecha colaboración se convierte en fundamental para el uso seguro de estos fármacos. El chequeo de interacciones en distintas bases de datos es muy recomendable, pues en muchas ocasiones la información entre unas y otras resulta complementaria, la concordancia entre ellas a veces es pobre y algunas resultan incompletas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.