En el organismo existen 2 tipos de tejido adiposo cuya función parece estar bien diferenciada. El tejido adiposo blanco almacena reservas energéticas en forma de lípidos, mientras que la función metabólica del tejido adiposo marrón es la oxidación de lípidos para producir calor. Un buen equilibrio entre ambos va a ser importante para mantener la homeostasis energética. En las últimas décadas ha cambiado radicalmente el concepto de tejido adiposo blanco, considerándose hoy en día un órgano endocrino que secreta numerosos factores con funciones autocrinas, paracrinas y endocrinas. Además, ya no podemos hablar del tejido adiposo blanco como un solo tejido, ya que las diferentes localizaciones muestran un perfil metabólico diferente con consecuencias también diferentes. Si bien la célula que caracteriza el tejido adiposo es el adipocito, este no es el único tipo celular presente en el tejido adiposo, ni siquiera el más abundante. Entre los otros tipos celulares del tejido adiposo se han descrito células madre, preadipocitos, macrófagos, neutrófilos, linfocitos y células endoteliales. El equilibrio entre estos diferentes tipos celulares, así como su perfil de expresión, están estrechamente relacionados con el mantenimiento de la homeostasis energética. El incremento del tamaño de los adipocitos, del número y del tipo de linfocitos y macrófagos infiltrados está estrechamente relacionado con las enfermedades del síndrome metabólico. El estudio de la regulación de la proliferación y diferenciación de preadipocitos, células madre, así como la comprensión de la interrelación entre los diferentes tipos celulares, nos van a aportar nuevas dianas para actuar frente a estas patologías.
There are two types of adipose tissue in the body whose function appears to be clearly differentiated. White adipose tissue stores energy reserves as fat, whereas the metabolic function of brown adipose tissue is lipid oxidation to produce heat. A good balance between them is important to maintain energy homeostasis. The concept of white adipose tissue has radically changed in the past decades, and is now considered as an endocrine organ that secretes many factors with autocrine, paracrine, and endocrine functions. In addition, we can no longer consider white adipose tissue as a single tissue, because it shows different metabolic profiles in its different locations, with also different implications. Although the characteristic cell of adipose tissue is the adipocyte, this is not the only cell type present in adipose tissue, neither the most abundant. Other cell types in adipose tissue described include stem cells, preadipocytes, macrophages, neutrophils, lymphocytes, and endothelial cells. The balance between these different cell types and their expression profile is closely related to maintenance of energy homeostasis. Increases in adipocyte size, number and type of lymphocytes, and infiltrated macrophages are closely related to the metabolic syndrome diseases. The study of regulation of proliferation and differentiation of preadipocytes and stem cells, and understanding of the interrelationship between the different cell types will provide new targets for action against these diseases.
En el organismo los lípidos se almacenan en 2tipos de tejido adiposo: el tejido adiposo blanco (TAB) y el tejido adiposo marrón (TAM). El TAB es el principal tejido de almacén de energía del organismo, además de atribuírsele la función de aislamiento y protección mecánica para algunos órganos vitales. Los adipocitos maduros del TAB muestran el perfil de expresión requerido para la síntesis de triacilgliceroles, captación de glucosa y lipogénesis, así como de lipólisis1. Este fenotipo permite que cuando el aporte de energía al organismo es excesivo y/o el gasto energético disminuye, el exceso de energía se deposite eficientemente en el TAB en forma de triacilgliceroles. Por otro lado, frente a una situación de escasez de ingesta energética y/o incremento del gasto energético el TAB moviliza los depósitos de lípidos liberando ácidos grasos y glicerol que a través de la sangre son transportados a los tejidos, donde serán oxidados para obtener energía2. En contraste, el TAM tiene la función fisiológica de metabolizar los ácidos grasos produciendo calor3. Esta función específica del TAM está sustentada por la elevada proporción en sus mitocondrias de la UnCoupling Protein-1 (UCP-1), proteína que cortocircuita el acoplamiento de la cadena respiratoria a la ATP sintetasa, permitiendo de esta forma la producción de calor3. Las diferencias funcionales y el equilibrio entre el TAB y el TAM contribuyen al mantenimiento del balance energético del organismo.
El TAB tradicionalmente ha sido considerado un tejido poco activo, pero hoy se sabe que es altamente dinámico sintetizando y secretando numerosos factores, no solo lipídicos sino también proteicos, que intervienen en la regulación de un amplio rango de procesos fisiológicos y metabólicos. A pesar de que a finales de la década de los ochenta ya se describe que el TAB secreta hormonas esteroideas4, no es hasta 1994 —con el descubrimiento de la leptina5, factor saciante sintetizado predominantemente por el TAB— que se reconoce al TAB como órgano endocrino. Posteriormente se han identificado numerosos factores liberados por el TAB con funciones autocrinas, paracrinas y endocrinas.
De las numerosas sustancias secretadas por el TAB, los ácidos grasos son cuantitativamente las moléculas más importantes y son liberados en periodos de balance energético negativo, como en el ayuno2. Otras moléculas de naturaleza lipídica son también secretadas por el TAB, incluyendo prostanoides —sintetizados por el propio tejido—, colesterol y retinol —que se almacenan para ser liberados posteriormente6— y hormonas esteroideas (esteroides sexuales y glucocorticoides), que en el TAB pueden experimentar transformaciones de formas inactivas a activas o viceversa, con un importante papel autocrino y paracrino7.
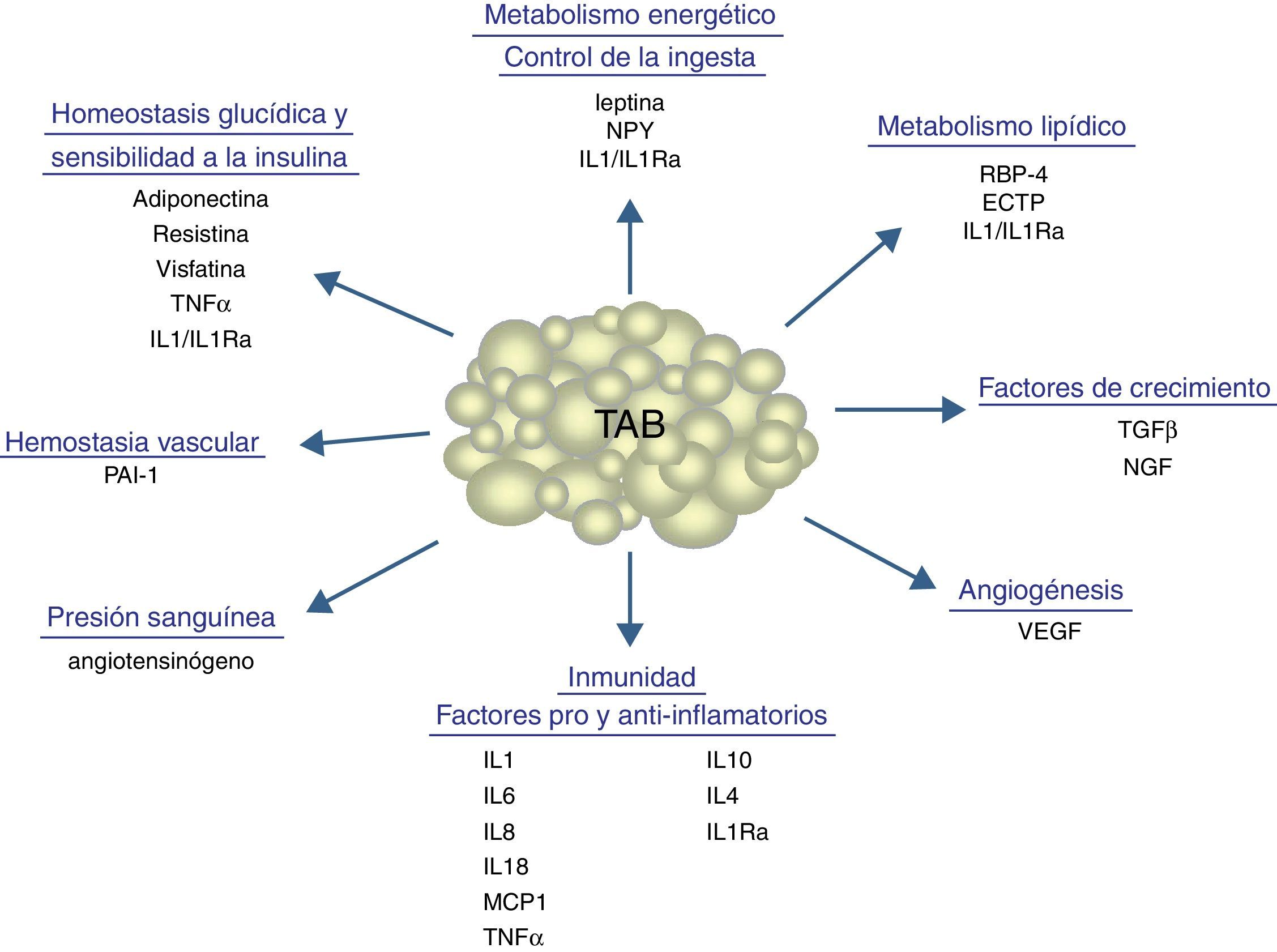
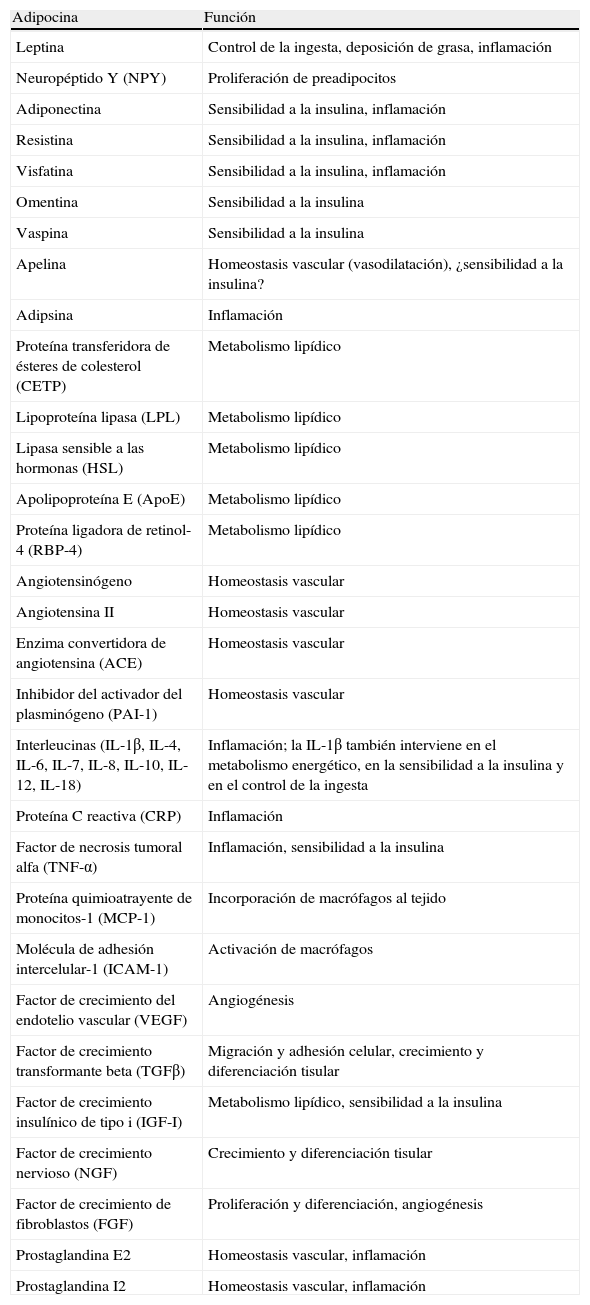
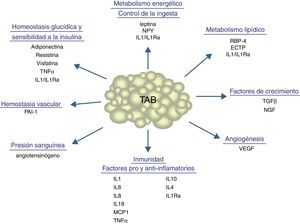
Aparte de sustancias de naturaleza lipídica, el tejido adiposo secreta un número considerable de factores proteicos (se han descrito más de 50) que se designan bajo la denominación común de adipocinas. De forma estricta, el término «adipocina» debería utilizarse para designar las proteínas que son sintetizadas y secretadas por el adipocito8. Sin embargo, de forma genérica se utiliza para referirse a las proteínas sintetizadas y secretadas por el TAB en su conjunto, aunque su síntesis principal sea a cargo de otros tipos celulares presentes en el tejido, como los macrófagos infiltrados. Las adipocinas son muy diversas en cuanto a la estructura química y a la función fisiológica9-11, y curiosamente muchas de ellas están relacionadas con el sistema inmunitario, incluyendo citocinas clásicas como TNF-α, IL-1β, IL-6, IL-8, IL-10, IL-4, IL-13 y MCP-1, pudiéndose establecer un nexo entre la inflamación y la obesidad, situación en que se incrementa la secreción de adipocinas proinflamatorias12. Las adipocinas también incluyen proteínas que intervienen en la regulación de la ingesta y del balance energético (leptina), en la regulación de la presión sanguínea (angiotensinógeno), en la hemostasia vascular (PAI-1), en el metabolismo lipídico (RBP-4, CETP), en la homeostasis glucídica (adiponectina, resistina, visfatina), en la angiogénesis (VEGF), así como factores de crecimiento (TGFβ) y proteínas de fase aguda y respuesta al estrés (haptoglobulina, α1-acid glycoprotein) (fig. 1). Como ya se ha señalado, son muchas las adipocinas que se han descrito, con un amplio e importante papel regulador a distintos niveles fisiológicos. En la tabla 1 se enumeran algunas de las adipocinas y su principal función descrita. Cabe señalar que esta función endocrina no es exclusiva del TAB, ya que muchos de estos factores son también sintetizados por el TAM3.
Procesos fisiológicos y metabólicos regulados por el TAB mediante la secreción de adipocinas.CETP: proteína transferidora de ésteres de colesterol; IL1: interleucina-1; IL1Ra: antagonista del receptor de la interleucina-1; IL4: interleucina-4; IL6: interleucina-6; IL8: interleucina-8; IL10: interleucina-10; IL18: interleucina-18; MCP-1: proteína quimioatrayente de monocitos-1; NGF: factor de crecimiento nervioso; NPY: neuropéptido Y; RBP-4: proteína ligadora de retinol-4; TGFβ: factor de crecimiento transformante β; TNFα: factor de necrosis tumoral alfa; VEGF: factor de crecimiento del endotelio vascular
Adipocinas secretadas por el tejido adiposo blanco y función fisiológica
| Adipocina | Función |
| Leptina | Control de la ingesta, deposición de grasa, inflamación |
| Neuropéptido Y (NPY) | Proliferación de preadipocitos |
| Adiponectina | Sensibilidad a la insulina, inflamación |
| Resistina | Sensibilidad a la insulina, inflamación |
| Visfatina | Sensibilidad a la insulina, inflamación |
| Omentina | Sensibilidad a la insulina |
| Vaspina | Sensibilidad a la insulina |
| Apelina | Homeostasis vascular (vasodilatación), ¿sensibilidad a la insulina? |
| Adipsina | Inflamación |
| Proteína transferidora de ésteres de colesterol (CETP) | Metabolismo lipídico |
| Lipoproteína lipasa (LPL) | Metabolismo lipídico |
| Lipasa sensible a las hormonas (HSL) | Metabolismo lipídico |
| Apolipoproteína E (ApoE) | Metabolismo lipídico |
| Proteína ligadora de retinol-4 (RBP-4) | Metabolismo lipídico |
| Angiotensinógeno | Homeostasis vascular |
| Angiotensina II | Homeostasis vascular |
| Enzima convertidora de angiotensina (ACE) | Homeostasis vascular |
| Inhibidor del activador del plasminógeno (PAI-1) | Homeostasis vascular |
| Interleucinas (IL-1β, IL-4, IL-6, IL-7, IL-8, IL-10, IL-12, IL-18) | Inflamación; la IL-1β también interviene en el metabolismo energético, en la sensibilidad a la insulina y en el control de la ingesta |
| Proteína C reactiva (CRP) | Inflamación |
| Factor de necrosis tumoral alfa (TNF-α) | Inflamación, sensibilidad a la insulina |
| Proteína quimioatrayente de monocitos-1 (MCP-1) | Incorporación de macrófagos al tejido |
| Molécula de adhesión intercelular-1 (ICAM-1) | Activación de macrófagos |
| Factor de crecimiento del endotelio vascular (VEGF) | Angiogénesis |
| Factor de crecimiento transformante beta (TGFβ) | Migración y adhesión celular, crecimiento y diferenciación tisular |
| Factor de crecimiento insulínico de tipo i (IGF-I) | Metabolismo lipídico, sensibilidad a la insulina |
| Factor de crecimiento nervioso (NGF) | Crecimiento y diferenciación tisular |
| Factor de crecimiento de fibroblastos (FGF) | Proliferación y diferenciación, angiogénesis |
| Prostaglandina E2 | Homeostasis vascular, inflamación |
| Prostaglandina I2 | Homeostasis vascular, inflamación |
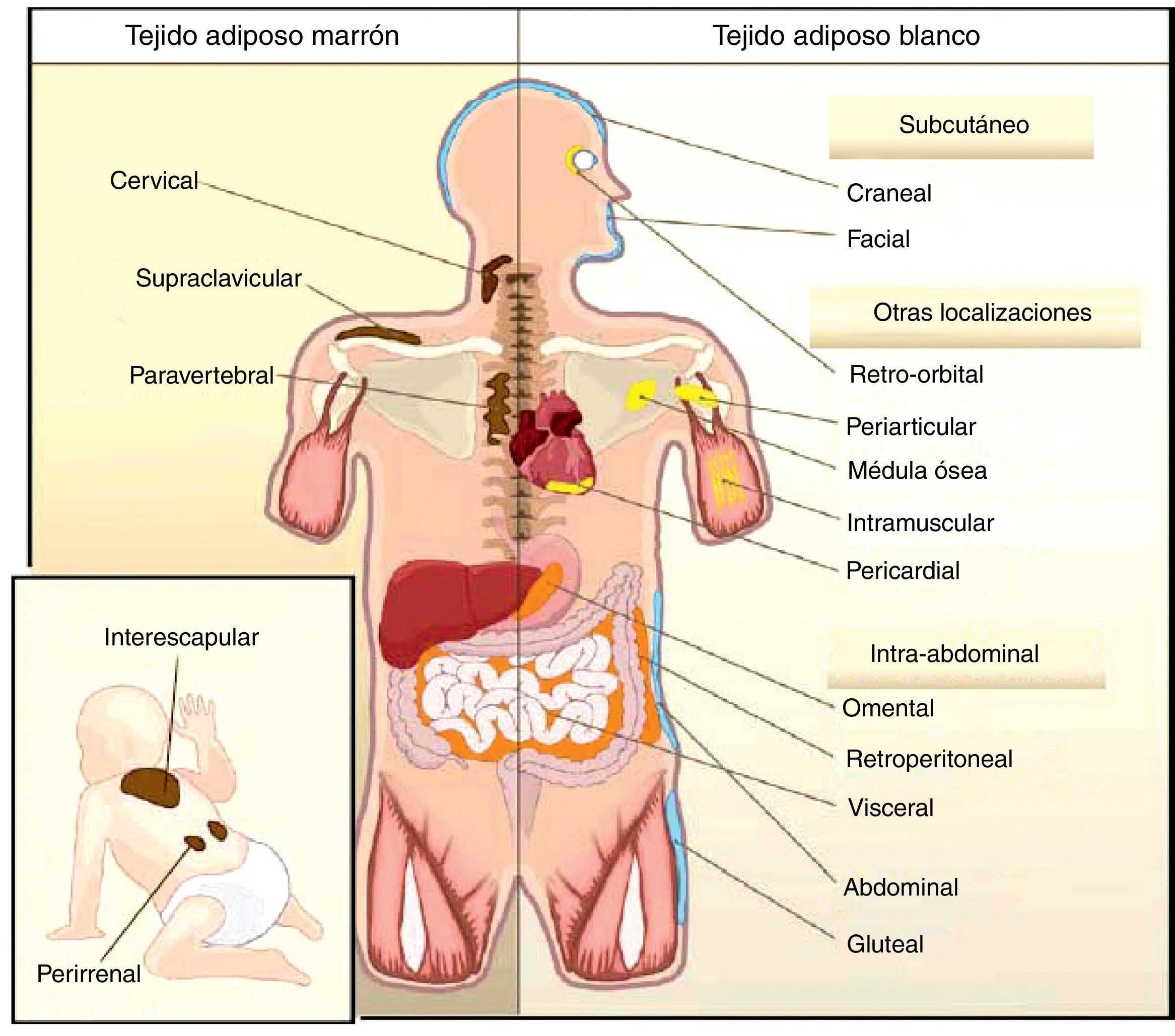
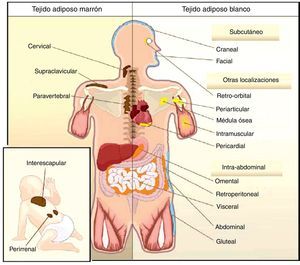
Todas las especies de animales han encontrado la forma de almacenar el exceso de energía para futuras necesidades. Así, por ejemplo, el nematodo Caenorhabditis elegans acumula grasa en el epitelio del intestino13, mientras que los tiburones lo hacen en el hígado14, siendo ambos tejidos de origen endodérmico. Sin embargo, en la mayoría de las especies el almacén de lípidos tiene lugar en el TAB que tiene origen mesodérmico. A pesar de un mismo origen embrionario, la distribución del TAB varía según las especies. En los invertebrados, así como en los anfibios y en los reptiles, predomina la disposición intraabdominal de grasa. En las focas y las ballenas predomina la disposición subcutánea, mientras que en el resto de los mamíferos y en las aves encontramos ambas localizaciones. Esta diferente distribución del TAB no se puede explicar simplemente por una adaptación evolutiva a climas más cálidos o más fríos, puesto que se ha visto que para una misma masa corporal mamíferos adaptados a ambientes árticos o tropicales presentan similar distribución de la grasa corporal15. En humanos el TAB se encuentra disperso en el organismo. A nivel intraabdominal encontramos los mayores depósitos alrededor del omento (omental), del intestino (mesentérico) y de las áreas perirrenales (retroperitoneal), y a nivel subcutáneo la grasa se localiza sobre todo a nivel de las nalgas, los muslos y el abdomen. Pero además de estos depósitos mayoritarios existen otras áreas en el organismo donde encontramos TAB, distinguiendo depósitos a nivel pericardial, perivascular o periarterial, periarticular, retro-orbital, intramuscular, médula ósea y cara (fig. 2). Actualmente se sabe que las diversas localizaciones del TAB tienen características metabólicas y endocrinas diferentes16,17. Así, por ejemplo, el TAB de las mamas y las nalgas es muy sensible a estrógenos, el de la parte superior de la espalda y el cuello es más sensible a los glucocorticoides, el visceral (intraabdominal) tiene un perfil de secreción de adipocinas relacionado con la inflamación y diabetes tipo2, mientras que el TAB subcutáneo muestra una menor secreción de adipocinas proinflamatorias. A nivel de TAB perivascular, distribuido ampliamente por toda la circulación arterial, se ha descrito un perfil de secreción similar al visceral, proinflamatorio. Se ha propuesto que evolutivamente el TAB perivascular (periarterial) podría haberse originado como un mecanismo fisiológico de regulación de la distribución del flujo sanguíneo posprandrial entre-órganos e intra-órganos; sin embargo, el exceso de TAB periarterial puede ser nocivo. Así, en condiciones de inactividad o exceso de energía estos depósitos se incrementan y, en consecuencia, hay una mayor producción de adipocinas proinflamatorias que pueden propiciar la aterosclerosis18. La distribución del TAB varía con la edad, de forma que al avanzar en edad se observa una tendencia a incrementar la grasa intraabdominal y a disminuir la subcutánea, y esto es así incluso en individuos con peso e índice de masa corporal (IMC) estable. También la distribución de la grasa está influida por factores genéticos, y un ejemplo claro es el caso de la marcada acumulación de grasa en las nalgas de las mujeres de la etnia sudafricana Hottentot/Khoisan (fig. 3). Existe, además, un dimorfismo sexual en cuanto a la distribución de la grasa corporal. Así, en el sexo masculino hay una mayor acumulación de grasa en la parte superior del cuerpo, lo que se conoce como distribución androide o de tipo manzana, mientras que en el sexo femenino la grasa predomina en la parte inferior del cuerpo, refiriéndose como distribución ginoide o de tipo pera. Sin embargo, pueden darse situaciones inversas según el fondo genético, y así encontramos mujeres con distribución de la grasa tipo androide, y a la inversa.
La obesidad se define como un exceso de grasa corporal, pero atendiendo a lo dicho en el párrafo anterior, según cuál sea la localización de ese exceso de grasa la obesidad se asocia con un mayor o menor riesgo de enfermedad cardiovascular y diabetes tipo2. Cuando se incrementa la deposición de grasa en la parte superior del cuerpo (tipo manzana), y concretamente la localizada a nivel intraabdominal, existe un mayor riesgo de complicaciones metabólicas19.
El TAM, a diferencia del TAB, solo lo encontramos en mamíferos: Su aparición en la evolución es tardía y se relaciona con la capacidad de termorregulación, es decir, con la homeotermia y la capacidad de termogénesis no temblorosa. Sin embargo, la aparición del TAM no está exclusivamente relacionada con la homeotermia, ya que las aves son animales endotérmicos (homeotermos) y sin embargo no tienen TAM, su capacidad de termogénesis no temblorosa depende de la expresión de UCP en el músculo20. En roedores el TAM es sobre todo abundante en el periodo perinatal, pero su presencia persiste durante la vida adulta. El TAM se distribuye en diferentes localizaciones corporales, y la más abundante es la interescapular21. En los últimos años se ha descrito que también se encuentran adipocitos marrones inmersos en los depósitos típicos del TAB21.
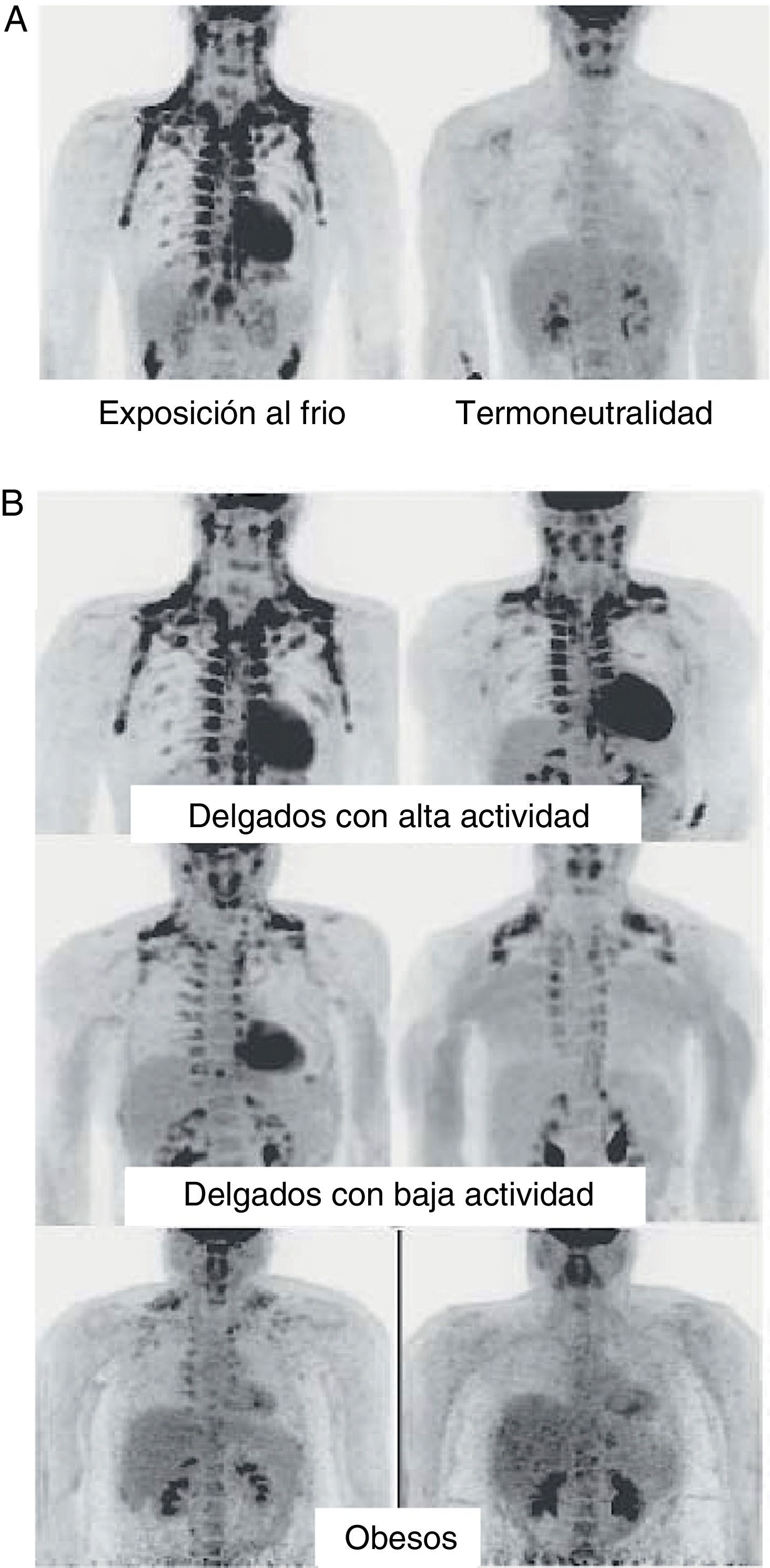
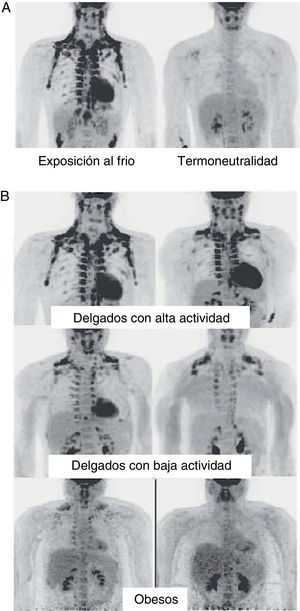
En humanos encontramos TAM en el feto y en el recién nacido localizado a nivel axilar, cervical, perirrenal y periadrenal3, pero su presencia disminuye rápidamente tras el nacimiento y tradicionalmente se ha considerado insignificante en el adulto, a excepción de los pacientes con feocromocitoma22 o en sujetos expuestos de forma prolongada a climas fríos23. Sin embargo, estudios recientes utilizando la técnica de tomografía por emisión de positrones (PET) muestran que la presencia de TAM en humanos adultos puede no ser tan extraña como se pensaba (fig. 4). En estos estudios se detecta un incremento de captación de 18F-fluorodesoxiglucosa (18F-FDG) mediante PET en tejido adiposo de las regiones paracervical, supraclavicular y paravertebral en individuos sanos sometidos al frío24,25, siendo la más abundante la supraclavicular. Mediante la obtención de biopsias se confirma la presencia de UCP-1 como marcador de TAM y la morfología multivacuolar distintiva del TAM25,26. Se observa que estas áreas de TAM se encuentran altamente inervadas por el sistema nervioso simpático, a diferencia de las áreas de TAB adyacentes27. Cuantificando la termogénesis no temblorosa por exposición al frío mediante 18F-FDG-PET se observa que las regiones con TAM funcional son más frecuentes en mujeres que en hombres, que la cantidad de TAM disminuye con la edad y que la cantidad de TAM se correlaciona inversamente con el IMC, especialmente en personas de edad avanzada26. El porcentaje de personas jóvenes en los que se encuentra TAM es más elevado que en personas de edad avanzada, aunque su actividad disminuye en jóvenes con sobrepeso u obesos25. Estos estudios parecen evidenciar definitivamente que el TAM tiene un papel en el metabolismo energético de humanos adultos, y el hecho que se encuentre en menor cantidad en individuos con sobrepeso u obesos podría apuntar a una nueva diana para el tratamiento de la obesidad.
Distribución y actividad del TAM en humanos detectada mediante tomografía por emisión de positrones (PET) con 18F-FDG. A)Incremento de la actividad del TAM en un individuo delgado expuesto a baja temperatura (16¿C) o en condiciones de termoneutralidad. B)Actividad del TAM en individuos delgados y obesos expuestos a baja temperatura (16¿C).Fuente: Van Marken Lichtenbelt et al.25
Además de estas regiones metabólicamente activas de TAM inmersas en diferentes localizaciones de tejido adiposo, también se han descrito depósitos de adipocitos marrones, positivos para la presencia de UCP-1, intercalados entre los músculos de las extremidades en una cepa de ratones resistentes a la obesidad inducida por la dieta, lo que sugiere que localizaciones ectópicas de TAM pueden también jugar un papel importante en la regulación de la homeostasis energética28.
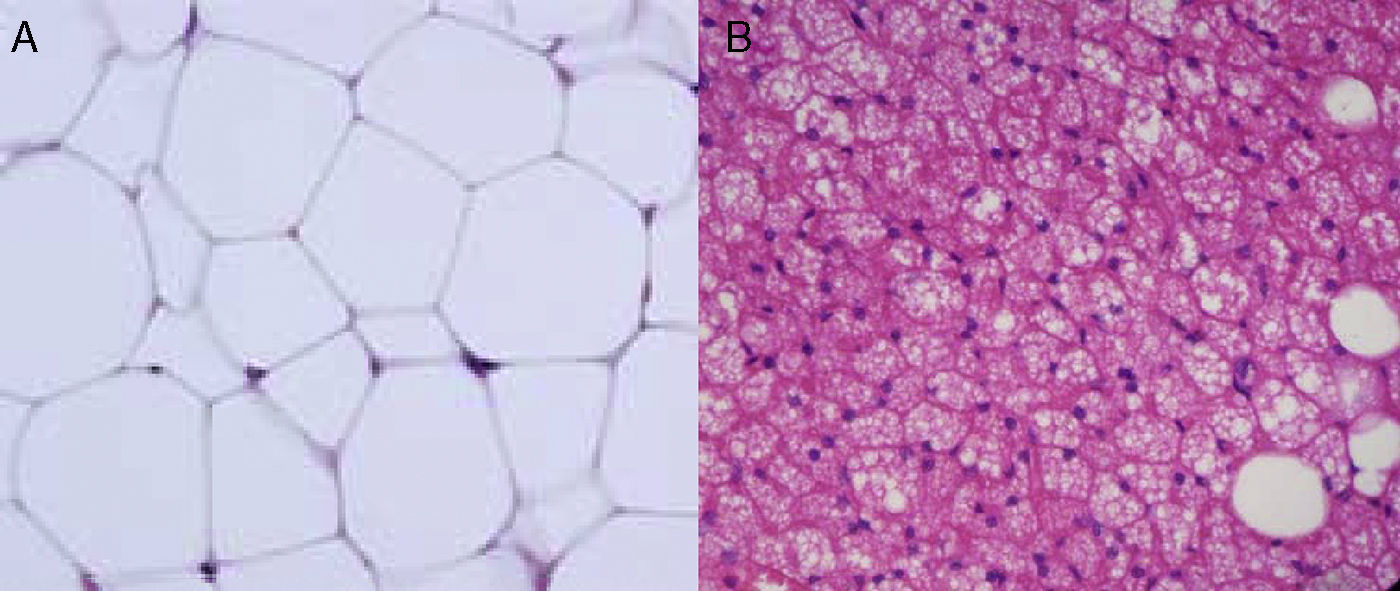
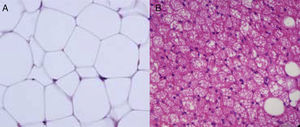
Heterogeneidad celular del tejido adiposoLas células que caracterizan el tejido adiposo son lógicamente los adipocitos, que son células grandes especializadas en la acumulación de lípidos, como ya hemos mencionado anteriormente. La diferencia entre los adipocitos del TAB y los del TAM es que mientras los adipocitos blancos poseen una sola vacuola de grasa que ocupa todo el citoplasma, el adipocito marrón se caracteriza por la presencia de múltiples vacuolas de grasa, así como una gran abundancia de mitocondrias en su citoplasma (fig. 5). Dado el tamaño de los adipocitos maduros, las observaciones histológicas inducían a pensar que estas células eran prácticamente las únicas existentes en este tejido, o al menos las más abundantes con diferencia. Sin embargo, actualmente se sabe que si bien los adipocitos son los que ocupan prácticamente todo el tamaño del tejido, no son el único tipo celular presente y posiblemente tampoco el más abundante. Se ha descrito que aproximadamente entre el 60% (subcutáneo) y el 80% (visceral) de las células del TAB de humanos obesos no son adipocitos maduros sino que corresponden a células del «estroma vascular»29. Entre las células que constituyen el estroma vascular se encuentran preadipocitos, macrófagos, células madre y células endoteliales29, y también se ha descrito la presencia de neutrófilos30 y linfocitos31. La proporción de los diferentes tipos celulares presentes en el estroma vascular puede variar según la situación fisiológica (inflamación) y la localización del TAB. Se ha estimado que en el TAB de obesos humanos los preadipocitos representan aproximadamente el 10% y los macrófagos otro 10%.
Los preadipocitos son células de tamaño pequeño de morfología parecida a un fibroblasto que, tras la estimulación adecuada, van a derivar en adipocitos maduros. La masa de tejido adiposo en el adulto viene determinada por el incremento del tamaño de los adipocitos (hipertrofia) hasta un determinado punto y del incremento del número de adipocitos (hiperplasia). El volumen de los adipocitos refleja el balance entre lipogénesis y lipólisis, mientras que su número es reflejo del equilibrio entre la proliferación, la diferenciación y la apoptosis de los preadipocitos y la apoptosis de los adipocitos. La capacidad de los preadipocitos para proliferar y diferenciarse, así como su susceptibilidad para sufrir apoptosis, difieren según la localización del tejido, lo que puede explicar las diferencias que se encuentran en la deposición de grasa en humanos obesos32. En el estudio de Spalding et al.33 se encuentra que aproximadamente el 10% de los adipocitos de todo el organismo son regenerados cada año. En este estudio se determina que el número de adipocitos en el adulto se mantiene relativamente constante, fijándose su número durante la infancia y la adolescencia. Los individuos obesos tienen un mayor número de adipocitos ya desde la infancia, pero el recambio es similar en individuos delgados y obesos.
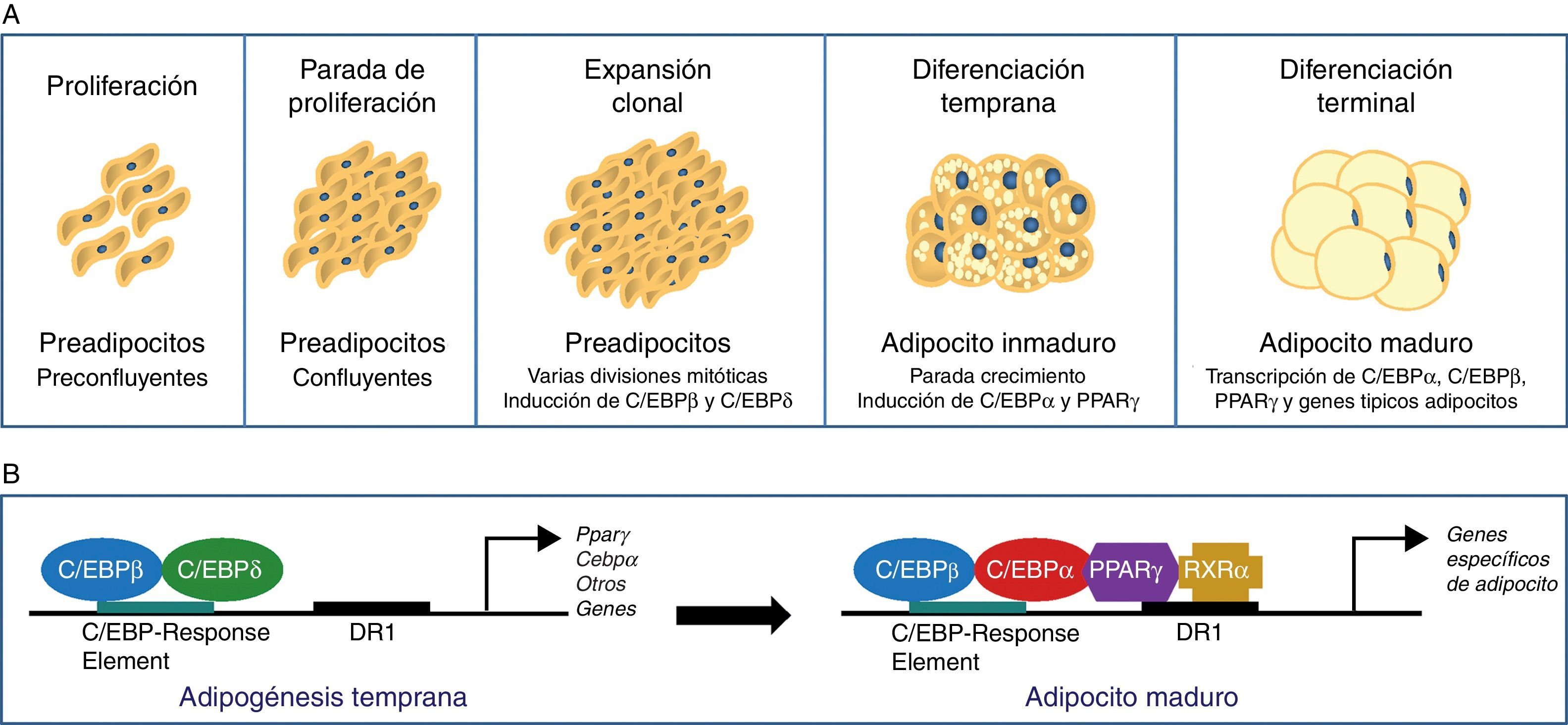
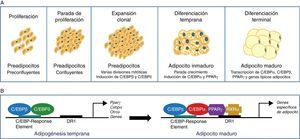
El proceso de diferenciación de preadipocitos a adipocitos se ha estudiado ampliamente en diversos modelos celulares de preadipocitos blancos (3T3-L1, 3T3-F442A) y líneas inmortales de preadipocitos marrones34. Así, en el proceso de transición de preadipocito a adipocito maduro se describe 4estadios. En primer lugar se da una parada de la proliferación inducida mediante una inhibición por contacto indicando que se ha llegado a la confluencia, y a partir de este momento el preadipocito está comprometido a diferenciarse en adipocito. Sigue una expansión clonal que se induce por señales hormonales y que está representada por unas cuantas divisiones mitóticas con la finalidad de sincronizar el ciclo celular. Se describe un estadio de diferenciación temprana, donde la división celular se detiene y se empiezan expresar genes característicos de adipocito, iniciándose la acumulación de lípidos. Finalmente, la morfología típica de adipocito se alcanza con la fase de diferenciación terminal, induciéndose la transcripción de genes típicos de adipocitos maduros (fig. 6). La coordinación de estos estadios se encuentra bajo el control de una compleja cascada transcripcional de factores reguladores en la que juegan un papel fundamental el receptor nuclear PPARγ y diversos miembros de la familia de factores de transcripción C/EBP35. Se ha demostrado que PPARγ es necesario para la diferenciación de los adipocitos y también para el mantenimiento de la diferenciación. Cuando se silencia PPARγ en adipocitos 3T3-L1 ya diferenciados, se induce desdiferenciación con pérdida de lípidos y disminución de la expresión de los marcadores de adipocitos maduros36. De las 2isoformas de PPARγ, es PPARγ2 la que se expresa preferentemente en el tejido adiposo36. La familia de factores de transcripción C/EBP incluye 5miembros: C/EBPα, C/EBPβ, C/EBPδ, C/EBPγ y CHOP. Se ha observado una expresión secuencial de estos factores durante la diferenciación adipocitaria, de forma que se requiere la expresión temprana de C/EBPβ y C/EBPδ, los cuales van a promover la expresión de C/EBPα y PPARγ, esenciales para la diferenciación total de los adipocitos35. La expresión de C/EBPβ parece ser, pues, fundamental en los primeros estadios de diferenciación; así, animales deficientes en C/EBPβ muestran una masa reducida de tejido adiposo37. En contraste, C/EBPα se requiere para la adipogénesis junto con PPARγ, aunque este último parece ser dominante en el proceso38 (fig. 6).
El conocimiento del proceso de diferenciación de preadipocitos a adipocitos es, pues, esencial para poder dar respuesta a problemas como la obesidad. Se ha observado que preadipocitos procedentes del TAB de diferentes localizaciones corporales muestran características específicas cuando estos son cultivados in vitro. En humanos se ha descrito que los preadipocitos procedentes de TAB subcutáneo abdominal muestran mayor capacidad de proliferación, diferenciación y menor susceptibilidad a la apoptosis que preadipocitos cuyo origen es TAB omental16,32, permitiendo diferenciar una población de preadipocitos de proliferación rápida y otros de proliferación lenta. Con posterioridad se ha descrito que ambos tipos de preadipocitos se encuentran simultáneamente en una misma localización, pero según esta predominan uno u otro. Así, se ha encontrado que en el TAB subcutáneo abdominal hay aproximadamente la mitad de cada subtipo, mientras que en el TAB omental el 90% de los preadipocitos son de proliferación lenta32. La presencia de 2subpoblaciones de preadipocitos con características diferentes pero con capacidad de diferenciarse podría constituir un mecanismo mediante el cual se explicaría la plasticidad en el desarrollo del tejido adiposo, pudiéndose regular la abundancia de cada subpoblación en respuesta a estímulos concretos, por ejemplo a citocinas proinflamatorias.
Además de heterogeneidad en cuanto a la población de preadipocitos, también se han descrito diferencias entre adipocitos maduros de una misma localización de TAB. Así en ratones knockout, a nivel de TAB para el receptor de insulina (FIRKO) o para la lipasa sensible a las hormonas (HSL) se describen 2poblaciones de adipocitos: una de diámetro pequeño (<50μm) y otra de diámetro mayor (>150μm)39-41. En tejido subcutáneo abdominal humano de sujetos sanos también se han encontrado 2poblaciones de adipocitos que se diferencian por su tamaño42. El perfil de expresión de ambas poblaciones resulta ser distinto, encontrándose en la población de mayor tamaño una expresión incrementada de proteínas relacionadas con inflamación (IL-8, CXCL2 [chemokine (C-X-C motif) ligand 2], E-selectina, SAA2 [serum amiloide A2], C1QR1 [complement component 1 q subcomponent receptor 1]) y, por tanto, síndrome metabólico. En otros estudios se describe una relación inversa entre el tamaño del adipocito y la expresión de genes lipogénicos, así como una fuerte relación entre adipocitos de tamaño pequeño y mayor sensibilidad a la insulina43.
Tanto en humanos como en roedores se ha observado que con la edad los depósitos de TAM van siendo reemplazados por TAB. También en determinadas situaciones, como estimulación adrenérgica o exposición al frío, se incrementa el número de adipocitos marrones inmersos en el TAB3,24,25. Existe, pues, una marcada plasticidad entre el TAB y el TAM que induce a pensar en la posibilidad que entre la heterogeneidad de las células del estroma vascular del TAB existan también preadipocitos determinados a diferenciarse en adipocitos marrones. El control del número de cada uno de estas poblaciones y de su diferenciación específica podría proporcionar nuevos tratamientos para la obesidad y sus complicaciones. En este sentido cabe señalar que existe cierta dificultad en su estudio, ya que faltan marcadores que puedan identificar preadipocitos con diferente potencial para diferenciarse y que morfológicamente son indistinguibles de cualquier tipo celular con morfología de fibroblasto.
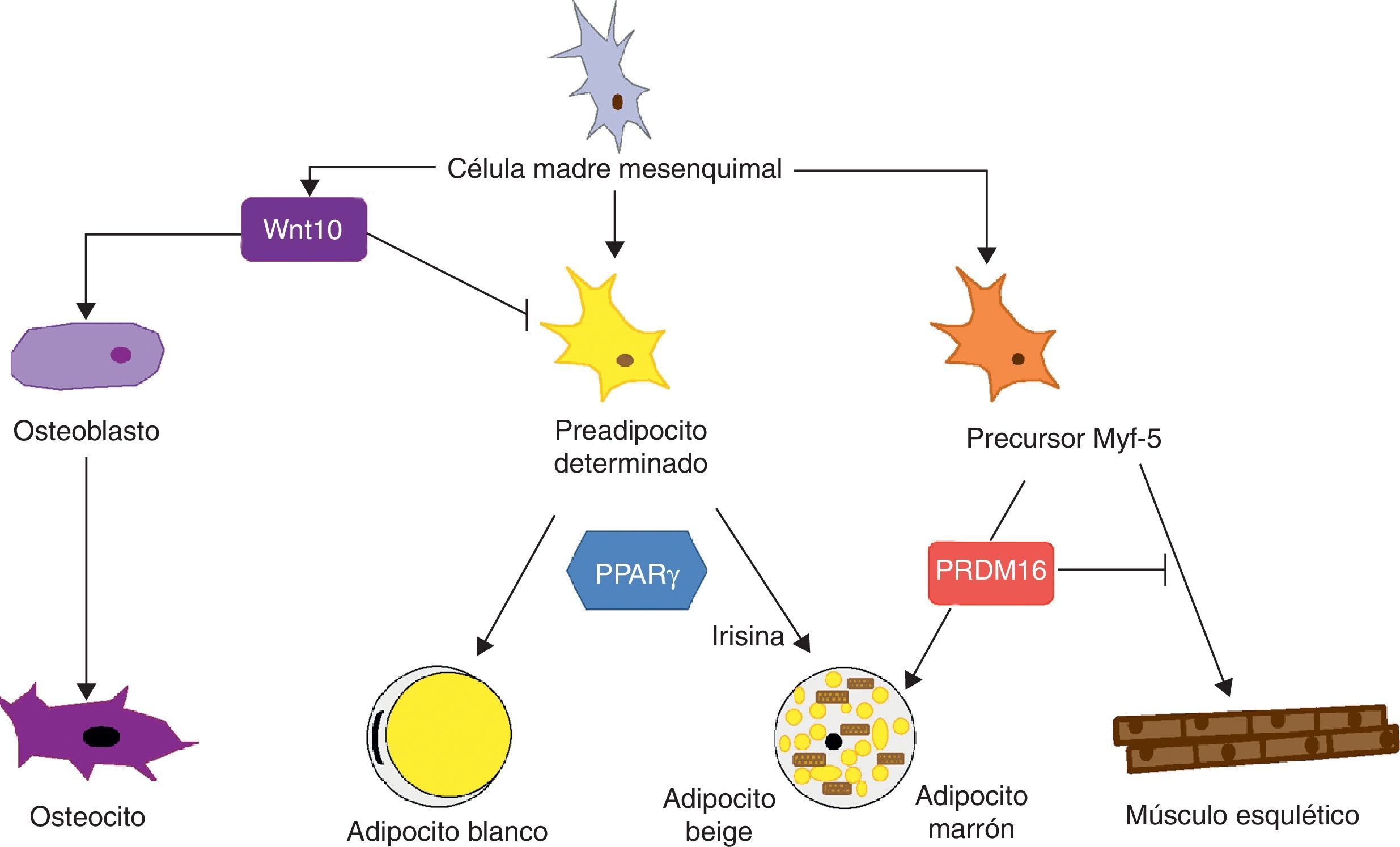
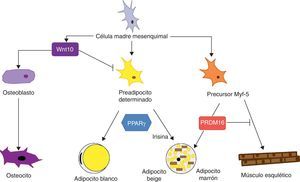
A nivel de médula ósea se aíslan células madres mesenquimales (MSC [mesenchymal stem cells]) que se han usado ampliamente para el estudio de la diferenciación de tejidos de origen mesodérmico, como es el caso del tejido adiposo, de forma que las MSC son capaces de diferenciarse a adipocitos, osteoblastos, condrocitos, mioblastos y tejido conjuntivo (fig. 7) según el entorno en que se encuentren44. Los estadios intermedios entre una célula madre mesenquimal y el adipocito maduro no es bien conocido, y en principio la teoría que se ha considerado más factible es que las MSC dan lugar a un precursor común (adipoblasto) que será capaz de diferenciarse en adipocito blanco o marrón en función de los estímulos concretos que reciba. Sin embargo, esta teoría no está del todo clara, ya que la falta de marcadores específicos dificulta la determinación de si existe un único precursor o bien este es diferente para los adipoblastos y/o los preadipocitos blancos y marrones, o si este precursor es diferente incluso para los preadipocitos de diferentes localizaciones de TAB. La idea de que los preadipocitos de los distintos depósitos de TAB tengan un origen distinto está apoyada por algunas observaciones. En primer lugar, los diferentes depósitos de TAB presentan variaciones cronológicas en cuanto a su desarrollo embrionario; por ejemplo, en roedores se desarrollan primero el periovárico y el subcutáneo y posteriormente el omental. En segundo lugar, está ampliamente descrito que el TAB subcutáneo y el visceral presentan un patrón de expresión substancialmente diferente45. Y en tercer lugar, este perfil de expresión diferencial parece ser una característica intrínseca del tejido. Ya se ha señalado que en cultivos de preadipocitos se observa que los de procedencia subcutánea tienen más capacidad para proliferar y diferenciarse que los de procedencia visceral32. También se ha descrito que algunos factores pueden afectar de forma distinta el desarrollo de los diferentes depósitos de grasa según su capacidad de respuesta y, por tanto, según las características intrínsecas del tejido. Por ejemplo, ratones transgénicos que sobreexpresan la 11β hidroxiesteroide deshidrogenasa en el TAB tienen el mismo nivel de enzima en varios tejidos pero solo desarrollan obesidad visceral7.
Diferenciación de la célula madre mesenquimal a diferentes tipos celulares. Estudios recientes apoyan la teoría de que no existe un precursor común para los preadipocitos blancos y marrones. Los preadipocitos marrones presentan una «firma miogénica». Sin embargo, los adipocitos marrones inmersos en masas del TAB parece que provienen de un precursor diferente que los localizados en las masas del TAM. Estos adipocitos inmersos en el TAB con expresión de UCP-1 se han denominado «adipocitos beige» y son especialmente sensibles a la hormona irisina.
Diferencias entre la localización del TAB y el perfil de expresión también se han descrito en relación con genes implicados en el desarrollo embrionario, en concreto para las familias de Glyp4, Tbx15 y HoxA5. Adipocitos y preadipocitos de ratón aislados de TAB de localizaciones subcutánea y visceral muestran un patrón de expresión de Glyp4, Tbx15 y HoxA5 diferente que se mantiene cuando estos preadipocitos son subcultivados y diferenciados in vitro45. Se ha observado que en humanos el perfil de expresión de estos genes se correlaciona estrechamente con el IMC y el patrón de distribución de grasa45. Concretamente la expresión de HoxA5 y Tbx15 predomina en el TAB visceral, mientras que Glyp4 se expresa más en el TAB subcutáneo. En el TAB visceral la expresión de Glyp4 y HoxA5 se correlaciona positivamente con el IMC y la circunferencia de la cintura (CC), mientras que la de Tbx15 se correlaciona negativamente.
En el TAB subcutáneo la expresión de HoxA5 se correlaciona positivamente con el IMC y la CC, mientras que la expresión de Glyp4 se correlaciona negativamente con ambos parámetros y Tbx15 se correlaciona positivamente solo con el IMC. Además, en el TAB subcutáneo los niveles de expresión de Glyp4 son extremadamente bajos para IMC superiores a 30. Se propone, pues, que la expresión de estos genes constituye un marcador excelente de la acumulación visceral de grasa45.
En cuanto a la especificidad del linaje de TAB y TAM observamos que también existen diferencias en cuanto a su patrón de desarrollo que apoyan una determinación específica de tejido. Sin embargo, la capacidad del TAB de transdiferenciarse a TAM21 estaría a favor de la hipótesis de un precursor común para ambos tejidos adiposos. Trabajos recientes argumentan que preadipocitos blancos y marrones se originan a partir de un linaje celular diferente y están predeterrminados a una única diferenciación46. En estos estudios se encuentra que preadipocitos blancos y marrones desarrollan un patrón de expresión diferente, que en el caso de preadipocitos marrones tiene una «firma miogénica» (Myf-5-lineage). Otros trabajos, además de apoyar estos hallazgos, muestran que las células precursoras de músculo esquelético pueden también diferenciarse en adipocitos marrones47. La decisión de que este progenitor se diferencie en adipocito marrón o célula muscular está regulada por el factor de transcripción PRDM16: su expresión induce diferenciación a adipocito marrón, y su silenciamiento, a célula muscular47. Este interlinaje entre miocito y preadipocito marrón confirmaría un diferente origen del TAB y del TAM que a la vez daría una explicación plausible a la cuestión de por qué los adipocitos marrones se especializan en el catabolismo lipídico más que en su almacén, perfil más parecido al metabolismo oxidativo del músculo esquelético. La idea de que el TAM y el músculo esquelético tienen un precursor común explicaría también por qué en algunas especies, como en las aves, el músculo esquelético tiene una función TAM-like20.
Estudios recientes muestran que los adipocitos marrones que aparecen inmersos en el TAB, tanto en roedores como en el caso de los humanos, tienen características diferentes a los adipocitos marrones de localizaciones típicas de TAM. De esta forma, parece ser que existirían 2tipos distintos de TAM. Por un lado tendríamos el TAM clásico, cuyos adipocitos tendrían una «firma miogénica» (Myf-5-lineage), y por otro lado las células positivas para UCP-1 que emergen en las masas de TAB y que no tienen una firma miogénica. Este segundo tipo de adipocitos marrones muestran un perfil de expresión muy parecido a los adipocitos blancos con una expresión de UCP-1 basal baja, pero responden al estímulo β-adrenérgico incrementando la expresión de UCP-1 igual que los adipocitos marrones. A estas células brown-like inmersas en el TAB sin marca miogénica se las ha denominado «adipocitos beige» y son especialmente sensibles a la hormona irisina48.
Macrófagos, neutrófilos y linfocitosEntre las células de la fracción del estroma vascular de tejido adiposo encontramos macrófagos. En el TAB la abundancia de macrófagos está relacionada con su tamaño, y existe una correlación directa entre el tamaño del TAB y el número de macrófagos infiltrados en este tejido, de forma que en el TAB de individuos obesos existe una mayor cantidad de macrófagos que en el de individuos con normopeso49. Estos macrófagos son los principales responsables de la secreción de citocinas pro-inflamatorias, como el TNF-α, la IL-6, la IL-8 y la IL-1b, relacionándose con el estado de inflamación presente en la obesidad12. La secreción de adipocinas como la leptina, la resistina y la adiponectina es consecuencia principalmente de la actividad de los adipocitos50.
Se ha descrito también que los preadipocitos procedentes del TAB, al igual que los procedentes de líneas inmortales como las células 3T3-L1, tienen capacidad para diferenciarse a macrófagos, cuando estos se inoculan en la cavidad peritoneal de ratón (Swiss nu/nu)51. Ambos tipos celulares (preadipocitos y macrófagos) presentan características comunes, como la capacidad de secreción de citocinas y la capacidad para la fagocitosis; esta última se pierde cuando los preadipocitos se diferencian a adipocitos maduros52. Esta característica de los preadipocitos plantea la idea de que quizá los macrófagos presentes en el TAB son derivados de preadipocitos. Sin embargo, hay datos que apoyan la hipótesis de que los macrófagos del TAB provienen de los monocitos circulantes53. Así, la síntesis de quimiocinas como la proteína quimioatrayente de monocitos-1 (MCP-1) por parte de los adipocitos y en proporción a la adiposidad induce un incremento de la infiltración del TAB por monocitos sanguíneos54. Diferentes productos de secreción de los adipocitos, entre ellos la leptina, incrementan la producción de proteínas de adhesión (ICAM-1) por parte de las células endoteliales induciendo transmigración y adhesión de monocitos sanguíneos53. La secreción de factor estimulador de colonias-1 (CSF-1) por parte de los adipocitos proporciona un microambiente favorable para que los monocitos se diferencien y se establezcan como macrófagos maduros del TAB49.
La inflamación crónica presente en la obesidad, junto con la mayor infiltración de macrófagos en el TAB, indica la existencia de una relación estrecha entre el sistema inmunitario y la obesidad. Recordemos que en la respuesta inflamatoria los neutrófilos son los primeros leucocitos seleccionados, y a medida que la respuesta inflamatoria avanza y el daño se repara, se produce un cambio progresivo en el tipo de células presentes en el tejido inflamado, incrementando la proporción de macrófagos que resuelven el daño y la inflamación. Sin embargo, cuando el estímulo inflamatorio persiste se llega a un estado inflamatorio crónico que desequilibra la relación entre células proinflamatorias y antiinflamatorias. Recientemente se ha descrito que en el proceso de inducción de la obesidad mediante dieta hiperlipídica en ratones existe una primera fase (3días) en que se produce la infiltración de neutrófilos en el TAB, mientras que a las 16semanas, cuando la obesidad ya está establecida, se observa la infiltración de macrófagos55.
Los macrófagos pueden mostrar un perfil proinflamatorio o antiinflamatorio según sean estimulados por diferentes citocinas. La activación clásica de los macrófagos es promovida por la secreción de moléculas producidas por linfocitosT helper, en particular el IFNγ, en respuesta a un daño o infección. Los macrófagos así activados se denominan de tipo 1 (M1) y son proinflamatorios y con actividad microbicida elevada. Los macrófagos pueden activarse de forma alternativa (M2) en respuesta a las interleucinas IL-4 y/o IL-13 (perfil M2a), secretadas entre otros tipos celulares por los adipocitos. El perfil M2a muestra un programa de expresión génica antiinflamatorio y contribuye activamente a la resolución de la inflamación56. Recientemente se ha descrito que el receptor nuclear PPARδ/β juega un papel clave controlando la activación alternativa en los macrófagos del TAB y de las células de Kupffer del hígado57,58.
Como se ha señalado anteriormente, la obesidad se caracteriza por una mayor infiltración de macrófagos en el TAB. El estímulo inicial que desencadena esta infiltración se desconoce, a pesar de que se apuntan factores como la hipoxia debida al incremento del TAB59 o el daño producido a causa de la hipertrofia de los adipocitos42. Se ha descrito que el fenotipo de los macrófagos del TAB de animales delgados corresponde al perfil M2a, mientras que el perfil de adipocinas liberado por el TAB de animales obesos indica la infiltración de macrófagos M1. Animales sometidos a una dieta hiperlipídica y con macrófagos PPARδ-/-, incapaces de activarse a M2, desarrollan de forma más marcada obesidad y resistencia a la insulina. En el hígado presentan un incremento de la lipogénesis que desemboca en esteatosis y un perfil de macrófagos (células de Kupffer) inflamatorio (M1). En el TAB se observa una menor sensibilidad a la insulina y la infiltración de macrófagos de tipo M157,58. Estudios en los que se provoca una disminución de macrófagos M1 en animales obesos se observa una disminución de marcadores inflamatorios a nivel del TAB y sistémico, a la vez que se normaliza la sensibilidad a la insulina60. Así pues, vemos que la presencia de macrófagos M1 y la incapacidad de su activación por la vía alternativa juegan un papel importante en el mantenimiento de la inflamación y en el establecimiento de la resistencia a la insulina y la obesidad.
La inflamación crónica es un proceso complejo que implica, además de la acumulación de macrófagos, la alteración de la función de los linfocitosT. Estos linfocitosT son uno de los componentes mayoritarios de las placas ateroscleróticas, y son importantes en su desarrollo a través de la comunicación con los macrófagos, ya sea célula a célula o mediante mediadores inflamatorios61. La presencia de linfocitosT en el TAB y su posible implicación en la inflamación presente en la obesidad ha sido estudiada recientemente. Wu et al.62 y Rausch et al.63 describen que existe una mayor infiltración de linfocitosT (CD3), además de macrófagos, en TAB perigonadal de ratones sometidos a dieta hiperlipídica a largo plazo en comparación con los animales delgados. Posteriormente se encuentra que esta infiltración de linfocitos T en el TAB es previa a la infiltración de macrófagos. En ratones con obesidad inducida por dieta hiperlipídica se observa infiltración de linfocitosT a las 5semanas de tratamiento que persiste hasta las 10semanas. La presencia de macrófagos no se observa a las 5semanas pero sí a las 10semanas de tratamiento31. Estos resultados sugieren que los linfocitos T pueden jugar un papel importante en la iniciación y la perpetuación de la inflamación del TAB.
En el TAB visceral de humanos obesos se encuentra una mayor expresión de marcadores de linfocitos T (CD3) en comparación con el de individuos delgados62. La abundancia de linfocitosT (CD3) en el TAB se correlaciona directamente con el diámetro de la cintura31. La caracterización de la población de linfocitosT por inmunohistoquímica en el TAB visceral muestra la presencia de linfocitos CD4 y no se encuentran linfocitos CD8. Los linfocitos CD4 expresan citocinas proinflamatorias como IFNγ y pueden ser responsables de la activación de los macrófagos en este tejido.
En estudios posteriores también se ha descrito que existen diferencias en el tipo de población de linfocitos infiltrados en el TAB de individuos delgados y obesos64. Se describe que el 10% de las células de la fracción del estroma vascular del TAB perigonadal de ratón delgado adulto corresponden a linfocitosT, mostrando una proporción de 3 a 1 entre CD4+ y CD8+, respectivamente. Sorprendentemente, más de la mitad de los linfocitosT CD4+ son positivos para Foxp3, proporción más elevada de la que se encuentra en tejidos linfoides como el bazo o los nódulos linfáticos. Este fenotipo corresponde a un tipo de linfoctosT reguladores (Treg) que parecen ser una de las defensas más importantes del cuerpo contra la inadecuada respuesta inmune, operando en contextos de autoinmunidad, alergia, inflamación, infección y tumorogénesis65. También se describe que en el momento del nacimiento el número de linfocitos Treg infiltrados es similar en el TAB perigonadal, en el subcutáneo y en el del bazo, pero que, a diferencia de los otros 2, en el TAB perigonadal la cantidad de linfocitos Treg se va incrementando progresivamente con la edad en ratones delgados64. En ratones obesos genéticamente ob/ob u obesidad inducida por dieta hiperlipídica se detecta una menor proporción de linfocitos Treg en el TAB perigonadal, mientras que es normal en el subcutáneo y el del bazo, de forma que se establece una relación directa entre menor infiltración de linfocitos Treg de localización visceral y presencia de obesidad, resistencia a la insulina, inflamación y síndrome metabólico en general. Los linfocitos Treg expresan un perfil de adipocinas no inflamatorias incrementando la expresión de IL-10, mientras que los linfocitosT convencionales (Tconv) que no expresan Foxp3 muestran un perfil proinflamatorio con expresión incrementada de IFNγ. En el TAB omental de humanos obesos se encuentra una menor expresión de Foxp3 versus CD3 que en TAB subcutáneo, lo que indica que en humanos obesos el TAB visceral también presenta menor proporción de linfocitos Treg. Evidentemente faltan experimentos para responder a múltiples preguntas, como ¿por qué se acumulan linfocitos Treg en el TAB visceral?, ¿por qué en la obesidad hay menor proporción de linfocitos Treg en el TAB visceral? De todas formas, parece claro que existe una importante relación entre el tipo de linfocito y el tipo de macrófago presente en el TAB. Es decir, existe un crosstalk entre linfocitos y macrófagos que va a determinar un perfil antiinflamatorio o proinflamatorio de estos tipos celulares.
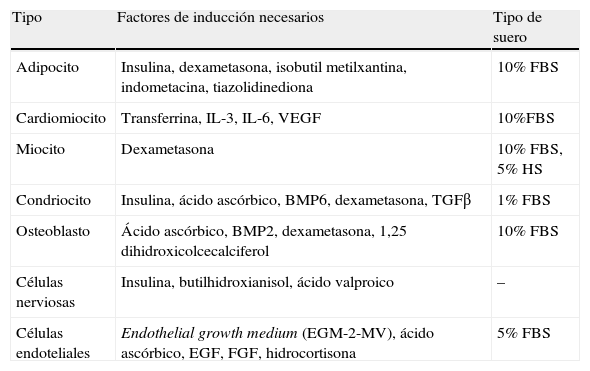
Células madre y plasticidad del tejido adiposoEntre las células del estroma vascular del TAB se encuentran también células madre (ADSC [adipose derived stem cells]) con características muy similares a las MSC de la médula ósea66. Encontramos en la bibliografía numerosos trabajos en los que se describe el potencial de estas ADSC para diferenciarse in vitro a tipos celulares diferentes según el estímulo recibido (tabla 2). Así, a partir de ADSC se han obtenido, además de adipocitos, células óseas, de cartílago, de músculo esquelético y cardiaco, células nerviosas y células endoteliales67. La presencia de células madre en el TAB del adulto pone en evidencia que persiste su capacidad para generar nuevos adipocitos, hecho que constituye otra diana de estudio en torno a la homeostasis energética y obesidad. Por otro lado, esta gran plasticidad de las ADSC y su capacidad angiogénica constituye actualmente un foco de gran interés para la medicina regenerativa, puesto que representan una fuente de células madre de fácil obtención en comparación con las MSC68.
Potencial de diferenciación in vitro de las células madre del tejido adiposo blanco (ADSC)
| Tipo | Factores de inducción necesarios | Tipo de suero |
| Adipocito | Insulina, dexametasona, isobutil metilxantina, indometacina, tiazolidinediona | 10% FBS |
| Cardiomiocito | Transferrina, IL-3, IL-6, VEGF | 10%FBS |
| Miocito | Dexametasona | 10% FBS, 5% HS |
| Condriocito | Insulina, ácido ascórbico, BMP6, dexametasona, TGFβ | 1% FBS |
| Osteoblasto | Ácido ascórbico, BMP2, dexametasona, 1,25 dihidroxicolcecalciferol | 10% FBS |
| Células nerviosas | Insulina, butilhidroxianisol, ácido valproico | – |
| Células endoteliales | Endothelial growth medium (EGM-2-MV), ácido ascórbico, EGF, FGF, hidrocortisona | 5% FBS |
En las 2 últimas décadas el conocimiento del TAB ha cambiado radicalmente, dejando de ser considerado un tejido cuya función es básicamente la de almacenar lípidos para ser considerado un órgano endocrino que secreta numerosos factores reguladores. Además su complejidad celular pone aún más en evidencia un papel dinámico y activo en la regulación de la homeostasis energética. Todos estos conocimientos abren numerosas dianas de estudio para comprender y poder intervenir en las patologías del síndrome metabólico. Nos va aportar nuevas perspectivas el conocimiento de la diferenciación de los preadipocitos, de por qué existen diferentes poblaciones de preadipocitos en una misma localización anatómica de TAB y de qué factores contribuyen a un predominio de uno u otro. Es interesante entender por qué el TAB visceral acumula linfocitos Treg y por qué estos disminuyen en la obesidad. El estudio del TAB desde todas sus perspectivas constituye en estos momentos, y va a serlo posiblemente en las próximas décadas, un órgano diana importante cuyo mejor conocimiento nos va aportar nuevas maneras de entender patologías como la obesidad y el síndrome metabólico en general.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.