En el carcinoma medular tiroideo (CMT) el perfil histológico e inmuno-histoquímico está mal definido. El objetivo de este estudio es determinar las características clínicas, histológicas e inmuno-histoquímicas del CMT, y analizar si existen diferencias entre los carcinomas esporádicos y familiares.
Material y métodoSe han incluido 55 tumores confirmados histológicamente. Fueron revisadas las preparaciones histológicas y se llevaron a cabo las tinciones de inmuno-histoquímica de los bloques de parafina del archivo.
ResultadosDe los 55 carcinomas, 19 (35%) fueron esporádicos y 36 (65%) de tipo familiar. La distribución por sexo es similar, sin embargo, los carcinomas familiares tienen una mayor frecuencia de pacientes menores de 40 años (p<0,001). En la mayor parte de los casos se ha observado un patrón de crecimiento sólido y el tipo celular plasmocitoide. Son hallazgos más frecuentes en el familiar la hiperplasia de células C y la multicentricidad, mientras que en el esporádico es más frecuente la necrosis tumoral, los focos hemorrágicos, la invasión vascular y la presencia de neovascularización. Respecto a la inmuno-histoquímica, los tumores muestran positividad intensa con marcadores para calcitonina, CEA y bcl-2, y proteína p53. En cuanto al estadiaje, los carcinomas familiares son diagnósticados en estadios más iniciales, con tamaño más pequeño y sin metástasis ganglionares (p<0,01).
ConclusionesLos CMT familiares presentan con más frecuencia hiperplasia de células C y multicentricidad, y los esporádicos muestran con más frecuencia focos de necrosis, hemorragia, invasión vascular y neovascularización. Ni los criterios histológicos ni los inmuno-histoquímicos son arquitecturales para diferenciar las formas familiar y esporádica.
The histological and immunohistochemical profile of medullary thyroid carcinoma is ill-defined. The objective of this study was to determine the epidemiological, histological, and immunohistochemical characteristics of medullary carcinoma and to analyze whether differences exist between sporadic and familial carcinomas.
Patients and MethodsFifty-five histologically confirmed tumors were studied. Histological slides were reviewed and immunohistochemical staining of the archival paraffin blocks was performed.
ResultsNineteen of the 55 carcinomas (35%) were sporadic, and 36 (65%) familial. Sex distribution was similar, but familial carcinoma was more common in patients under 40 years of age (p<0.001). A solid growth pattern and plasmacytoid cells were found in most cases. C-cell hyperplasia and multicentricity were more frequent findings in familial carcinoma, while tumor necrosis, hemorrhagic foci, vascular invasion, and neovascularization were more common in the sporadic type. Immunohistochemical staining was positive for calcitonin, CEA, bcl-2, and p53 protein. With regard to staging, familial carcinomas were diagnosed in the earliest stages, when they were smaller and there were no lymph node metastases (p<0.01).
ConclusionsFamilial cases were more frequent when there was more C-cell hyperplasia and multicentricity. Sporadic cases more frequently showed foci of necrosis, hemorrhage, vascular invasion, and neovascularization. Neither histopathological nor immunohistochemical criteria are useful for differentiating between familial and sporadic forms.
La patología tumoral tiroidea es variada1,2, y con frecuencia presenta importantes dudas diagnósticas3,4. El carcinoma tiroideo más frecuente es el carcinoma diferenciado, donde la cirugía y el tratamiento con yodo le hacen tener un pronóstico bastante favorable5. El carcinoma medular de tiroides (CMT) es una neoformación poco frecuente (3-10% de las neoplasias tiroideas) originado a partir de las células C parafoliculares, y se puede presentar de forma esporádica o familiar, con predominio de esta última, la cual se asocia a un fenotipo característico6–8.
Al ser el CMT un tumor poco frecuente existen dificultades para su estudio, dado el escaso número de pacientes y de series9. Además, desde el punto de vista histológico puede mostrar una gran variabilidad en sus características citoarquiteturales, lo que dificulta su reconocimiento y puede hacer necesaria la utilización de técnicas de inmuno-histoquímica para su diagnóstico9,10. También hay que tener en cuenta que no existe unanimidad a la hora de clasificar estos tumores en diferentes patrones cito-arquitecturales9, por lo que se encuentran estudios como el de Franc et al11 que consideran hasta 8 características arquiteturales y 9 celulares, mientras que otros contemplan menos12–14.
Por otro lado, el perfil inmuno-histoquímico de estos tumores es mal conocido debido a su infrecuencia y a la heterogeneidad de métodos que han utilizado para su determinación. Así, la valoración de los resultados obtenidos con las tinciones de inmuno-histoquímica resulta controvertida, pues no todos los autores coinciden en el modo de cuantificar el grado de positividad y puede haber variaciones en la sensibilidad de los diferentes anti-sueros utilizados9,13,15.
El objetivo de este estudio es analizar las características clínicas, histológicas e inmuno-histoquímicas del CMT, y determinar si existen diferencias clínicas, morfológicas e inmuno-histoquímicas entre los carcinomas esporádicos y familiares.
Pacientes y métodosCriterios de selección de la población a estudioSe han incluido 55 pacientes con CMT intervenidos en el servicio de ciugía general y aparato digestivo del Hospital Universitario Virgen de la Arrixaca entre 1971 y el 2004, que cumplian los siguientes criterios:
- 1.
Confirmación histológica de carcinoma medular de tiroides.
- 2.
Conservación de las preparaciones histológicas y bloques de parafina del CMT extirpado en la primera cirugía del tumor.
- 3.
Conservación de la historia clínica completa del paciente, y presencia en ella de los datos clínico-epidemiológicos mínimos incluidos en el protocolo del estudio.
Los datos referentes a las características clínicas y la evolución fueron recogidos de su historia clínica, de forma retrospectiva.
Las característias macroscópicas, microscópicas y de inmuno-histoquímica se obtuvieron revisando las preparaciones histológicas del tumor, junto con los datos existentes en su informe de anatomía patológica. Además, en cada paciente, en los bloques de parafina del tumor, se llevaron a cabo tinciones de inmuno-histoquímica para completar el estudio.
Descripción de la serieDe los 55 pacientes incluidos en el estudio, el 54% son mujeres (n=30) y el 66% (n=36) tienen una edad inferior o igual a los 40 años (edad media 36 años). Respecto al tipo de carcinoma el 35% (n=19) son esporádicos y el 65% (n=36) restante pertenecientes a familias con síndrome de NEM 2A (29 tienen la mutación «Cys634Thyr» y los 7 casos restantes la «Cys634Arg»).
Los valores de calcitonina basal previa a la cirugía fueron de 2.690,2 (931) pg/ml, de la calcitonina post-estímulo de 8.520,6 (1321) pg/ml, y de CEA de 16,3 (12) mcg/L
Todos los pacientes han sido intervenidos y se les realizó tiroidectomía total. Además, en un 29% (n=16) de los casos se asoció un vaciamiento central, en un 15% (n=7) un vaciamiento central y un vaciamiento yugular bilateral, y en un 5% (n=3) un vaciamiento yugular ipsilateral.
Variables a estudioLas variables estudiadas se agruparon en:
- 1.
Variables epidemiológicas: a) sexo; b) edad: ≤40 años y >40 años, y c) tipo de carcinoma: esporádico o familiar–síndrome de NEM 2A16,17.
- 2.
Características microscópicas: a) Patrón arquitectural, según la disposición pedrominante de las células tumorales: sólido (células dispuestas «en sábana» sin formar estructuras reconocibles), trabecular (células dispuestas en estructuras cordonales de grosor variable), y acinar (células en grupos redondeados de pequeño tamaño);b) Patrón citológico, según la morfología celular predominante en el tumor: plasmocitoide (células de citoplasma abundante y núcleo de localización excéntrica), fusocelular (células elongadas de aspecto fusiforme), células pequeñas (células de núcleo hipercromático y citoplasma escaso), oncocítico (células de citoplasma muy abundante, intensamente eosinofílico), y células claras (células de citoplasma muy abundante, ópticamente claro); c) Amiloide, demostrable con la tinción de rojo Congo; d) Colágeno; e) Calcificación, ya sea de tipo distrófico o cuerpos de psammoma; e) Hiperplasia de células C, definida como la presencia de al menos 50 células C por campo de bajo aumento18; f) Multicentricidad, dependiendo de la presencia o no de más de un nódulo tumoral reconocido macroscópicamente, y g) Otras características microscópicas de tumores malignos: necrosis (áreas de necrosis tumoral macro o microscópicas), mitosis (figuras mitóticas en al menos el 15% de las células tumorales), hemorragia (áreas hemorrágicas marco o microscópicas), invasión vascular (células tumorales en la luz o pared de vasos), y neovascularización (presencia de forma llamativa de vasos neoformados en el tumor).
- 3.
Características inmuno-histoquímicas. Las preparaciones iniciales fueron revisadas y se realizarón nuevas secciones a partir de los bloques de parafina. Una vez teñidos los tumores con cada uno de los marcadores, estos se clasificaron según su afinidad por éstos en tres grupos según el método semicuantitativo de Bergholm et al15, en tumores de inmunorreactividad baja (menos del 10% de las células teñidas), de inmunorreactividad media (entre el 10 y 50% de células teñidas), y de inmunorreactividad alta (más del 50% de células teñidas). Las características inmuno-histoquímicas analizadas son: a) Calcitonina (determinado con el anticuerpo primario DAKO Rabbit Anti-Human Calcitonin); b) CEA (anticuerpo primario DAKO Rabbit Anti-Human CEA); c) Bcl-2 (anticuerpo primario utilizado fue el DAKO ChemMate Mouse Anti-Human BCL-2 Oncoprotein); d) p-53 (anticuerpo primario DAKO ChemMate Mouse Anti-Human p53 Protein); e) Ki-67 (anticuerpo primario DAKO Rabbit Anti-Human Ki-67 Antigen), y f) C-erb-B2 (anticuerpo primaria DAKO Rabbit Anti-Human C-erb-B2 Oncoprotein).
- 4.
Características de estadificación y de evolución clínica. a) Estadio, según la clasificación TNM de 2002, actualizada en 200919. Se trata de Estadio I (tumor≤2cm, limitado al tiroides, sin metástasis ganglionares ni a distancia [T1,N0,M0]); Estadio II (tumor>2cm pero <4cm limitado al tiroides, sin metástasis ganglionares ni a distancia [T2,N0,M0]); Estadio III (tumor>4cm, limitado al tiroides o tumor con mínima extension extratiroidea sin metástasis ganglionares o a distancia [T3,N0,M0]; o cualquiera de los tres tipos descritos anteriormente [T1, T2 o T3] que presenten metástasis ganglionares en el nivel VI [pretraqueales, paratraqueales, prelaríngeos, ganglios linfáticos de Delfos, N1a]); y Estadio IV (T1, T2 o T3 con metástasis ganglionares superiores, afectación uni o bilateral de los huesos cervicales, N1b o, metástasis a distancia, M1; o T4a [tumor de cualquier tamaño que crece fuera de la cápsula tiroidea e invade el tejido celular subcutáneo, la laringe, la tráquea, el esófago o el nervio recurrente]- T4b [tumor que invade la fascia prevertebral, la arteria carótida o los vasos mediastínicos] con cualquier N o M); b) Tamaño (T1 [≤2cm], T2 [2-4cm], y T3 [>4cm]); c) Metástasis ganglionares, confirmadas histológicamente; d) Metástasis a distancia; e) Recidiva ganglionar, diagnosticada por punción aspiración biopsia o aumento de valores séricos de calcitonina, y f) Recidiva local.
Los datos fueron procesados con el paquete estadístico SPSS para Windows versión 11.0. Se realizó estadística descriptiva, el test de chi cuadrado cumplimentado con un análisis de residuos, y el test de Fisher si era necesario. Las diferencias se consideraron significativas para una p<0,05.
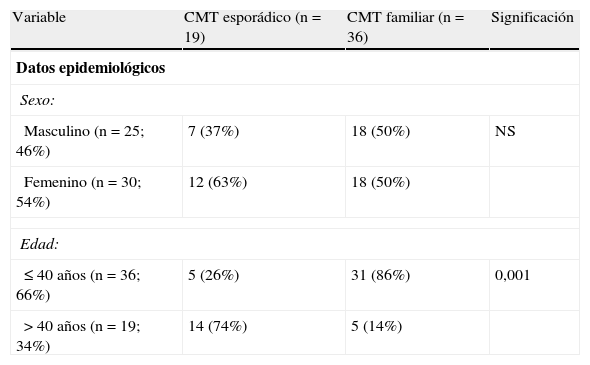
ResultadosDatos epidemiológicosLa edad media de los pacientes fue de 36 años (6-83 años), siendo el 54% mujeres. De los 55 carcinomas, 19 (35%) fueron esporádicos y 36 (65%) de tipo familiar. Considerada la serie de forma global, existe un ligero predominio femenino (relación hombre/mujer de 1/1,19) y una mayor frecuencia de casos diagnosticados y tratados a edades más tempranas (66% de pacientes con 40 o menos años) (tabla 1).
Diferencias entre el CMT esporádico y familiar
| Variable | CMT esporádico (n=19) | CMT familiar (n=36) | Significación |
| Datos epidemiológicos | |||
| Sexo: | |||
| Masculino (n=25; 46%) | 7 (37%) | 18 (50%) | NS |
| Femenino (n=30; 54%) | 12 (63%) | 18 (50%) | |
| Edad: | |||
| ≤40 años (n=36; 66%) | 5 (26%) | 31 (86%) | 0,001 |
| >40 años (n=19; 34%) | 14 (74%) | 5 (14%) | |
CMT: carcinoma medular de tiroides; NS: no significativo.
La distribución por sexo no muestra diferencias significativas entre los casos esporádicos o familiares. Sin embargo, respecto a la edad, los carcinomas familiares tienen una mayor frecuencia de pacientes de menores de 40 años que los esporádicos (86 frente a 26%; p<0,001).
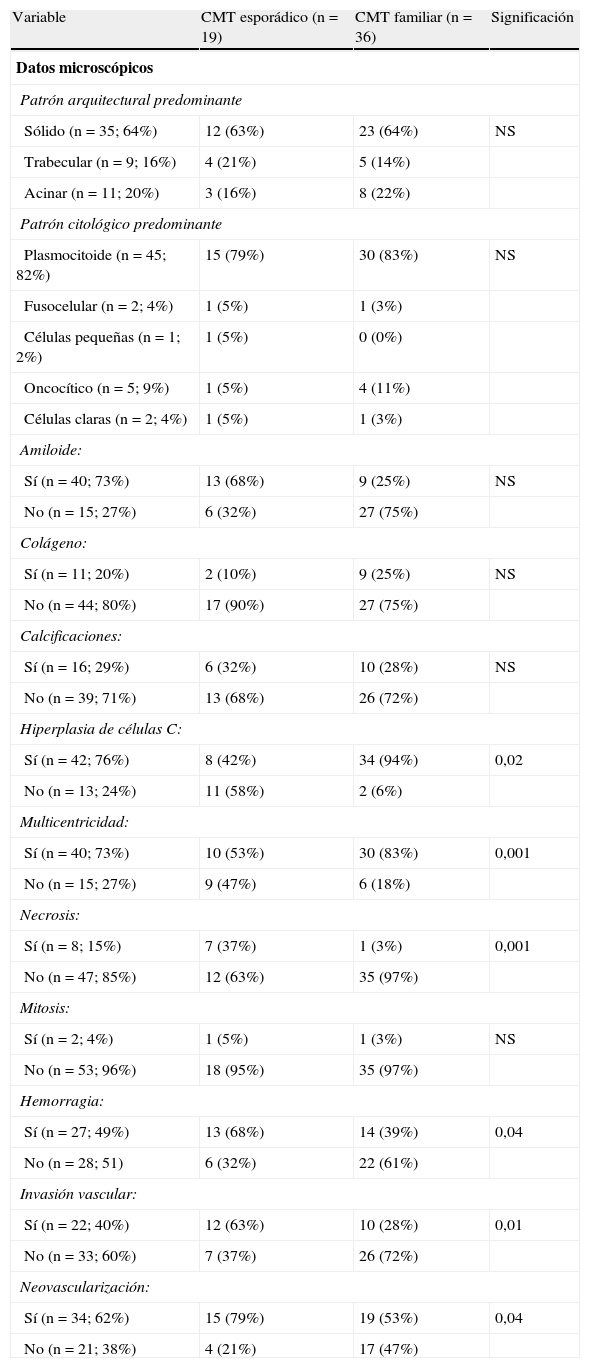
Características microscópicasEl patrón de crecimiento tumoral predominante es el de tipo sólido (64%) y el tipo celular más frecuente el plasmocitoide (82%). En el 73% de los casos se ha identificado sustancia amiloide, en el 20% áreas ocupadas por material colágeno, y en el 29% focos de calcificación. No se objetivan diferencias signitivas en ninguna de estas variables entre el CMT esporádico y familiar (tabla 2).
La presencia de hiperplasia de células C se ha observado en un 76% de casos y la multicentricidad en el 73%, ambas características más frecuentes en el tipo familiar (p<0,001 y p<0,02). Por el contrario la necrosis tumoral es un hallazgo infrecuente (15%), asociado mayoritariamente a CMT de tipo esporádico (p<0,001). Solo se han identificado figuras mitóticas en 2 de los 55 casos (4%), correspondiendo uno de ellos a la variante familiar y el otro a la esporádica.
Se han identificado focos hemorrágicos intratumorales en el 49% de los casos, invasión vascular en el 40% y neovascularización en el 62%. Las tres características microscópicas se asocian con más frecuencia a la variante esporádica del CMT (p<0,05), como puede verse en la tabla 2.
Diferencias entre el CMT esporádico y familiar
| Variable | CMT esporádico (n=19) | CMT familiar (n=36) | Significación |
| Datos microscópicos | |||
| Patrón arquitectural predominante | |||
| Sólido (n=35; 64%) | 12 (63%) | 23 (64%) | NS |
| Trabecular (n=9; 16%) | 4 (21%) | 5 (14%) | |
| Acinar (n=11; 20%) | 3 (16%) | 8 (22%) | |
| Patrón citológico predominante | |||
| Plasmocitoide (n=45; 82%) | 15 (79%) | 30 (83%) | NS |
| Fusocelular (n=2; 4%) | 1 (5%) | 1 (3%) | |
| Células pequeñas (n=1; 2%) | 1 (5%) | 0 (0%) | |
| Oncocítico (n=5; 9%) | 1 (5%) | 4 (11%) | |
| Células claras (n=2; 4%) | 1 (5%) | 1 (3%) | |
| Amiloide: | |||
| Sí (n=40; 73%) | 13 (68%) | 9 (25%) | NS |
| No (n=15; 27%) | 6 (32%) | 27 (75%) | |
| Colágeno: | |||
| Sí (n=11; 20%) | 2 (10%) | 9 (25%) | NS |
| No (n=44; 80%) | 17 (90%) | 27 (75%) | |
| Calcificaciones: | |||
| Sí (n=16; 29%) | 6 (32%) | 10 (28%) | NS |
| No (n=39; 71%) | 13 (68%) | 26 (72%) | |
| Hiperplasia de células C: | |||
| Sí (n=42; 76%) | 8 (42%) | 34 (94%) | 0,02 |
| No (n=13; 24%) | 11 (58%) | 2 (6%) | |
| Multicentricidad: | |||
| Sí (n=40; 73%) | 10 (53%) | 30 (83%) | 0,001 |
| No (n=15; 27%) | 9 (47%) | 6 (18%) | |
| Necrosis: | |||
| Sí (n=8; 15%) | 7 (37%) | 1 (3%) | 0,001 |
| No (n=47; 85%) | 12 (63%) | 35 (97%) | |
| Mitosis: | |||
| Sí (n=2; 4%) | 1 (5%) | 1 (3%) | NS |
| No (n=53; 96%) | 18 (95%) | 35 (97%) | |
| Hemorragia: | |||
| Sí (n=27; 49%) | 13 (68%) | 14 (39%) | 0,04 |
| No (n=28; 51) | 6 (32%) | 22 (61%) | |
| Invasión vascular: | |||
| Sí (n=22; 40%) | 12 (63%) | 10 (28%) | 0,01 |
| No (n=33; 60%) | 7 (37%) | 26 (72%) | |
| Neovascularización: | |||
| Sí (n=34; 62%) | 15 (79%) | 19 (53%) | 0,04 |
| No (n=21; 38%) | 4 (21%) | 17 (47%) | |
CMT: carcinoma medular de tiroides; NS: no significativo.
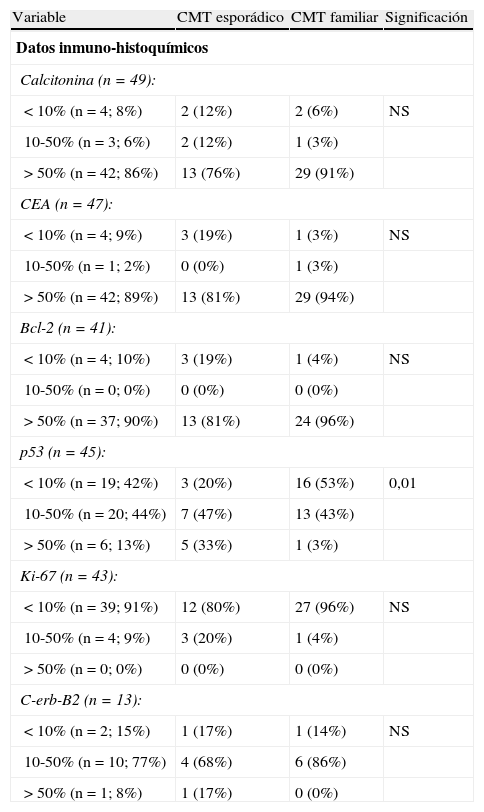
Los tumores muestran positividad intensa con marcadores para calcitonina (86%), CEA (89%) y bcl-2 (90%), sin que existan diferencias entre los casos esporádicos y familiares, como puede verse en la tabla 3.
Diferencias entre el CMT esporádico y familiar
| Variable | CMT esporádico | CMT familiar | Significación |
| Datos inmuno-histoquímicos | |||
| Calcitonina (n=49): | |||
| <10% (n=4; 8%) | 2 (12%) | 2 (6%) | NS |
| 10-50% (n=3; 6%) | 2 (12%) | 1 (3%) | |
| >50% (n=42; 86%) | 13 (76%) | 29 (91%) | |
| CEA (n=47): | |||
| <10% (n=4; 9%) | 3 (19%) | 1 (3%) | NS |
| 10-50% (n=1; 2%) | 0 (0%) | 1 (3%) | |
| >50% (n=42; 89%) | 13 (81%) | 29 (94%) | |
| Bcl-2 (n=41): | |||
| <10% (n=4; 10%) | 3 (19%) | 1 (4%) | NS |
| 10-50% (n=0; 0%) | 0 (0%) | 0 (0%) | |
| >50% (n=37; 90%) | 13 (81%) | 24 (96%) | |
| p53 (n=45): | |||
| <10% (n=19; 42%) | 3 (20%) | 16 (53%) | 0,01 |
| 10-50% (n=20; 44%) | 7 (47%) | 13 (43%) | |
| >50% (n=6; 13%) | 5 (33%) | 1 (3%) | |
| Ki-67 (n=43): | |||
| <10% (n=39; 91%) | 12 (80%) | 27 (96%) | NS |
| 10-50% (n=4; 9%) | 3 (20%) | 1 (4%) | |
| >50% (n=0; 0%) | 0 (0%) | 0 (0%) | |
| C-erb-B2 (n=13): | |||
| <10% (n=2; 15%) | 1 (17%) | 1 (14%) | NS |
| 10-50% (n=10; 77%) | 4 (68%) | 6 (86%) | |
| >50% (n=1; 8%) | 1 (17%) | 0 (0%) | |
CMT: carcinoma medular de tiroides; NS: no significativo.
Tampoco existen diferencias entre los tipos familiar y esporádico con respecto a la inmunorreactividad para Ki-67 (que es inferior al 10% en el 91%) ni para C-erb-B2 en el que el 77% de los casos muestran una positividad intermedia.
Para la proteína p53, el 44% presentan una positividad intermedia y el 13% alta, y se observa positividad alta más frecuente entre los esporádicos (p<0,01) (tabla 3).
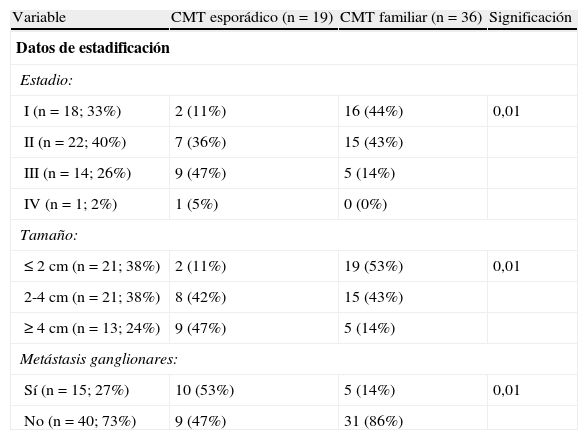
Datos de estadificaciónEl 27% de los pacientes (n=14) ha presentado recidiva del CMT. El intervalo libre de enfermedad al año fue de 88±5%, a los 5 años 73±7%, a los 10 años 73±7%, a los 15 años 61±10%, y en 20 años o más 61±10%. Existe un predominio de casos diagnosticados y tratados en estadios iniciales de la enfermedad (33% en estadio I y 40% en estadio II) y son pocos los tumores mayores de 4cm de diámetro (26% de casos) y los que tenían metástasis ganglionares en el momento del diagnóstico (27% casos) (tabla 4).
Diferencias entre los carcinomas medulares esporádicos y familiares
| Variable | CMT esporádico (n=19) | CMT familiar (n=36) | Significación |
| Datos de estadificación | |||
| Estadio: | |||
| I (n=18; 33%) | 2 (11%) | 16 (44%) | 0,01 |
| II (n=22; 40%) | 7 (36%) | 15 (43%) | |
| III (n=14; 26%) | 9 (47%) | 5 (14%) | |
| IV (n=1; 2%) | 1 (5%) | 0 (0%) | |
| Tamaño: | |||
| ≤2cm (n=21; 38%) | 2 (11%) | 19 (53%) | 0,01 |
| 2-4cm (n=21; 38%) | 8 (42%) | 15 (43%) | |
| ≥4cm (n=13; 24%) | 9 (47%) | 5 (14%) | |
| Metástasis ganglionares: | |||
| Sí (n=15; 27%) | 10 (53%) | 5 (14%) | 0,01 |
| No (n=40; 73%) | 9 (47%) | 31 (86%) | |
CMT: carcinoma medular de tiroides; NS: no significativo.
Se objetivan diferencias significativas respecto al estadio, el tamaño tumoral y la presencia de metástasis ganglionares entre los CMT esporádicos y familiares. Así, el CMT familiar es diagnosticado en un estadio I en el 44% de los casos y el esporádico en un 11% (p<0,01). Respecto al tamaño, el 53% de los familiares tienen un tamaño igual o inferior a 2cm frente al 11% de los esporádicos (p<0,01). Por último, el 86% de los casos familiares no tienen metástasis ganglionares frente al 47% de los esporádicos (p<0,01).
DiscusiónLas características epidemiológicas del CMT difieren de un área geográfica a otra. Así, en nuestra serie llama la atención la alta presencia de casos familiares (66%), 4 veces superior a la media esperada20,21, lo cual se debe a que nuestra área geográfica presenta una gran incidencia de síndrome de NEM17,22. Esta alta incidencia de casos familiares es la causa de algunas de las diferencias observadas respecto a otros estudios, como por ejemplo la edad media, debido a que muchos de ellos han sido diagnosticados en programas de cribado en familias portadoras, lo que permite descubrir la enfermedad en fases muy iniciales17.
En cuanto a las características microscópicas propias del CMT no existe unanimidad entre los autores a la hora de clasificar los diferentes patrones cito-arquitecturales. Así, Franc et al11 consideran 8 características arquitecturales y 9 celulares, mientras que otros como Dottorini et al12 o Schröder et al13 solo contemplan tres tipos citológicos y Kos et al14 solo tres arquitecturales. A pesar de esta falta de uniformidad, en la mayoría de series predominan las células de morfología plasmocitoide o poligonal12,13 dispuestas en un patrón de crecimiento sólido9,13,14,23. En nuestra serie solo el 4% presentan un tipo citológico predominante fusocelular, mientras en otras series constituye más del 20% del total13. Sin embargo, hay que tener en cuenta que mientras nosotros hemos tenido en cuenta únicamente la característica predominante, otros autores como Franc et al11 valoran más los rasgos diferenciales, lo cual puede justificar en parte las diferencias entre las series.
Al comparar los casos familiares con los esporádicos la apariencia histológica es similar entre ambos, a excepción de la hiperplasia de células C y la multicentricidad, observadas con mayor frecuencia en los casos familiares. Sin embargo, son frecuentes los casos de CMT esporádico con hiperplasia de células C (42%) y, aunque son pocos (6%), también hemos observado algunos casos de CMT familiar en los que no se ha podido demostrar dicha hiperplasia. Ambos hechos habían sido descritos previamente, y se defiende que la hiperplasia de células C es la precursora también del CMT esporádico24. Así, en la serie de Kebebew et al la bilateralidad entre casos esporádicos alcanza el 67%20 y apuntan la posibilidad de que hasta un 10% de CMT esporádicos correspondan a formas familiares que han pasado desapercibidas, lo que ha podido ocurrir con los casos más antiguos de nuestra serie. Otros autores como Hayashida et al apuntan la posibilidad de que la falta de hiperplasia de células C, en casos familiares, pueda deberse a un muestreo insuficiente de las áreas no tumorales en las piezas de tiroidectomía25.
La presencia de depósticos de sustancia amiloide, considerada una característica típica del CMT, solo pudo evidenciarse en un 73% de tumores, una proporción similar a la descrita por Bergholm et al15 y Schröder et al13, pero mucho más baja a la observada en otras series12,23. Por otro lado, rara vez los estudios hacen referencia a la presencia de calcificaciones, que en nuestro estudio representa el 29% de los casos, lo cual representa un porcentaje alto13.
En cuanto al resto de características microscópicas, la presencia de áreas de necrosis varía mucho de unas series a otras, desde un 50%11 hasta solo un 7%12. En nuestro estudio está en una cifra intermedia, con un 15% de los casos. La actividad mitótica suele ser poco frecuente (4% en nuestra serie) y, aunque algunos autores lo mencionan expresamente23, no se suelen dar datos concretos.
Las características histológicas comúnmente asociadas a una mayor agresividad tumoral, como son la presencia de necrosis, hemorragia, invasión vascular y neovascularización, se asocian más frecuentemente con el CMT esporádico. Esta asociación es muy probable que se deba más al tamaño tumoral, ya que el CMT de tipo esporádico es diagnosticado y extirpado con un tamaño mayor que el familiar.
Todos estos datos nos llevan a afirmar que no existen criterios histopatológicos que permitan diferenciar las formas familiar y esporádica del CMT.
Respecto a las características inmuno-histoquímicas, también hay controversia pues no todos los autores coinciden en el modo de cuantificar el grado de positividad9,13,15 y además existe variación en la sensibilidad de los diferentes anti-sueros utilizados9,13. En general, estos tumores presentan una alta positividad para calcitonina26, CEA12 y bcl-227,28, que en nuestra serie es del 86, 89 y 90%, respectivamente. En otros estudios, no con la misma metodología, esta posibidad es diferente. Así, Bergholm et al15 objetivan un 26% de positividad para calcitonina, Kos et al14 un 11%, etc. Las controversias en inmuno-histoquímica pueden orientar a una posible degradación del antígeno objetivo en el bloque de parafina debido a un almacenamiento largo o inapropiado del material9.
Respecto a otros marcadores los resultados son más desconocidos y heterogéneos. En este sentido, respecto al p53, se describen muy bajos índices de positividad (5-28%)27,28, sin embargo, nosotros hemos encontrado más del 13% de los tumores con más del 50% de células marcadas para p53 y un 44% con un 10-50% de células teñidas. Respecto a la positividad para Ki-67, en tumores tiroideos malignos se ha descrito que se sitúa sobre el 40%29, aunque en nuestra serie, centrada solo en el CMT, es mucho más baja. Así, un 91% expresó de forma muy baja o no expresó este antígeno. En cuanto a la información sobre C-erb-B2 y tiroides es muy escasa y no hace referencia al CMT. Así, Soda et al30 encuentran un 60% de positividad en tumores tiroideos malignos. Nosotros encontramos casi un 85% de tumores con positividad media o alta.
Con respecto a las características inmuno-histoquímicas, concretamente a la inmunorreactividad, la única diferencia observada entre las variedades familiar y esporádica es una mayor frecuencia de positividad baja (menos del 10% de células teñidas) para p53 en el CMT familiar y positividad alta (más del 50% de células teñidas) en el tipo esporádico, que puede estar relacionado con la presencia de formas agresivas dentro del grupo de los esporádicos. Los métodos inmuno-histoquímicos no son útiles para la discriminación entre casos esporádicos y familiares del CMT31.
Cada vez se van conociendo posibles marcadores inmuno-histoquímicos que es posible que en el futuro tengan alguna importancia pronóstica o diagnóstica en estos tumores. En este sentido, se va describiendo la expresión de diferentes proteínas en el CMT, como es la proteína p8 la cual parece ejercer un papel importante en la progresión del CMT32. Ito et al33 analizaron la expresión de cdc25B y cdc25A en el CMT, y observaron que el cDc25B es un marcador de agresividad y se expresa en el 36% de los casos.
Por último, en cuanto a las características de estadificación y de evolución clínica, la mayor parte de nuestros pacientes fueron intervenidos en estadios iniciales de la enfermedad, por la presencia de varios casos familiares diagnosticados mediante estudio genético. Así, mientras en la mayor parte de los estudios se describen metástasis ganglionares y, por tanto, estadio III o IV (>40%)15,21,23,34,35, nosotros solo las hemos observado en un 28% el estadio III y en un 2% el estadio IV. Por todo ello, la mayor parte de pacientes diagnosticados en estadio I y, por tanto, con tamaño inferior a 1cm y en ausencia de metástasis correspondan a la variedad familiar, mientras que la mayor parte de pacientes intervenidos en estadio III, con diámetro de más de 4cm o con metástasis ganglionares suelen ser de tipo esporádico. Esta detección más precoz a edades más jóvenes y en estadios más iniciales es la reponsable, como opinan Goudet et al o Samaan et al, del mejor pronóstico de las formas familiares36,37.
En conclusión, los CMT tienen un patrón de crecimiento sólido y células plasmocitoides, con presencia frecuente de sustancia amiloide, hiperplasia de células C, multicentricidad y neovascularización. La inmunorreactividad para calcitonina, CEA y bcl-2 es alta mientras que es baja para Ki-67 e intermedia para p53 y C-erb-B2. La comparación de casos esporádicos y familiares revela que la hiperplasia de células C y la multicentricidad se observan con más frecuencia en el CMT familiar, aunque no son exclusivas de este, mientras que el CMT esporádico muestra una mayor frecuencia de focos de necrosis, hemorragia, invasión vascular y neovascularización. Ni los criterios histopatológicos ni los inmuno-histoquímicos son útiles para diferenciar las formas familiar y esporádica del CMT.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.