Habitualmente, el diagnóstico de hipertensión y las decisiones clínicas para su tratamiento se basan en un número limitado de valores de presión arterial (PA) obtenidos en la consulta clínica. Sin embargo, la correlación entre el nivel de PA y el riesgo de daño en órganos diana y eventos cardiovasculares (CV) es mucho mayor para la monitorización ambulatoria de la PA (MAPA), tanto en población general como en pacientes con diabetes. Además, numerosos estudios independientes han demostrado que la media de PA durante el sueño es mejor marcador de riesgo CV que la PA clínica y que las medias de actividad o de 24h derivadas de la MAPA. La prevalencia de un patrón circadiano de la PA alterado y de hipertensión nocturna es muy elevada en pacientes con diabetes, por lo que en estos pacientes el diagnóstico de hipertensión y su control terapéutico son frecuentemente inadecuados en ausencia de valoración de la PA a lo largo de las 24h mediante MAPA. Por todo ello, la MAPA debe ser la herramienta de elección en pacientes con diabetes para el correcto diagnóstico de hipertensión y para establecer el esquema terapéutico más adecuado que permita el control de la PA nocturna elevada, lo que podría redundar a su vez en una reducción significativa de eventos CV.
The diagnosis of hypertension and the clinical decisions regarding its treatment are usually based on daytime clinic blood pressure (BP) measurements. However, the correlation between BP levels and target organ damage, cardiovascular (CV) risk, and long-term prognosis, is higher for ambulatory (ABPM) than clinic measurements, both in the general population as well as in patients with diabetes. Moreover, there is consistent evidence in numerous studies that the asleep BP better predicts CV events than either the awake or 24h means. The prevalence of abnormal BP pattern and sleep-time hypertension is extensive in diabetes, often leading to inaccurate diagnoses of hypertension and its therapeutic control in the absence of complete and careful assessment of the entire 24h, i.e., daytime and night-time, BP pattern. Accordingly, ABPM should be the preferred method to comprehensively assess and decide the optimal clinical management of patients with diabetes directed to properly reduce elevated sleep-time BP, which might also lead to a significant reduction of CV events.
La presión arterial (PA) presenta una variación diaria en gran parte predecible que resulta de la interrelación de diversos factores fisiológicos, neuroendocrinos y ambientales: (i) cambios en el comportamiento asociados al patrón de actividad-descanso; (ii) divergencia con relación al ciclo de luz-oscuridad en temperatura ambiental, humedad y ruido y (iii) variación circadiana (∼24h) endógena en parámetros neuroendocrinos, endoteliales, vasoactivos y hemodinámicos, por ejemplo, noradrenalina y adrenalina plasmáticas (sistema nervioso autónomo), péptido natriurético auricular y calcitonina, renina, angiotensina y aldosterona (sistema renina-angiotensina-aldosterona, RAAS)1,2. Diversos ritmos circadianos en funciones y procesos fisiológicos y bioquímicos afectan también de forma significativa la farmacocinética y farmacodinámica de la medicación antihipertensiva, como se ha descrito ampliamente3–5.
El diagnóstico de hipertensión y las decisiones clínicas para su tratamiento se basan habitualmente en un número limitado de valores de PA obtenidos en la clínica, ocasionalmente complementados por automedida domiciliaria siempre durante el ciclo de actividad6. Sin embargo, la correlación entre el nivel de PA y el riesgo de daño en órganos diana y eventos cardiovasculares (CV) es mucho mayor para la monitorización ambulatoria de la PA (MAPA), tanto en población general7,8 como en pacientes con diabetes9,10. Una de las ventajas adicionales de la MAPA es que permite la descripción y cuantificación del perfil de variación circadiana de la PA.
En las últimas décadas se ha explorado el valor de diversos parámetros calculados a partir de la MAPA como biomarcadores o mediadores de daño en órgano diana y de riesgo de eventos CV. En concreto, diversos estudios prospectivos de MAPA han demostrado el aumento de riesgo de daño en órganos diana y de incidencia de eventos CV fatales y no fatales asociado con la disminución en la profundidad de la PA (es decir, porcentaje de descenso de PA durante el sueño con respecto a la media de PA durante el periodo de actividad) que caracteriza a los sujetos con perfil no-dipper (profundidad de la PA sistólica [PAS] <10%), no solo en pacientes hipertensos tanto sin diabetes8,11–14 como con ella9,10,15–17, sino también en sujetos normotensos18. Además, numerosos estudios independientes han demostrado que la media de descanso (periodo de sueño) de la PA es mejor marcador de riesgo CV que la PA clínica convencional y que las medias de actividad o de 24h derivadas de la MAPA8,12–14,19–25, también en pacientes con diabetes10,17,26. En general, estos estudios demuestran que, cuando se analizan conjuntamente las medias de actividad y de descanso ajustadas por variables de influencia significativas (incluyendo sexo, edad, diabetes, enfermedad renal crónica, tabaquismo, evento CV previo, etc.), solo la media de descanso, pero no la de actividad, es un marcador significativo e independiente de morbimortalidad CV. Esta revisión presenta nuevas perspectivas emergentes sobre las alteraciones del patrón circadiano de la PA en pacientes con diabetes y su potencial normalización mediante la temporalización (cronoterapia) del tratamiento antihipertensivo al acostarse con el doble objetivo de aumentar el control de la PA y de disminuir el riesgo CV8,10,27–30.
Patrón de presión arterial ambulatoria en pacientes con y sin diabetesLos pacientes con diabetes constituyen uno de los grupos de mayor interés a la hora de evaluar el potencial de la MAPA como herramienta de diagnóstico, debido a la fuerte asociación entre esa enfermedad y el aumento de riesgo de daño en órganos diana, ictus y morbimortalidad CV. El patrón no-dipper y la hipertensión nocturna, condiciones que requieren necesariamente de la MAPA para su diagnóstico, son frecuentes en diabetes31–37. Sin embargo, la prevalencia reportada en la literatura médica del patrón no-dipper en diabetes es altamente inconsistente, entre el 30 y el 73%, posiblemente como consecuencia de las disparidades entre los diferentes estudios en las poblaciones evaluadas (pacientes tratados vs. no tratados, pacientes con diferente severidad de su condición clínica, etc.), tamaño de la muestra relativamente reducido, utilización de un único registro de MAPA de 24h y, por ello, de escasa reproducibilidad38,39, e inadecuada definición de los periodos de actividad y descanso mediante intervalos horarios prefijados para todos los pacientes estudiados. Además, varios investigadores han evaluado el patrón circadiano de la PA de pacientes con diabetes sin la requerida comparación con sujetos no diabéticos.
En uno de los primeros estudios sobre PA ambulatoria en diabetes, Fogari et al.31 evaluaron la prevalencia del perfil no-dipper en 96 pacientes con diabetes tipo 2 (48 normotensos y 48 hipertensos) y en 103 controles sin diabetes (50 normotensos y 53 hipertensos). En contraposición con los resultados de estudios posteriores en poblaciones de mucho mayor tamaño40, las medias de 24h y de actividad de la PA (definida de forma arbitraria como la franja de 06:00 a 22:00h, independientemente del ciclo de sueño/vigilia de cada paciente) fueron equivalentes en pacientes con y sin diabetes. La media de descanso de la PA (arbitrariamente de 22:00 a 06:00h) fue ligera, pero no significativamente mayor en pacientes con diabetes que en pacientes sin diabetes, tanto normotensos como hipertensos. La prevalencia del patrón no-dipper fue de las más bajas reportadas hasta la fecha, concretamente del 30 y 31% en pacientes con diabetes normotensos e hipertensos, respectivamente.
Cuspidi et al.34 evaluaron 2 veces en un periodo de 4 semanas mediante MAPA de 24h a 36 pacientes hipertensos tratados con diabetes de larga duración (>10 años) y a 61 pacientes hipertensos no tratados sin diabetes. La prevalencia del patrón no-dipper fue del 63,9 y 36,3% en pacientes con y sin diabetes, respectivamente, aunque estos resultados podrían estar sesgados debido a la ausencia de tratamiento antihipertensivo en el grupo de pacientes no diabéticos. Los autores también documentaron que (i) la variabilidad intraindividual del patrón no-dipper es menor en pacientes con diabetes; (ii) la clasificación de pacientes como dipper o no-dipper basada en un único registro de MAPA de 24h es más fiable en pacientes con diabetes y (iii) el perfil no-dipper más frecuente y reproducible en pacientes con diabetes está asociado con una mayor prevalencia de daño en órganos diana.
Pistrosch et al.36 reportaron una prevalencia del patrón no-dipper incluso mayor, 73%, en 107 pacientes hipertensos con diabetes evaluados una sola vez con MAPA de 24h. Estos autores concluyeron también que la alteración en la variación circadiana de la PA está más asociada con la hiperglucemia posprandial que con la basal en ayunas.
Por su parte, Afsar et al.35 encontraron una prevalencia del 56,3% del perfil no-dipper, definida por ellos como una profundidad <10% tanto en PA sistólica (PAS) como en PA diastólica (PAD), en 96 pacientes hipertensos con diabetes evaluados mediante MAPA de 24h. El requerimiento de incluir una profundidad <10% en PAD seguramente disminuyó de forma significativa la prevalencia real del perfil no-dipper, más adecuadamente definido de forma frecuente a partir de un descenso inadecuado solamente de PAS durante el sueño; teniendo en cuenta que el rango de variación a lo largo de las 24h es marcadamente diferente para la PAS y la PAD y que la definición de un perfil no-dipper se basa en un umbral arbitrario del porcentaje de la diferencia entre las medias de actividad y descanso de la PA, dicho umbral no puede en ningún caso ser el mismo para la PAS y la PAD41. Afsar et al.35 también concluyeron que el perfil de variación circadiana de la PA está relacionado con la resistencia a la insulina y que, por ello, el índice Homeostatic Model Assessment (HOMA) de resistencia a la insulina puede ser un predictor del perfil no-dipper en pacientes hipertensos con diabetes.
Recientemente, Ayala et al.40 investigaron la influencia de la diabetes sobre el perfil circadiano de la PA entre los pacientes hipertensos reclutados en el Proyecto Hygia, un estudio multicéntrico, prospectivo y controlado en el que participan actualmente 292 investigadores a través de una red de 40 centros sanitarios (mayoritariamente centros de Atención Primaria) en Galicia, diseñado para evaluar el valor pronóstico de la MAPA y la influencia de la hora de tratamiento antihipertensivo en el riesgo CV, cerebrovascular, metabólico y renal40,42–46. La muestra representa una población de pacientes hipertensos de ≥18 años de edad con una rutina habitual de actividad diurna y descanso nocturno. Siguiendo los criterios de inclusión y exclusión específicos para este estudio transversal, los autores identificaron a 12.765 pacientes hipertensos (6.797 hombres y 5.968 mujeres) de 58,1±14,1 (media±DT) años de edad (rango, 18 a 97 años) que completaron el estudio y proporcionaron toda la información requerida. Entre los participantes, 2.954 (1.799 hombres y 1.155 mujeres) tenían diabetes tipo 2, definida como glucemia basal ≥126mg/dl al menos en 2 ocasiones con ≥3 meses de diferencia o tratamiento para reducción de glucosa47. En el momento de la valoración, 525/3.314 pacientes con/sin diabetes no recibían tratamiento antihipertensivo y los restantes 2.429/6.497 pacientes con/sin diabetes estaban tratados. La PA fue evaluada de modo automático cada 20 min entre las 7:00 y 23:00h y cada 30 min durante la noche durante 48 h consecutivas con el objetivo de aumentar la reproducibilidad de los resultados38,39. Los participantes rellenaron un diario donde registraban la hora de acostarse por la noche, la hora en que se levantaban por la mañana, los horarios de las comidas, la realización de ejercicio físico y episodios de actividad física inusual, estados de alteración emocional y otros eventos que pudieran afectar a la PA. La PA ambulatoria se consideró controlada si la media de PAS/PAD en actividad y en reposo era <135/85 y <120/70mmHg, respectivamente6,41.
Los pacientes hipertensos con diabetes fueron predominantemente hombres, de mayor edad, con diagnóstico de albuminuria, enfermedad renal crónica, apnea obstructiva del sueño u obesidad, y presentaban mayores niveles de creatinina, ácido úrico y triglicéridos, pero menores niveles de colesterol total y filtrado glomerular estimado que los pacientes sin diabetes40. La PAS clínica fue significativamente mayor y la PAD significativamente menor en pacientes con diabetes; como consecuencia, se documentó una marcada diferencia entre grupos en presión de pulso (PP, diferencia entre PAS y PAD) medida en la clínica, significativamente mayor en pacientes con diabetes incluso después de corregir los resultados por la edad (p<0,001). La proporción de pacientes con PP ≥65mmHg y, por tanto, con mayor riesgo CV48, fue significativamente mayor en pacientes con diabetes que sin ella, 57 vs. 35% (p<0,001)40.
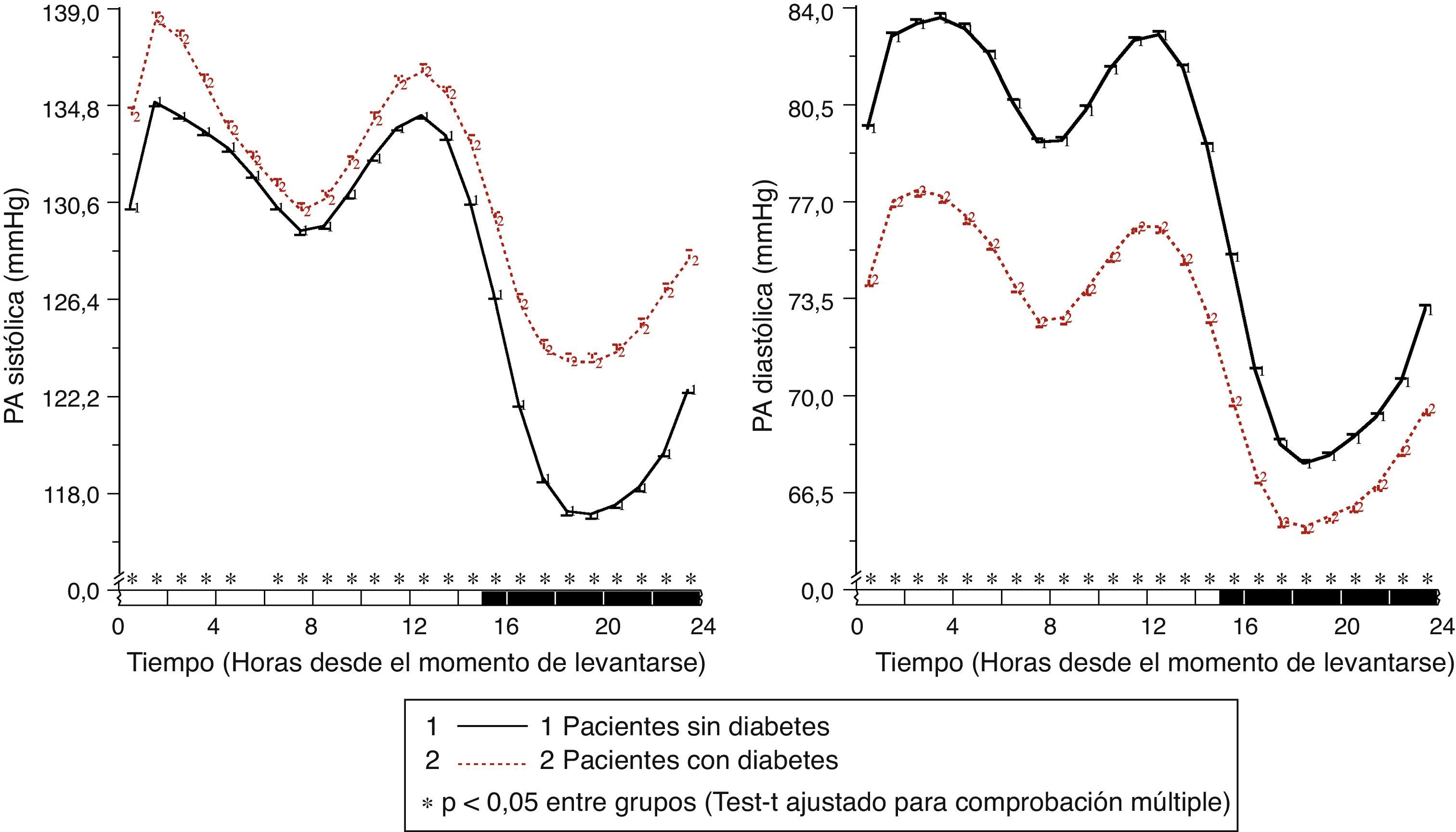
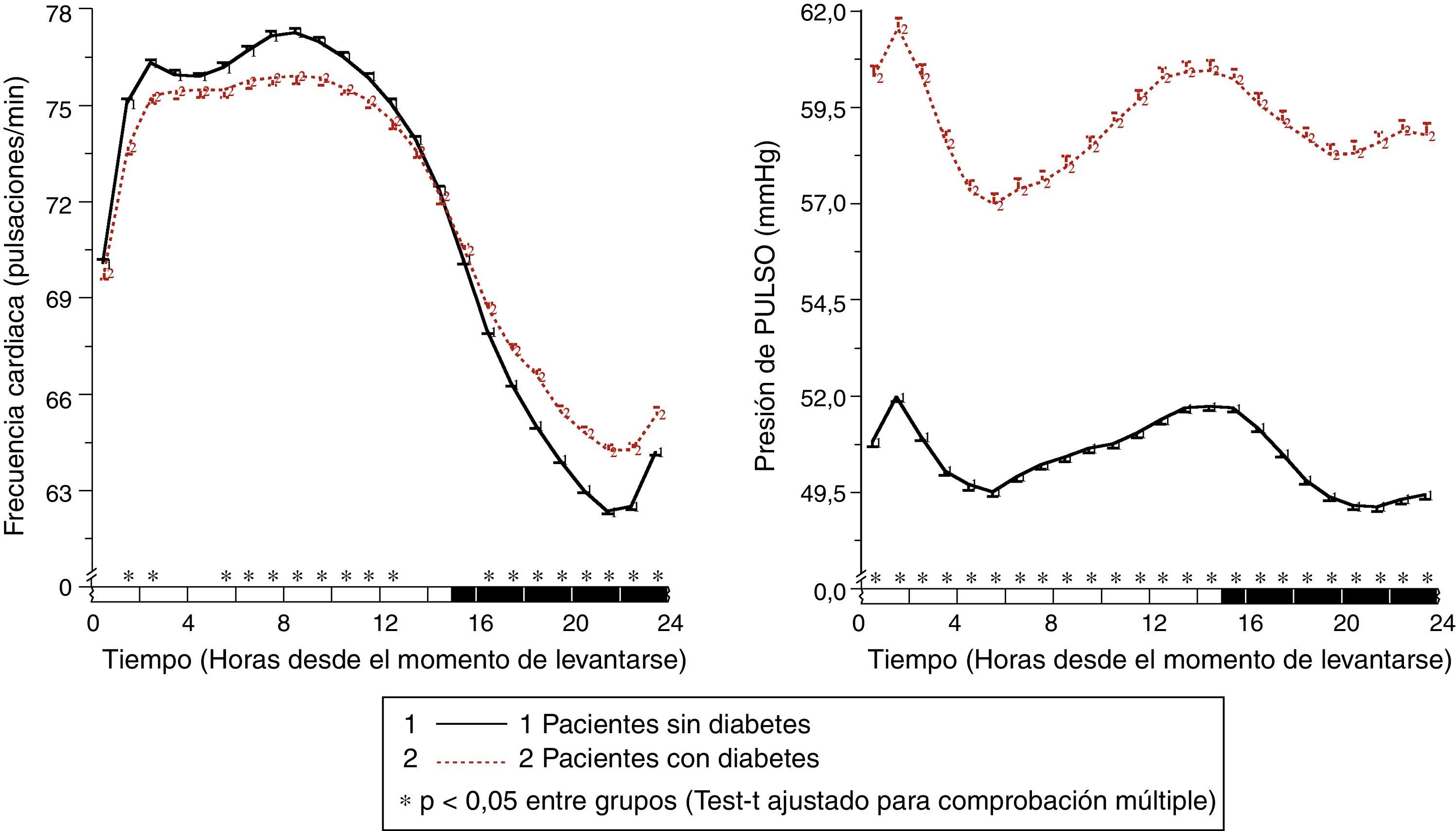
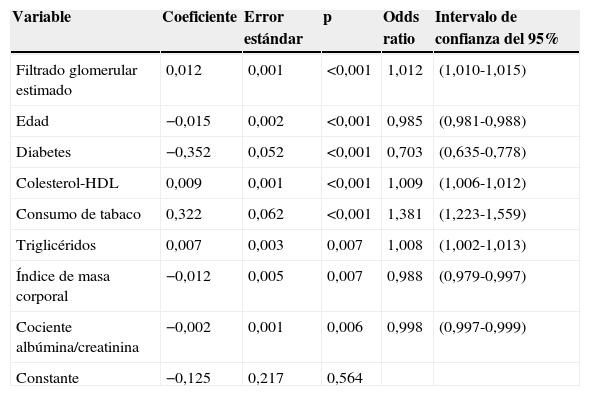
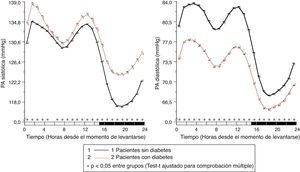
En pacientes con diabetes, la PAS ambulatoria fue significativamente más elevada (p<0,001), principalmente durante las horas de descanso nocturno y primeras horas del ciclo de actividad, independientemente de la presencia/ausencia de tratamiento antihipertensivo (fig. 1, panel izquierdo). La PAD ambulatoria, sin embargo, fue significativamente menor (p<0,001) en pacientes con diabetes, principalmente durante las horas de actividad diurna (fig. 1, panel derecho). Como consecuencia de estas diferencias en PAS y PAD, la PP ambulatoria fue significativamente mayor (p<0,001) en pacientes con diabetes a lo largo de las 24h del día (fig. 2, panel derecho). La proporción de pacientes con una media de 48h de la PP >53mmHg, un umbral asociado con mayor riesgo CV49, fue significativamente mayor en pacientes con diabetes (63 vs. 34%; p<0,001). La frecuencia cardiaca fue significativamente mayor durante las horas de descanso nocturno y menor durante la mayor parte del ciclo de actividad en pacientes con diabetes que sin ella (fig. 2, panel izquierdo). La prevalencia del patrón no-dipper fue significativamente mayor en pacientes con diabetes (62,1 vs. 45,9%; p<0,001), tal y como ha sido ya recientemente corroborado50. La mayor diferencia entre grupos fue en la prevalencia del patrón riser (profundidad de la PAS <0%; 19,9 vs. 8,1%; p<0,001). El factor principal en el diagnóstico de hipertensión o inadecuado control de PA en pacientes con diabetes fue la elevada PA durante el sueño; así, el 89,2% de los pacientes hipertensos con diabetes no controlados tenían hipertensión nocturna40.
Patrón circadiano de la PAS (izquierda) y PAD (derecha) en pacientes hipertensos sin (línea continua) y con diabetes (línea discontinua) evaluados mediante MAPA de 48h. La barra sombreada en el eje horizontal de las gráficas indica el horario promedio de descanso nocturno de los pacientes.
Fuente: Modificado a partir de Ayala et al.40.
Patrón circadiano de la frecuencia cardiaca (izquierda) y PP (derecha) en pacientes hipertensos sin (línea continua) y con diabetes (línea discontinua) evaluados mediante MAPA de 48h. La barra sombreada en el eje horizontal de las gráficas indica el horario promedio de descanso nocturno de los pacientes.
Fuente: Modificado a partir de Ayala et al.40.
Adicionalmente, Ayala et al.40 utilizaron los datos recogidos de los 12.765 participantes en su estudio transversal para investigar posibles factores de influencia sobre el perfil no-dipper en pacientes hipertensos. El análisis de regresión logística indicó que el perfil no-dipper (como variable categórica) se asoció simultánea y significativamente, en orden de importancia, con reducido filtrado glomerular estimado, edad avanzada, presencia de diabetes, colesterol-HDL bajo, no fumar (debido al esperado aumento de PA de actividad asociado al efecto presor del tabaco), triglicéridos bajos, índice de masa corporal elevado y cociente albúmina/creatinina elevado (tabla 1). Además, el patrón no-dipper se asoció significativamente con el aumento de fármacos antihipertensivos en dosis única matutina. Estos resultados indican la fuerte asociación entre la ausencia de descenso adecuado de PA durante el sueño (patrón no-dipper) y la diabetes, la presencia de enfermedad renal, envejecimiento y obesidad central.
Modelo de regresión logística del perfil circadiano (dipper/no-dipper) de la PA ambulatoria en pacientes hipertensos
| Variable | Coeficiente | Error estándar | p | Odds ratio | Intervalo de confianza del 95% |
|---|---|---|---|---|---|
| Filtrado glomerular estimado | 0,012 | 0,001 | <0,001 | 1,012 | (1,010-1,015) |
| Edad | −0,015 | 0,002 | <0,001 | 0,985 | (0,981-0,988) |
| Diabetes | −0,352 | 0,052 | <0,001 | 0,703 | (0,635-0,778) |
| Colesterol-HDL | 0,009 | 0,001 | <0,001 | 1,009 | (1,006-1,012) |
| Consumo de tabaco | 0,322 | 0,062 | <0,001 | 1,381 | (1,223-1,559) |
| Triglicéridos | 0,007 | 0,003 | 0,007 | 1,008 | (1,002-1,013) |
| Índice de masa corporal | −0,012 | 0,005 | 0,007 | 0,988 | (0,979-0,997) |
| Cociente albúmina/creatinina | −0,002 | 0,001 | 0,006 | 0,998 | (0,997-0,999) |
| Constante | −0,125 | 0,217 | 0,564 |
Odds ratio con sus intervalos de confianza del 95% para la profundidad de la PA sistólica como variable discreta (0=no-dipper, 1=dipper), calculado para cada ml/min/1,73 m2 de aumento en filtrado glomerular estimado; cada año de aumento en edad; cada mg/dl de aumento en colesterol-HDL; cada 10mg/dl de aumento en triglicéridos; cada kg/m2 de aumento en índice de masa corporal; y cada 10mg/gCR de aumento en cociente albúmina/creatinina. Diabetes definida como 0=no, 1=sí. Consumo de tabaco definido como 0=no, 1=sí. El filtrado glomerular se estimó mediante la ecuación CKD-EPI51. Las variables del modelo se listan en su orden de importancia, obtenido mediante selección de variables por análisis de regresión logística escalonado hacia delante.
En general, los sujetos hipertensos, incluyendo los pacientes con diabetes, ingieren toda su medicación antihipertensiva por la mañana. Sin embargo, se ha documentado que diversos ritmos circadianos en las funciones y procesos fisiológicos y bioquímicos pueden afectar de forma significativa la farmacocinética (procesos de liberación, absorción, distribución, metabolización y eliminación) y la farmacodinámica (efectos farmacológicos) de los fármacos antihipertensivos. Por lo tanto, el tiempo circadiano o el momento de administración del fármaco a lo largo de las 24h pueden modificar la farmacocinética o los efectos terapéuticos y adversos de los fármacos3–5.
Un buen número de ensayos clínicos aleatorizados con fármacos antihipertensivos de 6 clases diferentes (inhibidores de la enzima conversora de angiotensina [IECA], antagonistas de los receptores de angiotensina-II [ARA-II], antagonistas del calcio, α-bloqueantes, ß-bloqueantes y diuréticos) han documentado diferencias relevantes en su eficacia para reducir la PA, duración de acción, perfil de seguridad y efectos sobre el patrón circadiano de la PA que dependen de la hora del día de su administración (cronoterapia)3–5. Por ejemplo, la ingesta en monoterapia de IECA o de ARA-II a la hora de acostarse, en lugar de al levantarse, reduce en mayor medida la PA durante el sueño sin pérdida de eficacia durante las horas de actividad, lo que conlleva un aumento significativo de profundidad hacia un perfil más dipper. Estos resultados, además, son independientes de la vida media terminal del fármaco (habitualmente calculada solo a partir de estudios en los que los pacientes fueron tratados por la mañana) y parecen estar más bien relacionados con la activación del RAAS durante la segunda mitad del periodo de sueño2. Recientemente se ha documentado también de forma consistente la mayor reducción de PA durante el sueño con la ingesta por la noche, en comparación con la mañana, de diversas combinaciones fijas, incluyendo captopril-hidroclorotiazida (HCTZ), valsartán-amlodipino, fosinopril-amlodipino, olmesartán-amlodipino, amlodipino-HCTZ y valsartán-HCTZ4.
A pesar de la existencia de toda esta información, los efectos de la hora de administración de antihipertensivos sobre la regulación de la PA en pacientes con diabetes han sido escasamente investigados. Tofé y García52 utilizaron un diseño cruzado para evaluar en 38 pacientes hipertensos con diabetes tipo 2 los efectos sobre la PA ambulatoria del ARA-II olmesartán (40mg una vez al día durante 8 semanas) ingerido al levantarse o a la hora de acostarse. El tratamiento al acostarse, en comparación con su ingesta a la hora de levantarse, resultó en una reducción significativamente mayor de la media de descanso de la PAS (–16,2 vs. –11,8mmHg; p=0,007) y en un aumento de la profundidad de la PA hacia un perfil más dipper (7,4 vs. 2,2%; p<0,001).
Moyá et al.42 investigaron recientemente la influencia de la hora del día (con relación al ciclo de reposo/vigilia de cada sujeto) de tratamiento antihipertensivo sobre el perfil circadiano y el grado de control de la PA ambulatoria, así como sobre parámetros clínicos y analíticos de interés, en pacientes hipertensos con diabetes, utilizando para ello la cohorte de pacientes participantes en el Proyecto Hygia descrito en la sección anterior40. Entre los 2.429 pacientes hipertensos con diabetes evaluados bajo tratamiento antihipertensivo (1.465 hombres y 964 mujeres, de 65,9±10,6 años de edad), 1.176 (700 hombres y 476 mujeres) ingerían toda su medicación a la hora de levantarse, 336 (177 hombres y 159 mujeres) tomaban toda la medicación al acostarse y 917 (588 hombres y 329 mujeres) ingerían la dosis completa de algunos fármacos al acostarse y el resto al levantarse. Toda la medicación de administró una vez al día en dosis terapéuticas recomendadas. En este estudio, el protocolo no permitió la división de la dosis de ningún fármaco antihipertensivo para su ingesta varias veces al día. Así, los pacientes que ingerían un medicamento al acostarse tomaban la dosis completa a esa hora y no una parte del fármaco también al levantarse.
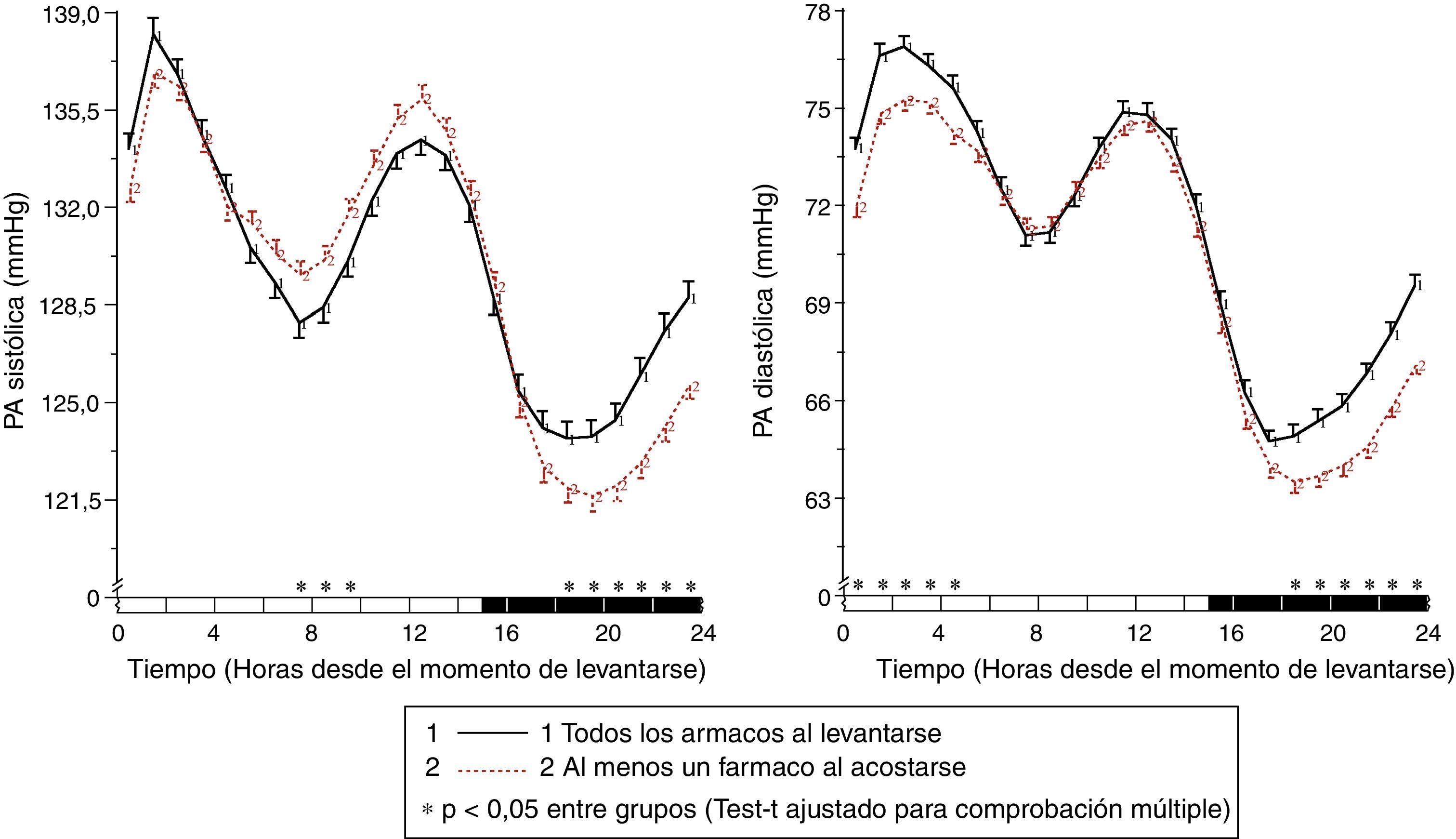
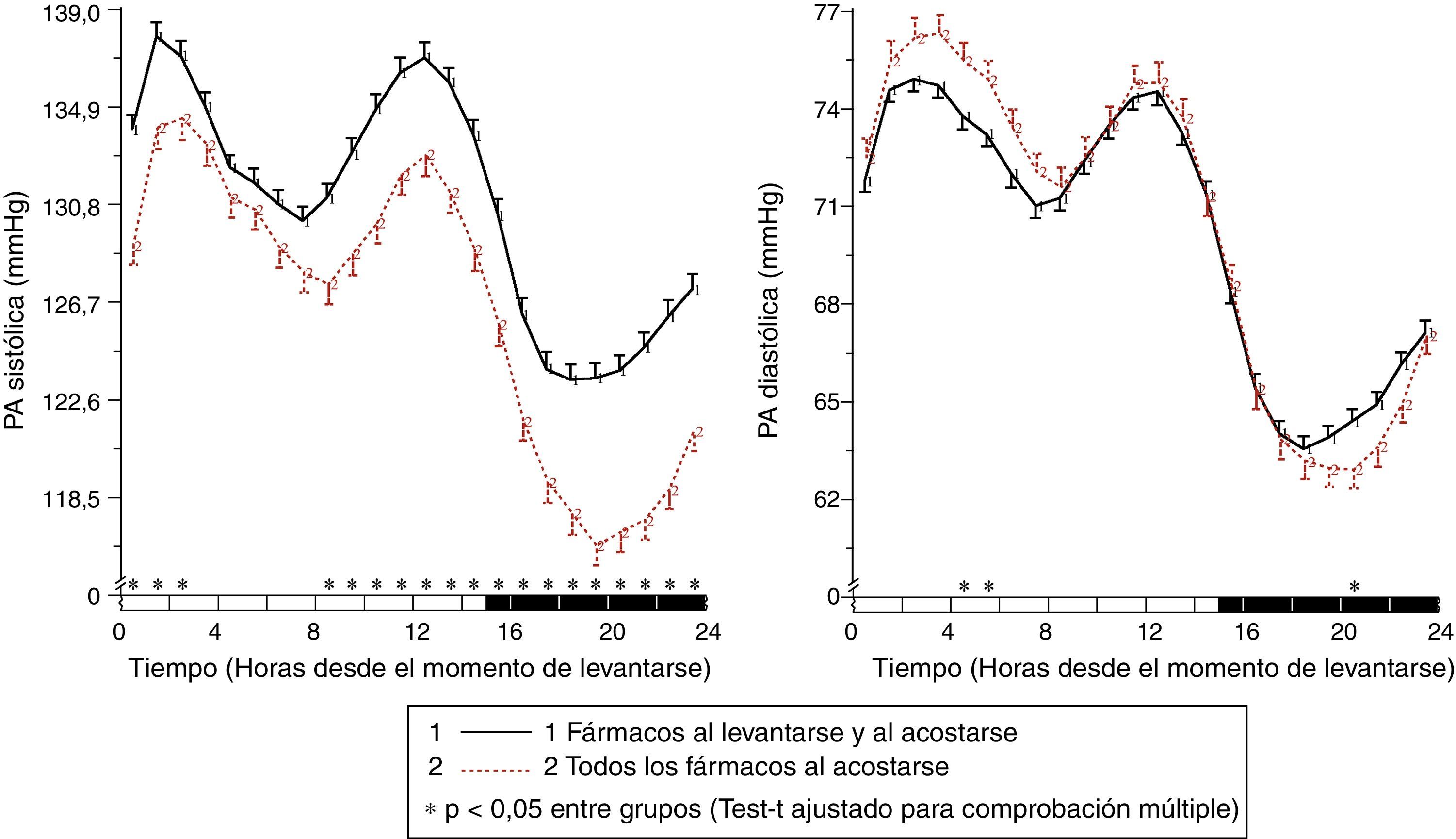
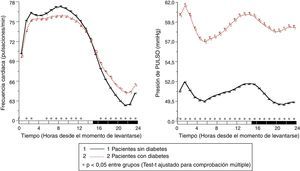
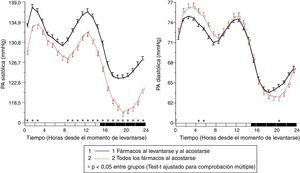
Los resultados del estudio de Moyá et al.42 indicaron, en primer lugar, que los pacientes con diabetes que ingerían la dosis completa de ≥1 fármacos antihipertensivos al acostarse, en comparación con los que tomaban toda la medicación al levantarse, tenían menor prevalencia de síndrome metabólico y enfermedad renal crónica (49 vs. 54%; p=0,023); tenían el cociente albúmina/creatinina, glucosa, colesterol total y colesterol-LDL significativamente menor (p<0,001); y tenían un filtrado glomerular estimado y colesterol-HDL significativamente mayor (p<0,001). Además, los pacientes que tomaban no solo alguno, sino todos los fármacos al acostarse tenían, en comparación con los otros grupos de tratamiento, los menores valores de glucosa, creatinina, ácido úrico y prevalencia de proteinuria (5,5%) y enfermedad renal crónica (40%; p<0,001 en comparación con los otros grupos). Por otra parte, la ingesta de ≥1 fármacos antihipertensivos en dosis completa al acostarse se asoció con una media de descanso de la PA significativamente menor que el tratamiento con toda la medicación al levantarse (p<0,001; fig. 3). La profundidad fue significativamente menor y la prevalencia del patrón no-dipper mayor con toda la medicación al levantarse (68,6%) que con ≥1 fármaco al acostarse (55,8%; p<0,001), y se redujo todavía más en los pacientes que tomaban toda la medicación al acostarse (49,7%; p<0,001), debido a que este último grupo se caracterizó por tener la menor media de descanso de la PAS (fig. 4). La prevalencia del patrón riser fue mucho mayor (23,6%) en los pacientes que tomaban toda la medicación al levantarse que en los que tomaban bien alguno (20,0%), bien todos los fármacos al acostarse (12,2%; p<0,001). Este último grupo presentó la mayor tasa de pacientes con PA ambulatoria bien controlada (p<0,001), lo cual se consiguió con un número menor de fármacos antihipertensivos (P<0,001) en comparación con los pacientes tratados al levantarse42.
Patrón circadiano de la PAS (izquierda) y PAD (derecha) en pacientes hipertensos con diabetes evaluados mediante MAPA de 48h y clasificados en función de su esquema de tratamiento antihipertensivo: ingesta de toda la medicación al levantarse (línea continua) o ingesta de la dosis completa de ≥1 fármaco al acostarse (línea discontinua). La barra sombreada en el eje horizontal de las gráficas indica el horario promedio de descanso nocturno de los pacientes.
Fuente: Modificado a partir de Moyá et al.42.
Patrón circadiano de la PAS (izquierda) y PAD (derecha) en pacientes hipertensos con diabetes evaluados mediante MAPA de 48h y clasificados en función de su esquema de tratamiento antihipertensivo: ingesta de fármacos tanto al levantarse como al acostarse (línea continua) o ingesta de toda la medicación al acostarse (línea discontinua). La barra sombreada en el eje horizontal de las gráficas indica el horario promedio de descanso nocturno de los pacientes.
Fuente: Modificado a partir de Moyá et al.42.
Por su parte, Suzuki y Aizawa53 aleatorizaron 34 pacientes hipertensos con diabetes tipo 2 que ya estaban recibiendo tratamiento antihipertensivo en 3 grupos en función del régimen terapéutico consistente en añadir 160mg del ARA-II valsartán: (i) la dosis plena con el desayuno; (ii) la dosis plena con la cena y (iii) la mitad de la dosis (80mg) 2 veces al día. Los autores reportaron la ausencia de diferencias entre los 3 grupos en la reducción tanto de la PA clínica como de la PA medida en el domicilio durante el ciclo de actividad de los pacientes. Los resultados de este y otros estudios sobre los posibles efectos de la hora de administración de los antihipertensivos basados exclusivamente en la valoración de la PA clínica o domiciliaria son de escaso interés práctico por diversas razones. Primero, el «efecto bata-blanca» puede comprometer la validez de los valores de PA determinados en la clínica, mientras que la inconsistencia en la técnica de automedida y reducido cumplimiento por parte del paciente puede comprometer las medidas de PA domiciliaria. Segundo, la elección de los tiempos de ingesta de medicación se basó en horas de reloj en lugar de utilizar la información biológica relevante asociada al ciclo individual de actividad y descanso de cada paciente, como se recomienda actualmente41. Tercero, y más importante, el protocolo de investigación de estos estudios no recogió datos de PA a lo largo de las 24h con el objeto de poder determinar las características clínicamente relevantes del perfil de variación circadiano de la PA que están más relacionadas con el riesgo CV, en particular la media de descanso y la profundidad de la PAS. Por ello, las conclusiones de esos estudios basados en protocolos inadecuados no solo son de escaso valor científico sino que incluso pueden ser engañosas, al añadir confusión en la literatura médica y la correspondiente e innecesaria controversia sobre el manejo más adecuado de los pacientes que requieren tratamiento5.
Influencia de la cronoterapia sobre el riesgo cardiovascular en pacientes con y sin diabetesLa mayoría de los estudios de MAPA realizados hasta el momento tienen muchas limitaciones, incluyendo: (i) el uso de franjas fijas arbitrarias de horas de reloj para definir vigilia/reposo (o erróneamente día/noche), lo que deriva en el cálculo de unos valores que no representan las verdaderas medias de actividad y descanso de PA de cada individuo; y (ii) la mayoría de los resultados publicados se derivan de estudios basados en un único registro de MAPA de cada paciente en el momento de inclusión, bajo la aparente presunción errónea de que el perfil de PA ambulatoria se mantiene inalterado durante los años de seguimiento a pesar de los efectos del tratamiento antihipertensivo, el envejecimiento y el desarrollo de daño en órganos diana o enfermedades concomitantes8,14,24. Así, la posible modificación de riesgo CV asociada a la normalización del perfil circadiano de la PA con el tratamiento antihipertensivo, es decir, la reducción específica de la media de descanso de la PA o el aumento de profundidad hacia un perfil más reductor (dipper) es todavía motivo de debate.
En este sentido, el estudio Monitorización Ambulatoria para Predicción de Eventos Cardiovasculares (MAPEC) se diseñó para (i) investigar prospectivamente el valor pronóstico comparativo de diversos parámetros derivados de la MAPA y (ii) si la ingesta de la dosis completa de al menos un fármaco antihipertensivo a la hora de acostarse ejerce mejor control de la PA y de la reducción de riesgo CV que la terapia convencional basada en administrar toda la medicación por la mañana al levantarse8,14,23,27–30. En este estudio prospectivo participaron 3.344 sujetos, de los cuales 2.610 eran pacientes hipertensos según criterios de MAPA6,41. En el momento de inclusión y luego anualmente (o con mayor frecuencia si era necesario ajustar el tratamiento antihipertensivo en función de los resultados de la MAPA) durante una mediana de 5,6 años de seguimiento, la PA y la actividad física (actigrafía de muñeca) se monitorizaron simultáneamente durante 48h a fin de determinar de forma precisa e individualizada las medias de actividad y descanso de la PA. Los resultados del estudio MAPEC, primero y único publicado hasta el momento en el que los participantes fueron evaluados de forma periódica mediante MAPA, indican, en primer lugar, que la media de descanso, pero no la de actividad, de la PAS es el predictor más significativo de eventos CV en un modelo de supervivencia ajustado por las variables significativas de sexo, edad, diabetes, anemia y enfermedad renal crónica (por cada 1-DT de elevación, hazard ratio [HR] 1,63; IC 95% [1,44-1,85]; p<0,001 para la media de descanso; 0,94 [0,81-1,08]; p=0,348 para la media de actividad). La valoración de la posible contribución conjunta de varios parámetros derivados de la MAPA como predictores de riesgo CV reveló que el mejor modelo ajustado incluye únicamente la media de descanso de la PAS (HR=1,23; IC 95% [1,16-1,32]; p<0,001) y la profundidad de la PAS (HR=0,98; IC 95% [0,97-0,99]; p=0,019). Además, cuando la media de descanso de la PAS se ajustó tanto por la media de actividad de la PAS como por la PA clínica, solo la primera predijo significativamente el aumento de riesgo de eventos CV, tanto en población general8,14 como específicamente en pacientes con diabetes10. Lo que es más importante, el análisis de los cambios en PA ambulatoria durante los años de seguimiento reveló una disminución del 17% de riesgo CV por cada 5mmHg de reducción de la media de descanso de la PAS, con independencia de cambios en PA clínica o en la media de actividad calculada a partir de la MAPA8,14,24. Estos resultados, en conjunto, indican que la media de descanso de la PA podría ser un nuevo objetivo terapéutico para reducción de riesgo CV que requiere, como es obvio, la evaluación precisa de los pacientes mediante MAPA41.
Por otra parte, los resultados de un reducido número de ensayos clínicos prospectivos permite valorar el impacto de la hora de tratamiento antihipertensivo sobre el riesgo CV. Así, en los estudios Syst.-Eur54, Syst.-China55, Heart Outcomes Prevention Evaluation (HOPE)56 y Controlled Onset Verapamil Investigation of Cardiovascular Endpoints (CONVINCE)57 el fármaco bajo investigación (nitrendipino, ramipril, verapamilo-COER) se administró por la noche. El objetivo en CONVINCE era reducir la PA a primeras horas de la mañana y no la PA durante el sueño nocturno; de hecho, la formulación de liberación retardada de verapamilo administrada al acostarse reduce en mucha mayor medida la PA de actividad que la de descanso58, por lo que su hora de administración más apropiada si el objetivo terapéutico es reducir la media de descanso de la PA no sería en ningún caso al acostarse. A pesar de ello, la comparación de los resultados de estos estudios de ingesta nocturna de medicación con los de 170 ensayos clínicos en los que el fármaco de investigación se administró por la mañana59 indica una reducción del 46% (p=0,008) en el riesgo relativo de evento CV cuando se ingiere la medicación antihipertensiva al acostarse en lugar de al levantarse60. Desafortunadamente, la medicación investigada en esos 4 ensayos con tratamiento nocturno no se aleatorizó para poder valorar los efectos de la misma medicación ingerida por la mañana.
El estudio MAPEC constituye así el primer y único ensayo prospectivo hasta el momento del impacto de la cronoterapia antihipertensiva sobre el riesgo CV. En este estudio, los pacientes aleatorizados a ingerir medicación al acostarse se caracterizaron por tener en su última evaluación con MAPA, después de 5,6 años de seguimiento, menor media de descanso de la PA, mayor profundidad, menor prevalencia del patrón no-dipper y mayor prevalencia de PA ambulatoria controlada que los pacientes que tomaban toda la medicación al levantarse27. Los pacientes tratados al acostarse tuvieron un HR de eventos CV totales significativamente menor que los pacientes tratados al levantarse (0,39; IC 95% [0,29-0,51]; p<0,001). La diferencia entre grupos también fue significativa para el total de eventos mayores, es decir, la suma de muerte CV, infarto de miocardio e ictus isquémico y hemorrágico (0,33; IC 95% [0,19-0,55]; p<0,001). Estos resultados se validaron en subgrupos de elevado riesgo CV y caracterizados, además, por una elevada prevalencia de hipertensión nocturna, incluyendo pacientes con diabetes28, hipertensión resistente23 y enfermedad renal crónica29.
ConclusionesLos estudios de MAPA publicados hasta el momento aquí revisados concuerdan en documentar la alta prevalencia de un patrón circadiano de la PA alterado en pacientes con diabetes. Lo que es más importante, la prevalencia del patrón riser, asociado con el mayor riesgo CV entre todos los posibles patrones de PA, es más del doble en pacientes con diabetes que sin ella. Los pacientes con diabetes presentan, además, una significativa elevación de PP ambulatoria a lo largo de las 24h, lo que refleja mayor rigidez arterial y puede ser así una causa añadida del documentado mayor riesgo CV en ellos. Una de las características determinantes del perfil de PA en diabetes es la elevada media de PA durante las horas de descanso nocturno, causa a su vez de una alta prevalencia de hipertensión nocturna y, como consecuencia, de errores en el diagnóstico de hipertensión cuando este se basa exclusivamente en la medida clínica de la PA o incluso en las automedidas domiciliarias. Estos resultados, en su conjunto, explican en gran parte el mayor riesgo CV de los pacientes con diabetes y justifican la necesidad de utilizar la MAPA como herramienta indispensable de diagnóstico de hipertensión en pacientes con diabetes, tanto para la correcta valoración de su riesgo CV como para establecer el esquema terapéutico más adecuado para el control de las elevadas PA nocturna y PP ambulatoria, lo que podría redundar a su vez en una reducción significativa de eventos CV, como ya ha sido demostrado28. Sin embargo, el injustificado alto coste de los dispositivos de MAPA comercializados en la actualidad se ha argumentado frecuentemente como posible limitación de la MAPA41, aunque el coste real por paciente de la MAPA es actualmente la mitad del de la determinación de glucemia. Por otra parte, el grado de tolerancia de los pacientes a la MAPA a lo largo del día y la noche se ha planteado como otra posible limitación de la MAPA, especialmente porque esta técnica de medida de PA puede provocar en algunos pacientes perturbaciones del sueño41. Además, el grado de reproducibilidad del perfil circadiano de la PA en registros de MAPA de 24h repetidos en los mismos sujetos con un intervalo relativamente corto de solo varias semanas también se ha descrito como una posible limitación de la MAPA. No obstante, en términos de reproducibilidad, la MAPA es marcadamente superior de la medida clínica de PA, especialmente si el periodo de monitorización se extiende a 48h como ha sido ya claramente demostrado38,39.
La meta del tratamiento antihipertensivo es reducir la PA con el objetivo de prevenir el daño en órganos diana y disminuir el riesgo de eventos CV. Los efectos beneficiosos asociados a la reducción de la PA son consistentes y, en cierto grado, independientes de la medicación utilizada. Desafortunadamente, las estrategias terapéuticas actuales, casi exclusivamente centradas en reducir la PA clínica6, no permiten eliminar los riesgos asociados a la PA elevada; por el contrario, permiten reducir el riesgo CV en aproximadamente un 33%, un resultado claramente subóptimo61. La revisión de la incidencia de eventos CV en los estudios prospectivos publicados revela que solo se ha podido conseguir un nivel relativamente bajo de eventos CV principales en los ensayos que incluyeron a pacientes hipertensos de riesgo CV basal bajo, es decir, estudios que excluyeron, entre otros, a pacientes de alto riesgo con diabetes, enfermedad renal crónica o eventos CV previos62. Además, los resultados colectivos de estudios previos sobre morbimortalidad CV que sí incorporaron a pacientes de esos grupos de alto riesgo mencionados indican que el tratamiento antihipertensivo no es capaz de reducir suficientemente el riesgo CV, lo que ha llevado a la creencia de que esos pacientes tienen un «riesgo residual» que no se puede aliviar con el tratamiento convencional63. Esta conclusión, no solo cuestionable sino rebatible30, se basa en los resultados de estudios cuyo único objetivo terapéutico fue disminuir la PA clínica convencional mediante la ingesta de fármacos en dosis única matutina.
Esta estrategia terapéutica, todavía habitual, no tiene en cuenta que (i) la correlación entre el nivel de PA y el riesgo CV es mucho mayor para la MAPA que para las medidas clínicas de PA7–9; (ii) la media de descanso de la PA, pero no la media de actividad o de 24h ni la PA clínica, es un marcador pronóstico independiente de riesgo CV8,10,14,20–24 y (iii) la eficacia para reducir el nivel (fundamentalmente de la media de descanso) y mejorar el patrón circadiano de la PA hacia un perfil más dipper de un buen número de fármacos antihipertensivos de 6 familias diferentes y de sus combinaciones depende marcadamente de su hora de ingesta con relación al ciclo de actividad y descanso del paciente3–5. En el ámbito concreto de la diabetes, los resultados del estudio de Moyá et al.42 a partir de datos de los participantes en el Proyecto Hygia documentan una prevalencia significativamente menor de marcadores de riesgo CV y un mejor perfil metabólico en pacientes con diabetes tratados al acostarse en comparación con los que tomaban toda la medicación al levantarse; los resultados documentan también una menor media de descanso de la PA y reducida prevalencia del patrón no-dipper/riser de alto riesgo CV en pacientes con diabetes tratados al acostarse. Estos resultados indican que el tratamiento al acostarse, junto con la valoración con MAPA para establecer el diagnóstico correcto de hipertensión y evitar la posible hipotensión nocturna asociada al tratamiento, deben ser el esquema terapéutico de preferencia en los pacientes con diabetes42.
Por otra parte, los resultados del estudio MAPEC8,14,23,27–30, a la espera de su posible confirmación por parte de otras estudios prospectivos como el Proyecto Hygia actualmente en curso40,42–46, indican que (i) reducir la media de descanso de la PA y aumentar la profundidad hacia un perfil más dipper –2 nuevos objetivos terapéuticos que requieren la evaluación de los pacientes con MAPA– disminuyen significativamente la morbimortalidad CV y (ii) la ingesta de la dosis completa de al menos un antihipertensivo, preferentemente todos, al acostarse reduce significativamente el riesgo de eventos CV tanto en población hipertensa general27 como específicamente en pacientes con diabetes28. En este sentido, es notorio que la American Diabetes Association haya reconocido la relevancia clínica de la cronoterapia antihipertensiva al recomendar que los pacientes hipertensos con diabetes deben ser tratados con ≥1 fármaco al acostarse47. Esta recomendación implica de hecho de que el tratamiento al acostarse debe ser el esquema terapéutico de elección en todo paciente con diabetes de nuevo diagnóstico de hipertensión. Esta misma recomendación, complementada con la indicación de utilizar la MAPA como nueva regla de oro para diagnóstico de hipertensión y valoración individualizada de riesgo CV, ha sido recientemente extendida a otros grupos, incluyendo los sujetos ancianos y los pacientes con enfermedad renal crónica, evento CV previo e hipertensión resistente o secundaria41.
Conflicto de interesesLos autores reportan no tener ningún conflicto de interés. Los autores son los únicos responsables del contenido de este manuscrito.