El peso elevado es un factor protector de la osteoporosis y el riesgo de fractura. Aunque en el caso de la obesidad, donde el sobrepeso se encuentra asociado a un acúmulo excesivo de grasa, esta relación no parece estar tan clara y, en ocasiones, se ha relacionado la misma con un descenso de la masa ósea. La obesidad interfiere con el metabolismo óseo a través de factores mecánicos, hormonales e inflamatorios. Estos factores se encuentran íntimamente relacionados con el peso, composición corporal y patrón dietético de estos pacientes. El efecto perjudicial o beneficioso neto sobre la masa ósea o sobre el riesgo de fractura de los distintos componentes de esta enfermedad todavía no es bien conocido. Es necesario reconocer a aquellos pacientes con mayor riesgo de padecer enfermedad ósea relacionada con la obesidad para la realización de una intervención adecuada.
High weight is a protective factor against osteoporosis and risk of fracture. In obesity, however, where overweight is associated to excess fat, this relationship does not appear to be so clear, excess weight has sometimes been associated to decreased bone mass. Obesity interferes with bone metabolism through mechanical, hormonal, and inflammatory factors. These factors are closely related to weight, body composition, and dietary patterns of these patients. The net beneficial or harmful effect on bone mass or risk of fracture of the different components of this condition is not well known. We need to recognize patients at a greater risk of bone disease related to obesity to start an adequate intervention.
El hueso es un órgano activo sobre el que actúan gran cantidad de factores. La osteoporosis y el riesgo aumentado de fractura son entidades que, en los últimos años, están adquiriendo gran relevancia debido al envejecimiento progresivo de la población y la repercusión sobre la calidad de vida y el impacto económico que suponen en la sociedad. En 2010 la prevalencia de osteoporosis en la Unión Europea en población mayor de 50 años era del 6,6% en hombres y 22,1% en mujeres; y del 5,5% en la población general. En los países más poblados (Alemania, Francia, Italia, España y Reino Unido) aproximadamente el 21% de mujeres entre 50 a 84 años cumplen criterios de osteoporosis1,2.
La obesidad supone la enfermedad metabólica más prevalente del mundo desarrollado y constituye una de las principales causas de morbimortalidad. En 2008 según la OMS se estimó que: 1.400 millones de adultos de más de 20 años tenían sobrepeso; más de 200 millones de hombres y cerca de 300 millones de mujeres eran obesas; en resumen una de cada 10 personas de la población adulta mundial eran obesas3. Según el estudio ENRICA desarrollado en población española entre 2008 y 2010 se observó que la prevalencia de obesidad en España era del 22,9% (24,4% hombres y 21,4% mujeres)4.
La relación entre el sobrepeso y el metabolismo óseo es controvertida. Desde hace tiempo se ha considerado el aumento del peso corporal como un factor de incremento de masa ósea y reducción del riesgo de fracturas5. Por otra parte, en los últimos años se van acumulando evidencias de que el sobrepeso y, sobre todo, el acúmulo de masa grasa pueden tener una influencia negativa sobre el riesgo de fractura sobre todo al ajustar según la masa ósea del paciente6.
La evidencia obtenida muestra que en mujeres posmenopáusicas con obesidad existe un aumento del riesgo de fractura de humero y fracturas osteoporóticas de tobillo y miembro inferior con una disminución del riesgo de fractura de cadera, pelvis y muñeca. En varones existen menos estudios disponibles pero aparece un patrón similar al de las mujeres7. Se ha postulado que el incremento en el riesgo de fractura puede relacionarse con la dificultad en la movilización y el incremento del número de caídas en los pacientes con obesidad8. En cualquiera de los casos, las razones del efecto de la obesidad sobre el hueso y sus consecuencias no tienen aún una clara explicación.
La prevalencia de la obesidad se está incrementando de manera importante en los últimos años; y existe un progresivo envejecimiento de la población. Estas 2 circunstancias se encuentran asociadas de manera intrínseca con la salud ósea, por tanto, esta revisión pretende:
- -
Conocer los mecanismos que relacionan la obesidad con la modificación del metabolismo óseo.
- -
Detectar los factores asociados a la obesidad que influyen negativamente sobre la densidad mineral ósea y el riesgo de fractura.
- -
Determinar la intervención a realizar para prevenir o mejorar el efecto sobre el hueso de estos factores relacionados con la obesidad.
El trabajo realizado es una revisión narrativa. Se realizó una búsqueda online en las bases de datos médicas: PUBMED y EMBASE. Las consultas realizadas fueron: «Obesity» [MESH] AND «Bone metabolism» [MESH]; «Body Composition» [MESH] AND «Bone Metabolism» [MESH]; «Obesity» [MESH] AND «Bone» [MESH]; «Obesity» [MESH] and «Vitamin D» [MESH] or «PTH» [MESH]. Se tuvieron en cuenta artículos originales, metaanálisis, revisiones sistemáticas y revisiones narrativas. La búsqueda se realizó el 1 de febrero de 2016 y no se establecieron límites de fecha de publicación.
Se priorizaron aquellos artículos con una metodología de más alta evidencia científica (guía clínica, metaanálisis, ensayo clínico aleatorizado, revisión sistemática, artículo original y revisión narrativa) publicados en los últimos 5 años.
Composición corporalA la hora de considerar el concepto de obesidad es muy importante valorar la aportación de los distintos componentes del peso (masa magra, masa grasa y agua). La masa magra y la masa grasa son determinantes independientes de la masa ósea, por lo tanto cada uno tendrá una influencia diferente y dependerá de varios factores9.
Masa magra y huesoEl aumento de la masa magra o masa libre de grasa se asocia a un incremento de la masa ósea. Esta situación puede deberse a un aumento de la carga mecánica sobre el hueso en relación con el peso y la hipertrofia muscular. A este respecto, el metaanálisis de Ho-Pham et al. mostró que la correlación entre masa magra y densidad mineral ósea del cuello femoral fue mayor que la de la masa grasa (r=0,39 [0,34-0,43] vs. r=0,28 [0,22-0,33]). El efecto de dicha masa magra fue mayor en hombres (r=0,43) y en mujeres premenopáusicas (r=0,45)10.
El efecto positivo del aumento de la masa magra se atribuye a factores relacionados con el estilo de vida como el ejercicio y la dieta, la suficiencia estrogénica, influencias genéticas o una combinación de estos factores. Por otra parte, el aumento de masa muscular tiene un efecto independiente sobre el riesgo de fractura a la hora de reducir la fragilidad y caídas relacionadas con la fractura osteoporótica11.
En la obesidad, a pesar de que se caracteriza por un aumento predominante de la masa grasa, existe también un aumento de la masa magra que puede justificar, en parte, el efecto beneficioso de esta sobre la densidad mineral ósea. Esta situación fue estudiada por Neubecker et al. comparando la densidad mineral ósea, la fragilidad del hueso y el riesgo de fractura entre pacientes obesos y pacientes con anorexia nerviosa, observando que las pacientes obesas (con mayor masa magra) tenían una mayor densidad mineral ósea y una menor fragilidad ósea, lo que sugiere un menor riesgo de fractura12.
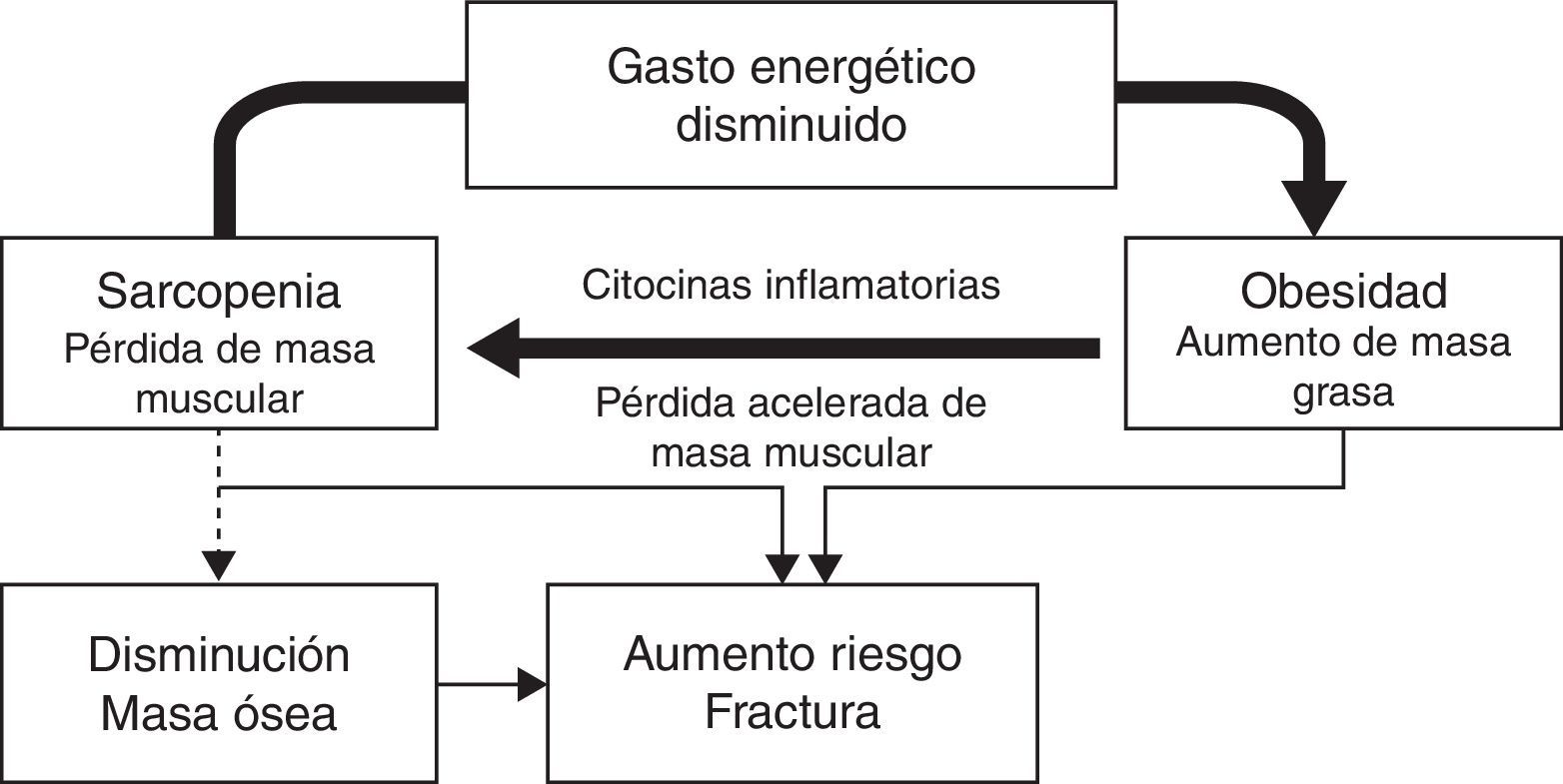
En el paciente anciano, o en aquellos obesos con enfermedades severas asociadas, está cobrando especial interés la enfermedad denominada obesidad sarcopénica. En esta enfermedad el aumento de peso se relaciona con un descenso relativo de la masa muscular13. La génesis de esta enfermedad está en relación con el daño muscular producido por mediadores inflamatorios en el entorno de un círculo vicioso de inactividad física progresiva que aumenta el tejido adiposo y enfermedades relacionadas con la obesidad que a su vez incrementan esta inactividad. La sarcopenia se ve potenciada por otros factores como la pérdida de sensibilidad a las alfa-motoneuronas, cambios en hormonas anabólicas y malnutrición.
En esta situación proinflamatoria se producen varias circunstancias: 1) una movilización preferente de músculo y no de grasa en el consumo de energía; 2) un nivel alto de inflamación que produce un descenso progresivo de masa muscular; y 3) deterioro de la calidad del músculo por depósito graso en el mismo debido al aumento de la resistencia a la insulina14.
Esta sarcopenia conlleva una menor influencia positiva de la masa muscular sobre el hueso junto con una disminución de la movilidad y un aumento del número de caídas. En un reciente estudio de Scott et al. se pudo observar que aquellos pacientes con obesidad no sarcopénica tenían una densidad mineral ósea superior en todas las localizaciones estudiadas (columna lumbar y cadera). Asimismo los pacientes con obesidad sarcopénica tenían tasas de fractura mayores, no vertebrales en el caso de los hombres (OR: 3,0 [1,7-5,5]) y en todas las localizaciones en el caso de las mujeres (OR: 2,8 [1,4-5,6]), aunque al ajustar estas últimas en función de la densidad mineral ósea de la cadera no existe significación11. Esta situación de movilidad reducida y aumento de la fragilidad se asocia a un incremento relativo de la masa grasa, lo que conlleva a una situación proinflamatoria que acompaña a esta entidad, lo que podría tener una influencia negativa sobre el hueso15 e incrementar el riesgo de fractura (fig. 1).
Masa grasa y huesoEl aumento predominante del peso en la obesidad es secundario a la masa grasa. Este componente corporal influye sobre el metabolismo óseo predominantemente a través de varios mecanismos:
- -
Desde un punto de vista cuantitativo el aumento de la masa corporal total conlleva un aumento de la carga mecánica con los efectos ya comentados. Aunque este efecto parece no ser el principal ya que, en algunos casos, el porcentaje de masa grasa no es el mejor predictor en la reducción del riesgo de fractura como observaron Moayyeri et al. al detectar una relación entre masa grasa y riesgo de fractura de cadera en mujeres, pero no en hombres16.
- -
Desde un punto de vista cualitativo, el aumento de masa grasa se asocia al incremento del tejido adiposo (adipocitos) que ha demostrado tener una funcionalidad: a) secreta hormonas como leptina, adiponectina y hormonas sexuales; b) promueve un estado proinflamatorio; c) presenta un precursor común mesenquimal entre osteoblastos y adipocitos. Estas características tienen una influencia sobre la densidad mineral ósea17.
- -
Por otra parte, la distribución de la masa grasa (visceral o subcutánea) puede tener relación con el metabolismo óseo18.
La influencia sistémica del tejido adiposo a través de mediadores es universalmente reconocida. La acción de estos mediadores (adipocinas y factores inflamatorios) puede tener un papel importante en el desarrollo de la masa ósea:
AdipocitocinasLas adipocitocinas son mediadores hormonales producidos por el tejido adiposo. Las 2 principales son la leptina y la adiponectina, con múltiples efectos sobre la saciedad, la resistencia a la insulina…, pero a nivel del metabolismo óseo su función es controvertida.
La leptina tiene un efecto bidireccional sobre el hueso. Por una parte, la leptina in vitro tiene una influencia sobre la médula ósea estimulando la diferenciación a osteoblastos e inhibiendo la diferenciación a adipocitos de las células pluripotenciales19. Por otra parte, la leptina puede actuar a través del sistema nervioso simpático inhibiendo la formación ósea a través de la reducción de la resistencia a la insulina y la disminución de su efecto anabólico sobre el hueso20. Se ha observado una acción directamente proporcional de la leptina sobre los marcadores de formación ósea e inversa sobre los marcadores de resorción en mujeres posmenopáusicas y adultos jóvenes21. Estas situaciones conllevan que valores elevados de leptina se asocien a una mayor densidad mineral ósea (r=0,18-0,33) y esto da lugar a una reducción del riesgo de fractura como nos muestra la revisión sistemática realizada por Biver et al.22. A pesar de este efecto beneficioso se ha observado que el perfil del metabolismo óseo es mejor en mujeres delgadas que en mujeres obesas, aun teniendo estas últimas niveles más elevados de esta hormona. Esta última circunstancia puede explicarse a través de 2 vías: a) en primer lugar en grados altos de obesidad existe una resistencia a la acción de la leptina; b) los niveles elevados de leptina producen una situación proinflamatoria que puede causar una peor salud ósea y del cartílago23.
A la luz de estos datos, se estableció la hipótesis de que la inyección de leptina podría potenciar la formación de hueso e inhibir la resorción ósea; pero al realizar esta intervención sobre un grupo de pacientes sometidos a una dieta de pérdida de peso no se observó efecto alguno sobre el metabolismo del hueso24.
La adiponectina es otra hormona producida por el tejido adiposo que produce un aumento de la sensibilidad a la insulina. Los osteoblastos expresan adiponectina y sus receptores, aumentando su diferenciación en respuesta a esta, además produce una inhibición de la osteoclastogénesis y la actividad del osteoclasto; aunque también aumenta la producción del ligando del receptor activador del factor nuclear κB (RANKL) y disminuye la osteoprotegerina25. Al analizar el efecto in vivo de la adiponectina se observó que niveles más bajos de esta se encuentran asociados con una mayor masa ósea23. La modificación de la situación de obesidad con el aumento de adiponectina asociado a un descenso de peso parece que no tienen relación con una mejoría en la densidad mineral ósea 26. En la obesidad y la diabetes mellitus tipo 2 esta hormona se encuentra disminuida, por lo que podría tener un efecto en estos pacientes, pero no hay evidencia suficiente para sustentarlo o usarlo como diana terapéutica.
Otra adipocina es la resistina, que aumenta de manera proporcional con la obesidad, y se relaciona con la resistencia a la insulina. Los efectos sobre el metabolismo óseo también son bidireccionales, pues, por una parte, se ha observado un aumento modesto de la proliferación de osteoblastos y, por otra, incrementa la formación de osteoclastos en cultivos de médula ósea. En la investigación de Otrowska et al. se observó que en mujeres con anorexia nerviosa los cambios en esta hormona podrían funcionar como predictores independientes de la elevación de crosslaps y RANKL; estas alteraciones podrían afectar negativamente al balance osteoprotegerina/RANKL y descompensar la situación de equilibrio del remodelado óseo27.
GhrelinaEs un péptido orexígeno secretado por el estómago y, entre otras funciones, estimula la diferenciación de preadipocitos a adipocitos y antagoniza la lipólisis. Los niveles de esta hormona se relacionan de manera inversa con el índice de masa corporal y con la resistencia a la insulina, por tanto, se encuentra disminuida en el síndrome metabólico28. Esta hormona podría tener un efecto protector sobre el metabolismo óseo al inhibir los precursores de los osteoclastos y las citocinas osteoclastogénicas (factor de necrosis tumoral-α [TNF-α], interleucina [IL]-1, IL-6); y modulando la diferenciación de los osteoblastos a través del eje GH-IGF-1 como han mostrado distintos estudios in vitro29. Sin embargo, la mayor parte de los estudios no han mostrado datos que relacionen los niveles de ghrelina con la densidad mineral ósea22, salvo Makovey et al. que relacionaban una menor masa ósea en caderas de mujeres jóvenes con niveles aumentados de ghrelina30 y Misra et al. que encontraron una asociación positiva entre la densidad mineral ósea de la columna lumbar y cadera con la ghrelina en adolescentes sanas31. Son necesarios más estudios dirigidos al estudio del metabolismo óseo en relación con esta hormona y su presencia en la obesidad.
Efecto endocrino del tejido adiposoLa obesidad se relaciona con una inflamación crónica de bajo grado. El tejido adiposo se encuentra infiltrado de macrófagos que originan una producción crónica de citocinas proinflamatorias, aumento de reactantes de fase aguda y activación de vías inflamatorias. Estas citocinas producen un incremento de la diferenciación de osteoclastos y, por tanto de la resorción ósea; esta situación mantenida de manera crónica produce una situación de osteopenia y osteoporosis32. Las citocinas con mayor efecto a nivel del hueso son la IL-6 y el TNF-α33.
La IL-6 está aumentada en la obesidad y en pacientes con incremento de la resistencia a la insulina. Esta molécula produce un aumento de la osteoclastogénesis, incrementando la resorción ósea34. Pero, por otra parte, también se ha observado una estimulación de la proliferación de osteoblastos en situaciones de alto turnover óseo35.
El TNF-α tiene un efecto similar al de IL-6. Además, potencia el efecto negativo sobre el hueso modulando la osteoclastogénesis a través de la vía del receptor RANK (receptor activador del factor nuclear κB): estimulando RANKL, reduciendo la producción de osteoprotegerina y sobreexpresando el receptor RANK36. La combinación de estos factores produce un efecto sinérgico que promueve la resorción ósea y deteriora el hueso.
EstrógenosLa asociación entre el estrógeno y el metabolismo óseo es clara y es la principal razón del descenso de la masa ósea asociado a la edad en las mujeres posmenopáusicas. En las mujeres obesas posmenopáusicas los estrógenos circulantes se mantienen parcialmente debido a la aromatización periférica (en relación con el tejido adiposo) de los andrógenos aumentados en relación con la resistencia a la insulina. Además el aumento de estrógeno circulante produce una estimulación de producción de osteoblastos en la médula ósea. Esta situación podría conducir a un aumento parcial de la masa ósea, y cierto papel protector sobre la osteoporosis17. Aun así, no existen muchos estudios diseñados para identificar esta funcionalidad, y en los que se ha realizado como el de Corina et al. no han observado que la acción estrogénica del tejido adiposo tenga un efecto significativo sobre el hueso, sobre todo en el caso de pacientes posmenopáusicas37.
Distribución de la masa grasaLa distribución corporal de la masa grasa se ha diferenciado en distintos compartimentos en relación con la enfermedad cardiovascular, diabetes mellitus y mortalidad. En el caso del estudio de la densidad mineral ósea también parece que podría tener un efecto sobre la misma. Se diferencian 2 tipos de tejido adiposo y de obesidad:
- -
Tejido adiposo visceral, relacionado con la obesidad central: Al realizar su medición indirecta, la circunferencia abdominal ha demostrado asociación variable con la masa ósea y el riesgo de fractura de manera modesta18. Se han realizado pocos estudios que midan la masa grasa con técnicas avanzadas (TAC y RMN); en estos estudios la grasa visceral está asociada negativamente con densidad mineral, contenido, estructura y fortaleza del hueso. En un estudio realizado por Cenci et al. se observó que, en mujeres posmenopáusicas, la grasa visceral medida mediante TAC se asociaba con menor calidad ósea (menor volumen de hueso trabecular, menor rigidez y alta porosidad cortical)38. En el estudio de Choi et al. se analizó la relación entre la presencia de adiposidad visceral y la densidad mineral ósea, dándose una relación inversamente proporcional al ajustar por factores de confusión metabólicos39. Esta relación negativa se puede deber a la mayor secreción de citocinas proinflamatorias producidas en este tipo de tejido y que tienen el efecto sobre el hueso comentado previamente.
- -
Tejido adiposo subcutáneo, relacionado con la obesidad periférica: En el caso del tejido adiposo subcutáneo existe menos evidencia y en los pocos estudios realizados la información es discordante, variando desde la no relación a la presencia de una asociación positiva con la masa ósea. En otro estudio de Gilsanz et al. se analizó la relación entre la distribución de la grasa y la resistencia ósea, detectándose una relación positiva de esta con la grasa subcutánea junto con una relación inversa en el caso de la grasa visceral40.
Aunque no existen suficientes estudios que comparen el efecto de ambos tipos de obesidad en el mismo contexto se puede concluir que el principal factor de influencia sobre el metabolismo óseo es la cantidad de tejido adiposo, por encima de su distribución19.
En este sentido, en distintas enfermedades como la obesidad, la anorexia nerviosa y la diabetes mellitus tipo 2 se ha observado una relación inversa entre la grasa de la médula ósea y la densidad mineral ósea. Entre las hipótesis que se postulan para este incremento se encuentra la presencia de un mismo precursor mesenquimal para el osteoblasto y el adipocito. En los pacientes obesos habría una mayor diferenciación hacia el tejido adiposo con una reducción del potencial de formación ósea. En el momento actual este dato es difícilmente medible y todavía no existe evidencia suficiente para conocer si puede existir un aumento en el riesgo de fractura41,42.
En resumen, el aumento de la adiposidad, asociado a un descenso de masa libre de grasa se ha asociado con un descenso de la densidad mineral ósea y el aumento de la fragilidad43. Aunque el efecto de este exceso de masa grasa y la situación de la inflamación sobre este metabolismo óseo aún no es muy bien conocida.
Resistencia a la insulinaLa obesidad está relacionada de manera intrínseca con el concepto de resistencia a la insulina y síndrome metabólico. Esta resistencia a la insulina y sus productos metabólicos (aumento de los niveles de insulina, amilina y preptina) se ha observado que pueden asociarse con el metabolismo óseo.
Insulina y péptidos relacionadosInsulinaLa elevación de los niveles de insulina se encuentra asociada positivamente con un aumento de la masa ósea. Esta situación puede deberse a un descenso de la actividad de los osteoclastos y un aumento del funcionamiento de los osteoblastos en relación con el incremento de estrógenos por aromatización y el aumento de las fracciones libres de estas hormonas debido al descenso de las proteínas de transporte de hormonas sexuales44. Entre los pacientes que sufren resistencia a la insulina se ha observado que aquellos con diabetes mellitus tipo 2 tienen un descenso en la masa ósea, lo que podría relacionarse con el descenso relativo de esta secreción de insulina44. En cuanto al riesgo de fractura, el metaanálisis de Vestergaard et al. puso en evidencia que tanto los pacientes con diabetes mellitus tipo 1 como tipo 2 tenían un aumento de riesgo de fractura de cadera, aunque la densidad mineral ósea fue diferente ya que los diabéticos tipo 1 tenían una densidad mineral ósea más baja que los tipo 245. El aumento del riesgo de fractura y los cambios observados en la densidad mineral ósea en el paciente diabético pueden deberse a multitud de factores como puede ser un balance de calcio negativo, hipoinsulinemia, deterioro de la función renal, productos de glicación avanzada, y el incremento de citocinas inflamatorias. Es necesario un estudio más profundo a este nivel para conocer el peso de cada uno de los factores sobre el riesgo de fractura para poder actuar sobre ellos.
AmilinaSe trata de un péptido cosecretado con la insulina, y por tanto aumentado en la resistencia a la misma, y que es miembro de la familia de la calcitonina. Parece ser que esta hormona puede tener efectos similares a la calcitonina induciendo la proliferación de osteoblastos in vitro, y descenso de la producción de osteoclastos46.
PreptinaEste péptido se secreta de la misma manera que los previos y también ha demostrado in vitro un efecto anabólico sobre el hueso, aunque no tiene efecto sobre los osteoblastos47.
Según estos hallazgos la resistencia a la insulina, al menos en sus fases iniciales, se podría relacionar con un aumento de la formación de hueso con descenso de la resorción y, por tanto, un aumento de la masa ósea44. Esta condición se va perdiendo conforme desciende la secreción de insulina pudiendo producir en el paciente diabético descensos en la densidad mineral ósea y aumento del riesgo de fractura.
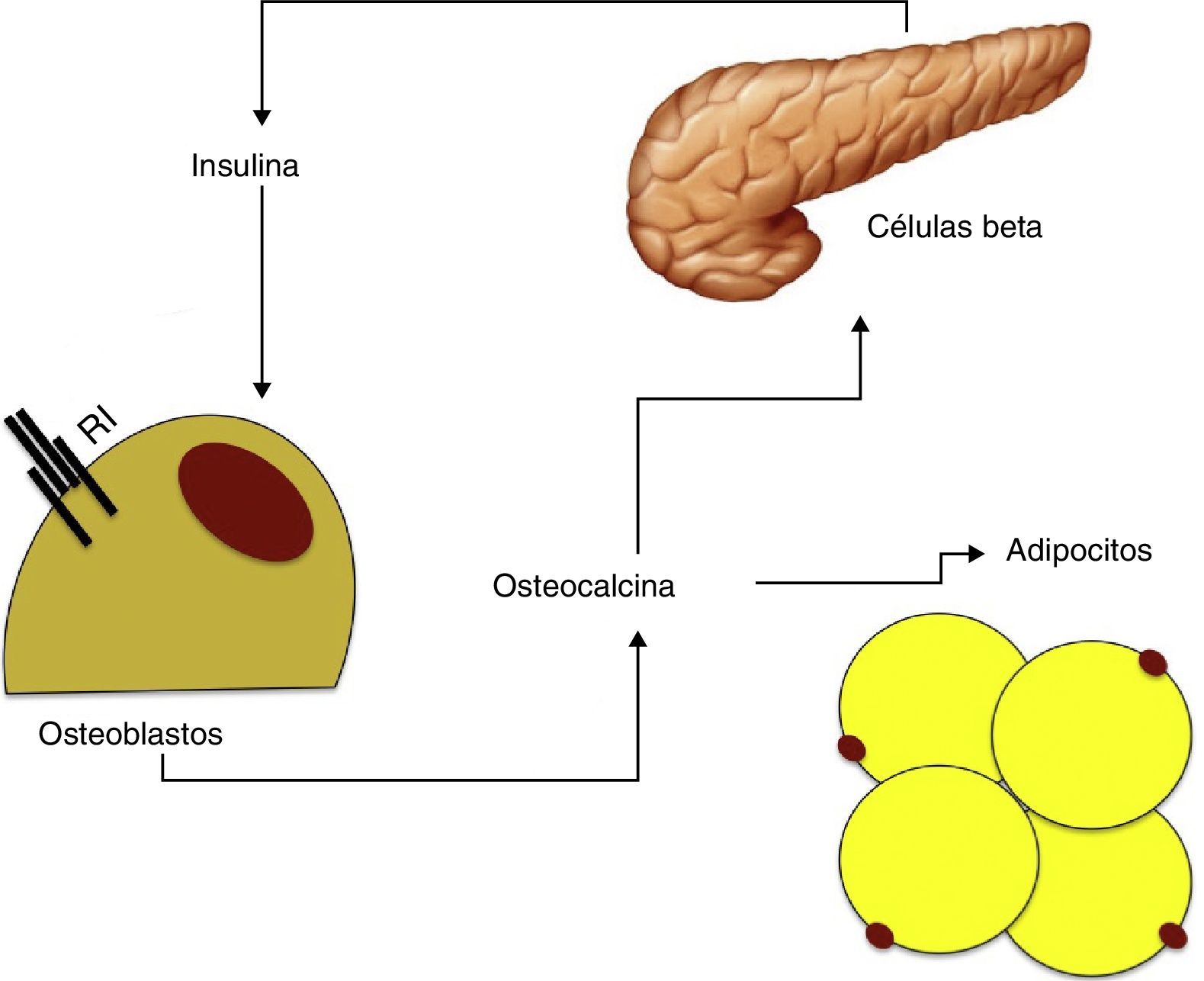
Resistencia a la insulina, osteocalcina y síndrome metabólicoLa osteocalcina es un péptido de 49 aminoácidos sintetizado únicamente por los osteoblastos y almacenado en la matriz mineral ósea como cristales de hidroxiapatita. Debido a sus características esta molécula es utilizada como marcador de formación ósea.
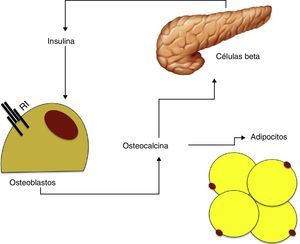
Se ha observado que la osteocalcina estimula la proliferación de las células beta y de la secreción de insulina in vitro, además de aumentar la producción de adiponectina lo que mejora la sensibilidad a la misma48. A su vez, como se ha comentado previamente, la insulina tiene un efecto sobre la producción y diferenciación de osteoblastos y de este péptido. Según estos hallazgos parece que existe un mecanismo de feedback entre las células beta pancreáticas, el tejido adiposo y el hueso (fig. 2).
Basándonos en los datos obtenidos se puede hipotetizar que la osteocalcina podría tener un papel central en la relación entre el metabolismo óseo y la resistencia a la insulina. El hiperinsulinismo aumentaría la producción de osteoblastos y de osteocalcina que, a su vez, estimularía la producción de insulina y mejoraría la sensibilidad a la misma a través de la adiponectina49.
En la obesidad, caracterizada por una alta resistencia a la insulina y una secreción disminuida relativa de la misma, se puede observar una disminución de la producción de osteocalcina según distintos estudios. En el reciente estudio de Bador et al. se objetivó una correlación negativa de la osteocalcina con la glucosa y la resistencia a la insulina medida mediante el HOMA-R. Asimismo se observó que en los pacientes diabéticos había unos menores valores de osteocalcina50. Esta situación podría producir un descenso de la formación ósea con un posible efecto negativo sobre la densidad mineral ósea en estos pacientes.
Hiperparatiroidismo secundarioVitamina DLos efectos de la vitamina D sobre el metabolismo óseo son bien conocidos: a) influye sobre los niveles de calcio y fósforo promoviendo el proceso de mineralización; b) controla la función y diferenciación de osteoblastos y osteoclastos promoviendo la formación de hueso a través de la inhibición de la función de la parathormona (PTH)51.
El déficit de vitamina D es una entidad de alta prevalencia en la población general. En la población española (analizando únicamente la población sana y de edad media) existe una situación basal de déficit de vitamina D con un 27,58% de la población por debajo de 20ng/ml y un 56,03% entre 20 y 30ng/ml52. Por otra parte, el efecto de la edad es importante, ya que los niveles de vitamina D en mujeres posmenopáusicas europeas son bajos situándose en un 79,6% de esta población, aunque en España los niveles son ligeramente más altos que en el resto de Europa53. Esta situación puede verse potenciada por el aumento de la adiposidad en el grupo de edad más alto (>65 años)54.
En la población obesa existe un descenso de los niveles de vitamina D sobre todo en situaciones de alto grado de la misma55. Esta disminución de los niveles de 25OH vitamina D en el paciente obeso probablemente se relacione con: a) disminución de la biodisponibilidad por el secuestro de esta vitamina por el tejido adiposo56, b) disminución de la 25 hidroxilación de la vitamina D en el hígado, sobre todo en casos de esteatohepatitis no alcohólica57, y c) disminución de la exposición a la luz solar por vestuario y disminución del tiempo pasado fuera de casa58. Esta hipovitaminosis habitualmente se encuentra relacionada con niveles elevados de PTH59. Estas 2 alteraciones pueden asociarse con un efecto adverso sobre el hueso cortical. En un estudio realizado en mujeres entre 25 y 71 años se mostró que aquellas pacientes con obesidad severa (IMC>35kg/m2) tenían una mayor densidad mineral ósea, pero en las pacientes que presentaban niveles mayores de PTH la densidad mineral ósea trabecular estaba disminuida60.
El déficit de vitamina D se puede asociar a una alteración del metabolismo óseo, de la función muscular y aumento de la resistencia a la insulina. Es especialmente importante mantener unos adecuados niveles sanguíneos de la misma pero aún no se conoce a qué niveles llegar ni cuál es la suplementación adecuada en cantidad o tipo de fuente.
Los niveles plasmáticos de 25OH vitamina D necesarios para evitar alteraciones secundarias al déficit se encuentran por encima de 30ng/ml, aunque las concentraciones óptimas son aquellas que están entre 36-40ng/ml.
Las recomendaciones dietéticas de vitamina D son de 15μg/día (600UI) hasta los 71 años y a partir de entonces de 20μg/día (800UI)61,62; aunque en muchos casos estas cantidades no son suficientes para mantener niveles adecuados de vitamina D en sangre, teniendo que recomendar cantidades superiores a 1,000UI/día63. El paciente obeso suele necesitar cantidades mayores de esta vitamina para conseguir niveles plasmáticos adecuados necesitando 2,5UI/kg para elevar 1ng/ml en plasma64.
Ingesta de calcio y fósforoLas recomendaciones de consumo de calcio según las distintas guías oscilan entre 1,000 y 1,500mg/día dependiendo de la edad y la situación fisiológica del individuo65. La absorción intestinal del calcio se encuentra influida por los niveles de la vitamina D, el estrógeno circulante y la cantidad ingerida de calcio. Por lo tanto, en el paciente obeso parece que existe un aumento de la absorción de calcio debido al incremento del estrógeno circulante, al mayor consumo de calcio y la mayor superficie absortiva intestinal66. Dada la influencia del calcio dietético en el aumento de la masa ósea esta situación puede suponer una cierta protección del sobrepeso y la obesidad sobre el metabolismo del hueso.
En España el consumo de fósforo en la población general respecto a las recomendaciones dietéticas es muy elevado, siendo similar en ambos sexos y en los distintos grupos de edad67. Aun así, en población con obesidad estos requerimientos son difíciles de caracterizar exactamente debido a la infraestimación de determinados productos ricos en fósforo como los refrescos y determinados aditivos alimentarios.
La ingesta elevada de fósforo, sobre todo asociada a una ingesta disminuida de calcio, se puede asociar con un hiperparatiroidismo secundario lo que conlleva un aumento de la resorción ósea, un descenso del pico de masa ósea y un incremento de la fragilidad del hueso. De la misma manera el aumento de la fosforemia puede producir un aumento de la carga ácida que, aunque parcialmente tamponada por el aumento de la ingesta proteica asociada, se puede relacionar también con un daño en el hueso68. Estas relaciones son, en su mayoría, hipótesis y requieren un estudio más profundo para su corroboración.
ConclusionesLa obesidad es una situación patológica que cambia el medio corporal influyendo en el metabolismo óseo a través de factores mecánicos, hormonales e inflamatorios.
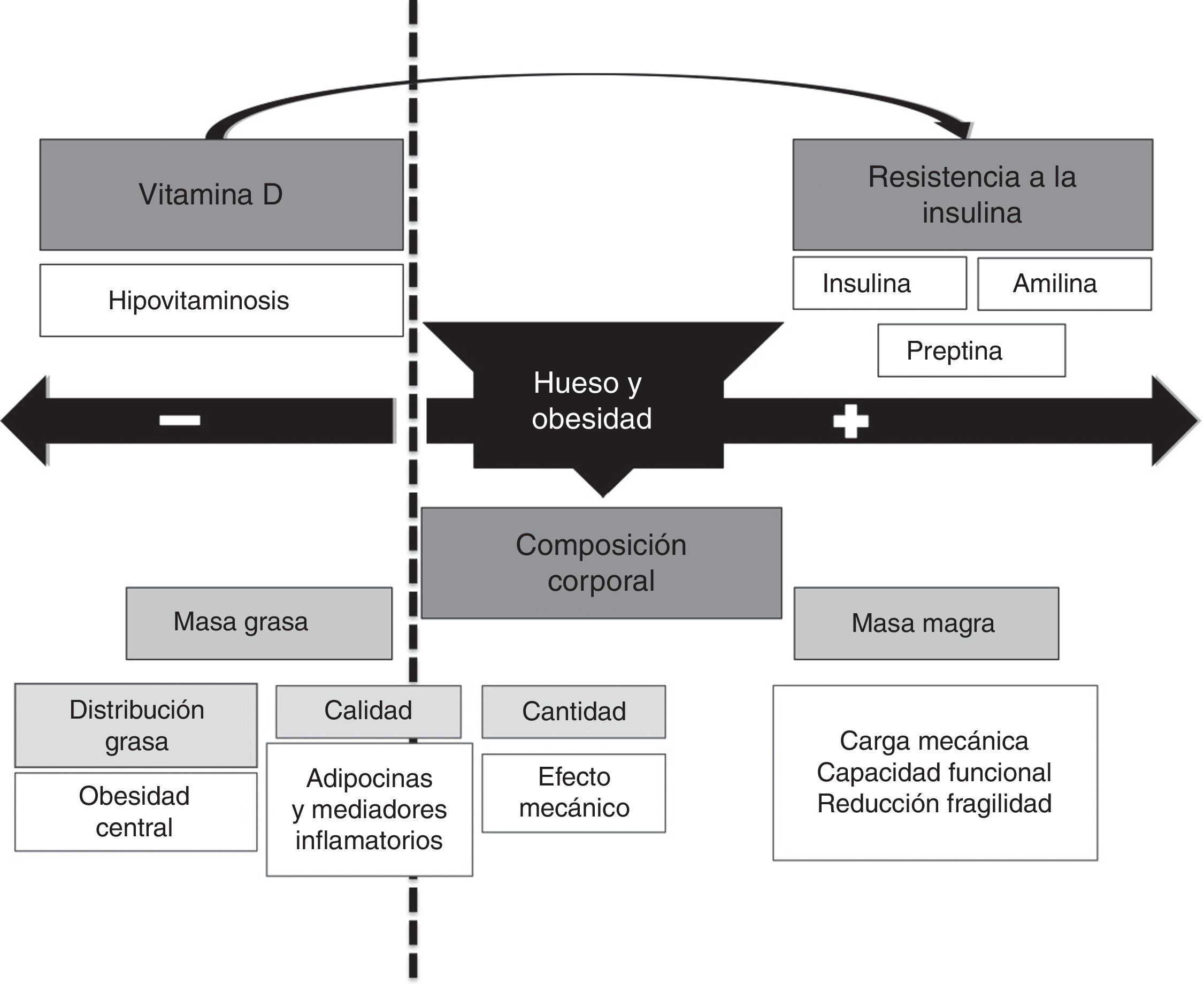
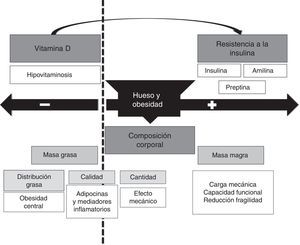
La relación entre la obesidad y la masa ósea puede ser bidireccional (fig. 3) con un aumento de la masa ósea que se basa en: 1) una mayor masa corporal se asocia con un aumento de la carga mecánica que estimula el incremento de la masa ósea como respuesta; 2) el aumento de masa grasa se asocia a un aumento de la conversión de andrógenos a estrógenos, lo que supone un estímulo positivo para el metabolismo óseo; 3) aumento de la secreción de insulina y amilina secundaria a la resistencia insulínica por las células beta.
Y por otra parte, un efecto deletéreo sobre el metabolismo óseo a través de las siguientes circunstancias: 1) la obesidad es un estado proinflamatorio que se asocia a la secreción de una serie de citocinas (IL-6, TNF-α) y una serie de adipocitocinas (adiponectina, leptina…). Si bien las primeras se ha observado que tienen una influencia negativa sobre el hueso, el papel de las segundas es aún parcialmente desconocido en humanos; 2) en el paciente obeso existe un descenso de los niveles de 25OH vitamina D circulante, debido en su mayoría al secuestro de la misma por parte del tejido adiposo. Esta situación puede producirnos una alteración en la formación de hueso, alterando la cantidad como la calidad (arquitectura) del mismo; 3) este descenso de vitamina D junto con el aumento del fósforo dietético se puede asociar a un aumento de la PTH que puede influir de manera independiente en el metabolismo óseo.
El efecto perjudicial o beneficioso neto de la obesidad sobre la masa ósea o sobre el riesgo de fractura de estos factores todavía no es bien conocido y son precisos más estudios observacionales y de intervención en esta área de conocimiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.