Primigesta de 33 años, que ingresa en nuestro centro por coma etiquetado de hiponatrémico 7 días posparto (PP) de recién nacido sano. Sin antecedentes personales ni familiares de interés ingresa en centro privado para alumbramiento tras gestación a término sin incidencias. A su llegada se objetiva hipertensión arterial y se decide realizar cesárea que se complica con abundante sangrado por desgarro del ligamento uterino derecho. En el control analítico posterior se objetiva AST 100 U/L (5-40), anemia (hemoglobina 6,5g/dL [12-16]), plaquetopenia de 21×10 E3/uL (150-450) y proteinuria en límites de síndrome nefrótico. Se trasfunden 4 unidades de hematíes y 7 de plaquetas y dada la hipertensión arterial mantenida se inicia perfusión de urapidilo, labetalol 200mg/6h y metildopa 500mg/6h. Por decisión de la paciente se administra monodosis de 1mg de cabergolina para inhibir la lactancia.
A los 7 días del PP refiere astenia intensa y cefalea. Presenta exploración física sin alteraciones con tensión arterial de 150-155/95-100mmHg. El hemograma muestra persistencia de la anemia y horas después presenta crisis tonicoclónica seguida de coma y es intubada. Permanece afebril, hemodinámicamente estable con tensión arterial de 135/80mmHg y FC 67 lpm. En la analítica presenta empeoramiento de la anemia, glucosa de 73mg/dL, CPK de 1710 U/L en relación con la convulsión y Na de 103 mmol/L. Ante la necesidad de prueba de imagen es trasladada a la UCI de nuestro centro.
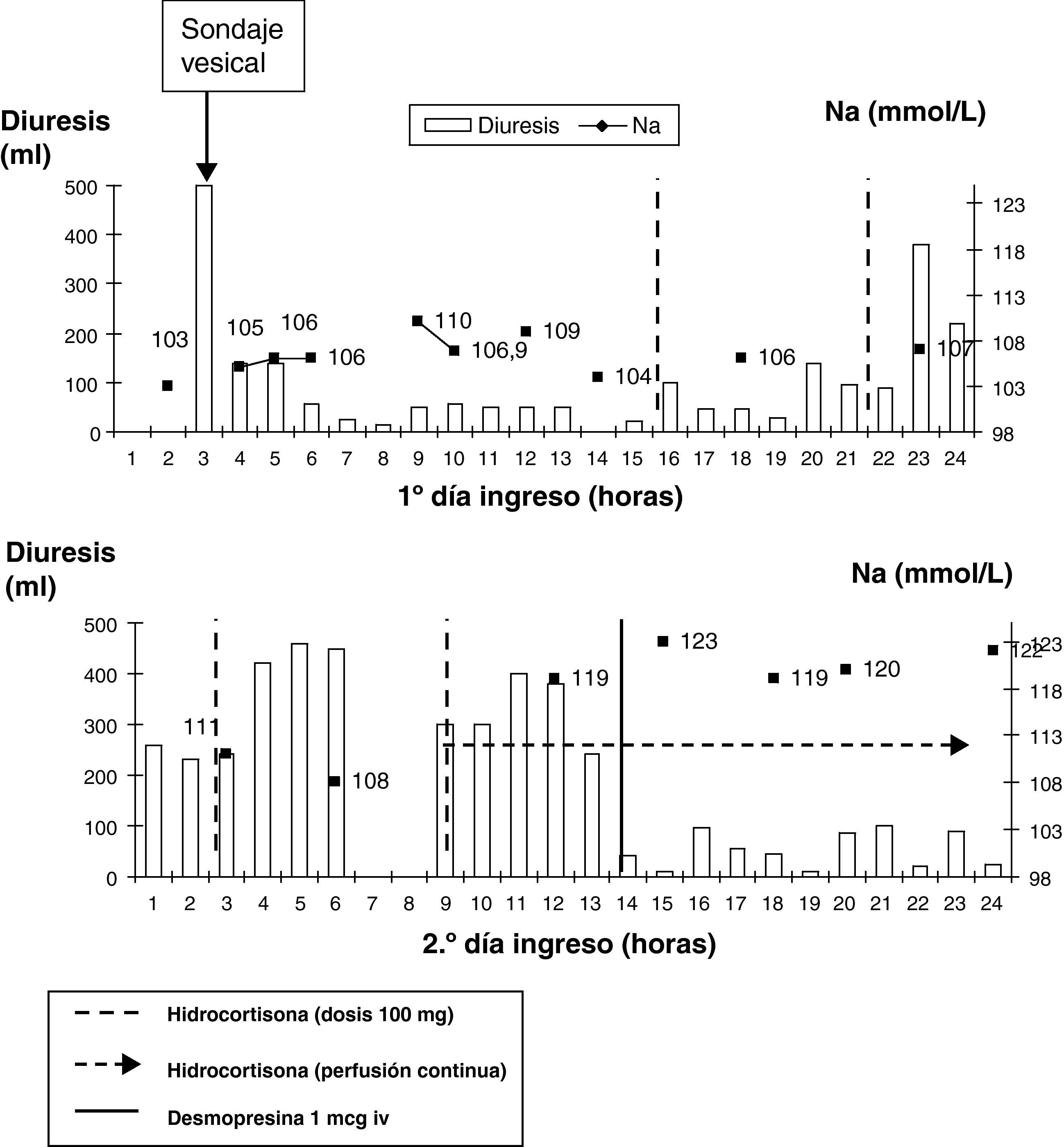
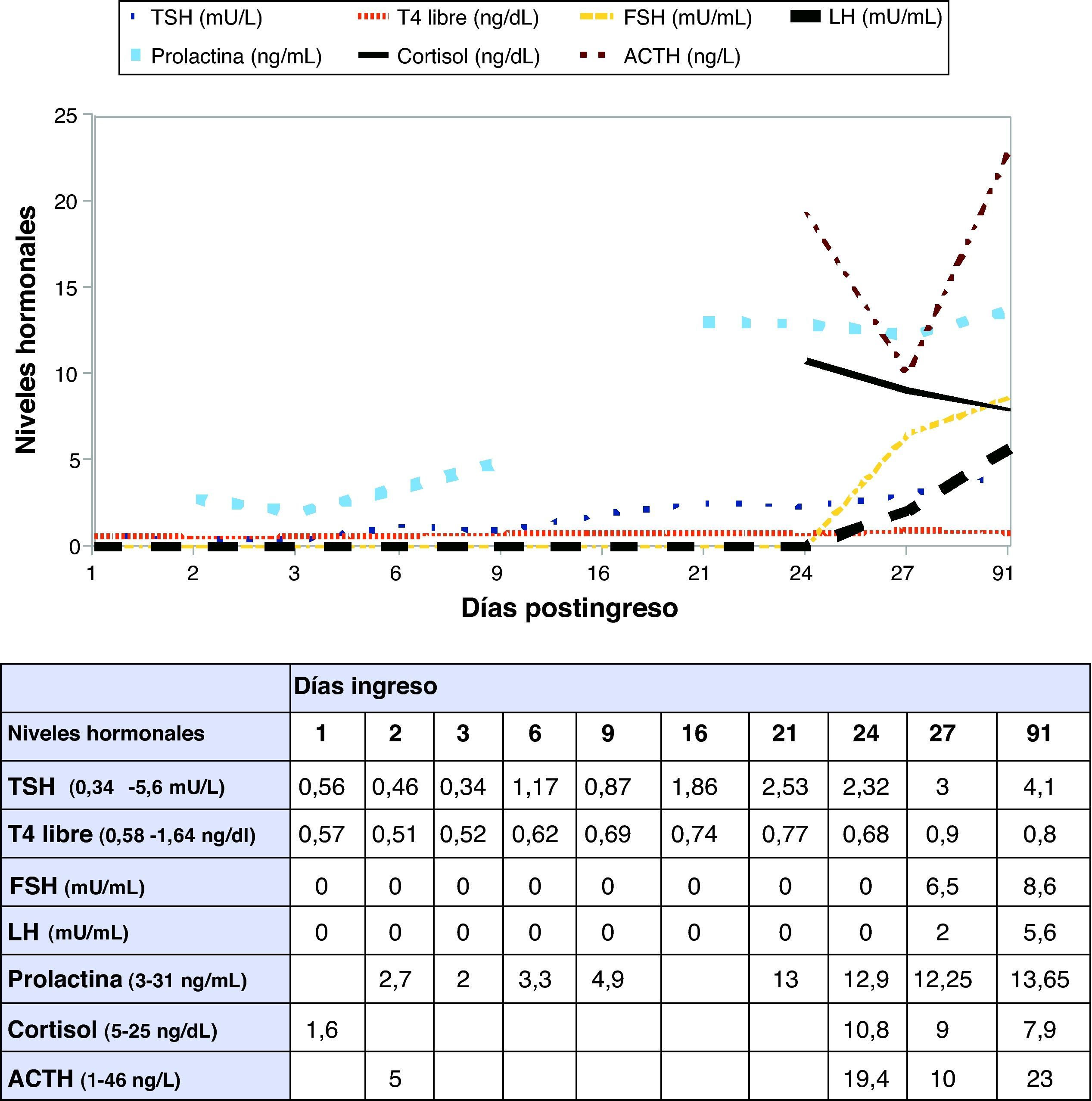
A su llegada a la UCI se confirma la natremia de 104 mmol/L (135-145) con glucosa 78mg/dL (60-100), urea 19mg/dL (15-50), creatinina 0,57mg/dL (0,5-1,2), osmolalidad en suero 224 mOsm/kg y en orina Na 41 mmol/L y osmolalidad de 384 mOsm/kg. Persiste la anemia con hemoglobina de 8,2g/dL normocítica y normocrómica y discreta elevación de las transaminasas. La radiografía de tórax y el TC craneal no hallan alteraciones y el electroencefalograma muestra afectación cerebral difusa. En la UCI se inicia administración de suero salino isotónico, 2.000mL en 5h sin mejoría. Durante el primer día de ingreso mantiene diuresis entre 15-50mL/h. Se solicita estudio hormonal: cortisol 1,6 ng/dL (5-25) que aumenta a 19,1 ng/dL (30’) y 18,7 ng/dL (60’) tras estimulación corta con 250 mcg de ACTH intravenosa, TSH 0,56 mU/L (0,34-5,6) y T4 libre 0,57 ng/dL (0,58-1,64). Ante la sospecha de insuficiencia suprarrenal se inicia sustitución con dosis de 100mg de hidrocortisona cada 6h, observando incremento de la diuresis a las 2h de cada dosis (145mL tras la primera, 470mL tras la segunda y 880mL tras la tercera) volviendo a descender la diuresis a las pocas horas de cada dosis, por lo que se inicia la administración de hidrocortisona en perfusión continua.
En el segundo día a las 6:00h presenta Na 108 mmol/L. A las 9:00h se solicita nuevo estudio hormonal que muestra T3 libre 1,8 pg/mL (2,5-3,9) y TSH y T4 libre que siguen disminuyendo. A las 12:00h aumenta el Na a 119 mmol/L (11 mmol/L en 6h) y la diuresis a 300-400mL/h por lo que se administra 1 mcg de desmopresina intravenosa (fig. 1).
Al tercer día presenta en analítica: hemoglobina 8,3g/dL, glucosa 112mg/dL, creatinina 0,47mg/dL, ácido úrico 0,8mg/dL (2,5-6), Na 120 mmol/L, K 4,2 mmol/L, LDH 869 U/L con normalización hipertransaminemia y en estudio hormonal: prolactina 2 ng/mL, LH y FSH indetectables, cortisol 41,4 ng/dL, TSH 0,34 mU/L, T3 libre 1,87 pg/mL y T4 libre 0,52 ng/dL. Durante el transcurso del tercer y cuarto días se observa aumento progresivo de la natremia hasta sodio de 138 mmol/L con variaciones de 10 mmol/L en menos de 24h y diuresis superiores a los 300mL/h por lo que se administran de nuevo dosis de 1 mcg de desmopresina.
Dada la recuperación de la natremia se decide desintubar, permaneciendo consciente, orientada, sin focalidad ni nuevas crisis comiciales. Se realiza RM que objetiva hipófisis de morfología y dimensión normales, con realce periférico y ausencia de captación central tras gadolinio compatible con isquemia no hemorrágica de la adenohipófisis en fase subaguda. El sodio se mantiene estable y se produce una mejoría progresiva de las hormonas tiroideas (T4 libre 0,62 ng/dL al sexto día).
Se decide traslado a la planta de endocrinología. La mejoría de las cifras tensionales y la desaparición de la proteinuria permiten disminuir los hipotensores hasta su suspensión. Con la mejoría del control hormonal, la disminución de la isquemia en la RM de control y el estudio inmunológico negativo, se inicia descenso progresivo de la corticoterapia hasta su suspensión. El día 27 de ingreso, previamente al alta, se realiza reevaluación hormonal que muestra cortisol basal de 9 ng/dL que aumenta a 14,8 ng/dL (30’) y 5,5 ng/dL (60’) tras estímulo corto con 250 mcg de ACTH intravenosa con mejoría del resto de parámetros, por lo que se decide prescribir corticoterapia sólo ante situaciones de estrés (fig. 2).
Tras el alta la paciente sigue sin precisar tratamiento de base. Las menstruaciones se retomaron a los 5 meses, volviendo a su regularidad a los 8 meses del alta. Analíticamente persiste la respuesta parcial del cortisol al test de estímulo corto con ACTH con recuperación del resto de hormonas persistiendo en la RM a los 6 meses la imagen de isquemia.
Analizando los datos durante su ingreso en la UCI observamos que la paciente presentaba una TSH en límites bajos con hipotiroxinemia inadecuada tratándose de una situación postembarazo. Aunque inicialmente se sospechó que podía deberse a hemodilución, la tendencia de la T4 libre a seguir bajando a pesar del aumento del sodio y de haber recibido altas dosis de glucocorticoides orientaron la sospecha hacia un hipotiroidismo central. Respecto al eje corticotropo, presentaba una cortisolemia basal inapropiadamente baja para la situación de estrés a la que estuvo sometida, con una respuesta prácticamente normal al test de estimulación corto con ACTH, que orientaban hacia una insuficiencia suprarrenal central de reciente instauración con capacidad de respuesta casi conservada a la ACTH exógena de unas suprarrenales que aún no habían tenido tiempo de atrofiarse. Además, la prolactina parecía estar demasiado disminuida para una monodosis de 1mg de cabergolina.
Hubiese resultado útil realizar test específicos de estímulo de la función hipofisiaria pero fueron inviables dada la situación de la paciente. Así pues, nos parece adecuada la decisión de iniciar hidrocortisona a dosis de estrés. Y creemos que hubiese sido también adecuada la sustitución de la hipotiroxinemia.
Los datos de hipopituitarismo junto al antecedente de complicaciones obstétricas con hemorragia que precisó transfusión y la imagen de isquemia de la adenohipófisis en la RM1,2 orientan como primera posibilidad diagnóstica el síndrome de Sheehan (SS).
Aunque la hiponatremia es la alteración electrolítica más frecuente del SS, su presentación suele ser crónica y aunque raro en países desarrollados, el coma hiponatrémico forma parte de la manifestación aguda del SS3–7. Los mecanismos por los que se produce son la hipersecreción “adecuada” de la vasopresina a la deficiencia de cortisol y en menor medida a la depleción de volumen (por las complicaciones del parto) y al hipotiroidismo (por la alteración de la eliminación del agua libre) simulando un cuadro de síndrome de secreción inadecuada de hormona antidiurética, aunque no debemos olvidar que el diagnóstico de este cuadro es de exclusión. Dada su fisiopatología, la hiponatremia en el seno del SS se caracteriza por la ausencia de respuesta a la infusión de suero salino iso e hipertónico hasta que no se acompaña de tratamiento sustitutivo con glucocorticoides y tiroxina que disminuyen la hipersecreción compensatoria de la vasopresina3,6.
Aunque en nuestra paciente no se administró tiroxina, analizando las tablas de flowchart (fig. 1) observamos que la natremia y la diuresis no empezaron a mejorar hasta que se inició la administración de hidrocortisona. Nos llama la atención que en la UCI, ante una hiponatremia grave (Na igual o inferior a 115 mmol/L) y sintomática con crisis comiciales y coma posterior indicativos de encefalopatía hiponatrémica aguda no se administrara suero salino hipertónico al 3%, conociéndose que las mujeres en edad fértil, forman parte del grupo de mayor riesgo de isquemia, herniación cerebral con compresión del tronco y muerte.
Aunque razonable el temor del uso de suero salino hipertónico por el riesgo de desarrollo del síndrome de desmielinización osmótica, el peligro no reside tanto en su uso sino en el retraso en su suspensión, por lo que es preciso monitorizar de forma estrecha para evitar ascensos de la natremia superiores a los 2 mmol/L/h, 10 mmol/L/24h o 18 mmol/L/48h. Esto explicaría, aunque fue un tratamiento discutible, la administración en la UCI de desmopresina de forma puntual cuando observaron elevaciones rápidas de la natremia asociadas a poliuria.
A parte de la excepcional presentación aguda del SS en esta paciente, durante su evolución se observó un descenso de la superficie de isquemia en la RM con una recuperación paulatina de las hormonas tiroideas (fig. 2), la TSH, la cortisolemia y la prolactina permitiendo la suspensión del tratamiento. Por lo que el cuadro parece corresponder a un SS transitorio, ya descrito previamente en la literatura, aunque la mayoría de recuperaciones se limitan al eje gonadotropo y/o lactotropo8,9 y sólo en un caso al corticotropo y somatotropo2.
Finalmente, este caso enfatiza la importancia de la monitorización analítica y en especial del ionograma en pacientes con parto complicado, y la necesidad del reconocimiento precoz de un cuadro que puede tener consecuencias letales para la mujer7.