Las manifestaciones cutáneas asociadas a la enfermedad tiroidea incluyen lesiones específicas como el quiste del conducto tirogloso y las metástasis cutáneas, signos inespecíficos como aquellos secundarios a alteraciones hormonales por hiper e hipofunción y, finalmente, las alteraciones dermatológicas asociadas a la enfermedad tiroidea, de las cuales aportamos 2 ejemplos clínicos.
La prevalencia de hipotiroidismo primario autoinmune (HPAI) alcanza el 5% de la población y hasta el 8,3% si se incluye el hipotiroidismo subclínico1. Entre las manifestaciones cutáneas asociadas al mismo tenemos que distinguir una serie de dermopatías más frecuentes en pacientes afectos de esta enfermedad (definida por la presencia de autoanticuerpos aunque estén eutiroideos) y otras que dependen directamente de la función tiroidea.
Entre las primeras, la frecuencia de disfunción tiroidea es variable; así, aparece en el 40-70% de las manchas melánicas de localización centrofacial, en el 42% de los varones y el 62% de las mujeres con vitíligo, en el 50% de los pacientes con candidiasis mucocutánea crónica, en el 34% de los pacientes con dermatitis herpetiforme, en el 8% de las reacciones de hipersensibilidad retardada y en el 8% de los pacientes afectos de alopecia areata. También son más frecuentes las asociaciones de la enfermedad tiroidea autoinmune con el pénfigo y otras enfermedades bullosas, el lupus eritematoso sistémico, la escleroderrmia, el sarcoma de Kaposi, el eritema anular centrífugo, el granuloma anular generalizado, la reticulohistiocitosis multicéntrica, el pseudoxantoma elástico, la mucinosis reticular eritematosa, la anemia (perniciosa, aplasia celular de células rojas), el herpes gestationis, la dermatomiositis, el síndrome de Sjögren, la polimiositis, otras endocrinopatías (acantosis nigricans, neoplasias endocrinas múltiples, síndrome de McCune-Albright, síndrome Sweet), el síndrome de CREST (calcinosis, síndrome de Raynaud, disfunción esofágica, escleroderma y telangiectasias), la psoriasis, el sídrome de Cowden con hamartomas múltiples, el síndrome ANOTHER (alopecia, distrofia ungueal, hipohidrosis y efélides), las acropaquias2 y las manifestaciones atópicas como la urticaria, el dermografismo y el angioedema3–5.
Entre las alteraciones cutáneas dependientes directamente de la hipofunción tiroidea destacan:
- -
La piel característicamente seca, pálida y fría por disminución del flujo capilar, de la sudoración y de la termogénesis; el queratoderma palmoplantar, que puede llegar a ser generalizado convirtiéndose en xeroderma, pero que responde espectacularmente al tratamiento sustitutivo.
- -
La queratosis pilosa de los folículos con alopecia permanente, el pelo adelgazado y la pérdida lateral de las cejas. Se puede acompañar de livedo reticularis en las extremidades6.
- -
El mixedema generalizado o mucinosis cutánea por acúmulo de ácido hialurónico y glicosaminoglicanos en la dermis. Esto motiva la característica facies hipotiroidea: piel gruesa, edema periorbitario y engrosamiento de mucosas con disfonía. Puede existir hiperpigmentación periocular (signo de Jelinek)7 e hipercarotinemia por la falta de metabolización hepática de caroteno con acúmulo del mismo en el estrato corneo, excretándose en el sudor y depositándose en áreas ricas en glándulas sebáceas.
- -
Una lesión poco frecuente relacionada con el hipotiroidismo primario y el síndrome poliglandular autoinmune tipo i, el eritema anular centrífugo, consiste en una erupción en forma de anillo con aclaramiento de la región central en las nalgas, los muslos y la parte proximal de los brazos. Su histología muestra un infiltrado linfocitario perivascular en la dermis media y profunda8.
- -
También pueden asociarse al hipotiroidismo el granuloma anular y el liquen plano oral, no bien conocidos por la mayoría de los endocrinólogos. Se presentan aquí 2 casos y se estudia su relación con la enfermedad tiroidea autoinmune.
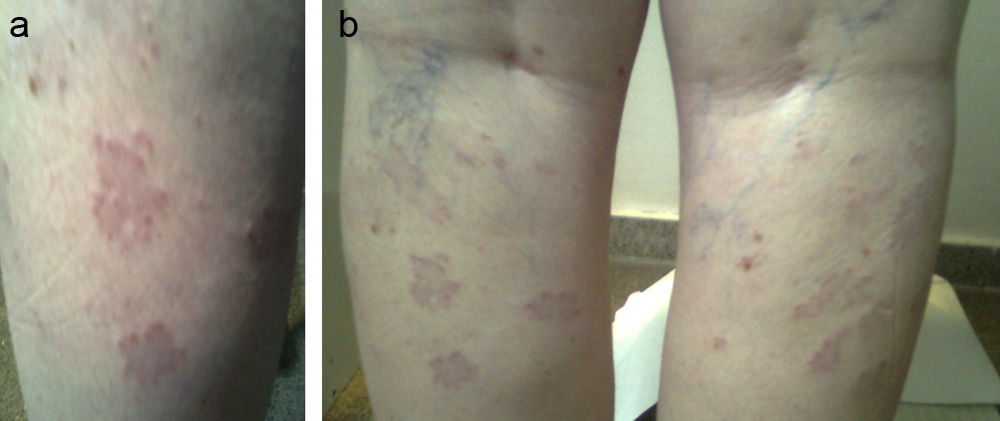
Paciente remitida a los 41 años por hipotiroidismo. Entre sus antecedentes destacaba una hija con vitíligo e HPAI y la paciente presentó melanoma in situ intervenido 2 años antes y en remisión. En la analítica solicitada por Dermatología presentaba un HPAI subclínico (TSH [tirotropina]: 8,7mcU/ml, T4l [tiroxina libre]: 0,92ng/dl, ATA-TPO [anticuerpos antiperoxidasa]: >1.300U/ml) que fue seguido en consulta sin tratamiento. Nueve años después refería afonía, piel seca y astenia con alteraciones menstruales perimenopáusicas (TSH: 8,34mcU/ml, T4l: 0,98ng/dl). Presentaba bocio grado i de superficie irregular con imagen ecográfica pseudonodular hipoecoica en polo superior del lóbulo izquierdo de 8,7mm. Desde entonces estaba en tratamiento con levotiroxina a dosis de 1,11mcg/kg de peso (TSH: 2,18mcU/ml). Un año después aparecieron lesiones papulosas confluentes en la cara posterior de ambas piernas por debajo del hueco poplíteo que fueron biopsiadas y se obtuvo el diagnóstico de granuloma anular (fig. 1 a y b). Fue tratada con corticoides tópicos sin mejoría de las lesiones, por lo que en el actualidad está en tratamiento con rayos PUVA (psoralenos y rayos ultravioleta A).
El granuloma anular es una lesión indurada no escamosa en forma de placas y pápulas de color de la piel anulares normalmente en las extremidades. Se considera una dermatosis autolimitada, crónica y benigna, de etiología desconocida y caracterizada por una inflamación granulomatosa debida a un mecanismo de hipersensibilidad tipo iv de la dermis. Se sugiere una predisposición genética ya que se ha relacionado con los haplotipos HLA-BW35 y HLA-A29. Se ha relacionado con la tiroiditis autoinmune (del 5,7 al 12% de los casos)9,10, la diabetes mellitus y algunas neoplasias como el linfoma de Hodgkin. Debido a ello, en los pacientes con granuloma atípico o de edad avanzada debe hacerse un estudio para descartar tumores sólidos y hematológicos, así como estados de inmunodepresión11. Algunos autores postulan que la asociación con la enfermedad tiroidea autoinmune puede ser fortuita debido a su alta prevalencia, mientras que otros sí publican una asociación estadísticamente más frecuente que explican mediante una predisposición genética, un mecanismo fisiopatológico autoinmune que induce a la apoptosis o factores precipitantes, comunes a ambos procesos10. Se cree que los queratinocitos, las células de Langerhans y los melanocitos liberan citoquinas que estimulan a las células inflamatorias. De las 4 formas existentes (localizada, diseminada, perforante lineal y subcutánea), el granuloma anular generalizado, constituido por 10 o más lesiones papulares tendentes a la confluencia anular, supone menos del 10% de los casos. La mayoría de los pacientes se diagnostican entre la 4.ª y la 7.ª década de la vida. Suelen tener una localización simétrica en tronco y extremidades. La anatomía patológica muestra granulomas en empalizada con infiltración linfocítica perivascular y predominio de linfocitos T colaboradores. En más de la mitad de los pacientes se resuelve espontáneamente sin tratamiento en el periodo de 2 meses a 2 años pero puede recurrir hasta en el 40% de casos, especialmente en los niños y a veces durar hasta 10 años. La forma localizada y autolimitada no suele necesitar tratamiento. En caso de pacientes que insistan en tratarse o en el granuloma generalizado9, se pueden intentar inyecciones intralesionales de corticoides (2,5 a 5mg/ml de triamcinolona), crioterapia y electrodesecación, advirtiendo al paciente de la posibilidad de atrofia o cicatrices12. Otros tratamientos que se han usado son: interferón beta-1, PUVA, ácido retinoico, tacrólimus, láser y tratamiento oral con retinoides, dapsona o ciclosporina13.
Caso 2Paciente de 50 años, sin antecedentes familiares ni personales de interés, seguida en consulta de Endocrinología desde el año 1998 por un HPAI subclínico diagnosticado a los 38 años de edad sin tratamiento hasta el año 2005. Coincidiendo con la menopausia, presentó TSH 22mcU/ml, T4l: 0,81ng/dl y ATA-TPO: >1.300 U/ml, con un bocio elástico y pequeño de grado i sin datos clínicos de disfunción hormonal ni compresión cervical. Se inició tratamiento sustitutivo a una dosis de 1,77 mcg/dl. Desde el año 2000 refería lesiones erosivas y ulceradas en la mucosa oral. En la exploración física presentaba lesiones blanquecinas en retículo localizadas a nivel de ambas mejillas con erosiones superficiales. La analítica, incluida la serología de hepatitis C, fue negativa. Con el diagnóstico de liquen plano oral se iniciaron corticoides sistémicos y tópicos, antipalúdicos de síntesis, y, finalmente, tras recaer al dejar los tratamientos, ciclosporina oral. En la última revisión, persistían las lesiones a nivel de la mucosa oral en la cara interna de la mejilla, así como en la lengua de patrón geográfico.
El liquen plano consiste en una erupción papular, inflamatoria y pruriginosa de curso crónico que afecta a piel y mucosas. Tiene una prevalencia del 1 al 3% de la población europea adulta, siendo más frecuente en mujeres de mediana edad (50-59 años)14,15. Representa una reacción autoinmune mediada por linfocitos T y dirigida contra los queratinocitos basales que expresan autoantígenos en su superficie y que han sido modificados por diversas causas. No están claros los antígenos específicos que provocan la respuesta inmune14,16. Entre los posibles desencadenantes, se han descrito la hepatitis C, fármacos, alérgenos de contacto y neoplasias. Se han implicado varias citoquinas proinflamatorias como las interleuquinas 2, 4, 6 y 10, factor de necrosis tumoral alfa, interferón alfa y factor de crecimiento transformador B1. Existen diversas formas clínicas en las que el liquen plano oral afecta con mayor frecuencia a la mucosa yugal pero también puede afectar a lengua, encías, paladar y otras mucosas y conjuntivas. La más frecuente es la forma reticular con lesiones blanquecinas entrelazadas formando una red que afecta de forma simétrica a ambas caras de la mucosa yugal y suele ser asintomática. Hay otra forma erosiva con úlceras superficiales que suele afectar más frecuentemente a las caras laterales de la lengua. Cuanto mayor sea el tiempo de seguimiento más frecuente es la evolución de una forma simple a otra combinada16. Un 15-20% de los pacientes con liquen plano oral tienen lesiones cutáneas y de un 1 a 5% se ha asociado al desarrollo de neoplasias orales17.
En un estudio reciente se revisó una base de datos de un servicio sanitario incluyendo 1.477 pacientes con liquen plano y 2.856 controles, analizando varias características clínicas y demográficas y encontrando una asociación significativamente estadística con el hipotiroidismo y la dislipidemia18.
En un estudio finlandés, publicado en septiembre de 2010, tras examinar las historias clínicas de 222 pacientes con liquen plano y 222 controles, encontraron una prevalencia del 15% de la enfermedad tiroidea en aquellos con liquen plano oral independientemente del tratamiento con levotiroxina. Hasta un tercio de los casos tenían una localización del liquen plano en la mucosa bucal y la lengua, como es el caso de la paciente aquí descrita. El hecho de tener una enfermedad tiroidea previa supone un riesgo doble de tener un liquen plano oral6. La resolución espontánea completa es rara16. Están descritas remisiones espontáneas en el primer año pero con recaídas posteriores en el 20% de los casos. Se ha intentado un tratamiento con corticoides orales, PUVA, retinoides, enoxaparina sódica, sulfasalazina, metronidazol y tratamientos biológicos como alefacept, efalizumab y basiliximab, con resultados variables. Aún se necesitan estudios de eficacia con mayor número de pacientes. Por ello, dado que algunos regresan espontáneamente y los tratamientos tienen muchos efectos secundarios, siempre debe valorarse la relación riesgo-beneficio antes de iniciarlos19.
En resumen, presentamos los casos clínicos de 2 pacientes con HPAI y lesiones dermatológicas paucisintomáticas que es importante tener presentes al realizar la historia clínica y la exploración física, ya que se pueden tratar y merecen seguimiento debido al potencial riesgo de malignización.