La obesidad es un problema de salud frecuente en nuestra población. La cirugía bariátrica es el tratamiento de elección en los casos graves, es muy efectiva (junto con una adecuada modificación de los hábitos de vida), pero también se asocia a múltiples efectos secundarios. Uno de los más frecuentes y que puede reducir marcadamente la calidad de vida es la diarrea. La diarrea que aparece posterior a una cirugía bariátrica puede ser de distintas causas y mecanismos fisiopatogénicos que van a depender, en parte, del tipo de cirugía realizada.
Las causas más frecuentes son el síndrome de dumping, la diarrea por vagotomía, el síndrome de intestino corto, la malabsorción de hidratos de carbono, la malabsorción proteica, las alteraciones de la microbiota, la infección por Clostridium difficile, el sobrecrecimiento bacteriano, la malabsorción de sales biliares, la insuficiencia pancreática, trastornos endocrinológicos, trastornos adictivos y otros trastornos digestivos no necesariamente relacionados con la cirugía.
Obesity is a prevalent health problem in our population. Bariatric surgery is the indicated treatment for severe cases. It is very effective (together with an adequate lifestyle modification) but it is also associated with frequent adverse events. One of the most frequent and disturbing adverse event is diarrhea. Diarrhea after bariatric surgery may be secondary to multiple causes and the physiopathogenic mechanisms may depend on the type of surgery performed.
The most frequent diarrhea mechanisms are dumping syndrome, vagotomy, short bowel syndrome, carbohydrate malabsorption, protein malabsorption, alterations of the microbiota, Clostridium difficile infection, bacterial overgrowth, bile salt malabsorption, pancreatic insufficiency, endocrinological disorders, addictive disorders, and other digestive disorders not necessarily related to surgery.
La incidencia de la obesidad presenta un aumento global en los últimos años. Según cifras de la Organización Mundial de la Salud, en 2016 alrededor del 13% de la población adulta mundial (un 11% de los varones y un 15% de las mujeres) eran obesos. Entre 1975 y 2016, la prevalencia mundial de la obesidad se ha triplicado1. Como consecuencia de este incremento, las técnicas quirúrgicas para tratarla también han aumentado. Existen numerosas técnicas quirúrgicas, que se subdividen en restrictivas (gastrectomía vertical, banda gástrica ajustable), mixtas (bypass gástrico en Y de Roux, mini gastric bypass —bypass con una sola anastomosis—) y malabsortivas (derivación biliopancreática o cruce duodenal, cruce duodenal modificado con gastrectomía vertical Single Anastomosis Duodeno-Ileal [SADI])2. La cirugía bariátrica en Europa ha presentado un crecimiento exponencial, pasando de 33.771 cirugías en 2008 hasta 112.843 en 2011, estabilizándose en los últimos años en una meseta3,4.
Debido a esta tendencia al alza de la cirugía bariátrica, se ha apreciado también, un aumento en los efectos indeseados. La diarrea es un problema frecuente en el paciente obeso, con una prevalencia de hasta el 30% respecto al 17% en la población no obesa5. Tras una cirugía bariátrica, esta prevalencia aumenta hasta un 75% de los pacientes sometidos a una anastomosis en Y de Roux6. Esto puede llegar a causar incontinencia fecal en un 50% de los pacientes sometidos a cirugía, que se asocia a un gran empeoramiento en la calidad de vida7.
Hay muchas causas de diarreas después de una cirugía bariátrica. El objetivo de esta revisión es enumerar y revisar las múltiples causas de diarrea en el paciente bariátrico con el fin de llegar a un diagnóstico etiopatogénico y un tratamiento adecuado, y mejorar así la calidad de vida de los pacientes.
Síndrome de dumpingLa diarrea es uno de los síntomas más frecuentes del síndrome de dumping. Tiene una prevalencia del 75% tras un bypass en Y de Roux, y del 45% tras una gastrectomía vertical8. Se deben diferenciar 2 tipos:
- 1.
El síndrome de dumping precoz aparece en el periodo posprandial inmediato (entre 10 y 30min), se produce debido a la exposición del intestino delgado a hidratos de carbono no digeridos. Estos producen una hiperosmolaridad intraluminal que causa una diarrea osmótica secundaria, con paso de líquido intersticial e intravascular a la luz intestinal. La pérdida del volumen endovascular a menudo ocasiona hipotensión. Todo este proceso activa péptidos intestinales vasoactivos (neurotensina, VIP, serotonina, sustancia P y catecolaminas) que producen palpitaciones, diaforesis y flushing9.
- 2.
El síndrome de dumping tardío se manifiesta entre 2 y 4h tras la ingesta en forma de hipoglucemia, que puede llegar a ser grave, manifestándose con una disminución del nivel de conciencia, convulsiones e incluso puede llegar a causar la muerte. Está descrita su aparición en cualquier tipo de cirugía bariátrica; en caso del bypass en Y de Roux está descrita una prevalencia de entre el 0,2 y el 6,6%10. Su fisiopatología no es bien conocida, existen muchas hipótesis, una de las más aceptadas lo explica por una rápida absorción de glucosa, que estimula la liberación de enteroglucagón y crea un estado hiperinsulínico que causa una hipoglucemia posterior9. Otros estudios atribuyen la hipoglucemia a una hipotrofia e hiperplasia de las células beta pancreáticas, secundaria a la diabetes previa a la cirugía y/o a la resistencia a la insulina, lo que condiciona una hipersecreción insulínica11,12. Estudios más recientes, han descrito que en caso de vaciamiento gástrico acelerado, se genera una hipersecreción y/o hipersensibilidad al glucagon like peptide 1 (GLP-1); péptido que actúa estimulando la producción de insulina, causando así hipoglucemia13,14.
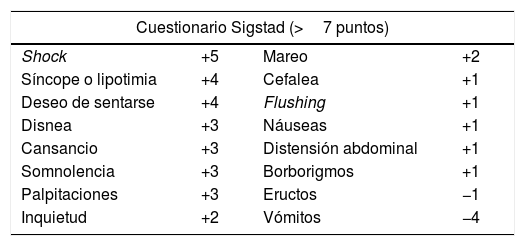
El diagnóstico se realiza en función del cuestionario Sigstad (una puntuación >7 puntos es diagnostica; tabla 1) y/o en el test con glucosa oral15; este test consiste en dar una sobrecarga de glucosa para desencadenar los síntomas.
Cuestionario Sigstad para el diagnóstico del síndrome de dumping
| Cuestionario Sigstad (>7 puntos) | |||
|---|---|---|---|
| Shock | +5 | Mareo | +2 |
| Síncope o lipotimia | +4 | Cefalea | +1 |
| Deseo de sentarse | +4 | Flushing | +1 |
| Disnea | +3 | Náuseas | +1 |
| Cansancio | +3 | Distensión abdominal | +1 |
| Somnolencia | +3 | Borborigmos | +1 |
| Palpitaciones | +3 | Eructos | −1 |
| Inquietud | +2 | Vómitos | −4 |
El tratamiento de primera línea se basa en un cambio de dieta, reduciendo los hidratos de carbono de absorción rápida y fraccionando la dieta. En segunda línea, los suplementos con pectina o galactomanano pueden ser útiles al aumentar la viscosidad del bolo alimentario y disminuir el vaciamiento gástrico (se recomiendan entre 10 y 15g por comida); no obstante, su efecto viene limitado por su escasa tolerancia15.
El octreotide puede ser un tratamiento efectivo. Sin embargo, al ser un análogo de la somatostatina, puede ocasionalmente empeorar la diarrea. Se recomienda iniciar el tratamiento a dosis de 50-100μg/3 veces al día; si la tolerabilidad es buena, se puede cambiar a formulación LAR® (lanreotide) a dosis de 20mg/mensuales16.
Otros tratamientos empleados con menor evidencia científica son la acarbosa (dosis de 100mg/diarios), que solo es útil en síndrome de dumping tardío y presenta escasa tolerancia17. El diazóxido (100-150mg/antes de las comidas) y el verapamilo (80mg/antes de las comidas), también se han utilizado en casos aislados18,19.
En casos refractarios hay que plantear la reversión de la cirugía20, siempre que sea posible. Como última opción tenemos la nutrición parenteral total, que se reservará como último recurso ante un cuadro de difícil control pese al tratamiento médico y/o a la reversión de la cirugía.
Existen perspectivas de futuro en cuanto al manejo del síndrome de dumping. Cabe destacar el ensayo clínico de Craig et al. en el cual asumiendo la hipótesis de la hipersecreción y/o hipersensibilidad del GLP-1 en el síndrome de dumping tardío, se administró tratamiento con exendina-9-39, un antagonista del receptor GLP-1, evitando la hipoglucemia en el 100% de los casos (un total de 10 pacientes)21. También, la sitagliptina (un inhibidor del enzima dipeptidil peptidasa IV) ha sido descrita como un tratamiento eficaz en el síndrome de dumping tardío en un caso clínico publicado por Kurihara et al.22. Hacen falta más estudios prospectivos y aleatorizados que demuestren la eficacia de estos tratamientos para poder ser incluidos en el algoritmo terapéutico.
Síndrome posvagotomíaLa vagotomía puede ser realizada de forma intencionada para causar saciedad precoz y mejorar así los hábitos dietéticos o de forma involuntaria como complicación intraoperatoria23. La clínica característica es la saciedad precoz y los vómitos, pero la diarrea puede ocurrir hasta en un 10%. La fisiopatología de esta diarrea no está bien establecida, si bien participan en esta las alteraciones de la microbiota, la hipomotilidad y la hipoacidez gástrica8. El octreotide, puede ser un buen tratamiento para las diarreas secundarias al síndrome posvagotomía.
Síndrome intestino cortoEl síndrome del intestino corto se produce en un 4% de los pacientes después de una cirugía bariátrica24, debido a una reducción excesiva de la superficie de absorción intestinal.
No existe ninguna prueba suficientemente sensible ni específica que permita el diagnóstico del síndrome del intestino corto. Por eso hay que sospecharlo y realizar un correcto diagnóstico de exclusión.
El tratamiento inicial consiste en aplicar medidas de soporte mediante nutrición enteral. Se debe intentar restituir la anatomía normal mediante una cirugía de reversión si es posible. En casos refractarios, se recomienda tratamiento con nutrición parenteral. El intestino corto secundario a una cirugía bariátrica justifica el 6,4% de los pacientes con nutrición parenteral en domicilio en EE. UU.25,26.
Recientemente se ha comercializado la Teduglutide (Gattex®, Revestive®) que es un polipéptido análogo del glucagón like peptide 2 (GLP-2), que actúa inhibiendo la dipeptidil peptidasa. Esto aumenta el tiempo de semivida del GLP-2 de 20min a 2h, promoviendo así el crecimiento de la mucosa intestinal. Los resultados del estudio en fase III aún están pendientes de publicar, pero la hipótesis es que consigue una clara reducción de los requerimientos de nutrición parenteral27.
Malabsorción de hidratos de carbonoExisten varios tipos de malabsorción de hidratos de carbono, los más relevantes los de lactosa, fructosa y sacarosa. La malabsorción de lactosa es la más frecuente en la población general (prevalencia de hasta un 80-95% en Escandinavia y Alemania, de entre el 30-40% en España)28 es por este motivo, que nos centraremos, únicamente, en ella. La lactosa es un carbohidrato que se absorbe tras la acción de la enzima lactasa. Esta enzima tiende de forma natural a disminuir con la edad. Además, ciertos fenómenos intercurrentes, como infecciones intestinales, pueden exacerbar esta tendencia natural y causar déficit de lactasa, impidiendo que se pueda absorber la lactosa.
La influencia de la cirugía bariátrica como fenómeno exacerbador en este proceso es indeterminado29, si bien un antiguo estudio escandinavo encontró una tasa de intolerancia a la lactosa del 30% después de un bypass yeyuno-ileal30.
Cuando la lactosa no se absorbe, llega íntegra al colon, creando una situación hiperosmolar que genera una diarrea osmótica. Además, la flora saprofita del colon la metaboliza generando ácidos grasos de cadena ligera, dióxido de carbono, hidrogeno y metano, que produce la tríada clínica característica de distensión, diarrea y flatulencias.
El diagnóstico de la malabsorción de lactosa se basa en la respuesta a una dieta de prueba. También puede realizarse un test del aliento con lactosa, aunque su fiabilidad es reducida. El tratamiento se basa en dieta de exclusión de lactosa. También se puede aportar la enzima lactasa de forma exógena en situaciones especiales dónde es difícil realizar una correcta dieta sin lactosa (restaurantes, viajes…).
Malabsorción proteicaLa mayoría de macro y micronutrientes, entre ellos las proteínas son absorbidas en el yeyuno medio y distal31. Ciertas técnicas de cirugía bariátrica, entre ellas el bypass en Y de Roux, excluye estos segmentos, por lo que se puede producir malabsorción de los mismos.
La hipoalbuminemia ocurre en el 18% de los pacientes sometidos a un cruce duodenal32. La hipoalbuminemia se asocia a diarrea y malnutrición, con una fisiopatología similar a la enfermedad de Kwashikor33.
El tratamiento se basa en medidas de soporte. En ciertas situaciones se debe intentar restablecer la anatomía con una cirugía de reversión. La nutrición parenteral se reserva como última alternativa terapéutica.
MicrobiotaLa microbiota no es un sistema fijo, sino que varía a largo del tiempo de un individuo influenciada por la dieta, la obesidad, el ejercicio físico, los fármacos, etc. La cirugía bariátrica puede alterar la microbiota, no solo por la alteración anatómica del tránsito intestinal, también por la pérdida de peso y la modificación de la dieta. El estudio de Shao el et.34 demuestra que el bypass en Y de Roux, disminuye la diversidad de la microbiota, aumentando la familia Gammaproteobacteria y disminuyendo la Clostridia. Se ha postulado que esta alteración de la microbiota, puede ser también una causa de diarrea.
Clostridium difficileLa diarrea por C. difficile, es una situación distinta al resto. Se trata de una diarrea aguda secundaria a una colitis aguda infecciosa causada por este germen. La cirugía bariátrica, junto con la antibioterapia, ya sea como profilaxis o como tratamiento en caso de complicaciones, son un factor de riesgo para la colitis por C. difficile35. Se presenta como una colitis inflamatoria, ocasionando diarreas y una enteropatía pierde proteínas secundarias.
Habrá que sospecharla cuando aparezca una diarrea aguda en el postoperatorio inmediato, o posterior a la cirugía en caso de antibioterapia previa. Su diagnóstico se basa en la detección de su toxina en una muestra de heces. La primera línea de tratamiento es la vancomicina vía oral36, desplazando al metronidazol oral a una segunda línea (debido la farmacocinética del metronidazol —se absorbe casi por completo en el intestino delgado— y a las alteraciones anatómicas poscirugía bariátrica). En casos graves está indicada la combinación de vancomicina oral y metronidazol intravenoso. La fidaxomicina se utiliza en la tercera línea37. En pacientes con enfermedad recidivante, el trasplante fecal sería una opción de tratamiento38.
Sobrecrecimiento bacterianoSe define como una cantidad excesiva de bacterias en el intestino delgado39, su prevalencia es del 41% en pacientes obesos, secundario a una alteración de la motilidad del intestino delgado40.
Tras una cirugía bariátrica, aumenta el riesgo de sobrecrecimiento bacteriano debido a las anastomosis quirúrgicas41. Las zonas anastomóticas, son un punto de alteración de la motilidad, especialmente las anastomosis término-laterales, en las que queda un extremo ciego que actúa como reservorio.
La clínica que produce el sobrecrecimiento bacteriano es diarrea y dolor abdominal, en ocasiones puede acompañarse de manifestaciones extraintestinales como poliartritis y lesiones dermatológicas42.
Su diagnóstico ideal se basa en el cultivo del aspirado yeyunal (>104 colonias/ml), técnica poco accesible. En la práctica clínica, habitualmente se realiza un test de aliento con glucosa/lactulosa marcada, con una sensibilidad y especificidad del 62 y 83%, respectivamente43. El tratamiento se basa en la administración de antibióticos no absorbibles una semana al mes de forma cíclica, generalmente rifaximina (400mg c/12h) o metronidazol (250mg c/12h).
Debido a la escasa rentabilidad de los test diagnósticos y la ausencia de efectos adversos de su tratamiento, está indicado realizar una prueba terapéutica con rifaximina ante la sospecha de sobrecrecimiento bacteriano.
Malabsorción de sales biliaresEl 95% de las sales biliares se absorben a nivel del íleon, cualquier alteración anatómica o funcional a nivel ileal que se produzca por una cirugía bariátrica puede ocasionar su malabsorción. También está relacionada con la colecistectomía (previa o concomitante a la cirugía bariátrica) y a la vagotomía44.
En caso de malabsorción, esta ocasiona diarreas sin dolor abdominal. Su diagnóstico se basa en el test de SeHCAT, que consiste en la cuantificación fecal de ácidos biliares radiomarcados ingeridos45. Se trata de un test caro y de difícil aplicación clínica, por lo que estaría indicado realizar un test terapéutico con colestiramina, un quelante de las sales biliares que tiene una tasa de éxito de hasta el 96% a dosis adecuadas46.
Insuficiencia pancreática exocrinaSe ha registrado una prevalencia de insuficiencia pancreática exocrina de entre un 19-48% tras un bypass en Y de Roux, también en técnicas de cruce duodenal y SADI. Esto es debido a que las enzimas pancreáticas se degradan durante su paso por el asa biliopancreática, antes de entrar en contacto con los alimentos ingeridos47. Además, la proporción que llega indemne al asa alimentaria tiene un menor tiempo de contacto.
Su diagnóstico se debe realizar mediante la cuantificación de grasa fecal en 72h (test de Van de Kamer). En este tipo de pacientes, la elastasa fecal no es un buen marcador. Esto es debido a que la secreción de enzimas pancreáticas puede estar preservada, pero no son capaces de actuar (precisan de la neutralización del ácido procedente del estómago, gracias a la alta concentración de bicarbonato duodenal, ausente tras la cirugía bariátrica), dando lugar a un falso negativo.
El tratamiento se basa en administrar enzimas pancreáticas sustitutivas vía oral. Sin embargo, estas enzimas pueden no ser de utilidad, pues se administran en forma de mini-microesferas con recubrimiento entérico incluidas en cápsulas de gelatina. Las cápsulas se disuelven en el estómago, liberando las mini-microesferas, que al llegar al duodeno (pH>6) se desintegran liberando las enzimas activas. Dado que estos pacientes presentan alteración de la anatomía con anastomosis gastro-yeyunales, muchas veces no se alcanza este nivel de pH, por lo que no se liberan las enzimas y persiste la malabsorción y las diarreas48. En tal caso, dado que existen pocas alternativas terapéuticas, se debe valorar una cirugía de reversión si es posible.
Trastornos endocrinológicosEste tipo de trastornos está más relacionado con la propia obesidad mórbida y sus comorbilidades que con la cirugía bariátrica.
Existen múltiples factores asociados a la diarrea en la diabetes mellitus y en la obesidad, los más destacados la ingesta de alimentos ricos en azúcar, la asociación de la diabetes con la enfermedad celíaca y la alteración de la motilidad por alteración del sistema nervioso autónomo entérico (que puede favorecer al mismo tiempo al sobrecrecimiento y a la insuficiencia pancreática exocrina). En los casos de cirugía bariátrica indicada por síndrome metabólico o diabetes mellitus, que se consigue curación de esta, la tasa de recaída postoperatoria es de entre un 11%49,50 y un 35,1%51 a los 5 años, según las series consultadas.
Otro trastorno endocrinológico que puede causar diarreas es el hipotiroidismo en tratamiento sustitutivo. En los pacientes hipotiroideos sometidos a cirugía bariátrica, se debe monitorizar estrictamente la TSH y la T4, pues tras una importante pérdida de peso y de tejido adiposo, se produce una alteración de la distribución previa de los fármacos, pudiendo ocasionar una sobredosis de L-tiroxina y en consecuencia las diarreas por hipertiroidismo farmacológico52.
Trastornos adictivosEl alcohol y la nicotina producen diarrea cuando se consumen en cantidades excesivas. El estudio de King et al.53 muestra un mayor riesgo de abuso de alcohol después de la cirugía bariátrica.
Otros trastornos digestivosNo hay que olvidar que los pacientes con una cirugía bariátrica también pueden presentar diarreas por las mismas causas que en la población general, pueden presentar gastroenteritis, síndrome de intestino irritable, celiaquía, colitis microscópica (ambas asociadas a la diabetes) e incluso enfermedad inflamatoria intestinal.
DiscusiónComo hemos comentado previamente, la diarrea es un problema común en el paciente con obesidad, pero se ve exacerbado tras una cirugía bariátrica. Estos últimos años ha habido un incremento muy importante de los pacientes sometidos a cirugía bariátrica, por lo que sus efectos adversos, entre ellos la diarrea, también se han visto aumentados.
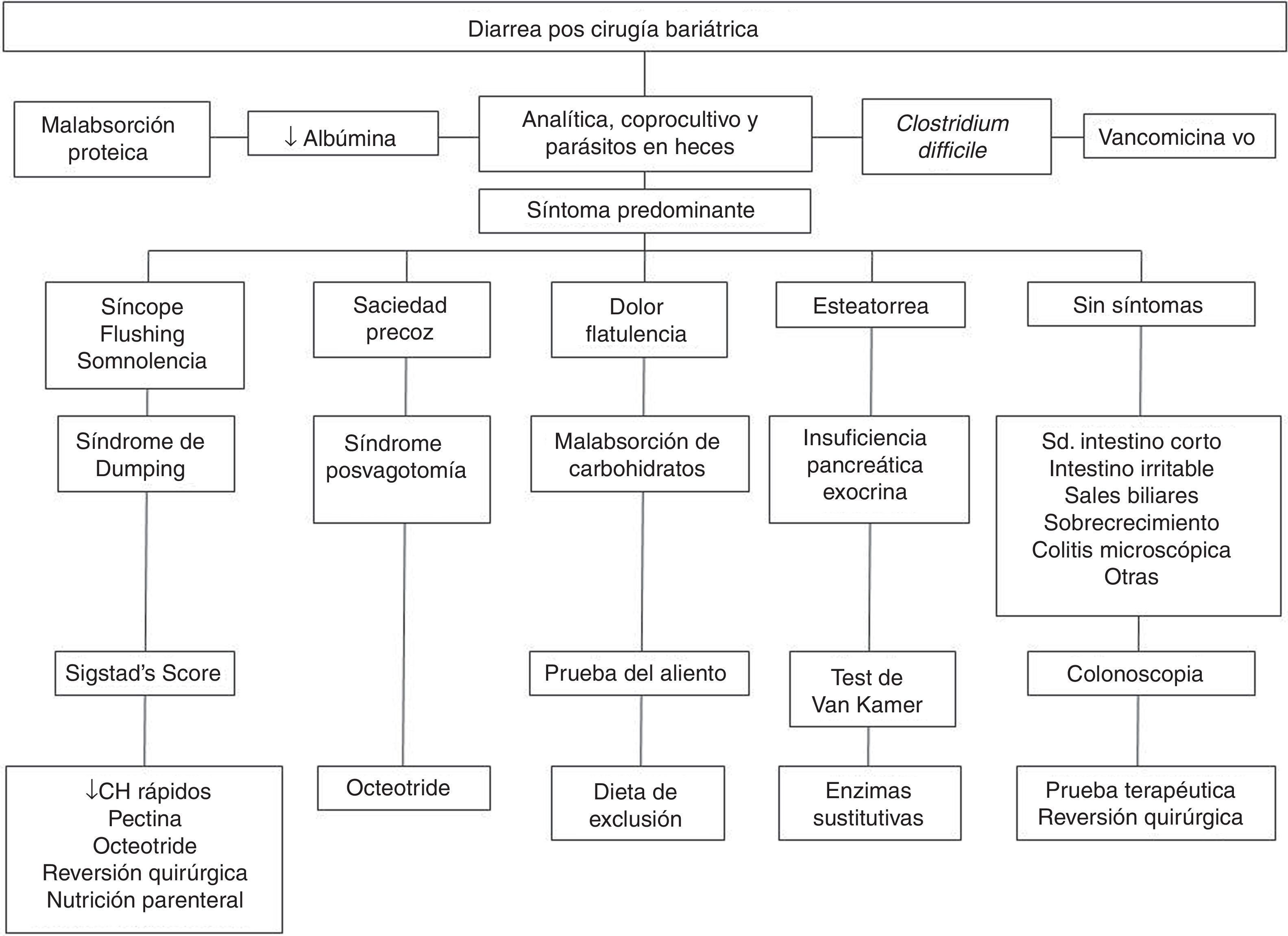
El diagnóstico etiológico de la diarrea tras una cirugía bariátrica puede suponer un reto. Los diagnósticos más frecuentes y que debemos tener en cuenta son el síndrome de dumping, el sobrecrecimiento bacteriano, la malabsorción de sales biliares, la malabsorción de hidratos de carbono y la insuficiencia pancreática. La herramienta más útil de la que disponemos para poder llegar al diagnóstico es la anamnesis. Con ella, debemos encontrar el síntoma guía que presentan los pacientes (a parte de la diarrea) y en función de este, dirigir las pruebas complementarias (fig. 1).
Si obtenemos un diagnóstico etiológico, podremos ofrecer al paciente un tratamiento dirigido; que será más eficaz, conseguirá un mejor manejo de la diarrea, y contribuirá a mejorar su calidad de vida.
FinanciaciónNo se ha recibido financiación para la realización de este trabajo.
AutoríasCon relación a la contribución de los autores, Eduard Brunet ha realizado una revisión sistemática del tema y ha redactado el manuscrito, Assumpta Caixàs y Valentí Puig han colaborado en la redacción del manuscrito y en su revisión. Todos los autores leyeron y aprobaron el manuscrito final.