Este posicionamiento surge con el objetivo de consolidar la obesidad como enfermedad, una de las más prevalentes e infravaloradas, menos diagnosticadas y tratadas de la historia1.
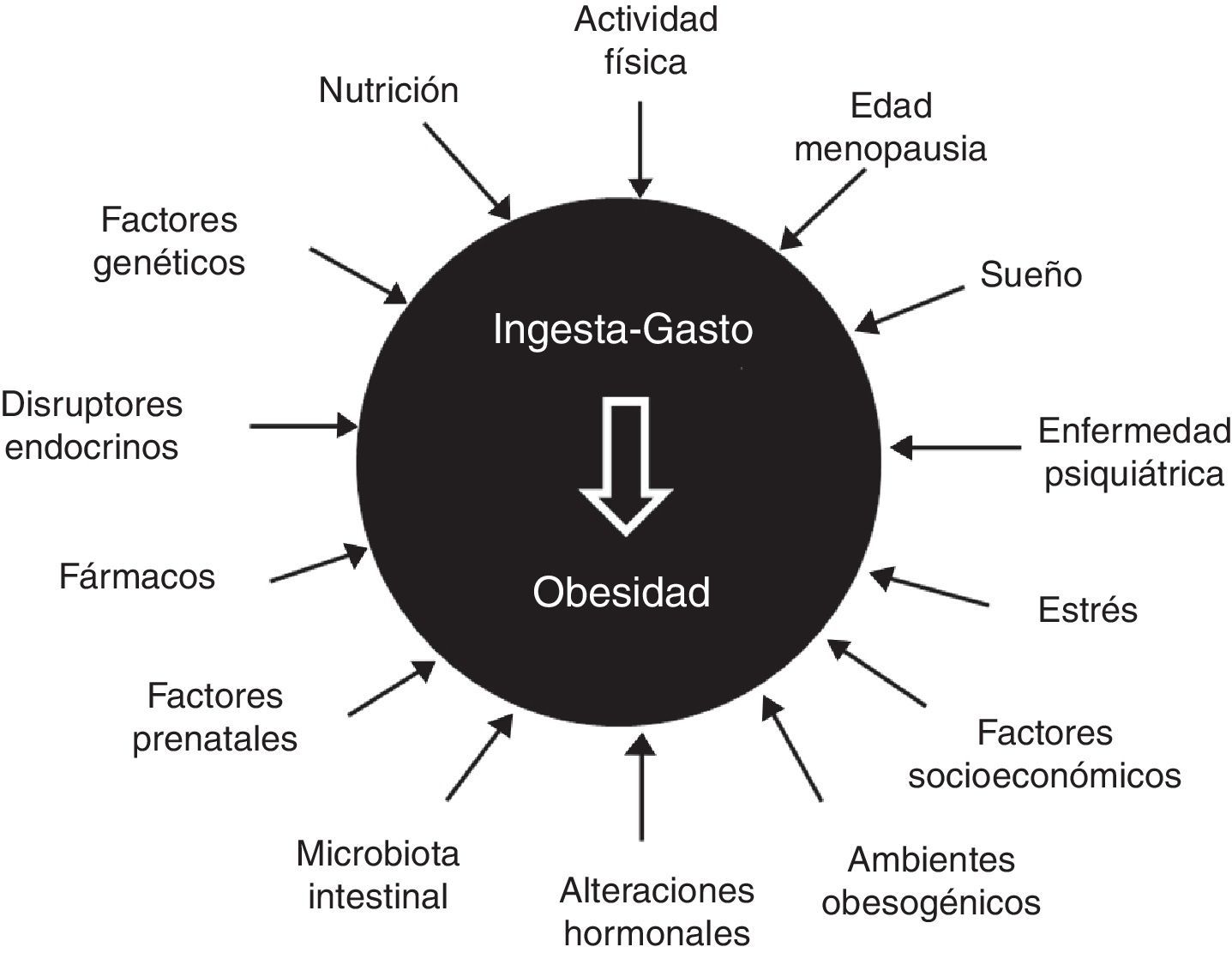
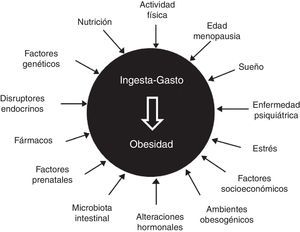
Etiopatogenia: elementos clásicos y nuevos protagonistasEntre los elementos clásicos encontramos la edad (sarcopenia y mayor masa grasa en mayores de 65 años), el sexo (declive de hormonas anabólicas y estrógenos tras la menopausia), la genética (múltiples variantes génicas implicadas, pero con influencia aislada), el sedentarismo, el comportamiento alimentario (interacción entre factores biológicos y emocionales), determinados fármacos (antidiabéticos, anticonceptivos, antihistamínicos y psicotropos), la disfunción hipotálamo-hipofisaria y algunas enfermedades endocrinas2–5 (fig. 1).
Remarcando la complejidad de la enfermedad, también participan en su desarrollo la cronodisrupción (desfase horario, cambios del ciclo sueño-vigilia y privación de sueño), la epigenética y programación fetal (desnutrición y sobrealimentación materna, incluso en el periodo preconcepcional), la enfermedad psiquiátrica (independientemente del tratamiento), el estrés (tanto crónico como incontrolado), la microbiota intestinal (predominio de firmicutes sobre bacteroidetes, una microbiota poco diversa), los disruptores endocrinos (bisfenol A, ftalatos, pesticidas e insecticidas), el patrón alimentario (exceso de grasas y azúcares refinados, consumo insuficiente de frutas y verduras), un estatus socioeconómico desfavorecido y un ambiente obesogénico (dispersión urbana, disponibilidad de comida…)6–9.
¿Cómo y cuándo se diagnostica?La obesidad se define por un porcentaje de masa grasa (MG) superior al 25% en hombres y al 33% en mujeres. Cuando no podemos medir la MG utilizamos el IMC (obesidad leve o clase i [30-34,9kg/m2], moderada o clase ii [35-39,9kg/m2] y grave, mórbida o clase iii [≥40kg/m2]), o el perímetro de cintura (PC) (obesidad abdominal [≥102cm en hombres, ≥88cm en mujeres; en bipedestación y sobre la cresta ilíaca]). El IMC no informa de la distribución de la grasa corporal, no diferencia entre masa magra (MM) y MG, y es un mal indicador en sujetos de baja estatura, edad avanzada, musculados, con retención hidrosalina o gestantes10. No se considera útil medir el PC cuando el IMC≥35kg/m2.
La SEEDO promueve el uso de clasificaciones de obesidad que unen descriptores antropométricos y clínicos11, así como fórmulas matemáticas desarrolladas en población española para estimar el porcentaje de MG (Clínica Universidad de Navarra-Body Adiposity Estimator)12.
Epidemiología en EspañaSegún el IMC la prevalencia es del 21,6% (22,8% varones, 20,5% mujeres), aumentando con la edad, y siendo mayor en mujeres a partir de los 50 años; mayor en el Principado de Asturias (25,7%) y menor en Islas Baleares (10,5%)13. Según el PC la obesidad abdominal es del 36%, incrementándose hasta el 62% en mayores de 65 años14.
¡Adelante con la tecnología!El análisis de la composición corporal debe incorporarse al diagnóstico, evaluación clínica y seguimiento de la obesidad. La bioimpedancia eléctrica es sencilla y no invasiva, estima la masa libre de grasa e indirectamente la grasa corporal total; no hay suficiente validación en IMC>35kg/m2. La densitometría de rayos X de doble fotón es la técnica de referencia para evaluar la grasa corporal total y la distribución de la grasa regional15. Tanto la tomografía axial computarizada como la resonancia magnética nuclear son técnicas de referencia para estimar el área de grasa visceral y subcutánea a nivel de L4-L5, e intrahepática a nivel de D12-L1.
Comorbilidades clásicas ¿qué hay de nuevo?La alta prevalencia del síndrome metabólico en la obesidad sugiere que sus distintos componentes comparten la lipotoxicidad como mecanismo etiopatogénico. La hipertensión arterial (HTA) es un 25-40% más frecuente en el obeso que en la población general, implicando en su desarrollo la mayor activación simpática y del sistema renina-angiotensina-aldosterona. La obesidad es responsable del 44% de la carga de diabetes mellitus tipo 2 (DM2), donde la prevalencia de obesidad es del doble que en la población general.
Obesidad y nuevas comorbilidadesLa obesidad es causa prevenible de cáncer de colon y recto, de mama en mujeres posmenopáusicas, de endometrio, riñón, esófago y páncreas16. Es el principal factor de riesgo para el síndrome de apnea hipoapnea del sueño. Incrementa un 25% la posibilidad de sufrir trastornos del estado de ánimo y ansiedad. La prevalencia de la enfermedad hepática no alcohólica por depósito de grasa alcanza el 100% en sujetos con obesidad mórbida17. Además, se asocia a artrosis de cadera y rodilla, pero también de articulaciones no de carga como las manos.
Beneficios de la pérdida ponderalJunto a cambios en el estilo de vida, perder un 5-10% del peso reduce hasta un 1,0% la HbA1c y las necesidades farmacológicas para la diabetes, así como la presión arterial sistólica y diastólica, y el uso de tratamiento antihipertensivo18. Incrementa la sensación de bienestar y la capacidad funcional. Pérdidas moderadas, del 3-5%, ya producirán beneficios. Perder entre 2,5 y 5,5kg de peso tras 2 años reduce el riesgo de DM2 un 30-60%.
Tras cirugía bariátrica existe una reducción de eventos cardiovasculares mortales y no mortales, con resultados favorables en mortalidad global, diabetes, factores de riesgo cardiovascular, cáncer, síndrome de apnea hipoapnea del sueño, dolor articular y calidad de vida19.
El riesgo que confiere la obesidadLa tabla 1 describe los datos mínimos que deben constar en la historia clínica de un sujeto con obesidad. El sistema de clasificación de Edmonton utiliza 5 categorías, en función de la morbilidad y del perfil de riesgo de la enfermedad, siendo capaz de predecir el aumento de la mortalidad20. Si bien no existe ninguna obesidad saludable, definimos a un obeso metabólicamente sano cuando presenta solo una o ninguna de las anormalidades cardiometabólicas asociadas a la obesidad.
¿Qué datos mínimos, clínicos y de laboratorio, son necesarios para la correcta evaluación del paciente con obesidad?
| Peso (kg) y altura (cm) |
| Índice de masa corporal (kg/m2) y perímetro de cintura (cm) |
| Presión arterial sistólica y diastólica (mmHg) |
| Triglicéridos en ayunas (mg/dl o mmol/l) |
| Colesterol HDL y LDL (mg/dl o mmol/l) |
| Glucosa en ayunas (mg/dl o mmol/l) y HbA1c (% o mmol/mol). Cálculo de resistencia a la insulina (HOMA) |
| Niveles de hormona estimulante del tiroides (TSH) y de enzimas hepáticas (ALT y AST) |
| Proteína C reactiva ultrasensible |
| ¿Hay síntomas de apnea del sueño? |
| Enfermedad coronaria |
| ¿Alguna medicación que favorece la ganancia de peso? |
| ¿Hace actividad física con regularidad? |
| ¿Otros factores etiológicos? |
| ¿Otras comorbilidades? HTA, dislipidemia, alteraciones de la glucemia (prediabetes/diabetes), osteoartritis, colelitiasis, RGE, irregularidades menstruales, infertilidad, depresión y deterioro calidad de vida |
| ¿Alteraciones de la conducta alimentaria (picoteos, compulsiones, trastorno por atracón, bulimia nerviosa)? |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; HDL: high density lipoprotein; HOMA: homeostasis model assessment; HTA: hipertensión arterial; LDL: low density lipoprotein; RGE: reflujo gastroesofágico.
Cada 5kg/m2 de incremento en el IMC aumenta significativamente la mortalidad para DM2 (HR 2,16), enfermedad renal crónica (HR 1,59), cardiopatía isquémica (HR 1,39), accidente cerebrovascular (HR 1,39), enfermedad respiratoria (HR 1,20) y cáncer (HR 1,10)21.
Ganancias modestas (≥5kg) tras los 18 años en mujeres (tras los 20 años en varones) aumentan el riesgo de enfermedades del corazón y DM2, independientemente del IMC inicial.
En los obesos de mayor edad la comorbilidad es más prevalente y grave, si bien el IMC se asocia con una mortalidad relativa más baja22.
Niño obeso, ¿adulto obeso?En la infancia el diagnóstico se establece según percentiles de IMC. Entre los 6 y 9 años tiene una prevalencia en España del 18,3% (en Europa ocupa el segundo lugar en varones y el tercero en chicas)23. La prevalencia de comorbilidades es menor que en el adulto, y sí, se proyecta a mayor edad, con momentos críticos en su desarrollo: el primer año de vida, el periodo entre los 4-6 años y la adolescencia24. El tratamiento se sustenta sobre 3 pilares: reorganizar los hábitos alimentarios, potenciar la actividad física y motivar al niño, con ayuda del entorno familiar y social.
Plan de alimentaciónPrevención y tratamiento de la obesidad deben integrar la consecución y mantenimiento de un estilo de vida saludable (alimentación, ejercicio, determinantes sociales, geopolíticos y ambientales). Incluye modificaciones cuantitativas (reducir raciones y aporte energético) y cualitativas (variar la proporción de diferentes nutrientes).
Un patrón saludable incluye un mayor consumo de verduras y frutas, seguido, aunque con menor grado de evidencia, de cereales integrales, lácteos bajos en grasa, pescado, legumbres y frutos secos. Disminuir la ingesta de carnes, incluyendo carnes procesadas y alimentos azucarados, también es característico de este patrón25.
La dieta mediterránea «hipocalórica» es el modelo que respalda la SEEDO, por representar mejor este enfoque equilibrado y saludable, con baja ingesta de ácidos grasos saturados, trans y azúcares añadidos, y un alto consumo de fibra vegetal y ácidos grasos monoinsaturados. Sus beneficios sobre la salud, incluida la mortalidad, están claramente establecidos26.
En relación con las dietas modificadas en macronutrientes, no hay estudios que permitan establecer sus ventajas. Ello, junto a su generalización, la ausencia de control médico estricto y la presencia de intereses comerciales hace que su uso no sea recomendado por la SEEDO. El uso de alimentos funcionales tampoco está sustentado por evidencias científicas.
Los peligros de una dieta inadecuada incluyen desnutrición o déficit de micronutrientes, empeorar el riesgo cardiovascular, favorecer trastornos de la conducta alimentaria, trasmitir conceptos nutricionales erróneos o fomentar el sentimiento de frustración.
La SEEDO se posiciona en contra de cualquier modelo de dieta sin aval científico. Es fundamental insistir en la necesidad de una alimentación variada, saludable y equilibrada en el contexto de la dieta mediterránea y en la práctica de ejercicio físico regular.
Actividad física: no todo es lo mismoLa actividad física (AF) representa el movimiento muscular cotidiano. El ejercicio físico (EF) es la AF realizada de forma estructurada, planeada y repetitiva. La actividad deportiva es el EF según unas normas, generalmente con fines competitivos. La forma física es el conjunto de beneficios obtenidos tras realizar EF.
La AF se mide mediante la unidad metabólica en reposo (MET), que corresponde a 3,5ml O2/kg/min, consumo mínimo de oxígeno para mantener las constantes vitales. Leer, conducir, trabajar sentado y las labores del hogar gastan entre 1 y 3 MET. La AF moderada (andar rápido, ciclismo tranquilo) se realiza entre 3 y 6 MET y la AF intensa (correr, saltar, aerobic) a partir de los 6 MET.
La pérdida ponderal realizando solo EF es clínicamente irrelevante, si bien existe gran variabilidad individual. Sin embargo, un programa de EF es importante, casi imprescindible, para dificultar la recuperación del peso perdido27. La mejora psicológica que aporta el ejercicio contribuye a reducir la ingesta energética de causa emocional, siendo más útil en personas con hiperfagia de estrés.
¿Cómo prescribir un programa de ejercicio físico?Se recomienda un mínimo de 30′ diarios de ejercicio de intensidad moderada o alta, 5 o más días a la semana (150′/semana; 300′/semana para prevenir la ganancia ponderal) y limitar la inactividad física28.
Combinar EF aeróbico (caminar, trotar, bailar, esquiar, pedalear, etc.) y anaeróbico obtiene mejores resultados que realizados de forma aislada29. Por su efecto sobre la masa muscular el ejercicio anaeróbico está especialmente indicado en personas mayores.
La prescripción debe ser personalizada, considerando preferencias y habilidades de cada persona, condición física, situación cardiorrespiratoria y ortopédica, medicación y discapacidades (tabla 2). Al considerar los efectos adversos, considerar la sobrecarga en articulaciones de carga y el compromiso respiratorio.
Consejos para iniciar la prescripción de un programa de ejercicio físico en la práctica clínica habitual
| Consejo 1 | Medir el nivel de actividad/inactividad. Para ello podemos utilizar un podómetro, según el cual clasificaremos al sujeto obeso en sedentario (<5.000 pasos/día), activo moderado (5.000-10.000 pasos/día), o activo saludable (>10.000 pasos al día). Otra alternativa es la versión corta del Cuestionario Internacional de Actividad Física (IPAQ), validado en castellano, que clasifica el nivel de actividad física en bajo (no realiza), moderado o intenso |
| Consejo 2 | Establecer como objetivo cambiar e incrementar el nivel de actividad, según la situación de cada persona |
| Consejo 3 | Realizar un mínimo de 30′ diarios de ejercicio de moderada a alta intensidad 5 o más días a la semana (150′/semana), pudiendo concentrar todo el ejercicio semanal en solo 2 sesiones. Elegir cualquier actividad que sea agradable, aceptada por el paciente y fácil de realizar. Pueden ser actividades cotidianas (como andar o ir en bicicleta), ejercicios programados supervisados (por ejemplo, clases en gimnasios), u otras actividades como nadar, subir escaleras andando, etc. |
| Consejo 4 | Aconsejable realizar calentamiento previo, que incluya el movimiento articular, durante unos 10min, para evitar lesiones musculares |
| Consejo 5 | Indicar frecuencia e intensidad siendo lo más flexible posible, utilizando ambas variables para conseguir el mismo fin. El aumento de intensidad de la actividad aporta mejoras en la forma física. Una modalidad de entrenamiento de alta intensidad y corta duración es el High Intensive Interval Training, que consigue mejoras a nivel cardiorespiratorio |
| Consejo 6 | Contactar con algún amigo o hacerlo en grupo. Utilizar música para marcar el ritmo |
| Consejo 7 | Mantener un nivel de hidratación adecuado, ingiriendo en total alrededor de 1,5l de agua antes, durante y después del ejercicio. Evitar ingestas de agua superiores a 200ml/15min (tasa máxima de absorción por parte del intestino), lo que genera molestias intestinales (típico dolor del costado) |
| Consejo 8 | Llevar ropa y calzado adecuado hace el ejercicio más agradable y evita lesiones |
| Consejo 9 | Tras el ejercicio dejar unos 5min de enfriamiento (por ejemplo caminar lento), lo que facilita la desaparición del lactato muscular |
Utilizaremos fármacos en el sujeto con IMC>30kg/m2 o >27kg/m2 asociado a comorbilidades mayores, cuando tras 3-6 meses en un programa estructurado no pierda >5% del peso inicial. Si este es bien tolerado y la pérdida ponderal supera el 5% del peso inicial el tratamiento debe continuarse de forma crónica mientras persista la indicación.
Tras orlistat la European Medicines Agency aprobó en 2015 2 nuevos fármacos: liraglutida 3,0mg (Saxenda®) y la combinación de bupropión (360mg) con naltrexona (16 o 32mg) (Mysimba®). El primero es agonista del receptor de GLP1, de administración diaria y subcutánea. Tras 56 semanas consigue pérdidas del peso inicial de 8,0±6,7% (8,4±7,3kg)30. Bupropión/naltrexona se administra por vía oral, consiguiendo pérdidas de peso del 5,4-8,1%, pudiendo ser útil en pacientes con sintomatología depresiva31. Como efectos secundarios las náuseas-vómitos son los más destacados con liraglutida; las cefaleas, la sequedad de boca, las náuseas y los mareos con bupropión-naltrexona. Ambas están contraindicadas en el embarazo. Los efectos secundarios son transitorios y no suponen una causa principal de abandono.
Liraglutida contribuye a reducir la presión arterial, mejorar los parámetros de riesgo cardiovascular y disminuye la mortalidad cardiovascular, siendo de elección en pacientes con DM2 o prediabetes32. Bupropión/naltrexona mejora la presión arterial y el perfil lipídico.
Prevención de la obesidadEl objetivo es disminuir el desarrollo de sobrepeso y obesidad en individuos con peso normal y sobrepeso, respectivamente, impidiendo la reganancia ponderal. Recomendamos identificar y actuar sobre los grupos de mayor riesgo (tabla 3)33.
Grupos de riesgo que deben identificarse y en los que realizar una prevención selectiva destinada a evitar la ganancia ponderal
| Sujetos con sobrepeso |
| Distribución central de la grasa corporal |
| Personas obesas que han perdido peso |
| Cambios cíclicos de peso |
| Enfermedades que predispongan a obesidad (genéticas, traumatológicas, endocrinas, etc.) |
| Pacientes sometidos a determinados tratamientos (corticoides, antihistamínicos, ansiolíticos) |
| Predisposición familiar a la obesidad y al sedentarismo |
| Factores de riesgo ambiental (bajo nivel sociocultural, falta de disponibilidad de frutas y verduras) |
| Hábitos nutricionales incorrectos (aumento de ingesta calórica y grasa, de alimentos muy calóricos y bebidas azucaradas, etc.) |
| Períodos de la vida críticos para la obesidad (gestación, de los 5 a 7 años, la adolescencia y la menopausia) |
| Antiguos fumadores |
| Sujetos altamente motivados para evitar el aumento de peso |
Debe conseguirse la implicación de la industria alimentaria (calidad nutricional y etiquetado), medios de comunicación (información veraz y contrastada), poder legislativo y autoridades (medidas reguladoras y coercitivas sobre la industria, incentivos económicos al consumo de ciertos alimentos), administraciones locales (urbanismo), centros educativos (comedores escolares, limitar máquinas expendedoras de bebidas azucaradas) y de trabajo (prescindir de ascensores y medios mecánicos, disponer de áreas de esparcimiento) y sociedades científicas. Estas deben liderar la lucha contra la obesidad, alertar sobre sus consecuencias y estimular las estrategias de prevención.
Tratamiento de la «diabesidad», ¿hay algo nuevo?La reducción ponderal es el primer escalón, y debe estar presente en todas las fases del tratamiento junto con el ejercicio34. El momento del diagnóstico es crítico para prescribir la pérdida ponderal.
El tratamiento farmacológico de la diabetes está condicionado por la ganancia ponderal asociada con sulfonilureas, tiazolidinendionas e insulina. Sin embargo, los agonistas del receptor de GLP1 asocian reducciones ponderales de 2,9kg comparado con placebo, antidiabéticos orales o insulina35. De forma similar, la pérdida ponderal con los inhibidores del SGLT2 se sitúa entre 1,8-2,3kg versus placebo36.
La remisión de la DM2 tras la cirugía gastrointestinal alcanza el 72% a los 2 años, con una tasa de remisión del 30,4% a los 15 años37. Se ha descrito también una reducción en la incidencia de complicaciones micro y macrovasculares, y consigue mejor control metabólico que el tratamiento convencional38,39. Entre los factores pronósticos asociados a remisión encontramos menor edad, menor tiempo de evolución, menor cifra de HbA1c, mayor concentración de péptido C, y no precisar tratamiento con insulina40. En nuestro país, la indicación en sujetos con IMC <35kg/m2 se limita a la participación en ensayos clínicos.
Cirugía bariátricaIndicada cuando el IMC≥40kg/m2 o en formas menos graves de obesidad (IMC 35-40kg/m2) con comorbilidades graves asociadas, en sujetos entre 18 y 60 años (individualizando adolescentes y edad avanzada). Para indicar cualquier técnica tendremos en cuenta el patrón alimentario, el IMC, las comorbilidades asociadas y el riesgo quirúrgico.
Las expectativas del paciente deben ser moduladas en el preoperatorio. El objetivo de la cirugía es conseguir una pérdida ponderal que mejore comorbilidades y calidad de vida. Si bien el by-pass gástrico en Y-de-Roux (BPGYR) se considera la técnica de referencia, la gastrectomía vertical está en auge por su simplicidad y efectividad41. Varios estudios han mostrado una pérdida ponderal inicial similar al BPGYR, aunque falta evaluar sus resultados a largo plazo42. El abordaje laparoscópico debe ser la norma, y la mortalidad intraoperatoria ser <0,5%. Las principales complicaciones se derivan de infecciones, hemorragias y fallos de sutura41.
Es preciso un seguimiento multidisciplinar a largo plazo, que asegure una pérdida ponderal adecuada y la adherencia a estilos de vida saludables; no hay que olvidar que la cirugía puede modificar la absorción y la biodisponibilidad de algunos fármacos43.
Si bien modificar el tracto gastrointestinal puede suponer una alternativa terapéutica para los componentes del síndrome metabólico, no puede recomendarse la cirugía metabólica de forma generalizada44.
Tras la cirugía deben utilizarse métodos anticonceptivos eficaces, independientes de la absorción intestinal, y evitar la gestación hasta transcurridos 12-18 meses45.
¿Dónde tratar al paciente obeso?Debe elaborarse un único protocolo de valoración y tratamiento de la obesidad, que refleje los criterios de derivación entre atención primaria y especializada, facilitando la comunicación entre profesionales. Actividades de formación continuada y el desarrollo coordinado de líneas de investigación deben ser una constante46.
FinanciaciónLa Sociedad Española para el Estudio de la Obesidad (SEEDO) ha contado con la colaboración no condicionada de Novo Nordisk y AstraZeneca.
Conflicto de interesesA. Lecube declara haber recibido honorarios como miembro de asesoría científica (Novo Nordisk, AstraZeneca, Janssen) y por conferencias patrocinadas (Novo Nordisk, AstraZeneca, Sanofi, Boehringher-Lilly). D. Bellido declara haber recibido honorarios como miembro de asesoría científica (Novo Nordisk, Boeringher-Lilly, Sanofi) y por conferencias patrocinadas (Novo Nordisk, Boeringher-Lilly, Sanofi, AstraZeneca, Janssen, Almirall, Novartis, MSD). P.P. García-Luna declara haber recibido honorarios como miembro de asesoría científica (Novo Nordisk, Vegenat) y por conferencias patrocinadas (Novo Nordisk, Sanofi, Nestlé, MSD, Janssen). F.F. Casanueva declara haber recibido becas de investigación, pago por consultorías o conferencias de Novo Nordisk, Lilly, Pfizer, AstraZeneca, Boheringer Manheim, Novartis y Janssen.
S. Monereo, M.A. Rubio, P. Martínez-de-Icaya, A. Martí, J. Salvador, L. Masmiquel, A. Goday, E. Lurbe, J.M. García-Almeida, F.J. Tinahones, E. Palacio, M. Gargallo, I. Bretón, S. Morales-Conde, A. Caixàs, E. Menéndez y M. Puig-Domingo no presentan ningún conflicto de intereses relacionado con su participación en este documento.
Comparten primer autor.
Este documento ha recibido la aprobación de las juntas directivas de la Sociedad Española de Endocrinología y Nutrición y de la Sociedad Española de Diabetes. La versión completa puede encontrase en la página Web de ambas sociedades (www.see.es;www.sediabetes.org), así como en la de la Sociedad Española para el Estudio de la Obesidad (www.seedo.es).