Conocer la prevalencia de citologías de categoría Bethesda III, su tasa de malignidad y analizar si existen diferencias en la segunda citología, tasa de malignidad, tipo de carcinoma y estadio TNM entre los grupos atipia citológica (AC) y atipia arquitectónica (AA).
Pacientes y métodoEstudio retrospectivo de 973 citologías. Las de categoría Bethesda III se agruparon en AC cuando se apreció atipia nuclear pero no diagnóstica o sospechosa de malignidad, y en AA cuando se trató de extensiones con poca celularidad, pero con un patrón predominantemente microfolicular y con coloide mínimo o ausente. Se correlacionaron los resultados citológicos y anatomopatológicos.
ResultadosHallamos 87 (8,9%) citologías de categoría Bethesda III (34 AC, 53 AA). Se realizó una segunda citología en 23 casos (16 AC, 7 AA) con resultado benigno en el 68,7% de los AC y 71,4% de los AA. Fueron intervenidos quirúrgicamente 64 casos (23 AC, 41 AA) y 15 (23,4%) resultaron malignos: 39,1% AC vs 14,6% AA (p=0,029). Hubo un falso negativo en la segunda citología. El carcinoma papilar variante folicular fue el más frecuente (60%). No hubo diferencias entre AC y AA respecto al tipo de neoplasia ni estadio TNM.
ConclusionesNuestra prevalencia de citologías de categoría Bethesda III está dentro de lo recomendado. La tasa de malignidad es significativamente superior en el grupo AC, pero sin diferencias en el resultado de la segunda citología, tipo de carcinoma hallado ni estadio TNM. La división de la categoría Bethesda III es útil para proporcionar una mejor estratificación del riesgo de malignidad.
To ascertain the prevalence of Bethesda category III cytologies and their malignancy rate, and to analyze differences in the second cytology, malignancy rate, type of carcinoma, and TNM stage between the cytological atypia (CA) and architectural atypia (AA) groups.
Patients and methodA retrospective study of 973 biopsies. Bethesda category III cytologies were classified as CA when nuclear atypia was seen but they were not diagnostic or suspicious of malignancy, and as AA when smears had few cells but had a predominantly microfollicular pattern and minimal or absent colloid. The cytological and pathological results were correlated.
ResultsThere were 87 (8.9%) Bethesda category III cytologies (34 CC, 53 AA). Second cytologies were performed in 23 patients (16 with CA, 7 with AA), and a benign result was found in 68.7% of CA and 71.4% of the AA group. Sixty-four patients (23 CA, 41 AA) underwent surgery and 15 of these (23.4%) had a malignant disease: 39.1% CA vs 14.6% AA (P=.029). There was a false negative result in the CA group. The follicular variant of papillary thyroid carcinoma was the most common malignancy (60%). There were no differences in type of carcinoma or TNM stage between CA and AA patients.
ConclusionsThe reported prevalence of Bethesda category III cytologies was as expected. The malignancy rate was significantly higher in the CA group, but there were no differences in the result of the second cytology, type of carcinoma found, or TNM stage. The division of Bethesda category III cytologies is useful to provide a better stratification of the risk of malignancy.
La categoría iii de la clasificación de Bethesda para el diagnóstico citológico de los nódulos tiroideos representa un grupo heterogéneo de lesiones1–3, por lo que su porcentaje de resultados en cada serie y la tasa de malignidad asociada reflejan la idiosincrasia del centro y de la población que atiende4–8. Es por ello recomendable, cuando no crucial, que cada centro recopile, analice y valore los resultados citológicos y anatomopatológicos de estos pacientes4-6,9.
Para aclarar la naturaleza de los nódulos tiroideos con citología de categoría Bethesda III se recomienda repetir la citología, realizar una biopsia por punción, llevar a cabo un estudio de biomarcadores moleculares o una intervención quirúrgica en función de los datos clínicos, ecográficos, citológicos, moleculares y preferencia del paciente1,3,7,9–11. Esta recomendación es así de ambigua porque por el momento no se ha conseguido identificar con precisión de forma preoperatoria a los pacientes con nódulos malignos entre aquellos que han tenido una citología de categoría Bethesda III. Ni los datos clínicos ni inmunohistoquímicos o el estudio de los biomarcadores moleculares han conseguido obtener resultados lo suficientemente discriminatorios como para implementarse en la clínica de forma rutinaria9,12. Incluso los datos ecográficos sugestivos de malignidad en nódulos tiroideos no seleccionados (microcalcificaciones, hipoecogenicidad, mayor altura que anchura y/o márgenes irregulares) no suelen resultar de utilidad para detectar la malignidad en los que tienen citología de categoría Bethesda III5,12–14.
En algunos estudios la división de la categoría Bethesda III en atipia citológica (AC) y atipia arquitectónica (AA) ha marcado diferencias relevantes en el riesgo de malignidad, siendo significativamente más elevada en la primera5,15–21. En el reciente metaanálisis de Valderrabano et al.21 el riesgo relativo de malignidad en los nódulos con categoría Bethesda III con AC fue 3,63 veces superior al del grupo AA. Ello ha dado lugar a inferir que el manejo de estos pacientes podría diferenciarse en función del grupo AC o AA al que pertenezcan2. No obstante, estas diferencias en la tasa de malignidad no han sido corroboradas por otros autores5; más aún, el consenso de Bethesda en 20173 insiste en que atipia de significado incierto (término vinculado a la atipia citológica) y proliferación folicular de significado incierto (término vinculado a la atipia arquitectónica) son sinónimos y no deben interpretarse de forma diferente. Por tanto, la división en grupos de la categoría Bethesda III no ha sido mayoritariamente aceptada y no ha llegado a implementarse en las guías clínicas como un factor independiente del riesgo de cáncer3,10.
Por otra parte, una tasa de malignidad de magnitud elevada (similar a la de otras categorías citológicas para las cuales se recomienda intervención quirúrgica) y claramente superior en el grupo AC respecto al grupo AA de la categoría Bethesda III, podría suponer implicaciones prácticas como que una segunda citología y/o el uso de biomarcadores moleculares (ambas opciones recomendadas actualmente para todos los casos de la categoría Betehsda III) solo serían útiles en el grupo AA, puesto que los casos del grupo AC, por su alta tasa de malignidad, serían preferentemente dirigidos a la exéresis quirúrgica9,20.
El objetivo del presente estudio consiste en conocer nuestra prevalencia de citologías de categoría Bethesda III obtenida del estudio de pacientes con bocio nodular y su tasa de malignidad asociada, así como analizar si existen diferencias en el resultado de la segunda citología, en la tasa de malignidad, en el tipo de carcinoma hallado y en su estadio TNM entre los grupos AC y AA.
Material y métodosSe trata de un estudio retrospectivo, descriptivo de la práctica clínica habitual, que incluye las 973 citologías de nódulos tiroideos efectuadas entre abril de 2011 (fecha en la que se implantó la clasificación de Bethesda en nuestro centro hospitalario) y noviembre de 2017. Las intervenciones quirúrgicas de algunos de estos pacientes se demoraron hasta abril de 2018. Para evitar sesgos se han excluido aquellos pacientes con el antecedente de tiroidectomía por cáncer de tiroides. El estudio ha sido revisado y aprobado por el Comité Ético de Investigación de la Fundació Assistencial Mútua Terrassa. Se ha obtenido el consentimiento informado de todos los pacientes.
La punción-aspiración de los nódulos tiroideos para el estudio citológico se realizó por el método de palpación entre abril de 2011 y mayo de 2016 (n=658), y por el método ecoguiado con valoración del material extraído in situ desde mayo de 2016 hasta noviembre de 2017 (n=315), siempre por un mismo operador (L.G.P.). Las citologías de categoría Bethesda III se agruparon en AA cuando la distinción entre neoplasia folicular y nódulo hiperplásico hipercelular no fue posible, tal como ocurre en las extensiones con poca celularidad, pero con un patrón predominantemente microfolicular y con coloide mínimo o ausente. Por otra parte, se agruparon en AC cuando se apreció atipia nuclear, pero no diagnóstica o sospechosa de malignidad, como ocurre ante la observación de ocasionales hendiduras nucleares o pseudoinclusiones nucleares, un patrón anormal de cromatina o superposición nuclear y celular19,20,22.
Quedó a criterio del paciente y de cada médico responsable la decisión de repetir la citología en 2-3 meses, el seguimiento clínico y ecográfico o la exéresis quirúrgica de la lesión. Los pacientes con un bocio multinodular compresivo o cuya segunda citología resultó de nuevo de categoría Bethesda III, sospechosa para neoplasia folicular (categoría Bethesda IV), sospechosa de malignidad (categoría Bethesda V) o benigna (categoría Bethesda II), pero con hallazgos ecográficos altamente sospechosos de malignidad fueron remitidos a cirugía10.
En los pacientes sometidos a cirugía se correlacionaron los nódulos con citología de categoría Bethesda III con el diagnóstico anatomopatológico correspondiente. Los carcinomas incidentales (incluidos microcarcinomas) distintos del nódulo con citología de categoría Bethesda III fueron analizados por separado. Los tumores del tipo neoplasia folicular tiroidea no invasiva con hallazgos nucleares de tipo papilar (NIFTP) se han computado únicamente entre marzo de 2017 (fecha en la que se empezaron a diagnosticar en nuestro centro) y abril de 2018 (fecha en la que se intervinieron quirúrgicamente los últimos pacientes incluidos en el estudio).
Las estimaciones de la tasa de malignidad en los nódulos tiroideos están sujetas a varios sesgos, ya que no todos los nódulos se someten a resección quirúrgica. Por lo tanto, determinamos el rango concebible de la tasa de malignidad. La estimación del límite inferior se calculó dividiendo el número de nódulos malignos confirmados entre el número total de nódulos con citología de categoría Bethesda III. La suposición de que todos los observados (no operados) fueran benignos está sujeto a un sesgo de verificación, y por lo tanto subestima la prevalencia de malignidad. La estimación del límite superior se calculó dividiendo el número de nódulos malignos confirmados entre el número de nódulos intervenidos quirúrgicamente. Como los nódulos seleccionados para cirugía pueden tener otros síntomas clínicos o características ecográficas que aumentan la sospecha, este número está sujeto al sesgo de selección, sobreestimando la prevalencia de malignidad. Asumimos que la verdadera prevalencia se encuentra entre el límite inferior y superior.
Se han recopilado datos sobre los pacientes (sexo y edad), el grupo citológico (AC o AA), si se efectuó una segunda citología y su resultado según la clasificación de Bethesda1 y el tipo histológico de cáncer y su estadio TNM (8.ª ed)23 en el momento del diagnóstico si lo hubiere.
Mediante el análisis estadístico se describen las medias±desviación estándar (DE) de las variables continuas, y el número de casos (n) y el porcentaje (%) de las variables cualitativas. La relación entre variables cualitativas se exploró con la prueba de Chi cuadrado, y cuando no se cumplían sus condiciones con el test exacto de Fisher. Las diferencias en las variables cuantitativas respecto a variables cualitativas con 2 grupos se analizaron con el test «t» de Student. Se consideró estadísticamente significativo un valor de p<0,05.
ResultadosDe las 973 citologías de nódulos tiroideos efectuadas en el período de estudio, 87 (8,9%) correspondieron a resultados de categoría Bethesda III hallados en 74 mujeres y 13 hombres, con una edad media de 52,9±14,9 años. De ellos 34 casos se atribuyeron al grupo AC (39,1%) y 53 casos (60,9%) al grupo AA.
Se llevó a cabo una segunda citología en 23 casos (26,4%), 16 del grupo AC y 7 del AA, consiguiendo un diagnóstico citológico distinto de Bethesda I y Bethesda III en el 75% del grupo AC y en el 85,7% del grupo AA (p=ns) (tabla 1). En la mayoría de los casos donde se repitió la citología se obtuvo un resultado de benignidad, tanto en el grupo AC (68,7%) como en el AA (71,4%) (p=ns).
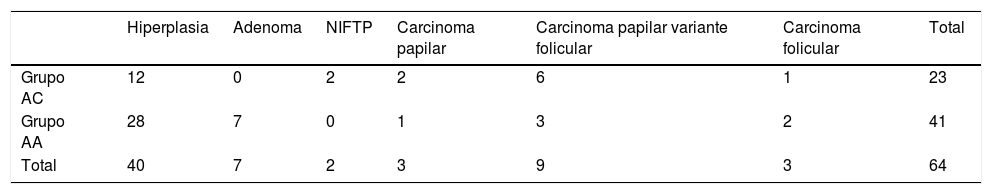
Fueron intervenidos quirúrgicamente 64 casos (73,6%). El estudio anatomopatológico resultó maligno en 15 casos, lo que supone una tasa de malignidad para la totalidad de los 87 pacientes del 17,2% y del 23,4% para los 64 pacientes intervenidos; en el caso del grupo AC esta tasa osciló entre el 26,5% y el 39,1% y en el grupo AA entre el 11,3% y el 14,6% (p=0,029 para los casos intervenidos y p=0,06 para los casos intervenidos y no intervenidos, al comparar los grupos AC y AA). La distribución según los grupos citológicos AC y AA se muestra en la tabla 2. Destaca un predominio del carcinoma papilar variante folicular (60% del total de cánceres).
Resultados del estudio histopatológico de los 64 casos intervenidos quirúrgicamente según el grupo citológico (p=ns)
| Hiperplasia | Adenoma | NIFTP | Carcinoma papilar | Carcinoma papilar variante folicular | Carcinoma folicular | Total | |
|---|---|---|---|---|---|---|---|
| Grupo AC | 12 | 0 | 2 | 2 | 6 | 1 | 23 |
| Grupo AA | 28 | 7 | 0 | 1 | 3 | 2 | 41 |
| Total | 40 | 7 | 2 | 3 | 9 | 3 | 64 |
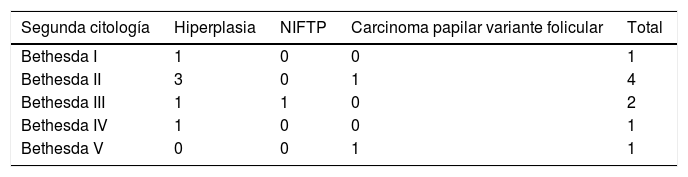
De los 64 pacientes intervenidos 9 (14%) tenían una segunda citología (tabla 3). Destaca un falso negativo perteneciente al grupo AC, el cual teniendo un resultado citológico benigno resultó ser un carcinoma papilar variante folicular.
No hubo diferencias significativas en cuanto al estadio TNM (8.ª ed.) de los tumores malignos encontrados según el grupo AC o AA (grupo AC: estadio i: 7/9 casos y estadio ii: 2/9 casos; grupo AA: estadio i: 5/6 casos y estadio ii: 1/6 casos).
DiscusiónEl estudio identifica un 8,9% de citologías de categoría Bethesda III, con un 39,1% de ellas AC y el 60,9% AA. La tasa de malignidad global estuvo entre el 17,2% y el 23,4%, siendo superior en el grupo AC (26,5-39,1%) respecto al grupo AA (11,3-14,6%). No se encontraron diferencias significativas entre los grupos AC y AA al repetir la citología, ni en cuanto al tipo de carcinoma hallado tras la intervención quirúrgica ni en el estadio TNM del mismo. Esta clasificación de la categoría Bethesda III demuestra ser de utilidad para estratificar el riesgo de malignidad y establecer un pronóstico diferenciado en cuanto al resultado histológico.
La categoría Bethesda III es heterogénea, pues incluye los aspirados de tiroides que no son suficientes para indicar malignidad o neoplasia, pero tienen características nucleares y arquitectónicas atípicas que limitan su inclusión en una categoría benigna1,3. En la mayoría de series de citologías de nódulos tiroideos la prevalencia de resultados de categoría Bethesda III oscila entre el 6% y el 20,5%5,6,20,24. El consenso de Bethesda 20173 considera que esta categoría es de último recurso, y no debería incluir más del 10% de las citologías de nódulos tiroideos. En el presente estudio la prevalencia de la categoría Bethesda III está dentro del rango recomendado.
Originalmente, el riesgo estimado de malignidad en la categoría Bethesda III estuvo entre el 5% y el 15% para el total de sujetos, y entre el 20% y el 25% en los intervenidos quirúrgicamente1. En series posteriores se comunicaron tasas de malignidad más elevadas y variables25. En aquellos pacientes remitidos a tratamiento quirúrgico la tasa de malignidad ha oscilado entre el 14% y el 48%, por lo cual se ha supuesto que en el total de los pacientes con una citología de categoría Bethesda III dicha tasa sería más baja, entre el 5% y el 43%1,2,4–6,10,19–21,25. Esta variabilidad puede estar en relación con la diferente presencia del grupo AC en las citologías de categoría Bethesda III de los nódulos analizados21. En nuestra serie la tasa de malignidad para la categoría Bethesda III está entre el 17% y el 23%, el cual es un valor relativamente bajo, y ello concuerda con una menor proporción de casos del grupo AC (39%) respecto al grupo AA (61%).
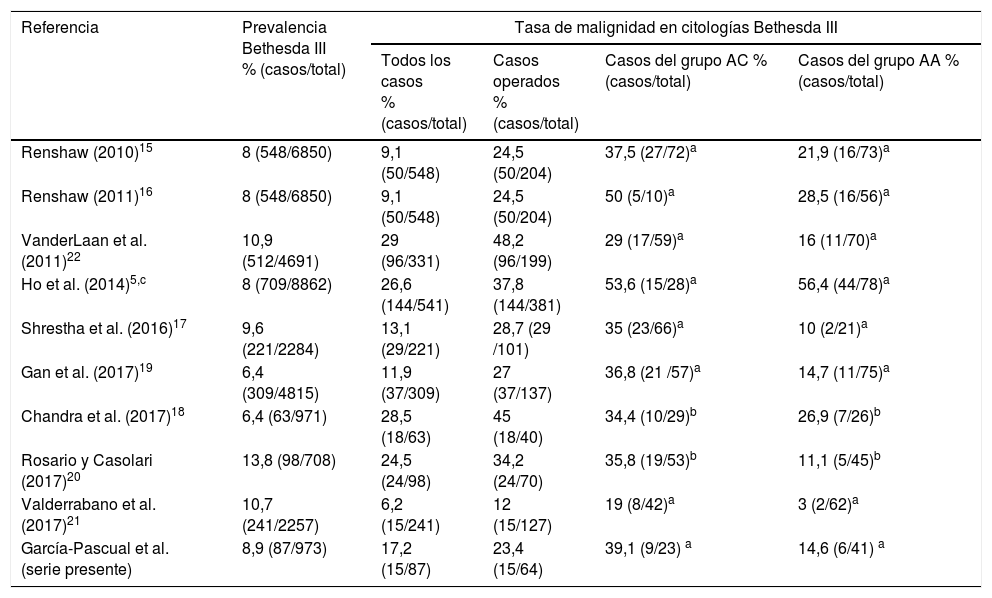
La estratificación de la categoría Bethesda III puede ser útil para reducir la heterogeneidad y conseguir una predicción más precisa de malignidad. Algunos estudios han encontrado tasas claramente superiores de malignidad en el grupo de nódulos con citología de categoría Bethesda III del grupo AC respecto al AA, sugiriendo considerar al paciente de forma diferenciada en ambos casos. Se han reportado tasas de malignidad entre el 24% y el 76% en los nódulos con AC, y entre el 7% y el 32% en los nódulos con AA2,15,17,19,20,22,24,26–29. El metaanálisis de Ahn et al.30 incluyo 15 estudios para comparar el riesgo de malignidad entre los grupos de la categoría III de Bethesda; la media del riesgo de malignidad en el grupo AC fue del 44,5% frente al 19,5% en el grupo AA. La razón del riesgo de malignidad entre el grupo AC y el AA fue de 2,64, destacando una sustancial heterogeneidad en ambos grupos. El metaanálisis de Valderrabano et al.21 incluyó 12 estudios con 1.452 nódulos con citología de categoría Bethesda III; el 47% tenían AC. El riesgo de malignidad en los nódulos con citología de categoría Bethesda III y AC fue 3,63 veces superior respecto a los que no tenían AC. Hubo una asociación directa entre la prevalencia de malignidad en los casos de citologías de categoría Bethesda III de los diferentes centros y la proporción de nódulos declarados con AC, lo cual puede explicar la variabilidad interinstitucional en la prevalencia de malignidad. Sin embargo, otros estudios, como el de Ho et al.5, con 541 pacientes con citología de categoría Bethesda III de los cuales 381 se intervinieron quirúrgicamente, no encontraron diferencias significativas en la tasa de malignidad al agrupar los casos en dichos grupos citológicos (53,6% vs 56,4%). En el presente estudio los casos intervenidos quirúrgicamente del grupo AC tuvieron una tasa de malignidad de aproximadamente 2,6 veces superior a la que presentaron los casos del grupo AA, situación que ha sido valorada clínicamente relevante por series de similares resultados (tabla 4).
Series de casos donde se analiza la tasa de malignidad de los grupos AC y AA de las citologías de categoría Bethesda III
| Referencia | Prevalencia Bethesda III % (casos/total) | Tasa de malignidad en citologías Bethesda III | |||
|---|---|---|---|---|---|
| Todos los casos % (casos/total) | Casos operados % (casos/total) | Casos del grupo AC % (casos/total) | Casos del grupo AA % (casos/total) | ||
| Renshaw (2010)15 | 8 (548/6850) | 9,1 (50/548) | 24,5 (50/204) | 37,5 (27/72)a | 21,9 (16/73)a |
| Renshaw (2011)16 | 8 (548/6850) | 9,1 (50/548) | 24,5 (50/204) | 50 (5/10)a | 28,5 (16/56)a |
| VanderLaan et al. (2011)22 | 10,9 (512/4691) | 29 (96/331) | 48,2 (96/199) | 29 (17/59)a | 16 (11/70)a |
| Ho et al. (2014)5,c | 8 (709/8862) | 26,6 (144/541) | 37,8 (144/381) | 53,6 (15/28)a | 56,4 (44/78)a |
| Shrestha et al. (2016)17 | 9,6 (221/2284) | 13,1 (29/221) | 28,7 (29 /101) | 35 (23/66)a | 10 (2/21)a |
| Gan et al. (2017)19 | 6,4 (309/4815) | 11,9 (37/309) | 27 (37/137) | 36,8 (21 /57)a | 14,7 (11/75)a |
| Chandra et al. (2017)18 | 6,4 (63/971) | 28,5 (18/63) | 45 (18/40) | 34,4 (10/29)b | 26,9 (7/26)b |
| Rosario y Casolari (2017)20 | 13,8 (98/708) | 24,5 (24/98) | 34,2 (24/70) | 35,8 (19/53)b | 11,1 (5/45)b |
| Valderrabano et al. (2017)21 | 10,7 (241/2257) | 6,2 (15/241) | 12 (15/127) | 19 (8/42)a | 3 (2/62)a |
| García-Pascual et al. (serie presente) | 8,9 (87/973) | 17,2 (15/87) | 23,4 (15/64) | 39,1 (9/23) a | 14,6 (6/41) a |
La repetición de la citología de los casos de categoría Bethesda III da lugar a un diagnóstico citológico distinto del Bethesda I y Bethesda III en una mayoría de casos, que oscila entre el 55% y el 80%, obteniendo en un 60% aproximadamente de dichas ocasiones un resultado de benignidad (categoría Bethesda II), el cual puede ser algo más frecuente en el grupo AA respecto al AC19. Ello justifica que sean pocos los pacientes intervenidos después de la segunda citología. En nuestro estudio la citología se repitió en pocos casos (26,4%) debido a que la mayoría de los pacientes se seleccionaron para tratamiento quirúrgico, como ocurre en otras series donde se refleja la práctica habitual5,6. Aun así, nuestros resultados encajan en este perfil, al conseguir un 78,2% de diagnósticos distintos de la categoría Bethesda I y Bethesda III tras la segunda citología, siendo un 69,5% de ellos benignos, aunque sin diferencias significativas entre los grupos AC y AA. Solo hemos reconocido un falso negativo citológico, perteneciente al grupo AC, pero dado el pequeño número de pacientes con una segunda citología benigna sometidos a intervención quirúrgica (4 casos), pensamos que es aventurado extraer conclusiones sobre este dato.
Aunque la tasa de benignidad después de la segunda citología ha sido elevada en nuestro estudio, tanto en el grupo AC como en el AA, el hecho de tener una elevada tasa de malignidad en el grupo AC, de magnitud similar a la reportada en la categoría iv de Bethesda, donde se considera suficiente para fundamentar una intervención quirúrgica1,3, no nos permite concluir que la repetición de la citología sea oportuna para los casos con citología de categoría Bethesda III grupo AC. Por el contrario, la tasa de malignidad del grupo AA es incluso menor a la reportada por el documento de Bethesda para los resultados de categoría Bethesda III1,3, donde no hay una recomendación tan expresa de intervención quirúrgica, y dado el elevado porcentaje de benignidad al repetir la citología en este grupo (71,4%), estaríamos de acuerdo con otros autores en reservar la segunda citología para los casos con citología de categoría Bethesda III grupo AA19.
De forma similar a nuestro estudio, en donde la neoplasia maligna más frecuente hallada entre los nódulos con citología de categoría Bethesda III ha sido el carcinoma papilar variante folicular, con una prevalencia del 60%, en la mayoría de los de estudios que analizan estos nódulos se describe una destacada presencia de esta neoplasia, si bien con un rango heterogéneo de prevalencia, acorde a este tipo de lesiones (Valderrabano et al.21: 54%; Walts et al.31: 42%; Chandra et al.18: 44%; Gan et al.19: 20%, de los cuales 23,8% en el grupo AC y 11,1% en el grupo AA; VanderLaan et al.22: 76%; Rosario et al.20: 34,5%, de los cuales 27,2% en el grupo AC y 57,1% en el grupo AA). La consideración de las lesiones tipo NIFTP antes del año 2017 como carcinomas papilares variante folicular ha podido contribuir a esta elevada prevalencia. Si extrapolamos nuestros resultados del período comprendido entre marzo de 2017 y abril de 2018 al total de la serie, habríamos podido encontrar 5 casos de NIFTP, con lo cual la prevalencia de carcinoma papilar variante folicular se habría reducido al 50%. Ningún estudio ha comunicado diferencias en cuanto al estadio TNM de la neoplasia entre los grupos AC y AA, tal y como ha ocurrido en nuestra serie.
Existen algunas limitaciones en este estudio. Primero, fue un estudio retrospectivo con un número relativamente bajo de casos que puede haber influido en la ausencia de detección de diferencias estadísticamente significativas al comparar variables. Segundo, no se evaluaron específicamente las diferencias interobservador y la variabilidad intraobservador en el diagnóstico citológico ni histopatológico. No obstante, todas las muestras fueron interpretadas por patólogos experimentados del mismo servicio.
La categoría de diagnóstico Bethesda III, tal como se define actualmente, es heterogénea con respecto a los criterios de inclusión y al riesgo estimado de malignidad para diferentes lesiones. Nuestro estudio apoya la noción de que el grupo AC tiene un riesgo significativamente superior de malignidad que el grupo AA. Aunque la práctica de usar calificadores de diagnóstico de Bethesda III no está recomendada por el consenso de Bethesda, nuestros resultados avalan su tipificación en grupos con el objetivo de proporcionar una mejor estratificación del riesgo de malignidad y manejo clínico de los pacientes con estos aspirados.
AutoríaCada autor ha contribuido materialmente en la investigación y preparación del artículo. En concreto:
- -
Luis García Pascual: idea y diseño del estudio, adquisición y procesamiento de datos, interpretación de resultados, escritura del borrador y aprobación de la versión final.
- -
Maria Lluïsa Suralles: adquisición y análisis de datos, revisión crítica del borrador y aprobación de la versión final.
- -
Xavier Morluis: adquisición y análisis de datos, revisión crítica del borrador y aprobación de la versión final.
- -
Laia Garcia Cano: adquisición y análisis de datos, revisión crítica del borrador y aprobación de la versión final.
- -
Clarisa González Mínguez: adquisición y análisis de datos, revisión crítica del borrador y aprobación de la versión final.
Ninguno.