En el hipotálamo existen poblaciones neuronales involucradas en la regulación de la ingesta, destacando la ghrelina como hormona orexígena (estimula el apetito). Después de los diferentes procedimientos de cirugía bariátrica se han observado cambios en los niveles plasmáticos de ghrelina, siendo los resultados de los estudios contradictorios. Existen muchas lagunas en cuanto al papel que desempeña la ghrelina en el proceso de pérdida de peso después de cirugía bariátrica.
Nuestro objetivo es describir el comportamiento de ghrelina en ayunas, comparando los cambios acontecidos en 2 técnicas quirúrgicas (bypass gástrico versus gastrectomía vertical) y su correlación con la pérdida ponderal.
Pacientes y métodoEstudio observacional de cohortes analíticas prospectivo, donde se incluyen 54 pacientes (27 por cada técnica quirúrgica) y un período de seguimiento de 12 meses. Se analizaron datos demográficos, datos antropométricos, comorbilidades, pérdida ponderal y evolución del comportamiento de ghrelina en ayunas.
ResultadosCon ambas técnicas quirúrgicas el comportamiento de ghrelina acilada fue similar, sin diferencias significativas entre bypass gástrico y gastrectomía vertical. Con ambos procedimientos se produce un ascenso de ghrelina acilada al 5.o día y caída posterior, para luego ir ascendiendo hasta alcanzar valores superiores a los preoperatorios a los 12 meses. Este aumento en los niveles de ghrelina no afecta a la pérdida ponderal, ya que al año de la cirugía con las 2 técnicas quirúrgicas se alcanza un 30% de pérdida de peso.
ConclusionesObservamos un incremento de los niveles de ghrelina acilada en ayunas al año de seguimiento con ambas técnicas quirúrgicas, cuando existe una pérdida ponderal del 30%.
Neuronal populations involved in the regulation of food intake, particularly the orexigenic (appetite-stimulating) hormone ghrelin, are found in the hypothalamus. Changes in plasma ghrelin levels have been observed following different bariatric surgery procedures, but the results from different studies are contradictory. Much remains unknown regarding the role of ghrelin in the weight loss process following bariatric surgery.
Our objective was to describe the behaviour of fasting ghrelin levels, comparing the changes occurring between 2 different surgical techniques (gastric bypass versus vertical sleeve gastrectomy) and their correlation with weight loss.
Patients and methodA prospective, observational, analytic cohort study of 54 patients (27 for each surgical technique) with a 12-month follow-up period. We analysed demographic data, anthropometric data, comorbidities, weight loss and evolution of fasting ghrelin.
ResultsThe behaviour of acylated ghrelin was similar with the 2 surgical techniques, with no significant differences between gastric bypass and vertical sleeve gastrectomy. With both procedures, there was an increase in acylated ghrelin on day 5 and a subsequent decrease, and levels then gradually increased to reach values at 12 months that were higher than those reported preoperatively. This increase in ghrelin levels did not affect weight loss, since one year post-surgery, 30% weight loss was achieved with both types of surgery.
ConclusionsWe observed an increase in fasting acylated ghrelin levels at one year of follow-up with both surgical techniques, with 30% weight loss.
Existen señales neurohormonales implicadas en la regulación homeostática, esenciales para comprender la patogénesis de los trastornos de la obesidad. El objetivo de dichas señales es conseguir/mantener un equilibrio energético, peso estable y la ingesta optima de nutrientes1.
En el hipotálamo existen 2 poblaciones neuronales involucradas en el control de la ingesta alimentaria2. La primera población es de neuronas que expresan neuropéptido Y y la proteína asociada a agouti, que estimulan la vía orexígena (aumentan el apetito), destacando en este grupo la ghrelina (producida fundamentalmente en el fundus gástrico y menor medida en otros órganos, intestino, páncreas, propio hipotálamo, etc..). Por otro lado, las neuronas que expresan propiomelanocortina y el trascrito regulado por cocaína-anfetamina estimulan la vía anorexígena (disminuyen el apetito); un ejemplo de hormonas que actúan en esta vía son: péptido Y (PYY) y glucagón like peptide-1 (GLP-1)3.
El gen de la ghrelina4 es un gen complejo, cuyo procesamiento da lugar a una amplia variedad de proteínas, con múltiples actividades biológicas: ghrelina acilada, ghrelina no acilada y obestatina. La ghrelina acilada es la que convencionalmente llamamos «ghrelina» y presenta una característica única que la diferencia de otros péptidos, clave para su actividad biológica, la adición por la enzima O-aciltransferasa de ghrelina de un grupo octanoil en la serina 3. Le confiere la capacidad de atravesar la barrera hematoencefálica y sus acciones están mediadas a través del subtipo 1a del receptor de secretagogos de la hormona del crecimiento (GHS-R). Tiene un amplio rango de efectos biológicos5: estimula la secreción de la hormona del crecimiento (GH), regula la ingesta de alimentos y el balance energético, disminuye la secreción de insulina, tiene efectos cardiovasculares y modula la proliferación celular. La ghrelina no acilada posee mayores concentraciones plasmáticas (70-90%), no se une al GHS-R 1a, no afecta a la secreción de GH y tiene un receptor que aún no se ha identificado.
El mecanismo de regulación de la secreción de ghrelina no se conoce con exactitud y la interpretación de las concentraciones de ghrelina es difícil, contrario a lo que se podría esperar, se encuentra disminuida en obesos y elevada en personas con índice de masa corporal (IMC) bajo, caquexia y anorexia nerviosa, sin por ello aumentar el hambre. Además de un papel de regulación a corto plazo, ghrelina participa en la regulación del peso a largo plazo. Los niveles plasmáticos de ghrelina están inversamente relacionados con el IMC, el nivel plasmático de ghrelina fluctúa de una manera compensatoria según las variaciones del peso corporal6.
Las modificaciones anatómicas derivadas de la cirugía bariátrica se han relacionado con cambios en la producción de diferentes hormonas. En la gastrectomía vertical (GV) se extirpa el fundus gástrico, produciendo una disminución drástica de la secreción de ghrelina7 y una aceleración del vaciamiento gástrico, y por lo tanto una elevación plasmática de la GPL-1 y del PYY8, ambos relacionados con la sensación de saciedad. Pero el mecanismo de la saciedad es mucho más complejo; existe un paso intermedio entre el estimulo digestivo y la respuesta del sistema nervioso central reflejada como sensación de saciedad. En esta vía neurohormonal están implicadas más de 100 hormonas y neuropéptidos, que son objeto actualmente de múltiples estudios científicos.
En el año 2002, Cummings et al.7 publicaron un estudio que ha sido referencia en la literatura posterior sobre los cambios en ghrelina en relación con la cirugía de la obesidad. La disminución de la concentración plasmática de ghrelina en respuesta a la administración oral de hidratos de carbono es bien conocida, pero no son tan abundantes los estudios que hayan medido la respuesta de la fracción acilada de ghrelina9. En un estudio transversal estos autores7 encontraron que el bypass gástrico (BP) se asociaba a una inhibición de los niveles de ghrelina en ayunas y una ausencia de oscilación en su concentración plasmática en relación con las comidas. Estudios posteriores no han corroborado esta observación, y de hecho, después del BP se han descrito cambios de la ghrelina en todas las direcciones10.
Los resultados entre los diferentes estudios son difíciles de comparar porque la mayoría no especifican qué fracción de ghrelina miden11,12 (total, no acilada o acilada); tampoco aportan datos sobre el procedimiento analítico ni el método de recolección. Predominan los trabajos que miden ghrelina después de la ingesta, siendo menos los estudios disponibles que observan la evolución de la ghrelina en ayunas9,13 y su relación con la pérdida ponderal.
Nuestro objetivo principal es describir el comportamiento de ghrelina acilada en ayunas, sin el estímulo del alimento, comparando los cambios acontecidos en 2 técnicas quirúrgicas (BP vs. GV). Como objetivo secundario analizaremos la pérdida ponderal y su correlación con ghrelina.
Material y métodoPacientesLos pacientes incluidos en el protocolo de estudio cumplen los criterios de inclusión y exclusión para la realización de un procedimiento de cirugía bariátrica según la Sociedad Española de Cirugía de la Obesidad (SECO)14,15. Se reclutaron 60 pacientes de forma consecutiva conforme se incluyeron en lista de espera quirúrgica y cumplían estos criterios. Finalmente solo 54 pacientes fueron incluidos para el análisis de los datos, 27 por cada técnica quirúrgica (BP vs. GV), el resto se excluyeron por pérdidas de muestra y errores de lectura de la misma.
Todos los pacientes fueron seguidos simultáneamente por los Servicios de Endocrinología y Cirugía General, informando de los riesgos y beneficios de cada procedimiento. Se les entregó un consentimiento informado por escrito según las normas del Comité de Ética de nuestro hospital, para las extracciones de sangre, congelación y almacenamiento posterior de los hemoderivados.
Las operaciones se realizan por vía laparoscópica y por el mismo equipo quirúrgico formado por 4 cirujanos bariátricos. La técnica del BP se lleva a cabo confeccionando un reservorio gástrico de 20-30ml, un asa alimentaria de 150cm y un asa biliopancreática de 100cm. La anastomosis gastroyeyunal se realiza con una endograpadora circular de 21mm, termino-lateral mecánica. Para la GV se confecciona una plastia gástrica con un tutor de 32Fr, iniciando la sección gástrica a 4-5cm del píloro y llegando hasta el ángulo de His, mediante endograpadora lineal roticulator.
Diseño del estudioEl estudio se realiza en el Servicio de Cirugía General del Complejo Hospitalario de Cartagena, en un período comprendido entre 2011-2013 y un período de seguimiento de 12 meses. Se trata de un estudio observacional de cohortes analíticas prospectivo.
Todos los pacientes incluidos en el estudio fueron sometidos a una evaluación completa antes de la intervención quirúrgica. Se realiza ecografía abdominal, tránsito esofagogástrico y endoscopia digestiva alta. Se incluyeron además de los datos demográficos, comorbilidades (hipertensión arterial, diabetes tipo 2, síndrome de apnea obstructiva del sueño y dislipidemias) y datos de seguimiento (porcentaje de sobrepeso perdido [PSP] y evolución de parámetros analíticos).
Las extracciones sanguíneas se llevan a cabo en el área de Consultas Externas y todos los pacientes cumplieron un ayuno de 12h. A cada paciente se le realizó una punción venosa y extracción de un tubo de sangre. Se trata de un tubo especial denominado BDTM P800 (2ml) que contiene aditivos específicos para la estabilización de distintos marcadores metabólicos plasmáticos. Contiene un spray seco EDTA-K2 como anticoagulante y un cocktail de inhibidores específicos de la dipeptidil peptidasa-IV. Debido a estas propiedades inhibidoras de proteasas, el uso de P800 está especialmente recomendado en ensayos de detección y cuantificación en plasma de ghrelina, permitiendo la protección y estabilización de estas hormonas. Este tubo tiene que mantenerse refrigerado a −2-4°C y, después de la extracción, su centrifugación se realizó en un plazo inferior a 72h, durante 10min a 3.500rpm. Se etiquetaron 2 tubos eppendorf por cada muestra de sangre, reflejando el número de historia clínica del paciente y momento de la extracción (preoperatorio y 5.o día, 1, 3, 6, 12 meses postoperatorios). Los eppendorf se almacenaron a −30°C.
HormonasPara el análisis de las muestras se utilizó el kit Human Metabolic Hormone Magnetic Bead, Panel 96 Well Plate Assay, MILLIPLEX® MAP Cat. # HMHMAG-34K.
MILLIPLEX® MAP es un panel metabólico humano diseñado para el estudio de biomarcadores, analíticamente validados e integrados en un solo panel. Permite investigar la expresión de múltiples analitos simultáneamente, con la ventaja de una mayor velocidad y sensibilidad. Se puede elegir cualquier combinación del panel que se oferta y diseñar un kit personalizado según las necesidades. En nuestro caso fue diseñado para poder determinar ghrelina acilada, realizando la determinación de cada analito por duplicado. También se determinaron GLP-1 activa y PYY total, que no están recogidas en este artículo y serán fruto de otro trabajo.
MILLIPLEX® MAP se basa en la tecnología Luminex ® xMAP ®, una tecnología rápida que es capaz de realizar una variedad de bioensayos (inmunoanálisis) en la superficie de perlas magnéticas fluorescentes codificadas, conocidas como MagPlex TM-C microspheres.
El análisis se produce cuando las microesferas pasan rápidamente a través de un láser y son cuantificadas, obteniendo múltiples resultados de cada muestra. Cada kit lleva adjuntos los rangos de control para el analito que se va a determinar, cuantificados en pg/ml.
En nuestro kit, el límite de detección inferior para ghrelina acilada fue 2pg/ml con un coeficiente de variación intraensayo del 2% e interensayo del 8%.
Parámetros antropométricosLos parámetros antropométricos evaluados de forma pre- y postoperatoria fueron:
- -
Talla (metros y centímetros)
- -
Peso (kilogramos)
- -
Peso ideal (kilogramos) según la fórmula Metropolitan Life (MetLife):
Peso ideal=(Talla(cm)−150)×0,75+50
- -
IMC o índice de Quetelec, calculado según la fórmula:
IMC=Peso/Talla2 (kg/m)
Para la evaluación evolutiva de los resultados de pérdida de peso se determino el PSP, considerándose exitosa la cirugía cuando alcanza un PSP>65%, y se determina con la siguiente fórmula:
PSP=(Peso inicial−peso actual/peso inicial−peso ideal)×100
Análisis estadísticoLos datos fueron analizados con el programa estadístico SPSS versión 20 para Windows (IBM, Estados Unidos). Los análisis fueron supervisados por la Unidad de Apoyo a la Investigación del Hospital Universitario de Santa Lucía, Cartagena.
Las variables cuantitativas se expresaron mediante media y desviación estándar o como mediana y rango intercuartílico, según lo apropiado. Aquellas variables categóricas se expresaron como frecuencia y porcentaje. La normalidad de las variables se estimó mediante un método gráfico (curvas P-P y Q-Q) y un test de contraste de hipótesis (Shapiro-Wilk).
Las comparaciones entre variables cuantitativas entre los grupos de comparación (BP vs. GV) se realizaron mediante el test de la t de Student/análisis de la varianza o mediante test de Mann-Whitney/Kruskal-Wallis, según lo apropiado. La comparación entre variables categóricas de grupos independientes (BP vs. GV) se realizaron mediante test de Chi2. Este análisis se realizó para cada punto de tiempo (preoperatorio, 5.o día, 1.er mes, 3.er mes, 6.o y 12.o mes). Para las variables cuantitativas se representó gráficamente la media y su intervalo de confianza al 95% a través del cálculo del error estándar de la media, para cada punto de tiempo. Para el análisis de datos apareados se utilizó el test de Friedman. Realizamos análisis de correlación con la prueba de Spearman para evaluar la relación entre ghrelina y el IMC. Se consideró una p<0,05 como estadísticamente significativa.
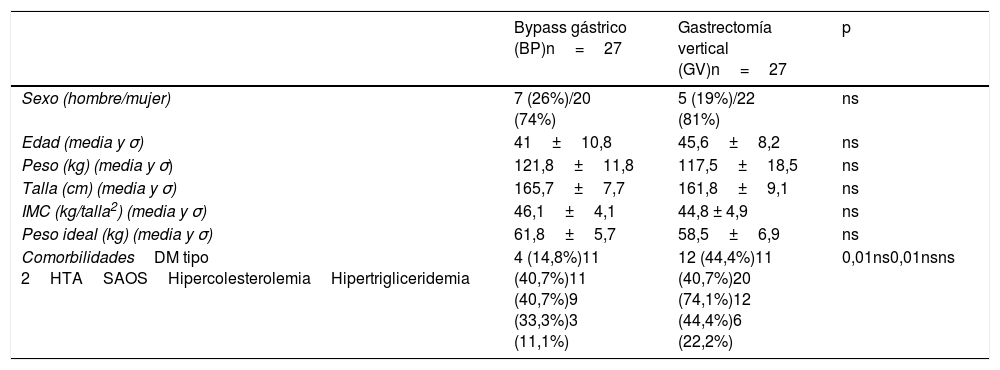
ResultadosCaracterísticas preoperatoriasLos grupos de estudio no presentaron diferencias preoperatorias en los datos demográficos. En cambio, en el grupo GV se observó mayor porcentaje de pacientes con diabetes mellitus tipo 2 y síndrome de apnea obstructiva del sueño, estadísticamente significativo con respecto al grupo BP (tabla 1).
Datos demográficos y comorbilidades precirugía
| Bypass gástrico (BP)n=27 | Gastrectomía vertical (GV)n=27 | p | |
|---|---|---|---|
| Sexo (hombre/mujer) | 7 (26%)/20 (74%) | 5 (19%)/22 (81%) | ns |
| Edad (media y σ) | 41±10,8 | 45,6±8,2 | ns |
| Peso (kg) (media y σ) | 121,8±11,8 | 117,5±18,5 | ns |
| Talla (cm) (media y σ) | 165,7±7,7 | 161,8±9,1 | ns |
| IMC (kg/talla2) (media y σ) | 46,1±4,1 | 44,8 ± 4,9 | ns |
| Peso ideal (kg) (media y σ) | 61,8±5,7 | 58,5±6,9 | ns |
| ComorbilidadesDM tipo 2HTASAOSHipercolesterolemiaHipertrigliceridemia | 4 (14,8%)11 (40,7%)11 (40,7%)9 (33,3%)3 (11,1%) | 12 (44,4%)11 (40,7%)20 (74,1%)12 (44,4%)6 (22,2%) | 0,01ns0,01nsns |
cm: centímetros; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal; kg: kilogramo; kg/m2: kilogramo/metro cuadrado; ns: no significativo; SAOS: síndrome de apnea obstructiva del sueño.
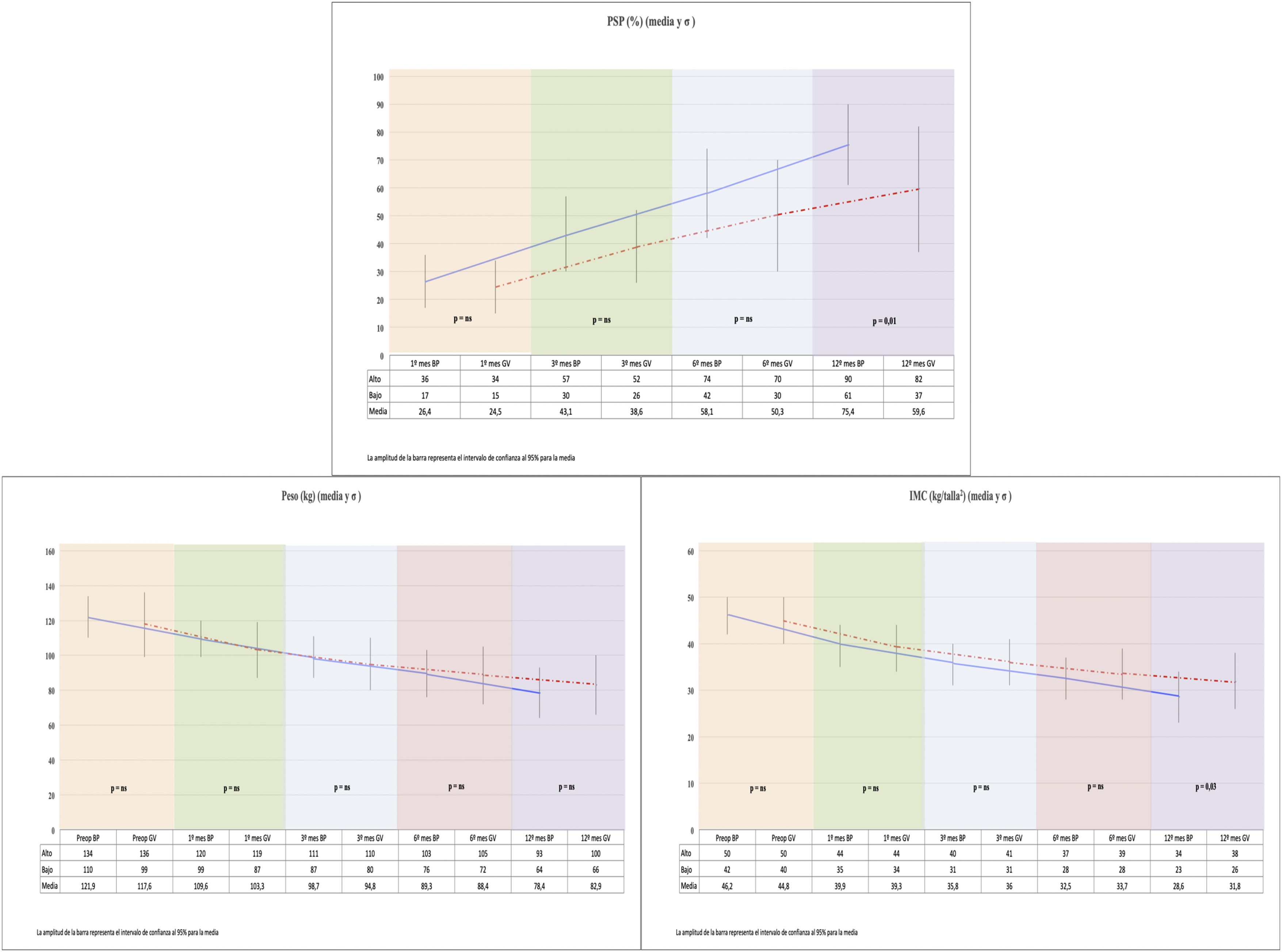
Si comparamos los 2 grupos, la disminución del IMC en el grupo BP fue mayor que en el grupo GV (p=0,038) al año de la cirugía (fig. 1).
Ambos procedimientos alcanzan una pérdida de peso considerable, pero el grupo BP presentó un PSP significativamente mayor que la del grupo GV a los 12 meses de la cirugía. El grupo GV no consigue alcanzar el 65% de PSP al año de seguimiento (fig. 1).
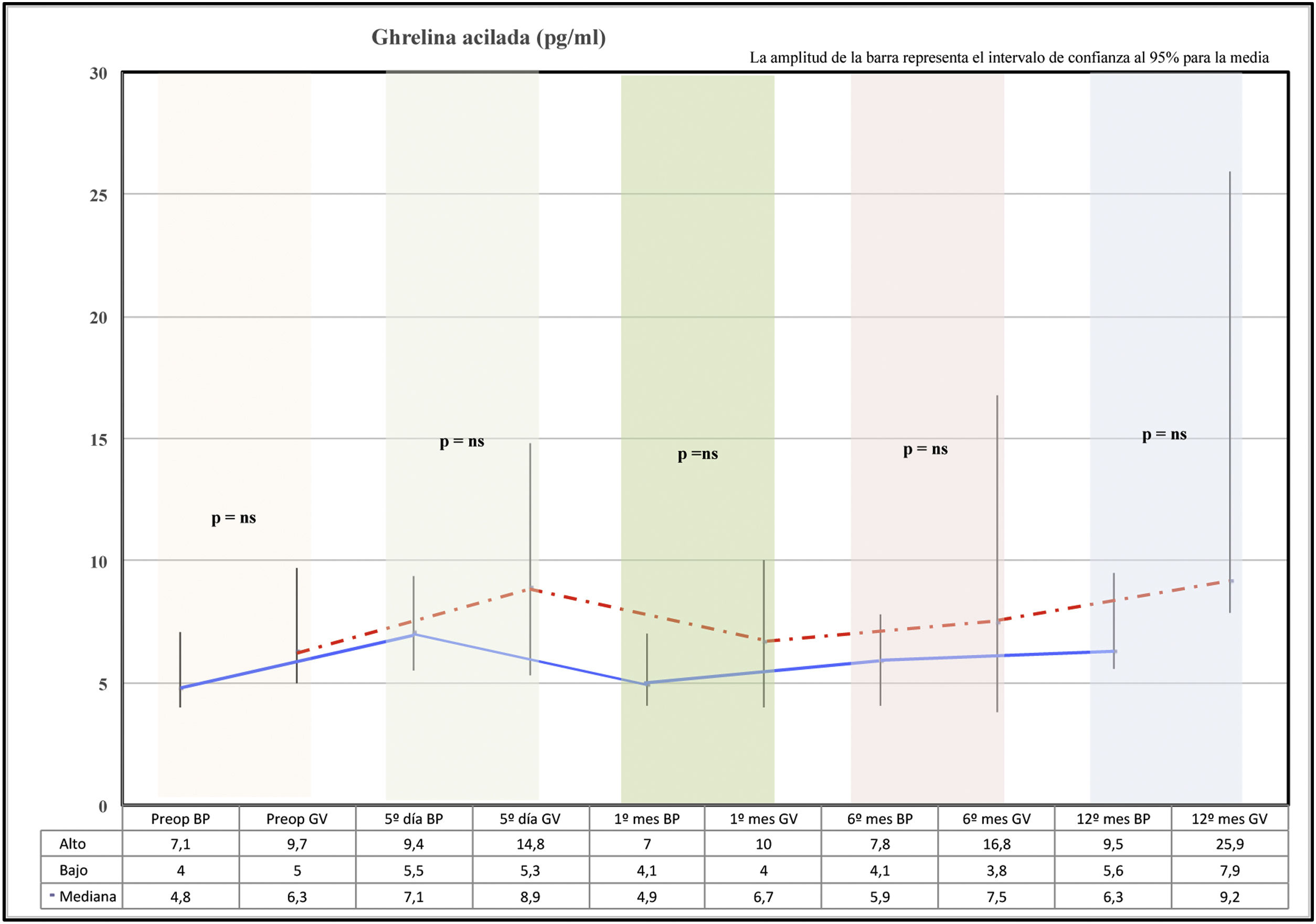
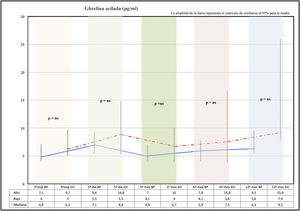
Comportamiento de ghrelina en ayunasCon los 2 procedimientos se produce un ascenso de ghrelina acilada al 5.o día de la cirugía. En el primer mes se observó una caída de la ghrelina con respecto al 5.o día postoperatorio en ambos grupos, para luego ir ascendiendo paulatinamente a lo largo de los meses hasta alcanzar valores superiores a los preoperatorios a los 12 meses.
La ghrelina acilada en la GV presenta valores más elevados a los 12 meses que el grupo BP, pero esta diferencia no fue significativa en el análisis estadístico (fig. 2).
Correlación ghrelina en ayunas e índice de masa corporal preoperatorio/12.o mesLa ghrelina acilada y el IMC medidos en el preoperatorio presentaron una relación lineal positiva (r=0,13; R2=0,00), no significativa (p=0,35). Es decir, no existe relación entre ghrelina y el IMC preoperatorio.
La ghrelina acilada y el IMC medidos a los 12 meses de la cirugía presentaron una relación lineal negativa (r=−0,01; R2=0,00), no significativa (p=0,92). Es decir, no existe asociación entre ghrelina y el IMC a los 12 meses de la cirugía.
DiscusiónEn este estudio observamos un incremento de los niveles de ghrelina acilada después de un año de seguimiento, no existiendo diferencias significativas entre realizar un BP o una GV. En cambio, hay una mayor pérdida ponderal en el grupo BP a los 12 meses, sin encontrar correlación significativa entre los cambios de ghrelina y el IMC.
Para comparar nuestros resultados con el resto de la literatura, realizamos una revisión bibliográfica elaborando una tabla que recoge las diferentes series de pacientes intervenidos de cirugía bariátrica, centrándonos fundamentalmente en el BP y la GV. La tabla 2 recoge el autor y año de publicación, los valores en ayunas de ghrelina y momento de la determinación, así como las características descritas por los autores en cuanto al método de recogida, almacenaje y kit utilizado para realizar el análisis.
Autor, año de publicación y series de ghrelina
| Autor, año | N | Ghrelina preop. (ayunas) | Ghrelina 1 día (ayunas) | Ghrelina 1 mes (ayunas) | Ghrelina 3 mes (ayunas) | Ghrelina 6 mes (ayunas) | Ghrelina 12 mes (ayunas) | Ghrelina 9-15 (24*-30**) meses (ayunas) | Ghrelina 72 meses (ayunas) | Tubo recogida | Centrifugado y almacenaje | Kit |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cummings et al., 20027 | 5 | 140pg/ml (BP)** | No especificado | No especificado | RIA; kit (Phoenix Pharmaceuticals) acilada y desacilada (ghrelina total) | |||||||
| Leonetti et al., 200323 | 11//10 | 213,5±79pg/ml (BPL)314,2±84,3pg/ml (BPL) | No especificado | Plasma −80°C | RIA, kit (Phoenix Pharmaceuticals, catalog n°. RK-031-30) acilada y desacilada (ghrelina total) | |||||||
| Faraj et al., 200322 | 25 | 80,8±27,7pm (BP) | Tubo EDTA+inhibidor aprotina | Centrifugado 1.500rpm/15min 4°CPlasma −80°C | RIA; kit (Phoenix Pharmaceuticals, Inc., Belmont, CA) ghrelina (no especificada) | |||||||
| Holdstock et al., 20039 | 66 | 86,9±40,2pmol/l (BPL) | 125±71pmol/l (BPL) | 141±70pmol/l (BPL) | No especificado | Plasma −70°C | RIA; kit (Phoenix Pharmaceuticals) ghrelina acilada | |||||
| Fruhbeck et al., 200413 | 8//8 | 360pg/ml (BPL)370pg/ml (GVL) | 125pg/ml (BPL)425 pg/ml (GVL) | No especificado | No especificado | RIA; kit (Linco Research, Inc., ST. Charles, MO, EE. UU.) ghrelina acilada | ||||||
| Korner et al., 200520 | 12 | 425±54 /ml (BPL) (total)143±27pg/ml (BPL) (acilada) | Tubo EDTA | Centrifugado 4°C 15minPlasma −80°C | RIA; kit (Phoenix Pharmaceuticals, Belmont, Calif) ghrelina total. RIA; kit (Linco Research) ghrelina acilada | |||||||
| Le Roux et al. 200611 | 6//6 | 430,4 (53,2)pmol/l (BPL)*491,3 (120,8)pmol/l (GVL)* | No especificado | No especificado | RIA; kit (Phoenix Pharmaceuticals) ghrelina (no especificada) | |||||||
| Sundbom et al., 200721 | 15 | 814 (735-904)pg/ml (BP) | 436 (397-478)pg/ml (BP) | 1.114 (964-1.288) pg/ml (BP) | No especificado | Suero −70°C | RIA; kit (Linco Research Inc. St. Charles, MO, EE. UU.) ghrelina total | |||||
| Whitson et al., 200718 | 10 | DM: 8,5pg/ml (acilada) 28pg/ml (no acilada) (BPL)No DM: 3,1pg/ml (acilada) 11pg/ml (no acilada) (BPL) | DM: 1,2pg/ml (acilada) 30pg/ml (no acilada) (BPL)No DM: 13,5pg/ml (acilada) 17pg/ml (no acilada) (BPL) | Tubo EDTA | Plasma −20°C | Luminex microsphere technology (Luminex Corp., Austin, TX) ghrelina acilada y ghrelina no acilada | ||||||
| Karamanakos et al., 20088 | 16/16 | 638±189pg/ml (BPL)605±185pg/ml (GVL) | 550±136pg/ml (BPL)124±30pg/ml (GVL) | 610±188pg/ml (BPL)399±135pg/ml (GVL) | 636±188pg/ml (BPL)398±100pg/ml (GVL) | 714±230pg/ml (BPL)399±97pg/ml (GVL) | Tubo EDTA+heparina+inhibidor calicreína aprotina | Centrifugado 4°CSuero −70°C | RIA; kit (Phoenix Pharmaceuticals) acilada y no acilada (ghrelina total) | |||
| Lee et al., 201119 | 13//13 | 20pg/ml (acilada), 31pg/ml (no acilada) (BPL)*11pg/ml (acilada), 12pg/ml (no acilada) (GVL)* | No especificado | No especificado | RIA; kit (Bertin Pharma, Montigny le Bretonneux, Francia) ghrelina acilada y ghrelina no acilada | |||||||
| Peterli et al., 201212 | 12//11 | 540pg/ml (BPL)430pg/ml (GVL) | 460pg/ml (BPL)270pg/ml (GVL) | 590pg/ml (BPL)350pg/ml (GVL) | Tubo EDTA+inhibidor DPP-IV | Plasma −20°C | RIA; kit (Linco Research Inc. St. Charles, MO,EE: UU.) ghrelina (no especificada) | |||||
| Ramón et al., 201225 | 7//8 | 584 (493-645)pg/ml (BPL)610 (449-775)pg/ml (GVL) | 682 (555-697)pg/ml (BPL)354 (281-403)pg/ml (GVL) | 730 (611-866)pg/ml (BPL)342 (316-445)pg/ml (GVL) | Tubo EDTA | Centrifugado 4°CPlasma −20°C | RIA; kit (Linco Research Inc. St. Charles, MO, EE. UU.) ghrelina total | |||||
| Krieger et al., 201224 | 16 | 1.132±476,8pg/ml (GVL) | 1.123,6±457,7pg/ml (GVL) | No especificado | Plasma −20°C | RIA; kit (Phoenix Pharmaceuticals Inc, Burlingame, CA) ghrelina total | ||||||
| Terra et al., 201326 | 13//17 | 0,81 (0,30)pg/ml (BPL)0,97 (0,49)pg/ml (GVL) | 1,01 (0,27)pg/ml (BPL)1,17 (0,36)pg/ml (GVL) | 1,04 (0,29)pg/ml (BPL)1,08 (0,37)pg/ml (GVL) | Tubo EDTA | Centrifugado 1.500×g15min | RIA; kit (Linco Research, Missouri, EE: UU.) ghrelina total | |||||
| Nannipieri et al., 201316 | 23//12 | 32 (14)pg/ml-1 (BPL)26 (5)pg/ml-1 (GVL) | 24 (16)pg/ml-1 (BPL)12 (12)pg/ml-1 (GVL) | No especificado | No especificado | Milliplex Map kits (Milllipore Corporation) on Bio-Plex 200 system (Bio-Rad Laboratories, Inc) ghrelina no acilada | ||||||
| Werling et al., 201317 | 20//15 | 700pmol/l (BPL)600pmol/l (GVL) | Tubo EDTA+heparina+inhibidor calicreína aprotina | Centrifugado 4°C 3100rpm 10minPlasma −70°C | RIA; kit (no especificado) ghrelina (no especificada) | |||||||
| Yang et al., 201427 | 16 | 37±13,3pg/ml (BPL) (acilada)462±166pg/ml (BPL) (no acilada) | 61,4±18,2pg/ml (BPL) (acilada)804±232pg/ml (BPL) (no acilada) | Tubo EDTA+potasio+500U aprotina | Centrifugado 2.000g 10min 4°CPlasma −80°C | ELISA; kit (Novatein Biosciences, MA, EE. UU.) ghrelina acilada y ghrelina no acilada |
BP: bypass gástrico abierto; BPL: bypass gástrico laparoscópico; DM: diabetes mellitus; DPP-IV: dipeptidil peptidasa-IV; GVL: gastrectomía vertical laparoscópica; RIA: radioinmunoanálisis.
Se tratan de pequeñas series de pacientes y la técnica utilizada por excelencia fue el radioinmunoanálisis, la mitad de los estudios comparan BP frente a GV vía laparoscópica. Dentro de ellos, las series más grandes fueron 23 BP vs. 12 GV16 y 20 BP vs. 15 GV17. Realizar comparaciones con nuestro estudio resulta difícil, muchos autores no especifican el tipo de ghrelina que midieron11,12, hecho que es muy importante ya que la forma activa de la ghrelina es la forma acilada. Si además le sumamos que utilizaron unidades de medida diferentes y escasas determinaciones a lo largo del tiempo, dificulta aún más el poder realizar comparaciones. De los 19 trabajos incluidos solo 6 de ellos miden la fracción de ghrelina acilada9,13,18–20,27, no pudiendo comparar nuestros resultados porque utilizan un método de análisis distinto y muchos no informan del método de procesamiento de la muestra. Dentro de ellos solo encontramos el estudio de Whitson et al.18 que utiliza metodología Luminex similar a nuestro estudio, con valores de ghrelina acilada medidos en picogramos/mililitro (pg/ml). Ellos realizan las mediciones en BP, dividido en 2 poblaciones, diabéticos y no diabéticos, observando un incremento de los valores de ghrelina acilada a los 6 meses en el grupo BP no diabéticos. Este comportamiento coincide con nuestros resultados, aunque esta diferenciación no la tuvimos en cuenta, nuestro grupo BP incrementa los valores de ghrelina acilada y también presenta escaso porcentaje de pacientes diabéticos (14,8%). Serán necesarios más estudios que clarifiquen si este hallazgo presenta alguna importancia.
Dentro del resto de trabajos incluidos en la tabla 2 podemos encontrar ciertas similitudes: en el grupo de Holdstock et al.9 se incrementan los niveles de ghrelina acilada a los 12 meses, el análisis se realiza en 66 BP. En cambio, en el grupo de Fruhbeck et al.13, los niveles se incrementan en la GV pero descienden en el BP medidos a los 6 meses de la cirugía. En nuestro estudio existe un incremento de los valores de ghrelina acilada con las 2 técnicas a los 12 meses de la cirugía. Por otro lado, en la serie de Karamanakos et al.8 (16 BP vs. 16 GV), aunque miden ghrelina total, se observa una caída en el primer mes de la ghrelina con respecto a niveles preoperatorios similar a nuestra serie y con ambas técnicas quirúrgicas. También observamos caída de ghrelina pero medido en el 3.er mes postoperatorio en la serie de Peterli et al.12(12 BP vs. 11 GV). En el grupo de BP abierto de Sundbom et al.21 se observó un aumento de los niveles a los 12 meses, superiores a los preoperatorios, pero en este caso se midió ghrelina total. Hay más datos disponibles de ghrelina acilada medida en BP7,9,18,27, existiendo un comportamiento general de incrementarse al año de seguimiento. En cambio, los resultados para comparar con GV son escasos11,13,19; en algunas series la ghrelina acilada claramente se incrementa (Fruhbeck et al.13) pero en otras no tenemos datos preoperatorios con los que comparar (Le Roux et al.11 y Lee et al.19), siendo los resultados discordantes. No existe un trabajo similar a nuestro estudio metodológicamente hablando y comparando BP vs. GV.
El 47% de los estudios7,11,13,16,19,21,23,24 no especificaron las características del tubo utilizado para la recolección de la muestra, el 26% de los estudios7,11,13,16,19 no informaban sobre el almacenaje y tratamiento de la muestra (centrifugado, temperatura, minutos), el resto especificaban solo algunas características del proceso. Los kits utilizados son diferentes, existen muchas casas comerciales y la expresión de las unidades es diferente. Podemos explicar la variabilidad de los datos de ghrelina en la influencia de los métodos de recolección. Un reciente trabajo informó de que una buena práctica para la recolección de ghrelina era utilizar tubos EDTA refrigerados y procesados inmediatamente para preservar la forma activa, sin congelación o descongelación28, aunque este método no se ha validado. Existen pocas descripciones en la literatura sobre métodos de recolección y es un área que precisa de investigación.
Por otro lado, tenemos que tener en cuenta que cada técnica quirúrgica puede condicionar la mayor o menor resección de la población productora de ghrelina en el fundus gástrico29. En nuestro grupo de pacientes, la técnica quirúrgica no influyó en esta diferencia, incluso en la GV donde se reseca el fundus gástrico, se observaron mayores niveles de ghrelina acilada a los 12 meses. A la vista de estos resultados, podríamos pensar que las modificaciones de ghrelina no se relacionan con la mayor o menor resección del fundus gástrico, sino que sus variaciones son el resultado del balance energético negativo que acontece en un paciente intervenido de cirugía bariátrica y esta perdiendo peso.
Un tema controvertido en los estudios que evaluaron ghrelina es si el paciente estaba perdiendo peso en el momento de su determinación. Faraj et al.22 informaron de que la ghrelina se mantenía sin cambios en los pacientes de peso estable, en cambio se incrementaban los niveles en los pacientes que estaban perdiendo peso. En una situación de pérdida de peso (dieta, anorexia, cirugía), los niveles de ghrelina tienden a incrementarse, por eso algunos autores dicen que debe ser medida en pacientes con peso estable9,22; existiendo una relación inversa entre IMC y ghrelina. Nosotros no observamos diferencias significativas a los 12 meses entre BP y GV. Interpretamos el incremento de ghrelina acilada al 5.o día como un mecanismo compensador en respuesta a una situación de ayuno prolongado y estrés quirúrgico, ya que aún no ha comenzado la pérdida de peso. Aunque después existe un descenso de estos niveles, los valores alcanzados a los 12 meses son superiores a los preoperatorios con ambas técnicas quirúrgicas. Este segundo incremento puede estar justificado porque se trata de pacientes que están en pleno proceso de pérdida de peso y actúa como un mecanismo compensador a largo plazo. Pero este análisis es más complejo, porque a pesar de que con ambos procedimientos existe una pérdida ponderal considerable, es mayor en el BP y en cambio se observan niveles ligeramente más elevados de ghrelina a los 12 meses con la GV, no siendo esta diferencia significativa en nuestros resultados. Por lo que podemos deducir que la pérdida de peso después de un procedimiento de cirugía bariátrica, en este caso BP o GV, es independiente a los cambios de ghrelina, como otros estudios han sugerido30,31.
Tenemos la limitación de que trabajamos con una población de sujetos con obesidad, donde destaca la hipertrigliceridemia y algunas muestras tenían una alta concentración de lípidos, interfiriendo con el método de análisis. Las microesferas llevan el anticuerpo adherido y este es el que se une al analito de la muestra, las altas concentraciones de lípidos dificultan la adhesión y por este motivo hubo dificultades en el análisis de algunas muestras. Las muestras donde observamos después del centrifugado un sobrenadante muy rico en lípidos fueron excluidas del estudio, ya que los valores hormonales más dispersos correspondían a este tipo de muestras.
Se trata de la mayor serie comparativa hormonal de la literatura con ghrelina acilada en ayunas, pero el pequeño tamaño de la muestra no permite extraer conclusiones definitivas. Utilizamos un sistema de determinación analítico relativamente novedoso, que permite el análisis simultáneo de varias hormonas con una única muestra. En este artículo presentamos los resultados de ghrelina, pero también se midieron niveles de GLP-1 y PYY. Existen escasos estudios en la literatura con los que poder comparar y su rentabilidad precisa de más investigaciones. Son necesarios estudios aleatorizados, con mayor tamaño muestral y a largo plazo para obtener conclusiones más consistentes.
ConclusionesObservamos un incremento de los niveles de ghrelina acilada en ayunas al año de seguimiento con ambas técnicas quirúrgicas (BP y GV), cuando existe una pérdida ponderal del 30%. No encontramos correlación lineal negativa entre ghrelina acilada y el IMC.
FinanciaciónBeca de Investigación: Subprograma de Proyectos de Investigación Fundamental no Orientada, convocatoria 2012. Ministerio de Economía y Competitividad. Referencia: BFU 2012-38103
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Unidad de Obesidad Mórbida del Hospital Universitario Santa Lucía de Cartagena por su colaboración activa en la elaboración de este manuscrito.
Al grupo de investigación de Nutrición y Bromatología de la Universidad de Murcia por la colaboración en la realización de los análisis hormonales.