Este estudio revisa las características clínicas de los pacientes con pie diabético ulcerado atendidos en una Unidad Multidisciplinar de Pie Diabético (UMPD) y analiza la mortalidad y los factores asociados a su supervivencia.
Material y métodosAnálisis de los datos obtenidos de todos los pacientes que consultaron por primera vez por una lesión por pie diabético a la UMPD durante el periodo 2008-2014. Los pacientes fueron seguidos hasta su fallecimiento o hasta el 30/6/16, con un máximo de 8,1 años.
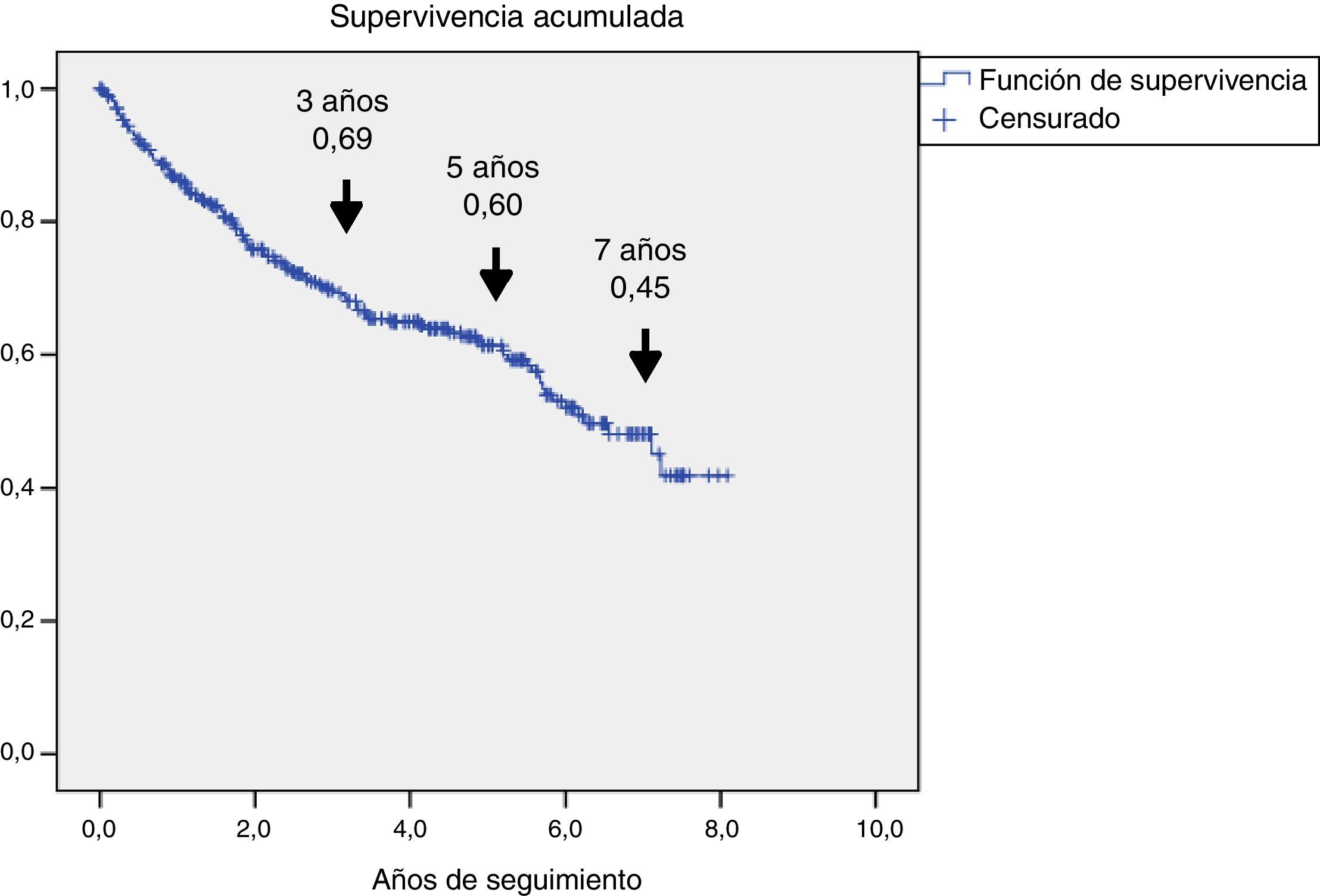
ResultadosSe incluyeron 345 pacientes, mediana (P25-P75) de 71 años (61,5-80), 321 (93%) con diabetes de tipo 2. Se caracterizaron por mal control glucémico; el 48% tenían HbA1c ≥ 8% y alta prevalencia de complicaciones crónicas: el 60,2% retinopatía, el 43,8% disfunción renal y el 47,2% cardiopatía isquémica o enfermedad cerebrovascular. Fallecieron 126 (36,5%), 69 de ellos (54,8%) por enfermedad cardiovascular. La supervivencia medida por Kaplan-Meier se redujo a un 69, 60 y 45% a los 3, 5 y 7 años, respectivamente. El análisis de regresión de Cox multivariante demostró las siguientes variables asociadas a la mortalidad con HR (IC 95%): edad 1,08 (1,05-1,11); amputación previa 2,24 (1,34-3,73); tabaquismo activo 2,10 (1,12-3,97); enfermedad cerebrovascular 1,75 (1,05-2,92); disfunción renal 1,65 (1,04-2,61) y cardiopatía isquémica 1,60 (1,01-2,51).
ConclusionesLos pacientes con pie diabético ulcerado se caracterizan por tener alta morbimortalidad; la enfermedad cardiovascular es la causa más frecuente de las muertes. Se precisa prestar más atención a este grupo de riesgo, individualizando objetivos y tratamientos a su situación y pronóstico vital.
This study reviews the clinical characteristics of patients with diabetic foot ulcer treated in a Multidisciplinary Diabetic Foot Unit (MDFU) and analyzes the mortality and factors associated with its survival.
Material and methodsData from all patients who attended the MDFU for the first time for a diabetic foot ulcer during the 2008-2014 period were analized. The patients were followed until their death or until June 30, 2016, for up to 8 years.
ResultsA total of 345 patients were included, with a median age (P25-P75) of 71 (61.5-80) years, and 321 (93%) had type 2 diabetes. They were characterized as patients with inadequate glycemic control, 48% had HbA1c ≥ 8% and high prevalence of chronic complications: 60.2% retinopathy, 43.8% nephropathy and 47.2% ischemic heart disease and/or cerebrovascular disease. A total of 126 (36.5%) patients died and 69 (54.8%) were due to cardiovascular disease. Survival measured by Kaplan-Meier declined over time to 69, 60 and 45% at 3, 5 and 7 years respectively. Cox's multivariate regression analysis showed the following variables associated with mortality, HR (95% CI): age 1.08 (1.05-1.11); previous amputation 2.24 (1.34-3.73); active smoking 2.10 (1.12-3.97); cerebrovascular disease 1.75 (1.05-2.92); renal dysfunction 1.65 (1.04-2.61) and ischemic heart disease 1.60 (1.01-2.51).
ConclusionsPatients with diabetic foot ulcer are characterized by high morbidity and mortality, with cardiovascular disease being the most frequent cause of death. It is necessary to pay more attention to this risk group, tailoring objectives and treatments to their situation and life expectancy.
Las causas más importantes que condicionan tener un pie diabético (PD) es la presencia de neuropatía diabética (sensitiva, motora o autonómica) y la enfermedad arterial periférica. Ambas complicaciones predisponen a que en los pacientes aparezcan lesiones y haya destrucción o infección de tejidos, que son la antesala de las amputaciones en más de un 85% de los casos1. Esta secuencia de sucesos —pie de riesgo, lesión y posterior amputación— es lo que ha condicionado la mayor parte de nuestros conocimientos en esta complicación, las estrategias preventivas y las intervenciones terapéuticas2. Aspectos menos conocidos son las características clínicas distintivas de los pacientes con PD, como son la mayor frecuencia de complicaciones macro- y microvasculares3 y la mayor mortalidad de los pacientes, estimada en casi el doble que la de una persona con diabetes mellitus (DM) pero sin PD4, lo que condiciona una reducción de la supervivencia a los 5 años en un 50-60%5.
Diversos posicionamientos científicos —ADA, NICE e IDF— dejan bien establecido cómo ha de realizarse el cuidado de los pacientes con lesiones por PD y aquellos que tienen alto riesgo para ulcerarse6–8. Esta atención se debe realizar por equipos multidisciplinarios en los que se incluyan distintas especialidades: podología, cirugía, medicina interna y endocrinología, entre otras. Sin embargo, esta aproximación, así como la organización de estos equipos, está dirigida fundamentalmente a prevenir lesiones y a optimizar el tratamiento del PD complicado9.
Conocer la comorbilidad de los pacientes, desde una perspectiva más global, no solo es útil para tratarlos de una manera óptima, sino que también permitiría tomar decisiones más juiciosas en función de su pronóstico vital10. Por otro lado, conocer por qué se mueren más estos pacientes y qué factores condicionan su supervivencia nos permitiría ser más realistas en nuestras expectativas y objetivos de control. Esto se hace aún más necesario si consideramos el bajo interés que despierta el PD entre los endocrinólogos en nuestro entorno11.
Durante el año 2008 en el Hospital Universitario Príncipe de Asturias (HUPA) se puso en funcionamiento una consulta de PD atendida por un endocrinólogo y un podólogo para dar cobertura a pacientes con PD. De manera progresiva se coordinaron distintas disciplinas, formándose así una Unidad Multidisciplinar de Pie Diabético (UMPD) integrada por las siguientes especialidades: cirugía vascular, cirugía general, radiología vascular e intervencionista, traumatología, infectología y medicina física y rehabilitación12.
Este estudio revisa las características clínicas de los pacientes con PD ulcerado atendidos en la unidad, analiza la mortalidad de los pacientes seguidos desde su primera consulta e investiga qué factores se asocian a su supervivencia.
Material y métodosEstudio observacional y retrospectivo que analiza los datos obtenidos de todos los pacientes con DM que consultaron por primera vez por una lesión por PD a la UMPD. Se incluyó a pacientes desde el 1/2/2008 hasta el 31/12/2014. Todos los pacientes fueron seguidos hasta su fallecimiento o hasta la última fecha en la que se pudieron obtener datos de la historia electrónica; la última fecha de registro fue el 30/6/16.
Descripción del funcionamiento de la Unidad Multidisciplinar de Pie DiabéticoLos pacientes con lesión por PD eran derivados preferentemente a la consulta de PD desde cualquier centro de salud de atención primaria, consulta de atención especializada o servicio de urgencias. En esta consulta se establecía un abordaje diagnóstico y terapéutico, siguiendo las guías del Consenso Internacional del Pie Diabético8 y se coordinaba la actuación con otras especialidades según necesidad, derivándose preferentemente a los servicios de cirugía general y vascular, bien de manera ambulatoria, bien para ingreso hospitalario. Todos los pacientes, con independencia de que precisaran ingreso hospitalario o valoraciones por otras especialidades, eran seguidos en la consulta de PD hasta la finalización del episodio, optimizando y coordinando el control glucémico y de las comorbilidades. Una vez cicatrizada la lesión, se valoraba si el paciente precisaba revisiones periódicas en la UMPD en función del riesgo de reulceración.
Área de influencia de salud de la Unidad Multidisciplinar de Pie DiabéticoEstaba formada inicialmente por un gran municipio urbano, Alcalá de Henares, y por 12municipios próximos. Durante el periodo de estudio la población censada se redujo de 362.785 hasta 248.673 habitantes, entre los años 2008-2014. Esta reducción de la población de referencia se debió a la apertura de un nuevo centro hospitalario, con lo que se repartió la población censada entre ambos centros.
Obtención y procesamiento de los datosLos variables correspondientes a las características clínicas de los pacientes fueron obtenidas de una base de datos diseñada específicamente para el seguimiento de los pacientes en la UMPD. En los pacientes de los que perdimos el seguimiento periódico en la consulta, se obtuvieron los datos a través de la plataforma HORUS, a fin de poder evaluar su situación actual. Desde esta plataforma se puede acceder a la historia electrónica de atención primaria, así como a los informes de los hospitales del Servicio Madrileño de Salud (SERMAS) y es única para toda la Comunidad de Madrid.
Se consideró la siguiente terminología: disfunción renal, con presencia de albuminuria >30mg/g, creatinina en primera orina de mañana (al menos 2determinaciones) o si el filtrado glomerular (FG) estimado mediante MDRD-4 era <60mL/min; neuropatía sensitiva, si había ausencia de sensibilidad con el monofilamento (10g) o diapasón (64-128Hz). Para la descripción de la lesión, en caso de ser múltiples, se describió solo la más severa. Se consideró como lesión isquémica a la ausencia de pulsos distales o pruebas diagnósticas confirmatorias: índice tobillo-brazo <0,9 o índice dedo-brazo <0,6 o presión transcutánea de oxígeno <30mm de Hg. La severidad de la ulceración se consideró según el estadio de Wagner (1-5)13 y la clasificación de Texas13 agrupada (1=1A, 2A, 1B, 2B; 2=3A, 3B; 3=1C, 1D, 2C, 2D, 3C, 3D) y la graduación de infección, según criterios IWGDF/IDSA (0-3)14.
Los datos referentes a la causa mayor responsable de la muerte de los pacientes fueron obtenidos de los informes clínicos durante la hospitalización o, en su defecto, de los datos registrados en la historia electrónica de los equipos de atención primaria. Si la muerte sobrevino de manera inesperada fuera del centro hospitalario, se consideró que su causa era de probable origen cardiovascular, y se agrupó junto con la cardiopatía isquémica, la insuficiencia cardiaca y la enfermedad cerebrovascular.
Expresión de los datos y análisis estadísticoLos datos fueron expresados como mediana y rango (P25-P75) para los datos cuantitativos o en valor absoluto y porcentaje (%) para los datos cualitativos.
Para analizar qué variables se asociaban con la mortalidad, se realizó análisis de supervivencia mediante regresión de Cox, univariante y multivariante, ajustada a variables independientes y con selección de variables hacia atrás. La medida del riesgo se presenta a través del HR (IC 95%). Los resultados obtenidos en el análisis univariante estadísticamente significativo se representaron mediante la función de Kaplan-Meier. Se estimó la supervivencia a los 3, 5 y 7 años tras la primera valoración en consulta. Se empleó el paquete estadístico SPSS, versión 15.0. Se consideró significativo si p < 0,05.
Consideraciones éticasEl proyecto del presente estudio fue aprobado por el Comité de Ética e Investigación Clínica del HUPA, código OE 26/2015. No se solicitó consentimiento informado a los sujetos incluidos en el estudio al tratarse de un estudio observacional y retrospectivo. En algunos casos los pacientes ya no eran seguidos en la UMPD o habían fallecido con anterioridad al inicio el estudio. Se realizó anonimización de los datos de los pacientes para mantener la confidencialidad.
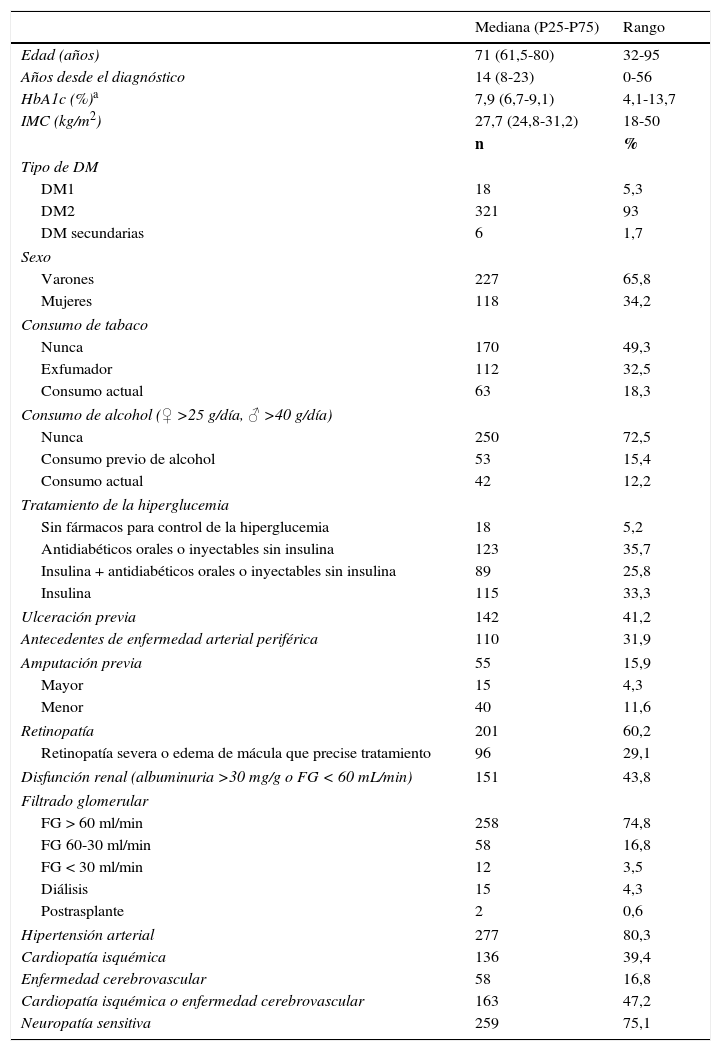
ResultadosCaracterísticas basalesSe incluyeron 345 pacientes, mediana (P25-P75) de 71 años (61,5-80), 321 (93%) con DM de tipo 2 (DM2); 227 (65,8%) eran varones. La inclusión de pacientes nuevos durante el periodo de estudio fue decreciendo (59, 56, 44, 57, 42, 48 y 39 sujetos entre los años 2008-2014, respectivamente).
Los datos más relevantes se muestran en la tabla 1. Si bien los años desde el diagnóstico de la DM representan una mediana de 14 años, 32 (9,2%) sujetos fueron diagnosticados en los 3 años previos a la consulta por ulceración. La mayoría de los sujetos (59,1%) precisaban tratamiento con insulina y la mitad de ellos presentaban complicaciones crónicas: el 60,2% retinopatía diabética; el 43,8% disfunción renal; el 39,4% cardiopatía isquémica y el 16,8% enfermedad cerebrovascular. El análisis del grado de control glucémico mostró que 165 (47,8%) presentaban valores de HbA1c ≥ 8%. El 41,2% de los pacientes habían presentado una ulceración previa cuando consultaron por primera vez en la UMPD y el 15,9% habían sufrido una amputación de miembro inferior.
Características basales
| Mediana (P25-P75) | Rango | |
|---|---|---|
| Edad (años) | 71 (61,5-80) | 32-95 |
| Años desde el diagnóstico | 14 (8-23) | 0-56 |
| HbA1c (%)a | 7,9 (6,7-9,1) | 4,1-13,7 |
| IMC (kg/m2) | 27,7 (24,8-31,2) | 18-50 |
| n | % | |
| Tipo de DM | ||
| DM1 | 18 | 5,3 |
| DM2 | 321 | 93 |
| DM secundarias | 6 | 1,7 |
| Sexo | ||
| Varones | 227 | 65,8 |
| Mujeres | 118 | 34,2 |
| Consumo de tabaco | ||
| Nunca | 170 | 49,3 |
| Exfumador | 112 | 32,5 |
| Consumo actual | 63 | 18,3 |
| Consumo de alcohol (♀ >25 g/día, ♂ >40 g/día) | ||
| Nunca | 250 | 72,5 |
| Consumo previo de alcohol | 53 | 15,4 |
| Consumo actual | 42 | 12,2 |
| Tratamiento de la hiperglucemia | ||
| Sin fármacos para control de la hiperglucemia | 18 | 5,2 |
| Antidiabéticos orales o inyectables sin insulina | 123 | 35,7 |
| Insulina + antidiabéticos orales o inyectables sin insulina | 89 | 25,8 |
| Insulina | 115 | 33,3 |
| Ulceración previa | 142 | 41,2 |
| Antecedentes de enfermedad arterial periférica | 110 | 31,9 |
| Amputación previa | 55 | 15,9 |
| Mayor | 15 | 4,3 |
| Menor | 40 | 11,6 |
| Retinopatía | 201 | 60,2 |
| Retinopatía severa o edema de mácula que precise tratamiento | 96 | 29,1 |
| Disfunción renal (albuminuria >30 mg/g o FG < 60 mL/min) | 151 | 43,8 |
| Filtrado glomerular | ||
| FG > 60 ml/min | 258 | 74,8 |
| FG 60-30 ml/min | 58 | 16,8 |
| FG < 30 ml/min | 12 | 3,5 |
| Diálisis | 15 | 4,3 |
| Postrasplante | 2 | 0,6 |
| Hipertensión arterial | 277 | 80,3 |
| Cardiopatía isquémica | 136 | 39,4 |
| Enfermedad cerebrovascular | 58 | 16,8 |
| Cardiopatía isquémica o enfermedad cerebrovascular | 163 | 47,2 |
| Neuropatía sensitiva | 259 | 75,1 |
DM: diabetes mellitus; FG: filtrado glomerular.
La mayoría de las lesiones eran superficiales: el 67% tenían estadio 1 de Wagner, 169 (49%) se clasificaron como isquémicas y un 56,6% presentaban algún grado de infección (material adicional, tabla e-1). De los 345 pacientes, 262 (76%) consiguieron cicatrización de la lesión, 40 (11,6%) finalizaron en amputación menor, 25 (7,2%) en amputación mayor y 18 (5,2%) fallecieron con la lesión sin cicatrizar.
Seguimiento de los pacientes y análisis de la mortalidadLos pacientes fueron seguidos hasta un máximo de 8,1 años, con una mediana (P25-P75) de 2,8 años (1,3-5,1). Fallecieron 126 (36,5%) personas con DM. En la tabla 2 se muestran las causas mayores que se identificaron como responsables de la muerte: destaca la enfermedad cardiovascular, que fue responsable del 54,8% de los fallecimientos. En el 28,6% de la muestra, el suceso se presentó de manera inesperada y tuvo un desenlace rápido, sin precisar hospitalización. En 9 (7,1%) de los pacientes se identificó la lesión como el factor desencadenante de la muerte.
Causa mayor responsable de la muerte
| n | % | |
|---|---|---|
| Enfermedad cardiovascular | 69 | 54,8 |
| Cardiopatía isquémica, insuficiencia cardiaca | 29 | 23 |
| Enfermedad cerebrovascular | 4 | 3,2 |
| Probable cardiovascular, muerte inesperada sobrevenida fuera del hospital | 36 | 28,6 |
| Enfermedad respiratoria con o sin infección | 24 | 19,1 |
| Asociada a la lesión del pie (fracaso multiorgánico o sepsis) | 9 | 7,1 |
| Enfermedad renal crónica terminal | 8 | 6,3 |
| Cáncer | 7 | 5,5 |
| Otras | 5 | 4 |
| Sepsis no respiratoria | 4 | 3,2 |
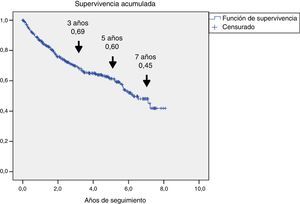
En la figura 1 se representa la supervivencia de los 345 pacientes, mediante curva de Kaplan-Meier: se observa que hubo una reducción progresiva de la supervivencia al 69, 60 y 45% a los 3, 5 y 7 años, respectivamente.
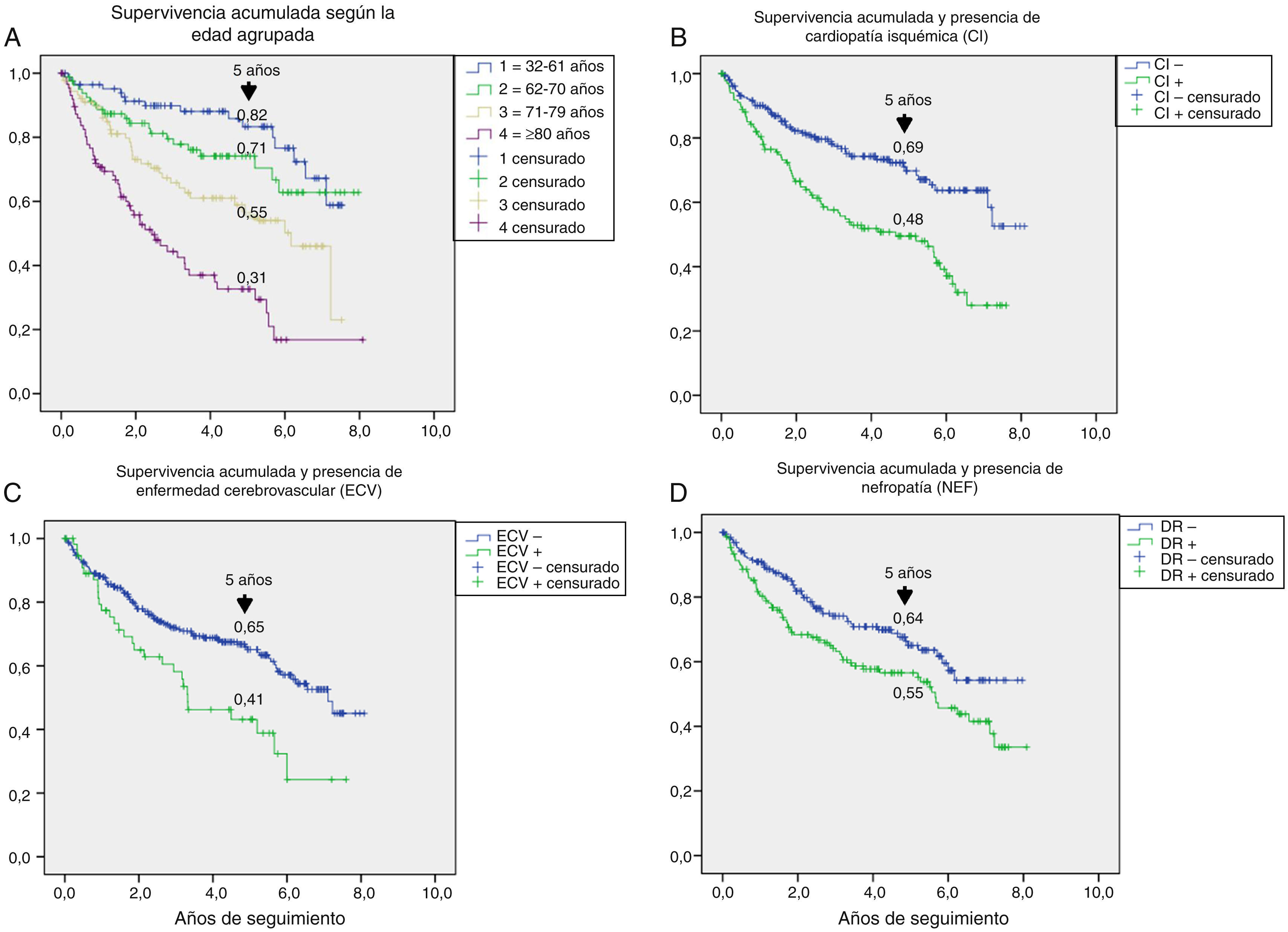
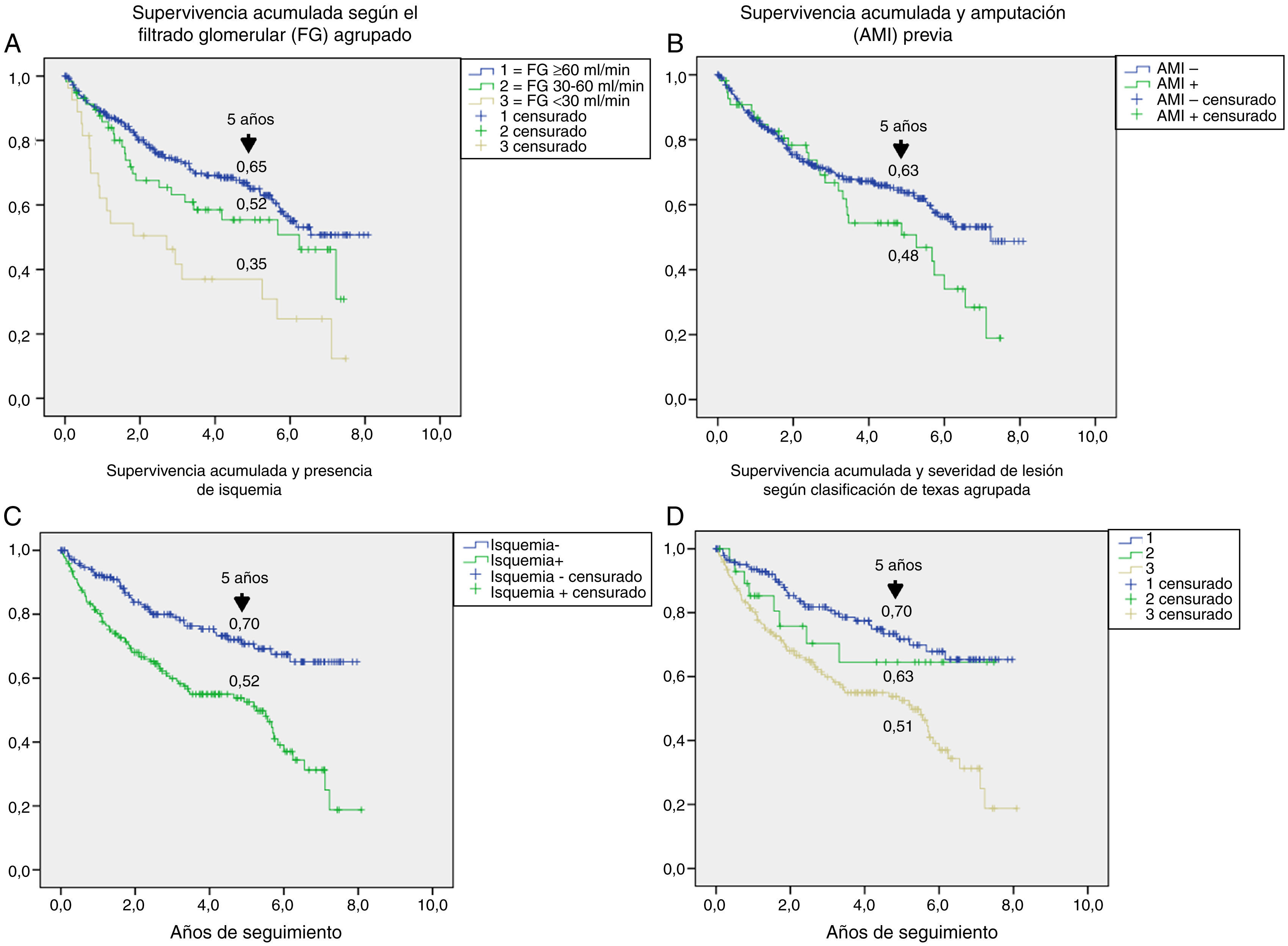
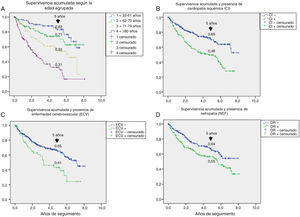
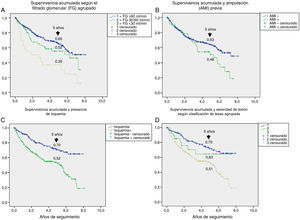
En la tabla 3 se muestran las variables predictoras de supervivencia, analizadas mediante regresión de Cox univariante. Se observa que la edad, DM2 vs. DM1, cardiopatía isquémica, enfermedad cerebrovascular, disfunción renal, reducción del FG, antecedentes de enfermedad arterial periférica, lesión isquémica y severidad de la lesión (Texas) se asociaron con una mayor mortalidad. En las figuras e-1 y e-2 (material adicional) se muestra la curva de supervivencia de las variables significativas y más representativas, así como la estimación de la supervivencia a los 5 años en cada una de las curvas de supervivencia. Tras excluir a aquellos sujetos que fallecieron con la lesión y cuando analizamos cómo influía el resultado sobre la lesión en la mortalidad, observamos que cualquier amputación aumentaba el riesgo de muerte (HR 1,66; IC 95%: 1,09-2,53; p=0,018) y si la amputación era mayor vs. menor o la lesión cicatrizaba, el HR aumentaba a 2,25 (IC 95%: 1,28-3,95; p=0,005).
Variables predictoras de supervivencia. Análisis univariante
| HR (IC 95%) | p | |
|---|---|---|
| Edad | 1,06 (1,04-1,08) | <0,001 |
| Edad agrupada en años (1=32-61; 2=62-70; 3=71-79; 4=≥80) | 1,84 (1,54-2,19) | <0,001 |
| Varón vs. mujer | 1,17 (0,80-1,70) | 0,412 |
| DM2 vs. DM1 | 3,67 (1,16-11,55) | 0,026 |
| Años desde el diagnóstico | 1,01 (1,00-1,03) | 0,051 |
| Año de primera consulta (2008-2014) | 1 (0,90-1,11) | 0,995 |
| HbA1c inicial | 0,91 (0,83-1,01) | 0,092 |
| IMC | 0,96 (0,92-1,00) | 0,087 |
| Tabaquismo activo | 0,74 (0,45-1,20) | 0,228 |
| Enfermedad cardiovascular | 2,67 (1,83-3,88) | <0,001 |
| Cardiopatía isquémica | 2,15 (1,51-3,05) | <0,001 |
| Enfermedad cerebrovascular | 1,90 (1,26-2,87) | 0,002 |
| Hipertensión arterial | 1,53 (0,92-2,52) | 0,095 |
| Disfunción renal | 1,57 (1,10-2,23) | 0,012 |
| FG agrupado (1=>60 ml/min, 2=30-60 ml/min y 3=<30 ml/min o en diálisis) | 1,59 (1,25-2,02) | <0,001 |
| Retinopatía | 0,72 (0,50-1,05) | 0,087 |
| Retinopatía estadificación (3=severa o EM, 2=moderada, 1=leve, 0=sin retinopatía) | 0,88 (0,75-1,02) | 0,085 |
| Amputación previa | 1,48 (0,97-2,25) | 0,066 |
| Enfermedad arterial periférica previa | 1,57 (1,10-2,24) | 0,011 |
| Neuropatía sensitiva | 0,73 (0,50-1,07) | 0,115 |
| Estadio de Wagner 1-413 | 1,07 (0,88-1,31) | 0,470 |
| Grados de infección 0-314 | 1,12 (0,91-1,35) | 0,298 |
| Lesión isquémica (ausencia de pulsos distales o pruebas diagnósticas confirmatoriasa) | 2,35 (1,62-3,42) | <0,001 |
| Clasificación de Texas13agrupada 1-3b | 1,58 (1,29-1,93) | 0,001 |
FG: filtrado glomerular.
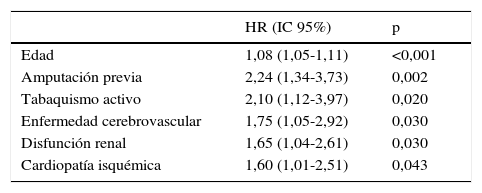
El análisis multivariante (tabla 4) permitió ajustar las variables basales predictoras de supervivencia y resultó que las variables asociadas de manera independiente a una mayor mortalidad fueron: edad, amputación previa, tabaquismo activo, enfermedad cerebrovascular, disfunción renal y cardiopatía isquémica.
Variables predictoras de supervivencia. Análisis multivariante ajustado a distintas variablesa con selección de variables hacia atrás
| HR (IC 95%) | p | |
|---|---|---|
| Edad | 1,08 (1,05-1,11) | <0,001 |
| Amputación previa | 2,24 (1,34-3,73) | 0,002 |
| Tabaquismo activo | 2,10 (1,12-3,97) | 0,020 |
| Enfermedad cerebrovascular | 1,75 (1,05-2,92) | 0,030 |
| Disfunción renal | 1,65 (1,04-2,61) | 0,030 |
| Cardiopatía isquémica | 1,60 (1,01-2,51) | 0,043 |
Edad, sexo, años de evolución, año de inclusión en el estudio, cardiopatía isquémica, enfermedad cerebrovascular, hipertensión arterial, disfunción renal, retinopatía, neuropatía sensitiva, severidad de la lesión (clasificación de Texas agrupada), tabaquismo activo, HbA1c, IMC y antecedentes de amputación de miembro inferior.
La presencia de úlceras por PD es un problema relevante en la población con DM y su prevalencia se estima de manera global en un 6,3%15. En este estudio hemos observado que estos pacientes tenían un perfil clínico distintivo y presentaban una reducción importante de su supervivencia. Esta menor supervivencia estaba causada, en su mayor parte, por enfermedad cardiovascular: estimamos que esta se redujo al 60% a los 5 años del seguimiento.
En la bibliografía se ha comunicado que los pacientes con PD ulcerado tienen más edad y presentan más años de evolución, por término medio unos 10 años superior, que los pacientes sin esta complicación15. El presente estudio, con 71 años de mediana y 14 años desde el diagnóstico de la DM, coincide con lo publicado en las 2series más amplias de pacientes que consultan por PD complicado16,17. Un aspecto que destacar es que casi un 10% de los pacientes, cuando consultaron, llevaban menos de 3 años desde el diagnóstico de la DM, por lo que está en consonancia con el curso larvado de su principal factor responsable, la neuropatía, que se desarrolla incluso en situaciones de prediabetes18. Aspectos como el perfil psicosocial negativo que envuelve a estos pacientes19 podrían favorecer que no se beneficien de un diagnóstico precoz y que consultaran en situaciones más avanzadas de la enfermedad. Este aspecto también podría contribuir al peor control glucémico y a la mayor frecuencia de complicaciones en todos los niveles, según se ha detectado en nuestro estudio y en series históricas20.
También eran pacientes que tenían menor IMC que la mayoría de los que nos consultan por DM221, aspecto comunicado en un reciente metaanálisis15. Este hallazgo explicaría que precisen con mayor frecuencia tratamiento con insulina, al ser pacientes más insulinopénicos, resultados que coinciden con lo publicado en series más amplias3,17. Más relevante es la presencia de una alta comorbilidad. Así, 163 (47,2%) pacientes presentaban cardiopatía isquémica o enfermedad cerebrovascular. Pero más frecuente, incluso, fue la presencia de retinopatía (60,2%), detectada en forma severa en el 29,1% de la muestra. Estos datos deberían condicionar tanto la elección del tratamiento empleado para corregir la hiperglucemia como los objetivos de control glucémico: estos deben ser individualizados y se debe perseguir reducir el riesgo de hipoglucemia22.
La principal causa de muerte en esta población fue la enfermedad cardiovascular en cualquiera de sus formas, datos que coinciden con publicado en la literatura4,23,24, seguida en frecuencia por la enfermedad respiratoria. Este último punto es razonable si consideramos la alta de exposición previa al tabaco en nuestra serie (32%) y que seguían siendo fumadores el 18,3%: la mayor prevalencia de tabaquismo es un distintivo más de la población con PD ulcerado15. En el análisis de las causas de la muerte, detectamos que 18 pacientes fallecieron con la lesión y, en 9 de estos (7,1% de las muertes), se identificó la lesión como precipitante de la muerte en los informes clínicos hospitalarios. Cabe reseñar que pocos son los estudios que de manera explícita describen cómo contribuye la lesión a la mortalidad de los pacientes: así, en el estudio de Ghanassia et al., el 19% de las muertes se asociaron a la lesión23.
El análisis de la supervivencia (fig. 1) demostró reducciones a un 60% a los 5 años de seguimiento, datos superponibles a lo comunicado previamente23–25. La mortalidad, estimada en el 8-10% al año5,20, poco se ha modificado en las 2últimas décadas3 y, aunque es distinta entre regiones, no parece existir una correlación espacial26 que pudiera explicar estas diferencias por desequilibrios en la asistencia sanitaria de estos pacientes. Esta mortalidad fue mayor que en estudios realizados en pacientes con DM2, con importante prevalencia de enfermedad cardiovascular27 y también fue superior a la detectada en los recientes análisis de seguridad cardiovascular, realizados en pacientes en prevención secundaria, cuya mortalidad global no fue superior al 3% anual28,29.
El análisis univariante permitió evaluar cómo contribuía de manera aislada cada una de las variables basales en el riesgo de muerte: la mayoría de ellas son bien conocidas5,20,25 y extrapolables a lo que se puede observar en cualquier paciente con DM, como es la edad, presencia de enfermedad macrovascular, enfermedad renal y deterioro del FG. Otras variables como la presencia de isquemia en la lesión, con un HR de 2,35 y la severidad de la lesión (HR 1,58) son exclusivas del PD ulcerado. Ya es clásico el estudio de Moulik et al., en el que observan, con 6 años de seguimiento, que la mortalidad fue más alta en los pacientes con úlceras isquémicas en comparación con los que tenían úlceras neuropáticas30. Más reciente es la relación entre severidad de lesiones y mortalidad31, en la que se demuestra que es el factor predictivo independiente de mortalidad, con mayor relevancia, incluso, que la propia enfermedad cardiovascular.
Al incluir todas las variables en la misma ecuación (tabla 4), observamos que las que mejor predecían la muerte de los pacientes fueron la edad, presencia de amputación previa, tabaquismo, enfermedad cerebrovascular, cardiopatía isquémica y presencia de disfunción renal, y que se quedaban fuera la isquemia y la severidad de la lesión. Quizá esos últimos factores nos estén informando de manera indirecta del estado vascular del paciente, de la severidad del daño multiorgánico y de su fragilidad.
Un aspecto no siempre bien entendido es atribuir la alta mortalidad de estos pacientes casi únicamente a su mayor edad. En la figura e-1, se estratifica la supervivencia según la edad y podemos observar que esta se reducía de manera progresiva a los 5 años, desde un 82% entre los menores de 61 años, a un 31% entre los mayores de 80 años, por lo que la menor supervivencia de los pacientes con DM con PD ulcerado afecta a todas las edades.
Existen distintas hipótesis que podrían explicar la alta mortalidad de estos pacientes31. Quizá la de mayor relevancia sea la que relaciona en el mismo paciente neuropatía periférica y neuropatía autonómica cardiovascular, lo que condiciona mayor grado de isquemia miocárdica, bien sea en forma de isquemia silente o con una peor respuesta adaptativa ante insultos isquémicos32,33. En consonancia con este planteamiento está el hallazgo en esta población de una mayor mortalidad entre los sujetos con prolongación de QTc (indicador de neuropatía autonómica cardiaca) con HbA1c < 7,5% en comparación con sujetos con HbA1c más elevada34. Precisamente la presencia de neuropatía periférica es el denominador común en mayor o menor grado de la mayoría de los pacientes con PD ulcerado.
Otra hipótesis propuesta es que la sepsis no controlada asociada a un úlcera infectada podría condicionar una mayor mortalidad en estos pacientes24; sin embargo, este mecanismo solo es plausible en el contexto de que la muerte ocurra únicamente mientras persista la lesión y no tras su cicatrización: en nuestra serie ocurrió en 18 (14,2%) de los pacientes.
Este estudio, que intenta sacar a la luz lo que esconde un paciente con PD ulcerado, tiene implicaciones prácticas, en cuanto que caracteriza a un paciente con alto riesgo cardiovascular y mortalidad global. Si bien son pocos los estudios dirigidos de forma específica a este grupo de pacientes35,36, estrategias multifactoriales dirigidas a individualizar el grado de control glucémico, evitando hipoglucemias e intensificando el control sobre factores de riesgo cardiovascular —como es el perfil lipídico, la presión arterial y el tabaquismo, que se han demostrado útiles en poblaciones con DM de alto riesgo cardiovascular— podrían mejorar la supervivencia de estos pacientes. Es quizá desde esta perspectiva, de un paciente más vulnerable, lo que nos debe alertar para estrechar su seguimiento.
Las limitaciones del presente estudio son:
- -
Las causas responsables de la muerte fueron obtenidas de los informes clínicos y la historia electrónica. Sin embargo, es bien conocido que no siempre existe concordancia entre los estudios post morten y los datos clínicos.
Las fortalezas del estudio son:
- -
Se incluyeron todos los pacientes con PD ulcerado atendidos en la UMPD con independencia de su severidad.
- -
Los datos fueron obtenidos por los mismos profesionales y de una base de datos confeccionada para el análisis de este estudio.
- -
El periodo de seguimiento hasta 8,1 años fue prolongado, lo que nos permitió obtener resultados de la atención de estos pacientes a medio-largo plazo.
En conclusión, los pacientes con PD ulcerado tienen un patrón clínico distintivo, caracterizado por tener muchos años de evolución, un mal control glucémico y un elevado grado de complicaciones micro- y macrovasculares. Estos pacientes, además, tienen una alta mortalidad que no se explica suficientemente bien considerando la edad y la coexistencia de otras comorbilidades. Las variables que se asociaron de manera independiente a la supervivencia fueron: edad, amputación previa, tabaquismo, enfermedad cerebrovascular, disfunción renal y cardiopatía isquémica. Se precisa prestar más atención a este grupo de riesgo, adecuar los objetivos y tratamientos a esta situación y contemplar su pronóstico vital en la toma de decisiones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.