La osteomielitis (OM) es la infección más frecuente asociada a las úlceras de pie diabético (PD). En la presente revisión se pretende ofrecer una actualización sobre el diagnóstico y el tratamiento de la OM de PD tras analizar fundamentalmente la base de datos MEDLINE a través de Pubmed con los criterios de búsqueda «Diabetic Foot Osteomyelitis». Se incluyeron en la presente revisión a criterio del autor los artículos más relevantes en el campo diagnóstico y terapéutico de la OM de PD. Tras la revisión y el análisis crítico de las publicaciones se puede concluir que el diagnóstico de la OM en PD no es sencillo debido a su presentación heterogénea. La recogida de signos clínicos inflamatorios junto al test del Probe-To-Bone y la radiografía simple se postulan como las pruebas de diagnóstico clínico básicas ante la sospecha de OM. La confirmación diagnóstica debería estar respaldada con la evaluación de pruebas de laboratorio, donde la VSG (>70mm/h)ha demostrado ser el valor más preciso. La RMN es la prueba de imagen con mayor precisión diagnóstica y cobra especial valor en el diagnóstico diferencial con el pie de Charcot. El aislamiento del patógeno mediante cultivo óseo es básico sobre todo cuando el paciente se trata exclusivamente con ATB. El tratamiento médico o quirúrgico debe basarse en las características clínicas del paciente y de la lesión, debiendo ser la cirugía siempre una opción posible en caso de fracaso del tratamiento médico.
Diabetic foot osteomyelitis (DFO) is the most common infection associated to diabetic foot ulcers (DFU). This review is designed to provide an update on the diagnosis and treatment of DFO based on an analysis of MEDLINE through PubMed using as search criterion “Diabetic Foot Osteomyelitis”. Authors have included in this review the most relevant manuscripts regarding diagnosis and treatment of DFO. After review and critical analysis of publications, it may be concluded that diagnosis of DFO is not simple because of its heterogeneous presentation. Clinical inflammatory signs, probe-to-bone test, and plain X-rays are postulated as the basic tests for clinical diagnosis when DFO is suspected. Diagnosis should be supported by laboratory tests, of which ESR (>70mm/h) has been shown to be most precise. MRI is the most accurate imaging test, especially for differential diagnosis with Charcot foot. Pathogen isolation by bone culture is essential when the patient is treated with ATB only. Medical or surgical treatment should be based on the clinical characteristics of the patient and the lesion. Surgery should always be an option if medical treatment fails.
El pie diabético (PD) es una complicación de la diabetes mellitus asociada al padecimiento de úlceras en el pie producidas por traumatismos externos o internos asociados a diferentes estadios de neuropatía diabética y enfermedad vascular periférica1. La consecuencia más grave del padecimiento de una úlcera del pie diabético es la amputación mayor o menor2. La amputación mayor se ha relacionado con una pérdida dramática en la esperanza de vida de estos pacientes que los sitúa en tasas de mortalidad cercanas y a veces superiores al cáncer de colón, próstata, mama o enfermedad de Hodking3.
La amputación del pie o de la pierna se produce fundamentalmente por eventos relacionados con la isquemia o la infección, siendo esta última la causa principal4. La infección del pie diabético puede afectar a tejidos blandos o al hueso, siendo las primeras las presentaciones clínicas más graves y de peor pronóstico. Sin embargo la osteomielitis (OM) es la infección más frecuente del pie diabético, presentándose en más del 20% de las infecciones moderadas y entre el 50-60% de las severas, y asociándose esta a altas tasas de amputación5.
La osteomielitis de pie diabético representa actualmente un desafío tanto en el aspecto diagnóstico como terapéutico y muchas de las consecuencias de su padecimiento se relacionan claramente con un diagnóstico tardío, una derivación retrasada o un tratamiento mal indicado.
El objetivo de esta revisión bibliográfica es establecer unas recomendaciones basadas en la evidencia y en la experiencia clínica de los autores que permitan a los lectores establecer unos criterios diagnósticos y orientarles hacía la mejor indicación terapéutica.
MetodologíaLa presente revisión bibliográfica se ha realizado en las bases de datos más importantes en el ámbito de la salud, aunque se ha focalizado en MEDLINE, a través de Pubmed de forma retrospectiva y hasta julio de 2016. Para la selección de artículos se utilizaron como criterios de búsqueda las palabras claves «diabetic foot osteomyelitis» incluidas en el título o en el abstract. También se incluyeron en la revisión las versiones actuales de las guías internacionales de consenso sobre evaluación y manejo de las infecciones de pie diabético publicadas por la «Infection Diseases American Association», guía IDSA 2012 y el «International Working Group of Diabetic Foot», guía IWGDF 2015.
La selección de los artículos se ha realizado de forma discrecional y a criterio del autor, centrándose en los aspectos de diagnóstico y tratamiento de la OM de PD. Una vez revisados los trabajos la presente revisión se ha estructurado en los apartados de diagnóstico de la OM de PD (diagnóstico clínico, pruebas de laboratorio, análisis microbiológico e histológico y pruebas de imagen) y tratamiento de la OM de PD (tratamiento médico y quirúrgico).
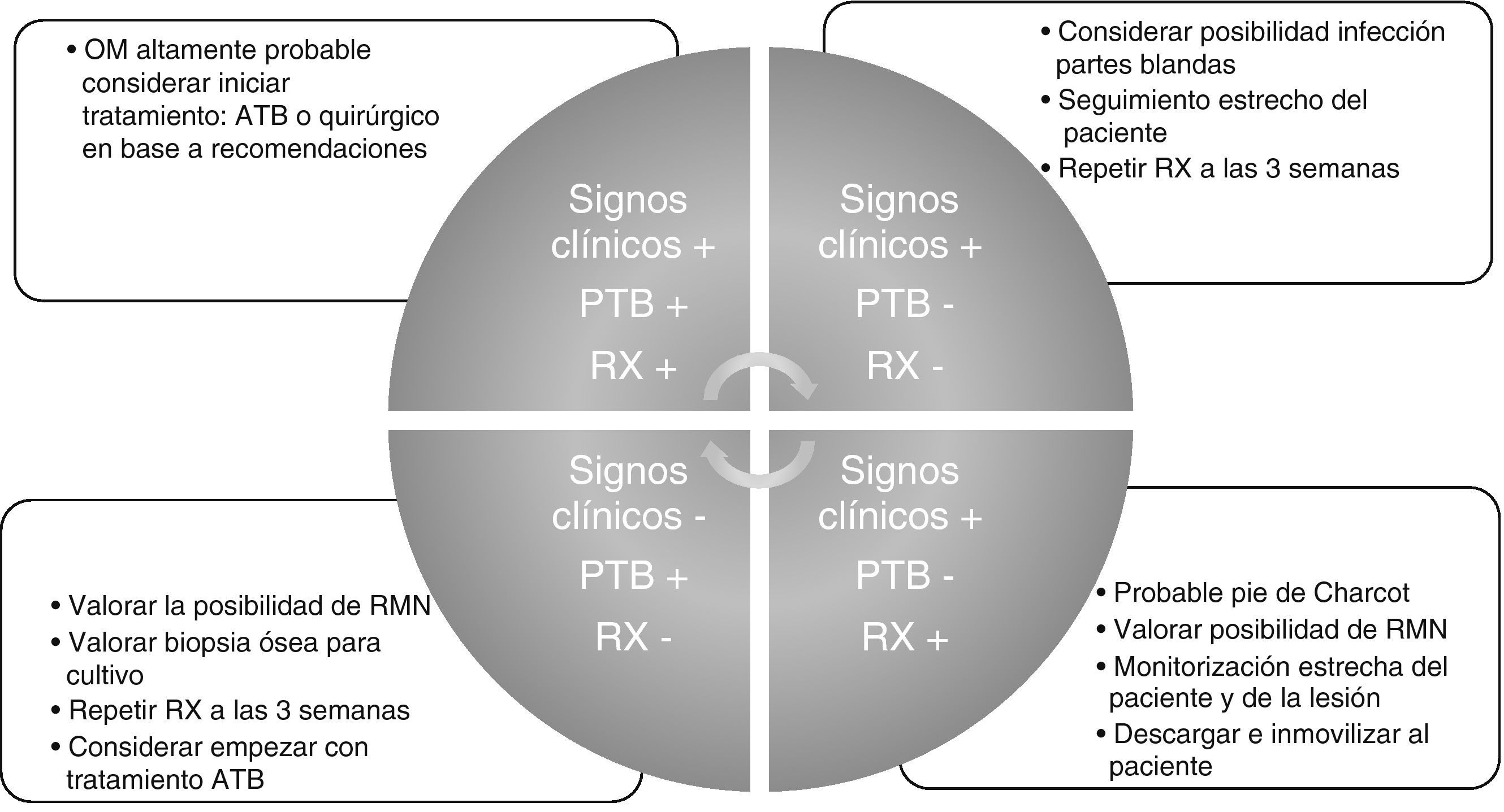
Diagnóstico de la osteomielitis de pie diabéticoEl diagnóstico de la OM de pie diabético comienza siempre con la sospecha clínica del padecimiento de la infección. Este supuesto es relativamente evidente cuando la OM se relaciona con infección de partes blandas puesto que va a haber una repuesta inflamatoria de estos tejidos. La presencia de signos clínicos inflamatorios en una úlcera cercana a una prominencia ósea (dolor, calor, rubor, tumor y celulitis) y/o la presencia de descarga purulenta o sinovial de una articulación son signos sugerentes de OM. Sin embargo de acuerdo a lo publicado en la literatura, los datos clínicos que se relacionan con la infección ósea no tienen un gran peso en su diagnóstico6.
Que el hueso sea visible a través de la úlcera, la exposición de estructuras capsulares, la presencia de un granuloma no adherido al lecho de la úlcera, la aparición de un dedo en salchicha (inflamación grosera de un dedo del pie que elimina la identificación de pliegues articulares) y/o una úlcera que no evoluciona en un período de 12 semanas en un paciente sin isquemia y con un dispositivo de descarga adecuado, son datos que se relacionan directamente con OM de pie diabético5.
Debemos tener en cuenta, que debido a la neuropatía diabética presente en la mayoría de los pacientes con osteomielitis, los signos y síntomas clínicos de la infección se silencian5. De la misma forma la presencia de enfermedad vascular periférica puede minimizar la presentación clínica. Estas circunstancias han propiciado que se describan en la literatura distintas presentaciones clínicas de la OM que a su vez se asocian a diferentes pronósticos7.
Sin embargo, la principal dificultad relacionada con el diagnóstico de la OM es la posibilidad de que el paciente padezca infección del hueso sin la coexistencia de ninguna manifestación clínica, circunstancia que ocurre en aproximadamente el 50% de las OM crónicas o en fase de fibrosis8.
Una vez que existe la sospecha clínica de OM o se quiere descartar la presencia de la misma se puede recurrir a dos pruebas clínicas que la literatura recomienda usar de forma combinada. La primera de ella es el test del probing to bone (PTB), consistente en la palpación de hueso a través de la úlcera con un estilete romo y estéril. Sus cifras de sensibilidad y especificidad se establecen en 0,87 y 0,91 respectivamente, su valor predictivo positivo (VPP) en 0,57 y su valor predictivo negativo (VPN) en 0,989. Un artículo que resumió la evidencia disponible en el diagnóstico de la OM de PD, afirmó que presentar un PTB positivo en una herida infectada es altamente sugestivo de OM, pero que si el PTB es negativo no es excluyente de diagnosticar OM10. En úlceras no infectadas, o en un paciente de bajo riesgo, la presencia de OM es poco probable si el PTB es negativo y en el caso de ser positivo, tiene una baja especificidad10. Un artículo11, publicó tasas de eficiencia del PTB del 94%, con una sensibilidad del 98% y una especificidad del 78%, un VPP del 95% y un VPN del 91%, lo que situaría al test del PTB como una herramienta eficaz en el diagnóstico de la OM.
Sin embargo, recientemente hay autores que han cuestionado la utilidad de esta prueba sobre todo en relación con el tipo de paciente en el cual esta podría ser más precisa12, matizando que presentar un PTB positivo no es sinónimo de presentar OM, y sugiriendo que el PTB se podría interpretar más como un método de screening y no como una prueba diagnóstica. De la misma forma alertan de que el uso sistemático e indiscriminado de este test podría generar sobrestimaciones, lo que conllevaría a tratamientos injustificados con terapias antibióticas, con el riesgo de generar resistencias. Evidentemente el resultado del PTB va a estar relacionado con la prevalencia de la enfermedad como ocurre en cualquier otra prueba diagnóstica.
Por tales motivos es recomendable interpretar siempre el PTB en asociación a la realización de una radiografía simple (RX).
Una de las principales dificultades de la interpretación diagnóstica de la OM mediante una RX, es que se tarda aproximadamente 2 semanas en que la pérdida ósea sea visible5, por lo que la recomendación es que se realice una radiografía al inicio y otra pasadas 2 semanas. En el caso de que no haya hallazgos radiológicos en el seguimiento, es poco probable que el paciente tenga OM, sin embargo, si se han desarrollado erosiones óseas es muy probable que tenga OM5. En una revisión10 indicaron, que debido a que los estudios publicados no evaluaron las radiografías de manera seriada, su exactitud como método diagnóstico es baja-moderada, probablemente por el retraso en que los cambios radiológicos sean visibles.
Otra dificultad es la interpretación de la RX de manera aislada, es decir, sin conocer las características clínicas de la úlcera, circunstancia que a menudo ocurre cuando el radiólogo informa la RX sin ver al paciente. La interpretación de la RX sin ver al paciente ni conocer su historia o antecedentes genera una baja asociación diagnóstica, incluso entre clínicos experimentados13. Este aspecto sugiere que siempre la RX debe ser interpretada de forma adicional al informe radiológico por el clínico que la solicitó.
Aunque el nivel y magnitud de la destrucción ósea observada en la radiografía tiene una clara influencia diagnóstica, no se ha asociado a ningún valor pronóstico cuando se tratan quirúrgicamente14.
La mayoría de los autores coinciden en que se puede realizar un diagnóstico preciso de la OM de PD cuando el PTB es positivo y hay signos radiológicos de destrucción ósea (sensibilidad del 97%, especificidad de 92%, VPP del 97% y un 93% de VPN), aunque también hay cierta influencia dependiendo del personal sanitario que lo valora y su nivel de especialización en el manejo del pie diabético15,16.
Por lo tanto es recomendable que la interpretación diagnóstica de ambas pruebas se realice de forma conjunta: PTB y RX simple, lo que aumenta la concordancia diagnóstica y disminuye la variabilidad entre los clínicos que las interpretan17.
Una vez que la sospecha diagnóstica se complementa con la asociación de las pruebas clínicas descritas anteriormente es recomendable contar con una analítica del paciente que nos pueda aportar cierta información en relación con el padecimiento de la OM. Se ha demostrado que la infección altera el control metabólico de los pacientes, siendo especialmente sensible los cambios en los niveles de glucemia4. Sin embargo en el caso de la OM no es frecuente encontrar alteraciones en los marcadores inflamatorios clásicos y aunque se han publicado diferentes artículos en búsqueda de algún marcador analítico que facilite el diagnóstico de la OM, lo cierto es que los datos aún no son concluyentes.
El biomarcador que ha demostrado tener más peso en el diagnóstico de la OM es la velocidad de sedimentación globular (VSG), un artículo de Malabu et al.18, concluyó que de los parámetros hematológicos, la VSG tenía la mejor discriminación diagnóstica entre la OM y la celulitis. Un estudio que comparó los hallazgos clínicos y de laboratorio en pacientes con y sin OM19, obtuvo como resultado que la unión de una VSG≥65mm/h y un tamaño de úlcera ≥2cm2 tuvo una sensibilidad del 83%, una especificidad del 77%, un VPP del 80% y un VPN del 81%, en el diagnóstico de la OM. Se ha consensuado acerca de que un valor superior a 70mm/h de VSG aumenta la probabilidad de padecer OM y actualmente sigue siendo la prueba de laboratorio más útil y estudiada para el diagnóstico de la OM de PD20,21. No obstante es importante recordar que es posible padecer una infección ósea con valores normales de VSG, siendo este por tanto un valor sumatorio pero no imprescindible para el diagnóstico de la OM al igual que la interpretación de otros marcadores inflamatorios22.
La utilidad de la proteína C reactiva (PCR) es escasa en comparación con la VSG o incluso la procalcitonina (PCT)10. Se ha demostrado que en las infecciones de PD existen alteraciones en la determinación en suero de PCT, aunque se requieren investigaciones adicionales para determinar su valor5.
Independientemente del valor diagnóstico de estos marcadores inflamatorios algún estudio ha intentado demostrar su utilidad en el pronóstico de estos pacientes o incluso como marcadores de curación de la OM. Un estudio que combinó la VSG y la PCR para evaluar los resultados del tratamiento de la OM de PD23, observó que estos marcadores no se relacionaron con la remisión de la OM, ni con la curación. Los valores más altos de VSG se asociaron a pobres resultados de tratamiento, y se demostró que un menor número de recuento de células blancas y menor tasa de filtrado glomerular, estaban relacionados con la remisión de la infección ósea. Otro estudio demostró que los pacientes tratados de OM normalizaban sus tasas de VSG cuando estos cicatrizaban independientemente del tratamiento recibido, no existiendo correlación ninguna con los valores de la PCR24.
Otros marcadores analíticos se han evaluado para el seguimiento de la OM, sin mucho éxito. Es el caso de un estudio de casos-controles25, que evaluó el aminotelopéptido terminal y la fosfatasa alcalina ósea, como marcadores de recambio óseo que podrían ayudar con el diagnóstico y seguimiento de los pacientes con OM, pero no se observaron diferencias significativas en estos niveles, siendo similares al ingreso y a las 6 semanas de tratamiento, incluso en pacientes con mal resultado frente a los pacientes con resultado favorable. Otro estudio26 analizó los marcadores inflamatorios para el diagnóstico y el seguimiento de la OM de PD, demostrando que la PCT se comportó como el mejor marcador para distinguir los pacientes que padecen de OM en el diagnóstico inicial. Las citoquinas proinflamatorias no parecieron ser útiles en la diferenciación de infección ósea y de tejido blando, aunque la interleuquina-6 (IL-6) junto a PCR, VSG y PCT, se redujeron en los pacientes con OM frente a los pacientes con infección de tejidos blandos.
Algunos datos experimentales indican que los niveles de factor de necrosis tumoral α elevados, pueden estar directamente relacionados con los cambios histopatológicos de la OM, y que la liberación local de la IL-6 también se incrementa en la OM bacteriana27.
Aunque en el momento actual no existen suficientes evidencias sobre la utilidad de estos parámetros, las directrices actuales de la guía IDSA4 sugieren que la disminución de los marcadores previamente elevados pueden ser de ayuda en la suspensión del tratamiento antibiótico. Así mismo la exploración clínica en combinación con la determinación de las pruebas de laboratorio pueden ser indicadores importantes de la presencia de OM, sin necesidad de realizar pruebas complementarias de imagen más caras19,22.
Cuando el diagnóstico de la OM no puede llevarse a cabo con los métodos descritos anteriormente o existen dudas sobre el diagnóstico diferencial del padecimiento se puede recurrir a pruebas más especializadas como la resonancia magnética nuclear (RMN). La RMN se considera la prueba de imagen más precisa, de las pruebas disponibles para el diagnóstico de la OM (sensibilidad 90%, especificidad 83%)28, ya que la interpretación de sus imágenes ha demostrado ser la modalidad de imagen más exacta, aunque su precisión en presencia de isquemia aún no es clara29. Los estudios han demostrado que posee la mejor precisión diagnóstica, además de ser bastante útil para evaluar la extensión y la profundidad de los tejidos blandos infectados, aunque la especificidad puede verse afectada por la dificultad de distinguir la OM de otras causas de edema medular10. Tiene la ventaja de que puede usarse tanto para diagnóstico, como para tratamiento y seguimiento de los pacientes30.
La tomografía axial computarizada (TAC) se ha usado a lo largo de los años combinada con diferentes marcadores para el diagnóstico diferencial de otras dolencias, como es el caso del pie de Charcot en el que se ha descrito la utilidad de la TAC por emisión de positrones con 18F-fluordesoxiglucosa15. Otro estudio valoró la eficacia de diagnóstico de la OM mediante TAC con emisión de fotón único 67Ga combinado con la biopsia percutánea, obteniendo dicha combinación una alta precisión y seguridad para el diagnóstico de la OM, en pacientes sin signos de infección en tejidos blandos31.
Las técnicas híbridas de 18F-FDG PET y PET/CT se han convertido en técnicas de imagen alternativas para el diagnóstico de la OM, pero los resultados obtenidos hasta ahora son preliminares y se necesitan investigaciones adicionales, además de que las fluctuaciones de glucosa pueden afectar a la captación tisular del 18F-FDG30.
La TAC con marcador de glóbulos blancos, se ha utilizado para la evaluación de la remisión de la OM, con una sensibilidad, especificidad, VPP y VPN para predecir la recidiva de OM del 100, 91,5, 71,5 y 100%, respectivamente, frente al 80, 33, 20 y 89% que presentan las radiografías y frente al 100, 12,5, 15,5 y 100% que presenta la gammagrafía ósea de 3 fases32. Otro estudio en el que realizaron TAC con marcadores de células blancas, antes y después del tratamiento de la OM, no obtuvo resultados concluyentes sobre su utilidad en el pronóstico de los pacientes33.
La gammagrafía ósea como prueba diagnóstica de la infección ósea, se considera demasiado inespecífica, excepto en el caso de la gammagrafía con leucocitos marcados que ha demostrado una utilidad moderada en el diagnóstico de la OM aunque su precisión en la localización anatómica de la infección ósea no es la ideal5,30.
El escáner óseo con tecnecio-99 de triple fase, también ha sido utilizado en el diagnóstico de la OM, sin embargo el número de falsos positivos es alto dada su baja especificidad, además puede continuar siendo positivo tras 4 meses de terapia exitosa10. El escáner óseo con células blancas como radiomarcador es útil en el diagnóstico y la evaluación del seguimiento de la OM tratadas con tratamiento médico, pero se trata de una prueba cara, que consume mucho tiempo y es menos específica que la RMN10.
El aislamiento del patógeno causante de la infección tiene una importancia capital, sobre todo cuando los pacientes están siendo tratados exclusivamente con ATB34. No existe consenso en la forma en la que se debe tomar la muestra ósea para cultivo, aunque es asumido que solo el cultivo de hueso tiene utilidad de cara al pronóstico de los pacientes.
El cultivo mediante frotis no es fiable y se corre el riesgo de aislar microorganismos no implicados en la OM, produciendo resistencias bacterianas y empeorando el cuadro. Senneville et al.35, demostraron que los resultados obtenidos mediante frotis no identificaban de forma fiable las bacterias que se aislaban en las muestras óseas ya que solo en el 17,4% (n=12) de las muestras fueron idénticas (cultivo óseo y de frotis). Elamurugan et al.36 concluyeron que el cultivo por frotis no es tan preciso en la identificación de todos los microorganismos responsables de la OM, frente a la toma de biopsias óseas. Otro artículo, publicado por Malone et al.37, concluyeron que los cultivos profundos de la úlcera se correlacionan bien con los cultivos óseos (25 de 34 casos, 73,5%, p<0,001) y por lo tanto proporcionan un método sensible para la evaluación y la orientación de probables patógenos que causan infecciones óseas, además de ayudar en la elección del antibiótico cuando no existe posibilidad de toma de biopsia ósea.
El procedimiento de toma de muestra para cultivo óseo puede influir también en el resultado, ya que se pueden producir falsos positivos, debido a la posible contaminación durante la toma de la muestra a través de la úlcera, o bien falsos negativos en el caso de pacientes con tratamiento previo o muestras recogidas erróneamente de un área no infectada5. En la última guía de consenso publicada por el IWGDF21 se define como la mejor alternativa la recogida de muestra ósea mediante procedimiento percutáneo35. Sin embargo este método precisa de profesionales entrenados, además de necesitar un fluoroscopio que guíe el trocar de biopsia y realizarse en un entorno quirúrgico. La toma de muestra a través de la úlcera, parece todavía una alternativa fiable, pero hay que tener en cuenta que debe realizarse tras un cuidadoso desbridamiento de la herida y siempre tener en cuenta un período de lavado previo de antibióticos de al menos 48-72 h38.
El estudio histológico de la muestra ósea se sigue considerando hoy en día como el «gold standard» para el diagnóstico de la OM. Se ha demostrado que existen cuatro tipos diferentes de OM atendiendo al infiltrado inflamatorio del tejido. Pudiendo presentarse como OM crónica, aguda, crónica-agudizada o fibrosis8. Este estudio ha permitido entender por qué las presentaciones clínicas de la OM son tan variadas, y conocer que en la OM crónica y fibrótica en la mayoría de los casos hay ausencia de signos clínicos. La definición de estos patrones histológicos ha ayudado a la coincidencia diagnóstica por parte de los patólogos que anteriormente carecían de un protocolo teórico de análisis histológico de este tipo de infecciones39. También se conoce que los cambios histológicos producidos por la OM son claramente diferenciables de los que se producen en el pie de Charcot40.
En los últimos tiempos está cobrando fuerza el estudio del microbioma de las bacterias que producen OM de PD, mediante técnicas de secuenciación genética41. En el análisis comparativo de las muestras mediante esta técnica frente a las técnicas convencionales, se aíslan más patógenos anaerobios, un mayor número de bacilos grampositivos y una mayor proporción de infecciones polimicrobianas. El uso de la tecnología biológica molecular avanzada es de particular interés en la OM especialmente en circunstancias en las que la cronicidad de la infección y la adhesión de las bacterias, dificulta el aislamiento de los patógenos implicados41.
Tratamiento de la osteomielitis de pie diabéticoExisten diferentes artículos en la literatura sobre el tratamiento de la OM, pero a día de hoy no se ha llegado a un consenso sobre cuál es la mejor opción terapéutica para resolverla. No es sencillo estandarizar una opción de tratamiento única, ya que la OM de PD no es homogénea, pudiendo tener varias presentaciones clínicas y estar asociada o no a isquemia y a infección de tejidos blandos. Por otra parte, la especialización médica o quirúrgica del profesional que trata al paciente y el entorno asistencial en el que se maneje, marcan claramente una preferencia por una opción de tratamiento u otra: médico (exclusivamente con antibióticos) o quirúrgico.
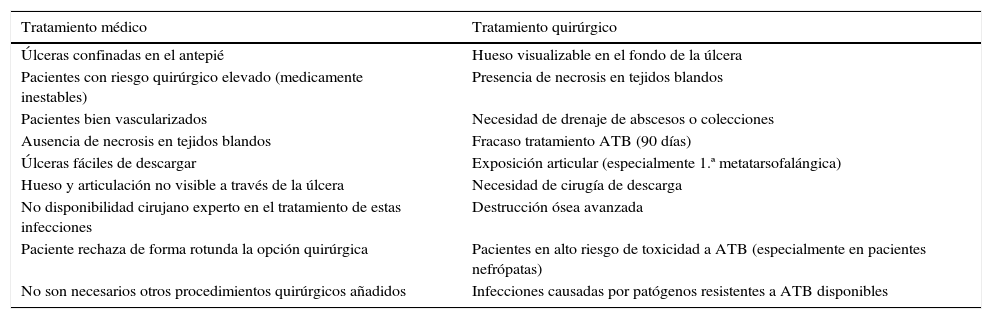
Existe un cierto consenso en cuándo la primera opción de tratamiento debiera ser médica o quirúrgica (tabla 1)42.
Indicaciones de tratamiento primario dependiendo de las características del paciente y de la lesión asociada a osteomielitis de pie diabético
| Tratamiento médico | Tratamiento quirúrgico |
|---|---|
| Úlceras confinadas en el antepié | Hueso visualizable en el fondo de la úlcera |
| Pacientes con riesgo quirúrgico elevado (medicamente inestables) | Presencia de necrosis en tejidos blandos |
| Pacientes bien vascularizados | Necesidad de drenaje de abscesos o colecciones |
| Ausencia de necrosis en tejidos blandos | Fracaso tratamiento ATB (90 días) |
| Úlceras fáciles de descargar | Exposición articular (especialmente 1.ª metatarsofalángica) |
| Hueso y articulación no visible a través de la úlcera | Necesidad de cirugía de descarga |
| No disponibilidad cirujano experto en el tratamiento de estas infecciones | Destrucción ósea avanzada |
| Paciente rechaza de forma rotunda la opción quirúrgica | Pacientes en alto riesgo de toxicidad a ATB (especialmente en pacientes nefrópatas) |
| No son necesarios otros procedimientos quirúrgicos añadidos | Infecciones causadas por patógenos resistentes a ATB disponibles |
Modificada de Lipsky42.
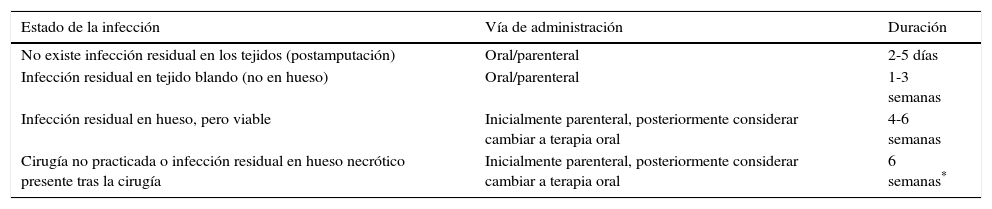
La duración del tratamiento ATB varía mucho en la literatura: de pocas semanas a más de un año. Los principales aspectos a tener en cuenta son cuándo realizar una resección ósea, qué antibiótico usar, por qué vía de administración, y durante cuánto tiempo (tabla 2)4,43. Es recomendable asegurar el diagnóstico de la OM previamente a la administración de ATB y pensar en la toma de cultivo óseo cuando se opte por tratar al paciente exclusivamente con ATB para reducir la posibilidad de generar resistencias21.
Recomendaciones sobre la vía de administración y la duración de la terapia antibiótica en relación con la presencia de infección residual en los tejidos y a la realización de desbridamiento quirúrgico previo
| Estado de la infección | Vía de administración | Duración |
|---|---|---|
| No existe infección residual en los tejidos (postamputación) | Oral/parenteral | 2-5 días |
| Infección residual en tejido blando (no en hueso) | Oral/parenteral | 1-3 semanas |
| Infección residual en hueso, pero viable | Inicialmente parenteral, posteriormente considerar cambiar a terapia oral | 4-6 semanas |
| Cirugía no practicada o infección residual en hueso necrótico presente tras la cirugía | Inicialmente parenteral, posteriormente considerar cambiar a terapia oral | 6 semanas* |
Modificada de Guía IDSA 20124.
Varios artículos han demostrado la eficacia del tratamiento médico para la OM. En un artículo de Embil et al.44, concluyeron que la OM se gestionó bien con tratamiento oral, con o sin desbridamiento en la mayoría de los casos (el 28% de las OM precisaron desbridamiento óseo y el 10% una amputación menor), y además añadieron que este tratamiento sería útil en centros en los que los especialistas en enfermedades infecciosas y los recursos operativos son limitados. En un estudio retrospectivo34 evaluaron los resultados de la OM tratados sin cirugía, obteniendo que la terapia guiada por cultivo óseo es un factor de predicción de éxito en pacientes diabéticos tratados sin cirugía, asociándose a la remisión de la infección. Un estudio prospectivo45 obtuvo que en el 66,9% de los casos curaron únicamente con antibiótico y el 13,9% requirió amputación, de los cuales un 1,5% fueron amputación mayor. En un estudio46, se describió la combinación de rifampicina y ofloxacino oral como tratamiento de la OM leve a moderada, aplicado una media de seis meses, definiendo la curación como desaparición de los signos y síntomas de infección y no padecer recaídas durante el seguimiento, obteniendo curación en un 88,2% de los pacientes y de estos el 76,5% se mantuvo en remisión durante un seguimiento medio postratamiento de 22 meses. Otro estudio47, identificó las variables clínicas que influyen en el resultado del tratamiento no quirúrgico de la OM, observando que en un seguimiento de 12 meses, el 63,5% de los pacientes tratados remitieron la infección (no signos clínicos ni radiológicos de infección), por lo que casi 2/3 con OM se curaron sin necesidad de realizar una resección ósea.
Otra opción de tratamiento es la aplicación local de ATB que cuenta con las ventajas de reducir la duración de la ATB oral, reducir costes hospitalarios, utilizar mayores concentraciones de ATB en la zona afectada con menores efectos farmacocinéticos y mayor capacidad frente a bacterias resistentes48,49. No obstante los datos disponibles hasta el momento acerca de esta terapia son insuficientes para evaluar su eficacia en la OM de PD4,21.
Pese a que parece demostrado que los cultivos óseos y la biopsia ósea ayudan a la correcta elección de la antibioterapia, no hay datos suficientes que indiquen cuál es la vía de administración idónea, ni su duración50. Un reciente estudio51 demostró que seis semanas de tratamiento obtienen los mismos resultados que doce, con una mejor tolerancia gastrointestinal, por lo que se ha asumido esta duración como suficiente para el tratamiento de la OM21.
Las principales limitaciones del tratamiento de la OM exclusivamente con ATB son: la necesidad de obtener un cultivo óseo para garantizar un buen pronóstico, la carencia de criterio sobre elección de la vía de administración en base a la severidad de la infección y las resistencias bacterianas, la ausencia de consenso sobre la duración idónea del tratamiento, mayores tasas de amputación mayor, mayor riesgo de recurrencia, la toxicidad asociada al ATB, la posibilidad de creación de resistencias bacterianas y la falta de certeza sobre la curación de la infección ósea, ya que en la mayoría de los estudios publicados se considera como éxito terapéutico la remisión de los signos de infección42,52.
Las ventajas del tratamiento antibiótico son: evitar posibles complicaciones relacionadas con el procedimiento quirúrgico, poder realizarse en cualquier entorno asistencial, la reducción de costes relacionados con la cirugía y evitar alteraciones anatómicas relacionadas con la técnica quirúrgica42.
De igual forma existen unos criterios donde la cirugía debiera ser la primera opción terapéutica (tabla 1). No obstante, siempre ante un fracaso de la terapia ATB debe considerarse la opción quirúrgica. Karchmer y Gibbons publicaron el primer artículo sobre la efectividad del tratamiento quirúrgico en pacientes con OM de PD en una serie de 110 pacientes con diagnóstico comprobado por biopsia ósea en el 96% de los casos, obteniendo una tasa de amputación mayor del 19% y una tasa de curación del 50%53. Un estudio posterior54, que evaluó los resultados del tratamiento quirúrgico en una serie de casos con OM confirmada mediante histopatología, concluyó que la cirugía conservadora sin amputación menor o mayor es un éxito en casi la mitad de los casos de OM de PD.
En los casos en los que la cirugía retira parcialmente la infección ósea, se han desarrollado estrategias55, mediante el uso postoperatorio de una solución superoxidada, en los que se logró el salvamento de la extremidad en el 100% de los casos, con una curación media de 6,8 semanas.
La cirugía conservadora, entendida como aquella en la que solo se retira el hueso infectado sin necesidad de practicar ninguna amputación, combinada con el tratamiento antibiótico es una opción atractiva, ya que podría reducir los cambios en la biomecánica del pie y reducir al mínimo la duración de la terapia antibiótica52; se acepta que la combinación de antibiótico con la extirpación quirúrgica del hueso infectado puede curar la mayoría de las OM52 y es eficaz tanto en la curación clínica como en el salvamento de la extremidad56.
En el año 2014, se publicó el primer ensayo clínico aleatorizado prospectivo24 que comparaba el tratamiento quirúrgico frente al tratamiento médico para la OM, concluyendo que la terapia antibiótica y el tratamiento quirúrgico tenían resultados similares en cuanto a las tasas de curación, tiempo de curación y las complicaciones a corto plazo en pacientes con úlceras neuropáticas del antepié sin necrosis de tejidos blandos. Un artículo retrospectivo, comparó pacientes con OM a los que se les trató mediante cirugía frente a tratamiento antibiótico, obteniendo resultados similares en ambos grupos57. Debido al alto riesgo de reulceración que suponen la eliminación de la cabeza de un metatarsiano58, es necesario tener en cuenta la aplicación de técnicas quirúrgicas que reduzcan esta posibilidad. La proporción de hueso metatarsal que se reseccione y la longitud del primer metatarsiano son factores que se han relacionado con el riesgo de reulceración posquirúrgica59,60.
Las ventajas de la cirugía son: reducir la duración de la terapia ATB, menores tasas de amputación mayor, permite la recogida de muestras óseas para el análisis microbiológico e histológico, permite la retirada del hueso necrótico, elimina las bacterias y el biofilm, previene recurrencias al eliminar las prominencias óseas y además supone una oportunidad para estabilizar el pie42.
Las desventajas de la cirugía serían la posibilidad de aumentar el riesgo de reulceración, los costes del procedimiento, aumentar el riesgo de morbilidad perioperatoria, la desestabilización del pie y el aumento del riesgo de reulceración por transferencia42.
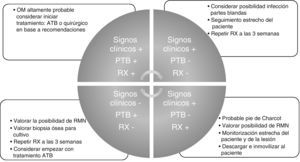
A modo de conclusión y resumen aportamos nuestra propuesta de orientación diagnóstica e inicio de tratamiento que puede aplicarse a cualquier entorno asistencial donde se trate el paciente y por cualquier especialidad tanto médica como quirúrgica (fig. 1).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.