Los estudios que relacionan la enfermedad periodontal (EP) y la diabetes mellitus gestacional (DMG) no son concordantes. Nuestro objetivo principal es evaluar la posible asociación entre la EP y la DMG. Además, analizamos los factores de riesgo para la DMG en nuestra muestra.
MétodosParticiparon 180 gestantes, 90 con DMG y 90 controles, del Hospital La Fe de Valencia. Se pasó un cuestionario y realizo un examen periodontal, valorándose los siguientes parámetros: número de dientes, índices de placa y sangrado al sondaje, profundidad de sondaje (PS) y nivel de inserción de clínica (NIC). La periodontitis se definió según criterios de la CDC-AAP.
ResultadosLas DMG tuvieron mayor valor promedio de PS (p = 0,001) y NIC (p = 0,028). Un 74,4% de las pacientes con DMG presentaron inflamación gingival vs. 57,8% de las no diabéticas. La periodontitis fue más prevalente en las pacientes con DMG (p < 0,05). La edad materna, el nivel de estudios y la presencia de periodontitis son factores independientes de riesgo para la DMG (OR = 1,16, IC 95% 1,07 a 1,25, p < 0,001), (OR = 0,37, IC 95% 0,19 a 0,72, p < 0,005) y (OR = 2,79, IC 95% 1,40 a 5,59, p < 0,005), respectivamente.
ConclusionesLos resultados sugieren que las embarazadas con diabetes gestacional asocian más enfermedad periodontal que aquellas sin dicha enfermedad gestacional. En nuestra muestra el riesgo de DMG puede estimarse a partir de la periodontitis, la edad y el nivel de estudios.
Studies linking periodontal disease (PD) and gestational diabetes mellitus (GDM) are not consistent. Our main objective is to evaluate the possible association between PD and GDM. We also analysed the risk factors for GDM in our sample.
Methods180 pregnant women participated, 90 with GDM and 90 controls, from Valencia's Hospital La Fe. A questionnaire was completed and a periodontal examination was performed, assessing the following parameters: number of teeth, plaque and bleeding on probing indices, probing depth (PD) and clinical attachment level (CAL). Periodontitis was defined according to the criteria of CDC-AAP.
ResultsThe GDM group had a higher mean value of PD (p = .001) and CAL (p = .028). Of the patients with GDM, 74.4% had gingival inflammation compared to 57.8% of the non-diabetic patients. Periodontitis was more prevalent in patients with GDM (p < .05). Maternal age, educational level and periodontitis are independent risk factors for GDM (OR = 1.16, 95% CI 1.07 to 1.25, p < .001), (OR = .37, 95% CI .19 to .72, p < .005) and (OR = 2.79, 95% CI 1.40 to 5.59, p < .005) respectively.
ConclusionsThe results suggest that pregnant women with gestational diabetes have more associated periodontal disease than those without gestational diabetes. In our sample, the risk for GDM can be estimated from periodontitis, age, and educational level.
La enfermedad periodontal (EP) abarca patologías infecciosas que afectan a los tejidos de soporte del diente. La gingivitis afecta únicamente la encía y es un proceso inflamatorio reversible mientras que la periodontitis es una infección bacteriana multifactorial que además de inflamación gingival cursa con la destrucción irreversible de las estructuras de soporte del diente1. La periodontitis tiene consecuencias tanto a nivel oral, siendo la más importante la pérdida de dientes, como a nivel sistémico, provocando un aumento del riesgo de sufrir enfermedades cardiovasculares y de descompensación de diabetes entre otros2. Las enfermedades periodontales afectan mundialmente a una gran parte de la población, siendo la periodontitis avanzada la sexta enfermedad más prevalente del planeta3.
La diabetes mellitus gestacional (DMG) es una intolerancia a la glucosa que se detecta por primera vez durante el embarazo y aparece en un 10-25% de los embarazos, dependiendo de la población estudiada y del criterio diagnóstico utilizado. Es la complicación médica más común del embarazo y su incidencia va en aumento4. Las diabéticas gestacionales son más propensas a desarrollar preeclampsia, aborto, partos prematuros y diabetes mellitus tipo 2 (DM2) en el futuro. Los neonatos de mujeres con DMG tienen más probabilidad de padecer hipoglucemia neonatal, problemas respiratorios o macrosomía5. Los niños nacidos de madres con DMG tienen mayor riesgo de obesidad y de sufrir DM2 en su vida adulta6. Los factores de riesgo para desarrollar DMG incluyen la edad materna avanzada, obesidad, grupo étnico, DMG en embarazos previos, macrosomía en partos anteriores, síndrome del ovario poliquístico, síndrome metabólico, familiares de primer grado con diabetes mellitus, niveles de colesterol HDL < 35 mg/dL o triglicéridos > 250 mg/dL, hipertensión arterial o enfermedad cardiovascular previa y gestación múltiple7.
Se han propuesto dos posibles mecanismos patogénicos por los que la EP afectaría a los resultados del embarazo1,8. En primer lugar, la vía directa, donde los microorganismos orales y sus productos podrían llegar a la unidad feto-placentaria e inducir directamente a la inflamación. El segundo mecanismo propuesto, la vía indirecta, se refiere a la inflamación sistémica de bajo grado que produce la periodontitis. Los pacientes con EP tienen aumentados distintos marcadores sistémicos de inflamación. Los mediadores inflamatorios y citoquinas producidos en los tejidos periodontales y otros órganos como el hígado, tales como las interleucinas-1 (IL-1), IL-6, IL-8, las alarminas, el TNF-α o las prostaglandinas E2 (PGE2), circulan por el torrente sanguíneo y podrían influir en la unidad feto-placentaria e inducir a complicaciones perinatales9.
Los resultados adversos del embarazo son un problema de salud pública y muchos estudios indican que la EP en gestantes podría causar complicaciones perinatales9–11. En embarazadas la periodontitis se ha asociado con partos prematuros, recién nacidos de bajo peso y preeclampsia8–12. Existen diferentes trabajos que estudian la relación de la periodontitis con la DMG. Sin embargo, los resultados son contradictorios. Algunos no encuentran asociación, en tanto que otros sí13,14.
El establecer una relación entre una salud periodontal deficiente y la DMG ayudaría a reducir la incidencia de la DMG y las repercusiones con ella asociadas.
Nuestro objetivo es el estudio de la posible relación entre la DMG y la EP. Como objetivo secundario hemos analizado los factores de riesgo para la DMG en nuestra muestra.
Material y métodoDiseñoSe trata de un estudio observacional del tipo casos y controles y transversal, donde se compara el estado periodontal de 90 gestantes con DMG (casos) y 90 sin DMG (controles), controladas en el Servicio de Obstetricia y Ginecología del Hospital U.P. La Fe de Valencia.
Los criterios de inclusión fueron:
- 1)
Edad gestacional mayor de 24 semanas.
- 2)
Cribado completo de DMG.
- 3)
Mayores de 18 años.
- 4)
Consentimiento informado.
Los criterios de exclusión fueron:
- 1)
Diabetes pregestacional tipo 1 o 2.
- 2)
VIH y enfermedades autoinmunes.
- 3)
Menos de 14 dientes.
- 4)
Haber recibido tratamiento periodontal durante los tres meses previos al estudio.
- 5)
Consumo de drogas, insulina o antidiabéticos orales antes del embarazo.
- 6)
Consumo de corticoides.
Los casos fueron gestantes diagnosticadas de DMG siguiendo los criterios diagnósticos recomendados por la National Diabetes Data Group (NDDG)15. A las embarazadas de alto riesgo para desarrollar DMG (con uno o más de los factores de riesgo indicados previamente) se realizó el despistaje con 50 g de glucosa vía oral (test de O’ Sullivan) en la primera visita del embarazo y si fuese necesario a las 24-28 y 32-36 semanas de la gestación16. En las gestantes de riesgo moderado-bajo, sin ninguno de los factores de riesgo, se les realizó una prueba entre las semanas 24-2816. Si el test de O’ Sullivan fue ≥140 mg/dL, se practicó la sobrecarga oral de glucosa (SOG) administrando 100 g de glucosa17. Las embarazadas con al menos dos de los siguientes valores patológicos (≥ 105 mg/dL, ≥ 190 mg/dL, ≥ 165 mg/dL y ≥ 145 mg/dL; basal, 1ª, 2ª y 3ª hora, respectivamente) fueron diagnosticadas de DMG. Los casos y controles incluyeron gestantes de la misma edad gestacional con y sin DMG respectivamente que cumplían los criterios de selección.
Definición y medidas periodontalesTodos los registros periodontales fueron realizados por un único dentista mediante espejo bucal número 5 y sonda periodontal PQ-W Williams (Hu-Friedy, Chicago, IL, EE. UU.). Cada diente se exploró en seis zonas (mesiovestibular, vestibular, distovestibular, mesiolingual, lingual, distolingual). Los parámetros registrados fueron:
- -
El número de dientes que presentaba cada paciente excluyendo los terceros molares.
- -
El índice de placa (IP) se calcula como el porcentaje de superficies que presentan placa en relación con el número total de superficies dentales evaluadas. El IP sirve para cuantificar el nivel de higiene oral del paciente. Se consideró que la higiene oral era aceptable cuando el IP era < 20%.
- -
El índice de sangrado al sondaje (IS) fue el método usado para valorar la inflamación gingival calculado como la proporción de zonas sangrantes al ser estimuladas por la sonda periodontal en seis localizaciones por diente (Trombelli et al.)18. Se consideró que había inflamación gingival cuando la paciente presentaba ≥ 10% de las localizaciones sangrantes.
- -
La profundidad de sondaje (PS) fue medida como la distancia desde el margen gingival al fondo de la bolsa periodontal. Se calculó la profundidad de sondaje media.
- -
El nivel de inserción clínica (NIC) fue calculado a partir de las medidas de recesión gingival (distancia desde la línea amelocementaria hasta el margen gingival) y la profundidad de sondaje y representa la distancia desde la línea amelocementaria hasta el fondo de la bolsa periodontal. Se calculó el nivel de inserción medio.
La periodontitis fue definida según los criterios clínicos de la clasificación de la CDC para estudios poblacionales y la Centers for Disease Control and Prevention and the American Academy of Periodontology (AAP), también llamada clasificación de Page & Eke19, según esta clasificación, la Periodontitis Severa se define como la presencia de dos o más zonas interproximales con perdida inserción clínica ≥ 6 mm, no en el mismo diente y una o más zonas interproximales con PS ≥ 5 mm. La periodontitis moderada se describe como la presencia de dos o más zonas interproximales con pérdida de inserción ≥ 4 mm, no en el mismo diente o dos o más zonas interproximales con PS ≥ 5 mm no en el mismo diente. La periodontitis leve se define como la presencia de dos o más zonas interproximales con pérdida de inserción ≥ 3 mm y dos o más zonas interproximales con PS ≥ 4 mm (no en el mismo diente) o bien una zona con PS ≥ 5 mm. Se consideró periodontitis como la presencia de periodontitis leve, moderada o severa, gingivitis como la ausencia de periodontitis e índice de sangrado al sondaje ≥ 10% y salud periodontal como la ausencia de periodontitis e índice de sangrado al sondaje < 10%.
No se realizaron tratamientos odontológicos durante el estudio. En el caso de detectar algún problema dental o periodontal se informó a las participantes para acudir a su odontólogo para realizar el tratamiento oportuno en función de las necesidades de cada paciente.
CuestionarioLas participantes del estudio cumplimentaron un cuestionario supervisado para la recogida de datos de filiación, socioculturales y de salud oral y general.
Análisis estadísticoSe realizó un análisis estadístico tanto descriptivo como inferencial.
Las variables cuantitativas se describieron mediante medias y desviaciones típicas (DT). Las variables cualitativas se describieron mediante frecuencias y porcentajes relativos.
Para la comparación de las variables y determinación de su relación estadística se emplearon diversas pruebas de verificación de hipótesis. La prueba de Kolmogorov-Smirnov se utilizó para determinar la normalidad de las variables cuantitativas. En el caso de no normalidad se aplicó la prueba no paramétrica de U de Mann-Whitney para muestras independientes de dos grupos. En los casos de variables normales se aplicó la prueba de t de Student para grupos independientes. Para analizar las relaciones bi-variadas entre las variables cualitativas se construyeron tablas de contingencia y se aplicó la prueba χ2. En todos los casos se utilizó el nivel de significación p < 0,05. Todos los resultados estadísticos, tanto del análisis descriptivo como del análisis inferencial, se llevaron a cabo mediante hojas de cálculo y los programas estadísticos IBM SPSS v 23 y MedCalc.
Consideraciones éticasTodas las pacientes recibieron las hojas de información y firmaron el consentimiento antes de su participación en el estudio. También fueron informadas de la confidencialidad de los datos recogidos siguiendo el protocolo de la Ley Orgánica de Protección de Datos (LOPD) 15/1999. El estudio se llevó acabo siguiendo la Declaración de Helsinki, y autorizado por el Comité Ético de Investigación Biomédica y la Comisión de Investigación de la Fe en mayo de 2017.
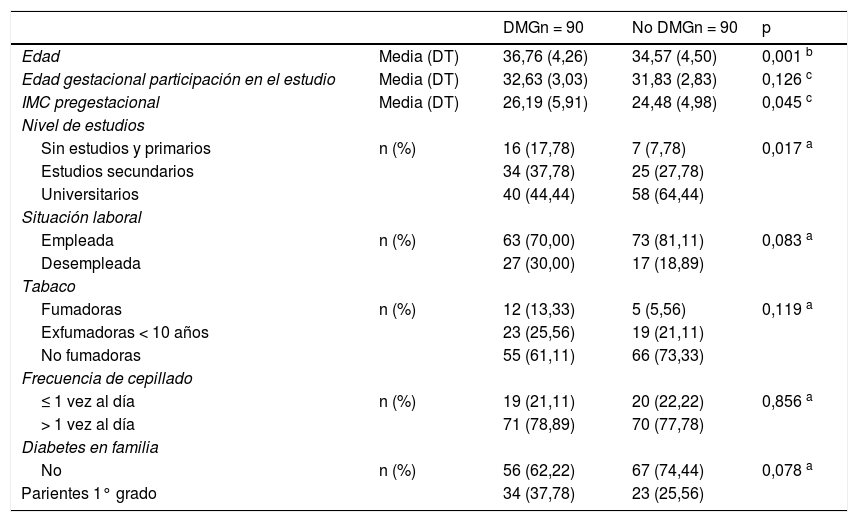
ResultadosSobre el total de la muestra (n = 180), se estudió la asociación de los factores sociales, locales, sistémicos y de otros factores en relación con la DMG. En la tabla 1 se muestra el análisis comparativo entre casos y controles. La edad gestacional a la que se realizó el estudio no fue diferente entre los dos grupos. Las gestantes con DMG tuvieron de forma significativa mayor edad e índice de masa corporal (IMC) y menor nivel de estudios. Sin diferencias en lo referido al resto de parámetros estudiados.
Características de la muestra según casos-control estatus
| DMGn = 90 | No DMGn = 90 | p | ||
|---|---|---|---|---|
| Edad | Media (DT) | 36,76 (4,26) | 34,57 (4,50) | 0,001 b |
| Edad gestacional participación en el estudio | Media (DT) | 32,63 (3,03) | 31,83 (2,83) | 0,126 c |
| IMC pregestacional | Media (DT) | 26,19 (5,91) | 24,48 (4,98) | 0,045 c |
| Nivel de estudios | ||||
| Sin estudios y primarios | n (%) | 16 (17,78) | 7 (7,78) | 0,017 a |
| Estudios secundarios | 34 (37,78) | 25 (27,78) | ||
| Universitarios | 40 (44,44) | 58 (64,44) | ||
| Situación laboral | ||||
| Empleada | n (%) | 63 (70,00) | 73 (81,11) | 0,083 a |
| Desempleada | 27 (30,00) | 17 (18,89) | ||
| Tabaco | ||||
| Fumadoras | n (%) | 12 (13,33) | 5 (5,56) | 0,119 a |
| Exfumadoras < 10 años | 23 (25,56) | 19 (21,11) | ||
| No fumadoras | 55 (61,11) | 66 (73,33) | ||
| Frecuencia de cepillado | ||||
| ≤ 1 vez al día | n (%) | 19 (21,11) | 20 (22,22) | 0,856 a |
| > 1 vez al día | 71 (78,89) | 70 (77,78) | ||
| Diabetes en familia | ||||
| No | n (%) | 56 (62,22) | 67 (74,44) | 0,078 a |
| Parientes 1° grado | 34 (37,78) | 23 (25,56) |
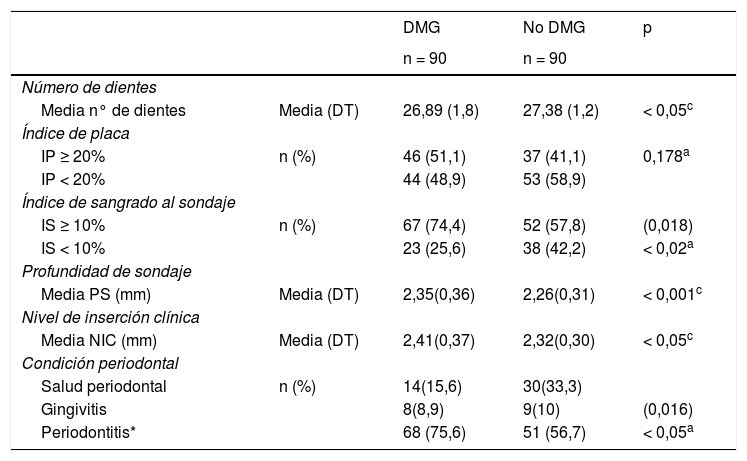
Al comparar la situación periodontal entre los casos y los controles, como se muestra en la tabla 2, las pacientes diabéticas gestacionales tuvieron de forma significativa un menor número de dientes, 26,89 ± 1,8 vs. 27,38 ± 1,2, p < 0,05. También las pacientes con diabetes gestacional presentaron estadísticamente mayor promedio de profundidad de sondaje y de nivel de inserción clínica, y hubo más diabéticas gestacionales con índice de sangrado gingival ≥ 10% (74,4% de los casos vs. 57,8% de los controles, p = 0,018). La presencia de periodontitis se dio en 68/90 de las diabéticas gestacionales, en tanto que fue en 51/90 en los controles p < 0,01, OR 2,36 IC 95% 1,25 a 4,47. Sin embargo, no se encontraron diferencias estadísticamente significativas (p = 0,178) entre el índice de placa y la DMG.
Características clínicas periodontales de las participantes del estudio
| DMG | No DMG | p | ||
|---|---|---|---|---|
| n = 90 | n = 90 | |||
| Número de dientes | ||||
| Media n° de dientes | Media (DT) | 26,89 (1,8) | 27,38 (1,2) | < 0,05c |
| Índice de placa | ||||
| IP ≥ 20% | n (%) | 46 (51,1) | 37 (41,1) | 0,178a |
| IP < 20% | 44 (48,9) | 53 (58,9) | ||
| Índice de sangrado al sondaje | ||||
| IS ≥ 10% | n (%) | 67 (74,4) | 52 (57,8) | (0,018) |
| IS < 10% | 23 (25,6) | 38 (42,2) | < 0,02a | |
| Profundidad de sondaje | ||||
| Media PS (mm) | Media (DT) | 2,35(0,36) | 2,26(0,31) | < 0,001c |
| Nivel de inserción clínica | ||||
| Media NIC (mm) | Media (DT) | 2,41(0,37) | 2,32(0,30) | < 0,05c |
| Condición periodontal | ||||
| Salud periodontal | n (%) | 14(15,6) | 30(33,3) | |
| Gingivitis | 8(8,9) | 9(10) | (0,016) | |
| Periodontitis* | 68 (75,6) | 51 (56,7) | < 0,05a |
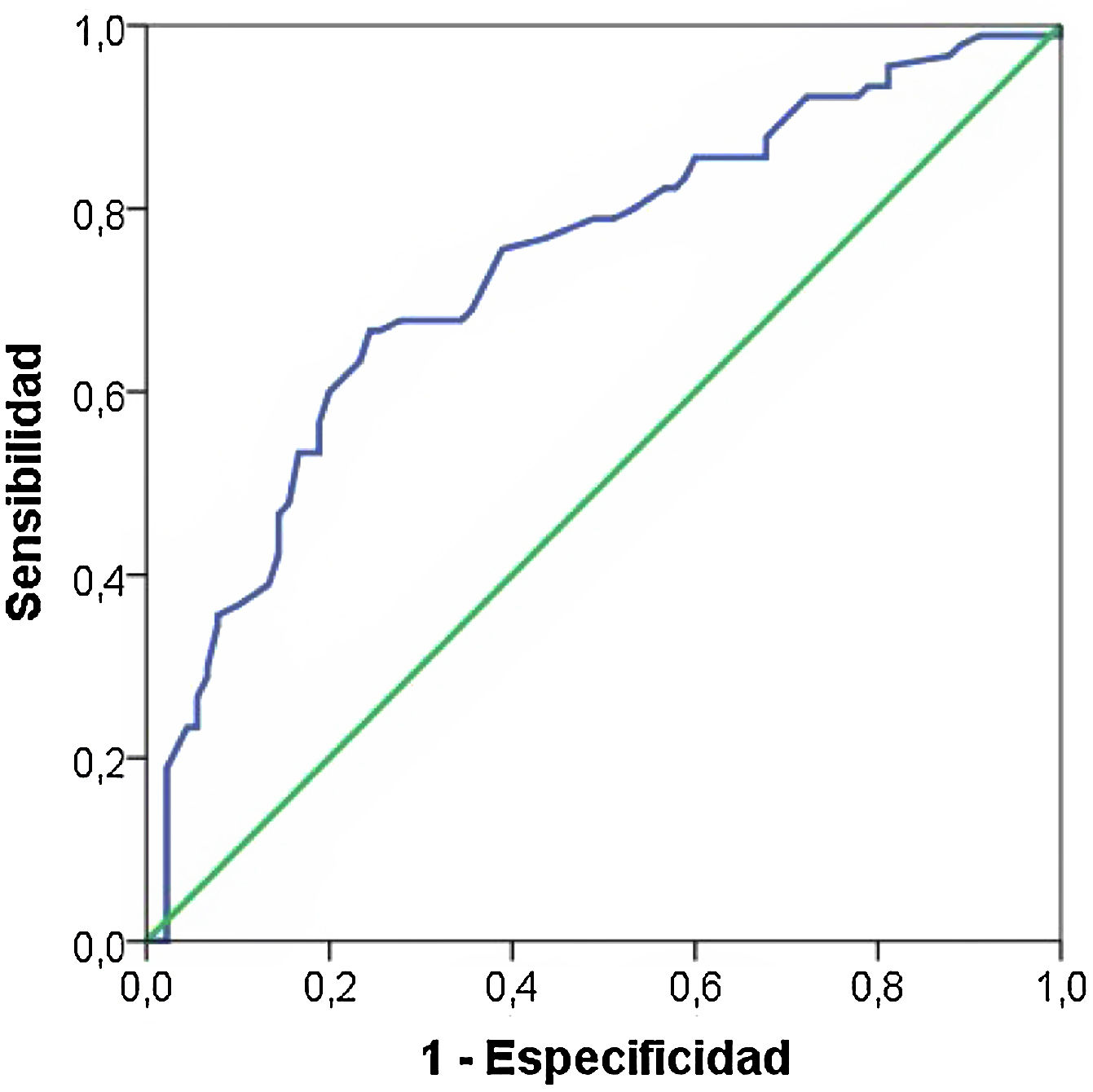
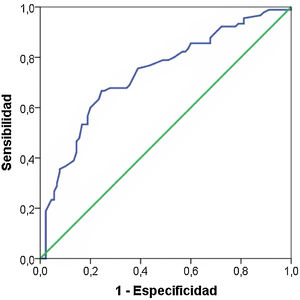
Puesto que la edad materna, el IMC, los antecedentes familiares de diabetes y el nivel sociocultural son factores considerados de riesgo de la DMG, pueden actuar como confusores de la influencia de la periodontitis (como valoración global de la salud periodontal). Por ello realizamos una regresión logística binaria y las variables predictoras las incluimos junto a la periodontitis. Sólo se asociaron significativamente la edad (OR = 1,16, IC 95% 1,07 a 1,25, p < 0,001), el nivel de estudios (OR = 0,37, IC 95% 0,19 a 0,72, p < 0,005) y la periodontitis (OR = 2,79, IC 95% 1,40 a 5,59, p < 0,005). En la figura 1 mostramos la curva ROC cuyos valores son ROC = 0,74 IC 95% 0,66 a 0,780, p < 0,005.
DiscusiónResultados principalesNuestro estudio muestra que las gestantes que desarrollaron una diabetes gestacional durante su embarazo, además de tener mayor edad y menor nivel de estudios, presentaban una peor condición periodontal que las gestantes no diabéticas debido a que tenían menor número de dientes, mayor presencia de inflamación gingival y de periodontitis, así como un mayor promedio de profundidad de sondaje y de nivel de inserción clínica. La edad materna, el nivel de estudios y la presencia de periodontitis son factores independientes de riesgo para la DMG.
Interpretación de los resultadosEn nuestra población, la periodontitis, la edad y el nivel educativo son factores de riesgo de la DMG, no así la historia familiar de diabetes o el IMC.
Los resultados de este trabajo no mostraron asociación significativa entre tener antecedentes de diabetes en familiares de primer grado y desarrollar DMG. Algunos trabajos coinciden con estos hallazgos20 mientras que otros sí hallaron relación21.
Por lo que concierne al IMC, se considera que un IMC ≥ 30 kg/m2 es un factor de riesgo para desarrollar DMG7. Algunos estudios observan la asociación del IMC con las mujeres que tuvieron DMG20–24. Nuestros resultados inicialmente muestran que un IMC mayor se da entre las diabéticas gestacionales, sin embargo, al realizar la regresión logística su importancia desaparece. Esto podría ser debido a la limitación de la muestra. De hecho, tan sólo 30 pacientes presentaron un IMC superior a 30, de las cuales 19 tuvieron DMG y 11 no, χ2 = 1,96, p = 0,16. Probablemente nuestro tamaño muestral es responsable de la no inclusión como factor de riesgo.
La presencia de placa bacteriana es el factor de riesgo principal de la EP, por lo que podría actuar como factor de confusión entre los parámetros periodontales y la DMG. En este estudio se observó que no había diferencias significativas en cuanto al IP entre los casos y los controles, por lo que descartamos la placa dental como posible confusor que podría exacerbar la relación entre EP y DMG. Bagis et al.24 tampoco encontraron diferencias en el IP entre los dos grupos. Sin embargo, otros autores sí que observaron diferencias significativas23.
Otros factores que no mostraron relación significativa con la DMG y que coinciden con lo observado en la literatura son el hábito tabáquico20,22 y la frecuencia de cepillado20,21,25.
Al analizar el sangrado al sondaje entre los casos y los controles se encontraron diferencias estadísticamente significativas. Hubo más embarazadas con DMG que presentaron inflamación gingival que en el grupo de los controles (74,4% vs. 57,8%, respectivamente). Estos resultados concuerdan con los encontrados por otros autores20,21,23,24. Kumar et al.26 en su trabajo concluyeron que la incidencia de DMG fue significativamente mayor en mujeres con gingivitis, periodontitis y enfermedad periodontal en general comparado con mujeres con encías sanas, coincidiendo con nuestros hallazgos.
En cuanto al número de dientes, las diabéticas gestacionales mostraron de forma significativa menor número que los controles. Estos resultados coinciden con los obtenidos por varios estudios22,23.
En este estudio los parámetros periodontales, media de PS y NIC se relacionan estadísticamente con la DMG. Encontramos diferencias significativas en la media de la PS entre las pacientes de los dos grupos (p = 0,001). Otros trabajos coinciden con el nuestro en la existencia de una PS media significativamente mayor en las gestantes diabéticas que en los controles20,21,23. Sin embargo, hay estudios como el de Bagis et al.24 que discrepan y no encuentran relación entre la PS media y la presencia o no de DMG. Con respecto al NIC medio en pacientes con DMG y sin DMG, encontramos diferencias significativas (p = 0,028). Otros trabajos como el de Chokwiriyachit et al.21 o el Ruiz et al.23 coinciden con estos hallazgos.
El nivel de estudios mantuvo diferencias significativas con la DMG. En este trabajo, es un factor independiente de riesgo de la DMG de manera que, a mayor nivel de estudios menor prevalencia de DMG. Otros trabajos no tuvieron en cuenta este factor21,23 o no hallaron relación20,22,25. El nivel de estudios se puede considerar un proxy de la situación económica, un mayor nivel de estudios generalmente se asocia a un mayor nivel económico, mayor educación sanitaria y acceso a cuidados de salud. Esta situación que es regla, también se da en nuestro país, así colectivos con menor nivel educativo (segmentados en cuatro categorías, donde se puede apreciar una dosis de dependencia inversa) tienen mayores tasas de prevalencia de: EPOC, asma, problemas mentales, cardiopatías, diabetes, obesidad, hipertensión, hipercolesterinemia (Ministerio de Sanidad 2018)27.
La edad avanzada es un factor de riesgo para la diabetes gestacional20,22,23. En este estudio las mujeres con DMG eran significativamente mayores que las gestantes del grupo control. De hecho, en nuestra casuística, la edad aparece como predictor OR 1,13, p < 0,001. El otro factor de riesgo que objetivamos en nuestro estudio es la presencia de periodontitis OR = 2,66, p < 0,005; son varios los autores que observan la asociación entre la periodontitis y la DMG20,21,23. Dos revisiones sistemáticas, publicadas en el mismo año, mostraron resultados contradictorios. La revisión de Esteves Lima et al.13 concluyó que las pruebas científicas no podían demostrar una asociación positiva entre la periodontitis y la DMG. Sin embargo, los resultados del meta-analisis de Abariga et al.14 sugirieron que las pacientes con periodontitis tenían más del doble de probabilidad de desarrollar DMG, dato semejante a nuestra estimación del riesgo. En el mismo sentido y más recientemente, Kumar et al.26 observaron una asociación entre la enfermedad periodontal y la DMG y un mayor riesgo de desarrollar preeclampsia, con un HR ajustado de 2,85, IC 95% = 1,47 a 5,53. Esteves Lima et al.13 observan en el metaanálisis de cuatro estudios transversales una asociación significativa (OR 1,67, IC 95% 1,20 a 2,32) y también en dos estudios de casos (OR 2,66, IC 95% 1,52 a 4,65), en tanto que cuando en este último grupo integran un estudio propio, desaparece la significación de riesgo (OR 1,69, IC 95% 0,68 a 4,21). Estos mismos autores señalan la dificultad en el estudio dadas las diferencias clínicas, metodológicas y estadísticas entre los estudios.
LimitacionesEntre las principales limitaciones de los estudios de DMG y periodontitis figura la discrepancia de las definiciones utilizadas tanto para diagnosticar la DMG como la periodontitis. En este trabajo, además de analizar los parámetros periodontales medias de PS y NIC, se ha utilizado el criterio de la CDC-AAP19. Trabajos recientes como el de Poulsen et al.25 de 2019 utilizaron este criterio.
Si bien en este estudio se objetiva una asociación entre la periodontitis y DMG, su diseño transversal no permite establecer juicios de causalidad. No está claro el tipo de relación entre periodontitis y DMG, si la periodontitis precede a la DMG, es decir, si es un factor de riesgo de la DMG o si tener DMG o una situación metabólica prediabética, aumentaría la prevalencia y la gravedad de la periodontitis. Además, existen estudios en los que el tratamiento de la periodontitis durante el embarazo no disminuye los efectos obstétricos adversos asociados a ella tales como la prematuridad o el bajo peso al nacimiento28,29. Nosotros no encontramos asociación entre la existencia de periodontitis con la prematuridad o la preeclampsia. Otros sí que la encuentran, con OR para parto prematuro y/o bajo peso entre 2,04 a 4,1930.
El número de pacientes examinadas es un factor limitante, ya que podría resultar insuficiente o se tendrían menos probabilidades para encontrar diferencias significativas a la hora de analizar de forma robusta enfermedades de prevalencia baja como la preeclampsia o el parto prematuro, que algunos autores relacionan con la periodontitis.
Otra posible limitación sería el diseño del estudio no ciego. Lo ideal hubiera sido que tanto en el momento de la recogida de datos como en la exploración clínica el examinador no hubiera conocido la condición de presencia o no de DMG de las participantes.
ConclusiónLas pacientes que desarrollan diabetes gestacional presentan una peor condición periodontal que las no afectas. El riesgo de DMG puede estimarse en nuestra muestra a partir de la periodontitis, la edad y el nivel de estudios.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.