El disgerminoma pertenece al grupo de tumores germinales de ovario y representa la contrapartida del seminoma testicular. Es un tumor poco frecuente que se presenta en pacientes jóvenes y cuyo pronóstico es favorable. Histológicamente, las células neoplásicas semejan células germinales primordiales; células grandes con abundante citoplasma claro y/o eosinófilo, con núcleo grande y nucléolos eosinófilos prominentes. Estas células se distribuyen a manera de trabéculas o cordones y están rodeadas por estroma de tejido conectivo y linfocitos pequeños. Debido a estas características, es importante realizar un adecuado diagnóstico diferencial con otros tumores morfológicamente similares, así como emplear la inmunohistoquímica para su tipificación. Se presenta el caso de una paciente de 23 años con un tumor de ovario derecho que se diagnosticó como disgerminoma «anaplásico ». Este término se ha empleado en aquellos casos en que el tumor presenta alta celularidad, escaso estroma, pleomorfismo nuclear, un alto índice mitótico y datos de invasión vascular. Sin embargo, aún no se ha establecido un consenso con respecto a si el patrón histológico es útil o no para definir el comportamiento de esta variante del tumor.
Dysgerminomas are ovarian germ cell tumors and represent the counterpart of testicular seminoma. This type of tumor is rare, mainly affects young women, and has a relatively favorable prognosis. Histologically, the neoplastic cells resemble primordial germ cells, namely, large cells with abundant clear to eosinophilic cytoplasm and a large nucleus with prominent eosinophilic nucleoli. These cells are distributed in cords and/or trabeculae and are surrounded by a stromal network composed of connective tissue and small lymphocytes.
Because of these features, correct differential diagnosis with tumors displaying a similar morphology should be made and immunohistochemistry should be performed for accurate typification. We present the case of a 23-years-old woman with a right ovarian mass diagnosed as an «anaplastic» dygerminoma. This term has been used in cases in which the dysgerminoma shows increased cellularity, minimal stroma, nuclear pleomorphism, a high mitotic index, and vascular invasion. However, consensus is lacking on whether the histological pattern defines the behavior of this tumoral variant.
El disgerminoma puro pertenece al grupo de tumores germinales de ovario y representa la contraparte del seminoma de testículo. Es el tumor maligno germinal más frecuente del ovario y constituye aproximadamente el 1% de todos los tumores que afectan a este órgano. Se presentan principalmente entre la 2.a y la 3.a décadas de la vida y hasta un 15% de estos tumores suelen ser bilaterales. Su pronóstico es generalmente favorable, con una buena respuesta al tratamiento mediante radio y quimioterapia y una supervivencia >75% a los 5 años1–3.
En ocasiones el disgerminoma presenta una arquitectura y una citología distintas a la clásica, lo que puede hacer difícil el diagnóstico. Hay casos en los que la neoplasia presenta atipia y un alto número de mitosis, y la citoarquitectura del disgerminoma puro puede no ser obvia. En estos casos la inmunohistoquímica ayuda a realizar el diagnóstico adecuado4. Este artículo se presenta un caso de disgerminoma «anaplásico» y se comenta la contribución de la inmunohistoquímica en el establecimiento de un diagnóstico diferencial.
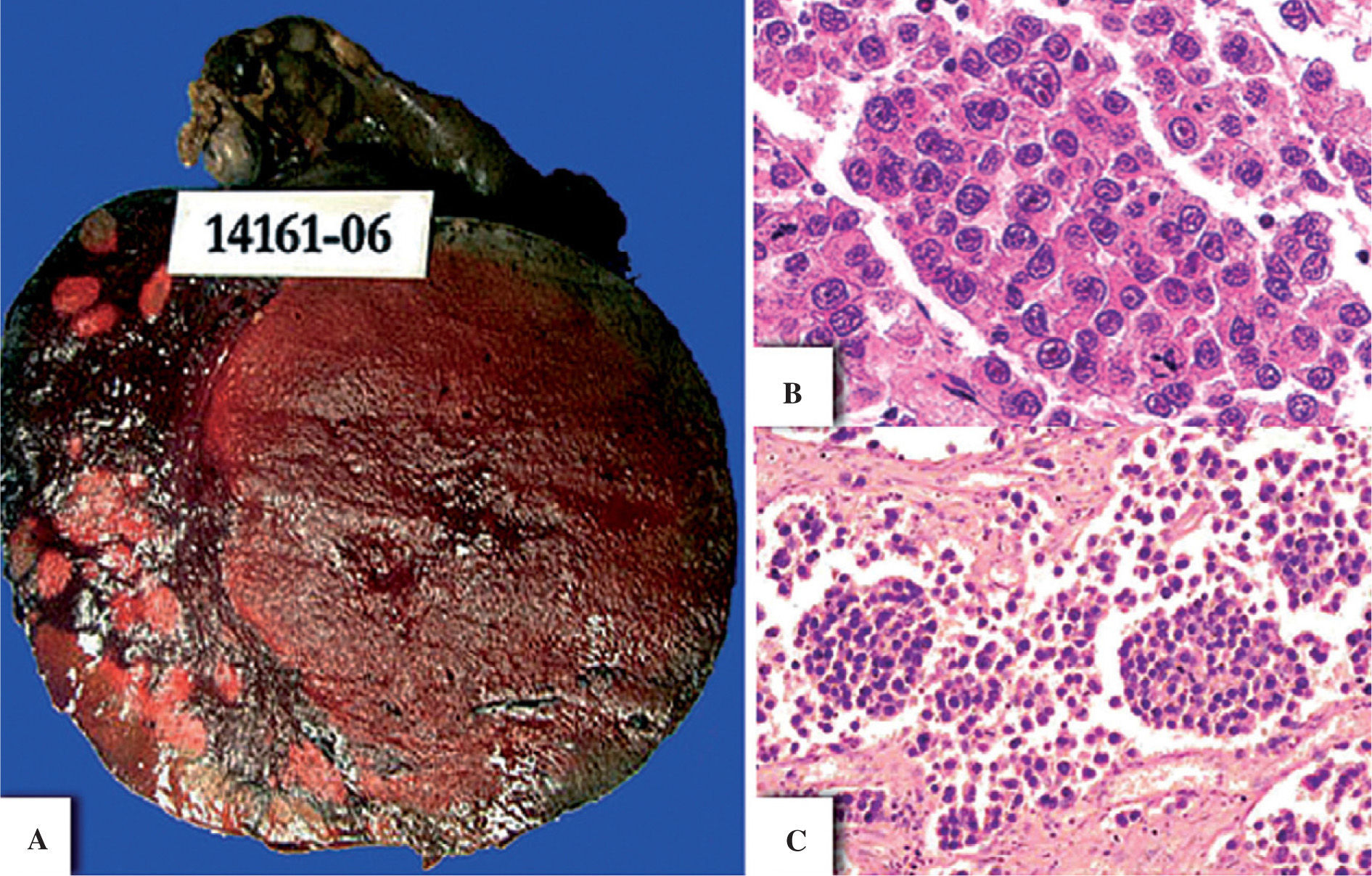
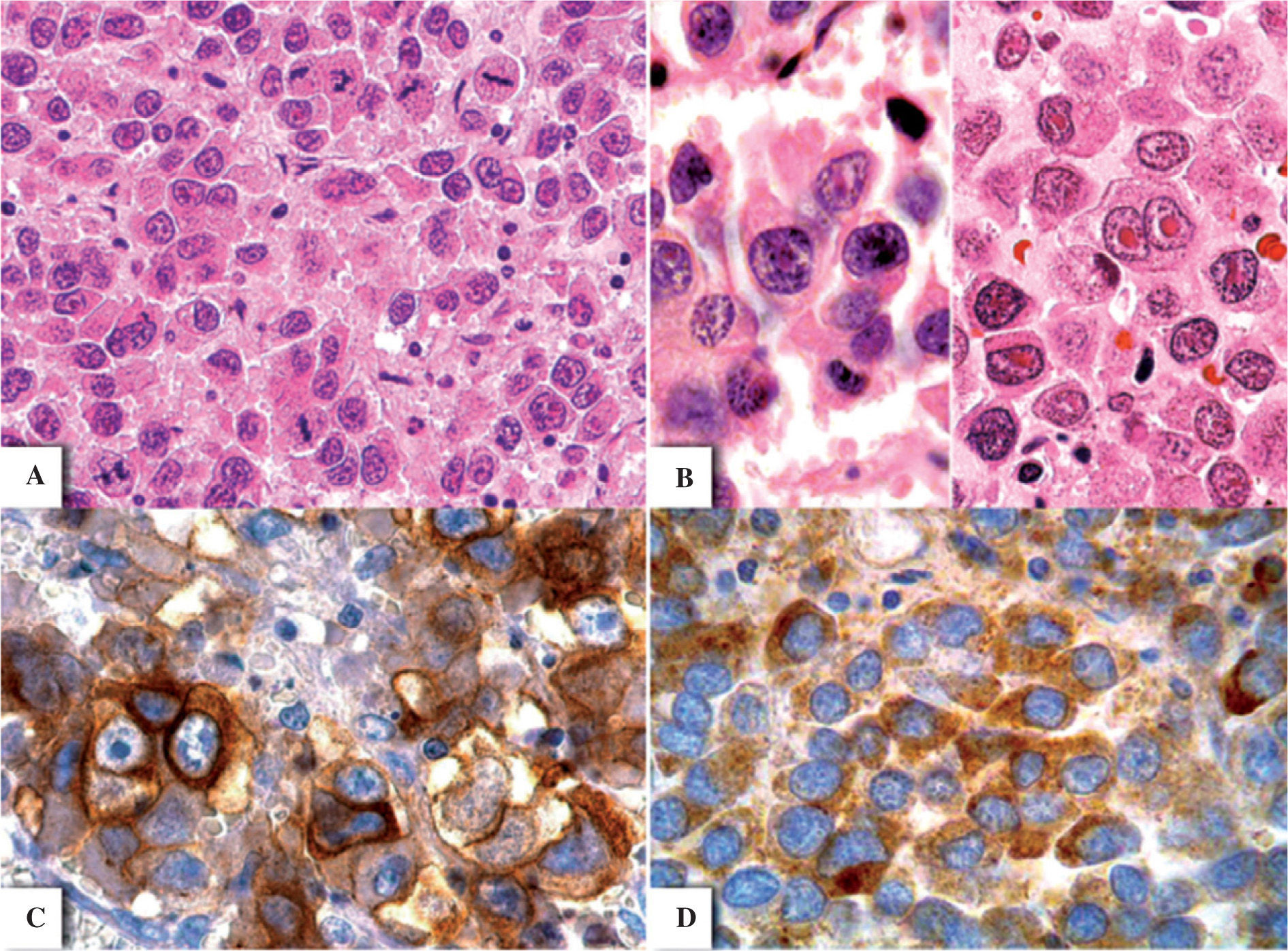
CASO CLÍNICO Y HALLAZGOS HISTOPATOLOGICOSPaciente de 23 años de edad, que acudió a la consulta por presentar sangrado transvaginal de más de 1 mes de evolución. Clínicamente, la paciente presentó un tumor abdominal en la fosa ilíaca derecha que en la resonancia magnética se identificó como dependiente del ovario derecho. El tumor ovárico se resecó quirúrgicamente, medía 10cm de diámetro mayor y su superficie era lobulada amarilla. Al corte, el tumor presentaba hemorragia intratumoral y era de consistencia firme, de superficie lisa amarillo-rojiza (fig. 1A). Microscópicamente, la neoplasia estaba compuesta por agregados dispersos de células de medianas a grandes que se disponían focalmente en cordones, separados por escaso estroma y rodeados por delgados tabiques fibrosos. Había linfocitos dispersos dispuestos irregularmente y necrosis y hemorragia multifocal acentuada (fig. 1B y C). Las células neoplásicas presentaban núcleos irregulares, nucléolos prominentes, abundante citoplasma eosinófilo, que focalmente daba apariencia «plasmocitoide». Algunas células neoplásicas mostraban atipia acentuada con nucléolos eosinófilos prominentes y se identificaron hasta ~ 10 mitosis en un campo de 40× (fig. 2A y B). El abordaje histológico se realizó con los diagnósticos diferenciales entre disgerminoma, linfoma/plasmocitoma y melanoma. En el estudio por inmunohistoquímica, las células neoplásicas presentaron positividad al PLAP (placental-like alkaline phosphatase) (Cell Marque, Austin, TX, 1:50) y CD117 (ckit) (Dako, Carpintería, CA, 1:400) (fig. 2C y D), y fueron negativas a CD30 (BerH2) (Dako, Carpintería, CA, 1:20), alfa-fetoproteína (AFP) (Cell Marque, Austin, TX, 1:2.000), citoqueratinas AE1-3 (Bio SB, Inc., Santa Barbara, CA, 1:100), CD138 (Cell Marque, Austin, TX, 1:30), proteína S-100 (BioGenex, San Ramon, CA, 1:2000) y HMB-45 (Bio SB, Inc., Santa Barbara, CA, 1:20). El diagnóstico fue de disgerminoma «anaplásico», debido a la presencia de abundantes mitosis, células pleomórficas y escaso estroma. No se realizó biopsia de ovario contralateral y se desconoce el estado actual de la paciente.
Tumor de ovario en una paciente de 23 años. Imagen macroscópica (A) y microscópica del tumor (B y C). Las células tumorales se encuentran formando trabéculas y/o cordones, presentan un patrón homogéneo y se encuentran separadas por escaso estroma. Esta imagen indica la presencia de disgerminoma.
Disgerminoma «anaplásico». Se observan abundantes mitosis y estroma intercelular compuesto por escasos linfocitos y fibras colágenas (A). Las células neoplásicas presentan abundante citoplasma eosinófilo con patrón «plasmocitoide» (B, izquierda), así como pleomorfismo, núcleos irregulares y células binucleadas con nucléolos eosinófilos prominentes (B, derecha). La inmunohistoquímica para CD117 fue multifocal y mostró expresión membranal en las células tumorales (C), mientras que la expresión de PLAP (placental-like alkaline phosphatase) fue citoplásmica difusa, con un patrón granular (D).
El disgerminoma se origina a partir de células primordiales germinales (ovocitos premeióticos)3 que se caracterizan por ser células grandes poligonales con bordes celulares bien definidos y abundante citoplasma claro o eosinófilo granular rico en glucógeno, PAS positivo. Los núcleos son grandes, con cromatina fina granular, y puede haber nucléolos prominentes. Estas células suelen distribuirse en un patrón trabecular y/o en cordones y se encuentran rodeadas por abundante estroma formado por fibras colágenas y cúmulos de linfocitos pequeños. Debido a las características morfológicas de las células, el diagnóstico diferencial debe realizarse con otros tumores de ovario como el carcinoma embrionario y el tumor de células de la granulosa, así como con linfomas de células grandes, adenocarcinomas de células claras o carcinomas metastásicos poco diferenciados. Ocasionalmente, como en el caso que aquí se presenta, las células neoplásicas adquieren características que pueden semejar células plasmáticas neoplásicas, o células de melanoma. Por todo lo expuesto, resulta crucial emplear técnicas de inmunohistoquímica para tipificar el tumor. Característicamente, el disgerminoma es positivo a PLAP, LDH (deshidrogenasa láctica), NSE (enolasa neuronaespecífica), CD1175 y al factor de transcripción OCT46; y negativo a CD30, AFP y claudinas7,8. Hasta un 10% de los casos pueden ser positivos a citoqueratinas8 y un 5% a β-gonadotropina coriónica (con presencia de células de sincitiotrofoblasto).
La presencia de mitosis y anaplasia puede variar en diferentes áreas de un disgerminoma. El término disgerminoma «anaplásico» se utiliza en casos de disgerminomas con alta celularidad, invasión vascular, escaso infiltrado linfocitario, pleomorfismo nuclear y alto índice mitótico (> 3 mitosis, campo de 40×)2. En el caso que aquí se presenta se identificaron todas las características antes mencionadas a excepción de la invasión vascular. Se ha informado de que esta variante presenta igual o, incluso en ocasiones, peor pronóstico que el disgerminoma clásico1–3,9. Sin embargo, aún no hay un consenso establecido en el que el patrón histológico encontrado sea de utilidad para poder definir el comportamiento del tumor2.
En resumen, se presenta un caso de disgerminoma «anaplásico» cuyo diagnóstico diferencial morfológico obligó a descartar otras neoplasias como melanoma y plasmocitoma que, aunque raramente, pueden afectar al ovario. La inmunomarcación en estos casos es imperativa para poder hacer el diagnóstico adecuado. No hay evidencia de que los disgerminomas anaplásicos estén asociados con un peor pronóstico.