El tratamiento de los tumores neuroendocrinos pancreáticos no funcionantes (TNEPNF) es la resección en caso de enfermedad localizada o metástasis hepáticas resecables. Existe controversia en metástasis hepáticas irresecables.
MétodosAnalizamos los datos perioperatorios y de supervivencia de 63 pacientes resecados por TNEPNF entre 1993 y 2012, dividiéndolos en 3 escenarios: A, resección pancreática (44pacientes); B, resección pancreática y hepática por metástasis hepáticas sincrónicas (12pacientes), y C, resección pancreática en presencia de metástasis hepáticas irresecables (6pacientes). Se estudiaron factores pronósticos de supervivencia y recidiva.
ResultadosLas cirugías más frecuentes fueron, pancreatectomía corporocaudal (51%) y duodenopancreatectomía cefálica (38%). El 44% de los pacientes requirieron una cirugía asociada, resecando sincrónicamente páncreas e hígado en 9. Dos pacientes recibieron un trasplante hepático durante el seguimiento. Según la clasificación de la OMS, se distribuyeron en G1: 10 (16%), G2: 45 (71%) y G3: 8 (13%). La morbimortalidad postoperatoria fue del 49 y del 1,6%, respectivamente. Al cierre del estudio, 43 (68%) seguían vivos, con una supervivencia actuarial media de 9,6años. La clasificación de la OMS y la recidiva fueron factores de riesgo de mortalidad en el estudio multivariante. La supervivencia actuarial mediana por escenarios fue de 131meses (A), 102meses (B) y 75meses (C), sin diferencias estadísticamente significativas.
ConclusionesEl tratamiento del TNEPNF sin enfermedad a distancia es la resección. Las metástasis hepáticas resecables en los tumores bien diferenciados deben resecarse. La resección del tumor pancreático con metástasis hepáticas sincrónicas irresecables debe considerarse en TNEPNF bien diferenciados. El grado de clasificación de la OMS y la recidiva son factores de riesgo de mortalidad a largo plazo.
The treatment of patients with non-functioning pancreatic neuroendocrine tumours (NFPNET) is resection in locally pancreatic disease, or with resectable liver metastases. There is controversy about unresectable liver disease.
MethodsWe analysed the perioperative data and survival outcome of 63 patients who underwent resection of NFPNET between 1993 and 2012. They were divided into 3 scenarios: A, pancreatic resection (44patients); B, pancreatic and liver resection in synchronous resectable liver metastases (12patients); and C, pancreatic resection in synchronous unresectable liver metastases (6patients). The prognostic factors for survival and recurrence were studied.
ResultsDistal pancreatectomy (51%) and pancreaticoduodenectomy (38%) were more frequently performed. Associated surgery was required in 44% of patients, including synchronous liver resections in 9patients. Two patients received a liver transplant during follow-up. According to the WHO classification they were distributed into G1: 10 (16%), G2: 45 (71%), and G3: 8 (13%). The median hospital stay was 11days. Postoperative morbidity and mortality were 49% and 1.6%, respectively. At the closure of the study, 43 (68%) patients were still alive, with a mean actuarial survival of 9.6years. The WHO classification and tumour recurrence were risk factors of mortality in the multivariate analysis. The median actuarial survival by scenarios was 131months (A), 102months (B), and 75months (C) without statistically significant differences.
ConclusionsSurgical resection is the treatment for NFPNET without distant disease. Resectable liver metastases in well-differentiated tumours must be resected. The resection of the pancreatic tumour with unresectable synchronous liver metastasis must be considered in well-differentiated NFPNET. The WHO classification grade and recurrence are risk factors of long-term mortality.
Los tumores neuroendocrinos pancreáticos (TNEP) representan actualmente el 2-5% de los tumores pancreáticos1-7. Con el incremento del uso de las nuevas técnicas de imagen ha aumentado el diagnóstico de los TNEP no funcionantes (TNEPNF), representando en la actualidad el 68-80% de los TNEP3,5-15. Los TNEPNF no están asociados con síntomas clínicos específicos, ya que no producen un exceso de hormona activa. El diagnóstico puede ser incidental, pero a menudo se descubren en una fase muy avanzada de la enfermedad, ya sea desde el punto de vista local, o incluso con metástasis hepáticas3,6,7,9-13,16. Actualmente, el tratamiento aceptado para estos pacientes es la resección quirúrgica, como lo demuestran diversos estudios que describen la mejoría en la supervivencia tras la cirugía6,8-13,16-18. La agresividad de los TNEP ha sido definida por criterios que incluyen la invasión local, la evidencia histológica de invasión linfática, vascular o perineural, y las metástasis a distancia1-3. En 2010, la Organización Mundial de la Salud (OMS) clasificó a los TNEP en tumor neuroendocrino (TNE) grado1, TNE grado2 y carcinoma neuroendocrino grado3, en base a la diferenciación histológica y a la actividad proliferativa (Ki67)4,5,7,9,19-23. Diversos autores ya han demostrado la utilidad de dicha clasificación al evidenciar peor supervivencia en grados elevados8,10,24. El objetivo de este estudio ha sido revisar los resultados a corto y a largo plazo tras el tratamiento quirúrgico de los TNEPNF durante los últimos 20años. Así mismo, estudiar los factores pronósticos de supervivencia y recidiva tras la resección quirúrgica.
MétodosHemos revisado la experiencia en el tratamiento de los pacientes remitidos a nuestra Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático por TNEPNF, y que hubieran sido tributarios del tratamiento quirúrgico, desde 1993 hasta 2012. Hemos registrado de forma prospectiva los datos demográficos, anatomopatológicos y de seguimiento de 63pacientes, a los que se les practicó resección del tumor primario pancreático con intención curativa o paliativa. Se definió intervención curativa cuando se resecó el tumor primario, y en los casos con metástasis hepáticas, estas fueran resecadas o tratadas con medios ablativos en su totalidad. Se definió resección paliativa aquella en la que se resecó el tumor primario en presencia de metástasis hepáticas irresecables; el objetivo fue prevenir la progresión local del tumor primario que pudiera disminuir la supervivencia o calidad de vida del paciente. Todos los pacientes tienen un estudio preoperatorio con tomografía computarizada (TC), y dada la extensión temporal de la serie, la técnica de la TC se ha modificado. Desde 1991 a 1994 se utilizó TC no helicoidal. Desde 1994 a 2004 se utilizó TC helicoidal de una corona. A partir de 2003 se utilizó la TC multidetector de 4, 16 y, posteriormente, 64coronas.
Se analizaron las características clínicas, patológicas y el tratamiento quirúrgico realizado, así como la morbimortalidad postoperatoria según la clasificación de Clavien-Dindo25,26 y la supervivencia y supervivencia libre de enfermedad a largo plazo. Definimos mortalidad postoperatoria la que sucede durante los primeros 30días tras la cirugía, o durante el ingreso. La fecha de seguimiento se obtuvo de las visitas médicas de control, en la historia clínica de cada paciente, y el tiempo de seguimiento se calculó desde el momento de la cirugía. Los parámetros anatomopatológicos que se analizaron fueron el diámetro máximo del tumor, el grado de diferenciación histológica, basado en el índice proliferativo (índice mitótico y Ki67), la presencia de invasión angiolinfática o perineural y las metástasis ganglionares y a distancia. El índice proliferativo tumoral fue analizado de forma retrospectiva, y el resto de datos se recogieron de forma prospectiva. Las secciones histológicas se obtuvieron del archivo de bloques de parafina y fueron evaluadas por un patólogo experto. Los tumores fueron clasificados según la clasificación de la OMS para TNEP de 2010 en TNE grado1 o grado2 y carcinoma neuroendocrino grado319-22. La clasificación se basa en el índice proliferativo (índice mitótico y Ki67). Así pues, consideramos tumores de grado1 aquellos con índice mitótico <2 y Ki67 <3%; de grado2 aquellos con índice mitótico de 2 a 20 y Ki67 entre 3 y 20%, y de grado3 aquellos con índice mitótico >20 y Ki67 >20%.
Por último, se dividió la serie en 3 escenarios clínicos, para su mejor análisis estadístico. El escenario A incluyó pacientes con resección pancreática por enfermedad localizada en el páncreas o localmente avanzada, en ausencia de enfermedad a distancia. El escenario B incluyó pacientes sometidos a resección pancreática y hepática, debido a la presencia de metástasis hepáticas sincrónicas resecables. El escenario C incluyó pacientes sometidos a resección pancreática en presencia de metástasis hepáticas sincrónicas irresecables. Se comparó la supervivencia de los pacientes a largo plazo de acuerdo con el escenario clínico.
Análisis estadísticoEn cuanto al estudio estadístico, en una primera fase se procedió al análisis descriptivo para cada una de las variables continuas con el cálculo de medidas de tendencia central (media o mediana) y de dispersión (desviación estándar y rango), y de las variables cualitativas según porcentaje de las mismas. A continuación se analizaron los factores de riesgo a largo plazo de mortalidad y recidiva y se realizó un estudio de regresión de Cox univariante y multivariante. Las curvas de supervivencia actuarial se calcularon y se compararon mediante el método de Kaplan-Meier y la prueba de log-rank, respectivamente. Se realizó un estudio bivariante de la serie según estadios de la clasificación de la OMS y el tamaño tumoral, para evidenciar la asociación de estas con otras variables. Para el análisis de las variables cuantitativas de datos independientes se ha utilizado la prueba no paramétrica o test U de Mann-Whitney. Para el análisis de las variables cualitativas se ha procedido a su análisis mediante el test chi-cuadrado o bien test exacto de Fisher según la distribución normal de las mismas. Se han considerado asociaciones significativas aquellas con un nivel de significación de p≤0,05. El paquete estadístico utilizado ha sido el SPSS v.20.
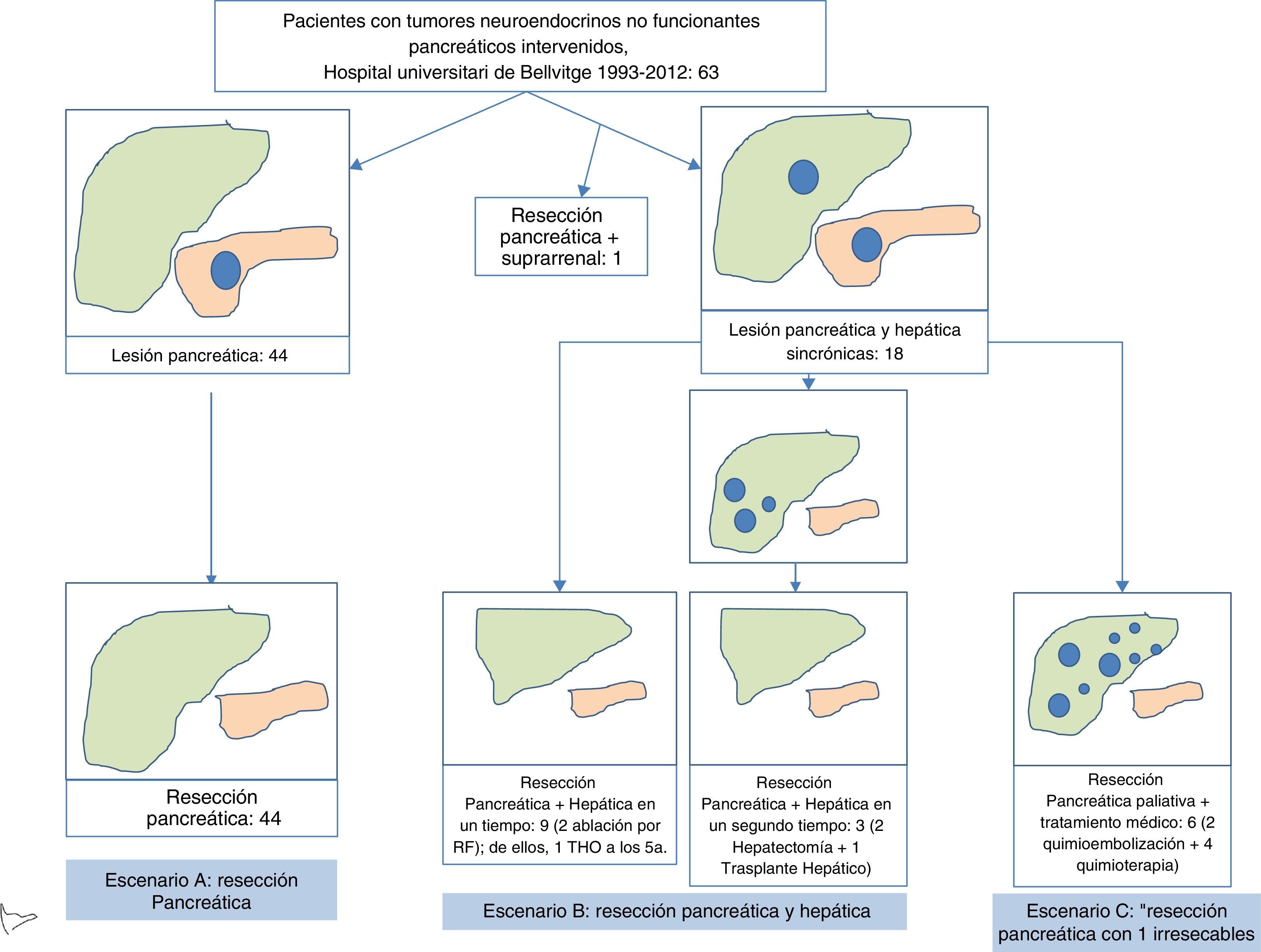
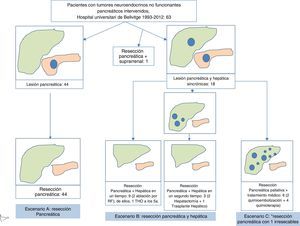
ResultadosEstadística descriptivaLos 63 TNEPNF resecados se presentaron con más frecuencia en hombres, con una media de edad de 55 (26-77) años. Los síntomas más frecuentes fueron dolor abdominal en el 32% e ictericia obstructiva en el 10%. Destaca que el 41% de los pacientes estaban asintomáticos en el momento del diagnóstico y tratamiento (tabla 1). Se localizaron con más frecuencia en la cabeza pancreática. En el estudio histológico, presentaban angioinvasión en el 55% de casos e invasión perineural en el 49%. El tamaño medio del tumor fue de 50 (9-200) mm; 14 (22%) pacientes tenían un tumor ≤2cm, 21 (33%) tenían un tumor de tamaño entre 2 y 4cm, y 28 (44%) tenían un tumor >4cm. En 19 pacientes se evidenció enfermedad extrapancreática; 18 (28%) pacientes presentaban metástasis hepáticas sincrónicas y un paciente tenia metástasis en la glándula suprarrenal. La cirugía más frecuente fue la pancreatectomía corporocaudal en el 51% de los casos; de estas, se realizaron un 28% por laparoscopia (tabla 1). La duodenopancreatectomía cefálica se realizó en el 38% de los casos. El 44% de los pacientes requirieron una cirugía asociada (figs. 1 y 2): en 2 pacientes se les practicó resección de la vena cava con injerto de cadáver, en 2 resección de tronco celiaco, en 11 resección metástasis hepáticas, en 11 esplenectomía, en 4 nefrectomía, en 3 colectomía, en 3 gastrectomía y en 2 suprarrenalectomía.
Análisis descriptivo de los pacientes tras la resección quirúrgica por tumor neuroendocrino pancreático no funcionante. Experiencia de 63 casos, Hospital Universitari de Bellvitge, 1993-2012
| Datos demográficos | |
| Edad,años, media | 55 |
| Hombre / Mujer | 33/30 |
| Forma de presentación - síntomas, n (%) | |
| Asintomático | 24 (41) |
| Dolor abdominal | 19 (32) |
| Ictericia | 6 (10) |
| Pancreatitis | 4 (7) |
| Colangitis | 1 (1,7) |
| Sin datos | 10 (–) |
| Características del tumor | |
| Tamaño, n (%) | |
| < 20 mm | 14 (22) |
| 20-40 mm | 21 (33) |
| > 41 mm | 28 (45) |
| Localización, n (%) | |
| Cabeza | 26 (41) |
| Cuerpo | 14 (22) |
| Cola | 23 (37) |
| Metástasis a distancia, n (%) | 19 (30) |
| Metástasis adenopática, n (%) | 26 (42) |
| Grupo OMS, n (%) | |
| 1 | 10 (16) |
| 2 | 45 (71) |
| 3 | 8 (13) |
| Estadio, n (%) | |
| I | 11 (18) |
| II | 16 (25) |
| III | 17 (27) |
| IV | 19 (30) |
| Datos de la cirugía | |
| Tipo de cirugía, n (%) | |
| Duodenopancreatectomía cefálica | 24 (38) |
| Pancreatectomía corporocaudal | 23 (37) |
| Pancreatectomía corporocaudal laparoscópica | 9 (14) |
| Enucleación | 3 (5) |
| Resección proceso uncinado | 2 (3) |
| Pancreatectomía medial | 2 (3) |
| Cirugía asociada, n (%) | 28 (44) |
| Complicaciones posquirúrgicas, n (%) | 31 (49) |
| Mortalidad postoperatoria, n (%) | 1 (1,6) |
| Estancia hospitalaria mediana, días | 11 (5-92) |
| Recidiva, n (%) | 24 (38) |
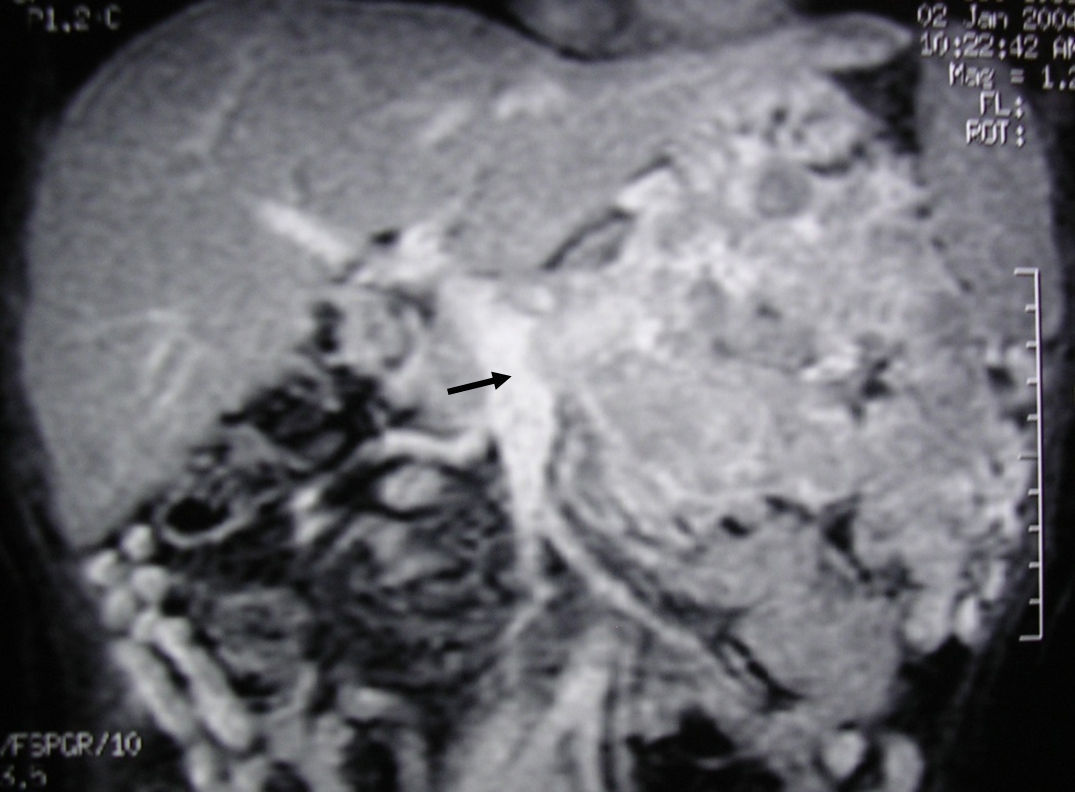
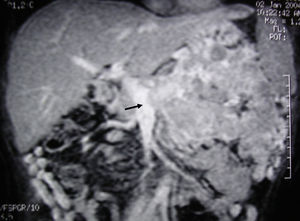
Imagen de RM hepática. Reconstrucción coronal de secuencia T1 3D con supresión grasa y contraste intravenoso en fase portal que demuestra una voluminosa lesión tumoral pancreática compatible con un tumor neuroendocrino con infiltración esplénica y renal. Se aprecia una protrusión del trombo tumoral de la vena esplénica (flecha) hacia la luz de la vena mesentérica superior. En el momento del diagnóstico (enero de 2004) la paciente tenía 39años, se practicó una pancreatectomía corporocaudal con resección del confluente venoso portomesentérico, esplenectomía, hemicolectomía izquierda y nefrectomía izquierda. Actualmente (mayo de 2016) la paciente está viva y sin recidiva tras 12años de seguimiento.
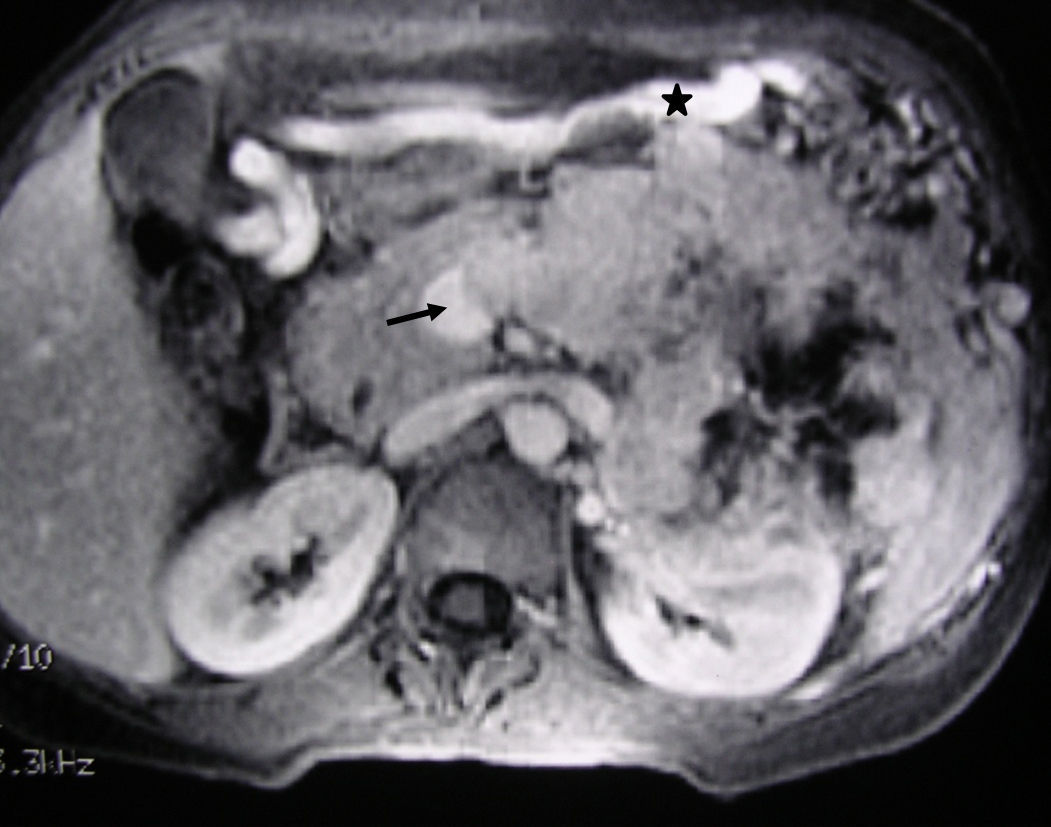
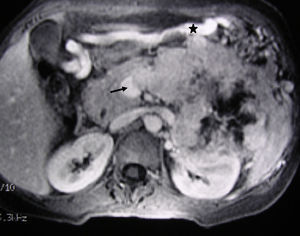
Imagen de RM hepática (mismo caso clínico de la fig. 1). Imagen axial T1 3D con supresión grasa y contraste intravenoso que muestra el tumor neuroendocrino del cuerpo-cola del páncreas, la trombosis tumoral de la vena esplénica (flecha). La voluminosa vena gastroepiploica (asterisco) traduce hipertensión portal segmentaria.
En cuanto a los escenarios definidos, 44 pacientes pertenecían al escenario A, 12 al escenario B y 6 al escenario C (fig. 3). Un paciente con metástasis suprarrenal no se incluyó en ninguno de los escenarios propuestos. De los 18 pacientes con metástasis hepáticas, 9 pacientes se trataron en el momento de la resección del primario: en 7 se realizó resección hepática y en 2 resección hepática y radiofrecuencia. Uno de estos pacientes a los 5años recibió trasplante hepático por recidiva hepática. En 3 pacientes se trataron las metástasis hepáticas en un segundo tiempo, en 2 pacientes se realizó resección hepática 2 meses después de resecar el tumor primario y en un paciente se realizó trasplante hepático. De los 6 pacientes en los que se realizó resección pancreática paliativa, en 2 se indicó quimioembolización hepática y 4 pacientes fueron tratados con quimioterapia adyuvante. La morbilidad postoperatoria fue del 49% (31/63). Según la clasificación de Clavien-Dindo, el 85% fueron de tipo i-ii-iiiA y el 15% del tipo iiiB-v. Las complicaciones más frecuentes fueron colección intraabdominal en 12pacientes y fuga pancreática en 15. La mortalidad postoperatoria fue del 1,6% (1/63). Dicho paciente falleció tras presentar hemoperitoneo masivo en el postoperatorio. La mediana de la estancia hospitalaria postoperatoria fue de 11 (5-92) días (tabla 1).
Flujo de los pacientes con tumores neuroendocrinos no funcionantes pancreáticos intervenidos en el Hospital Universitari de Bellvitge de 1993 a 2012 (n=63). El escenario A incluye pacientes con resección pancreática por enfermedad localizada en el páncreas o localmente avanzada, en ausencia de enfermedad a distancia. El escenario B incluye pacientes sometidos a resección pancreática y hepática, debido a la presencia de metástasis hepáticas sincrónicas resecables. El escenario C incluye pacientes sometidos a resección pancreática en presencia de metástasis hepáticas sincrónicas irresecables. Se ha comparado la supervivencia de los pacientes a largo plazo según el escenario clínico, sin hallar diferencias estadísticamente significativas.
Según la clasificación de la OMS, los pacientes se distribuyeron en G1: 10 (16%); G2: 45 (71%), y G3: 8 (13%). Según la clasificación TNM, los pacientes se distribuyeron en estadioi: 11 (18%); estadioii: 16 (25%); estadioiii: 17 (27%), y estadioiv: 19 (30%). El 42% de los pacientes tenían metástasis en ganglios linfáticos. En cuanto al estado actual de los pacientes y con un seguimiento medio de 4,6años, 43 (68%) seguían vivos. Veinticuatro pacientes (38%) presentaron recidiva (tabla 1).
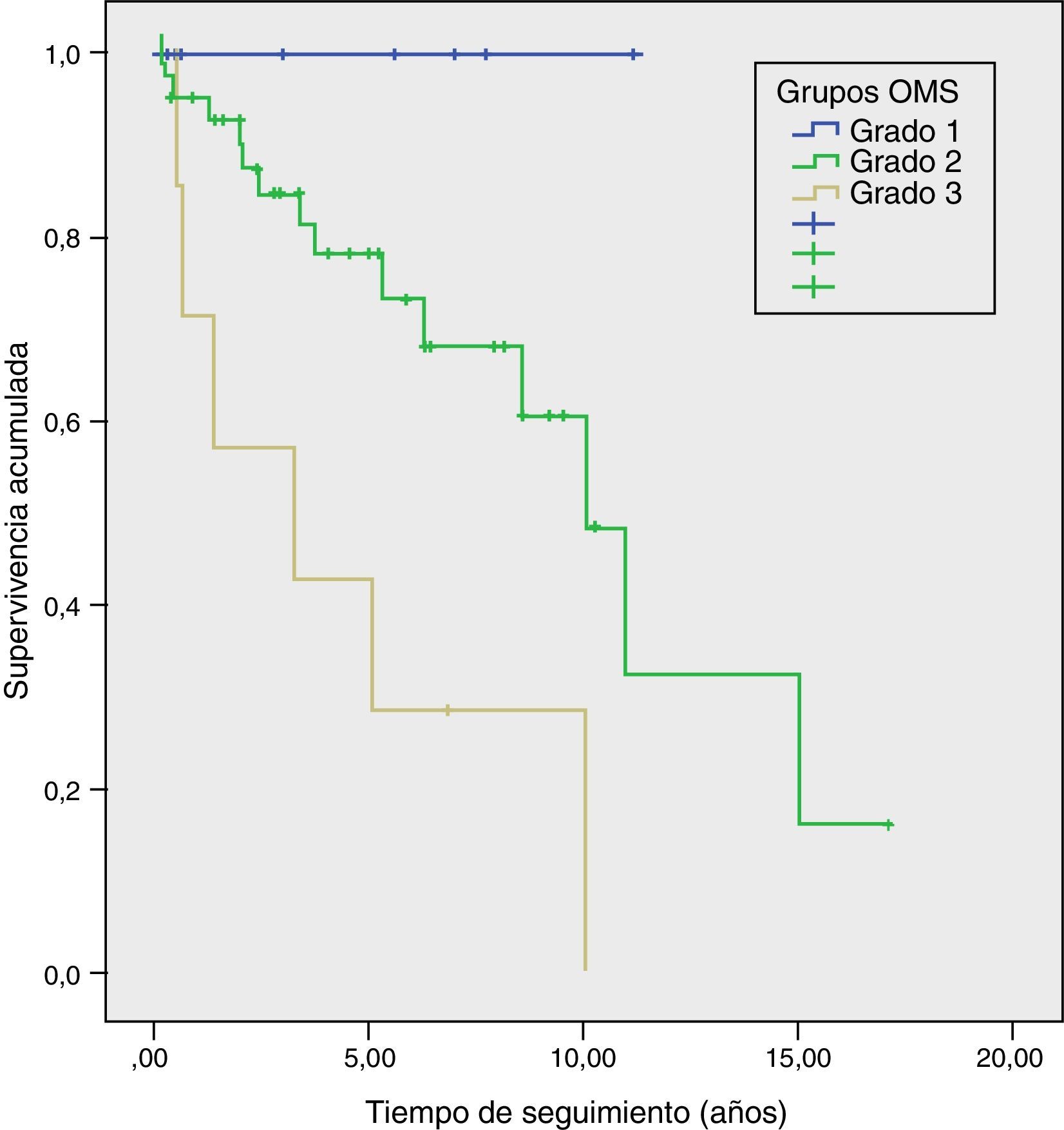
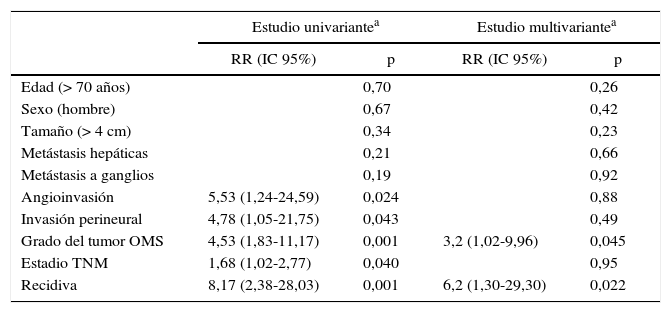
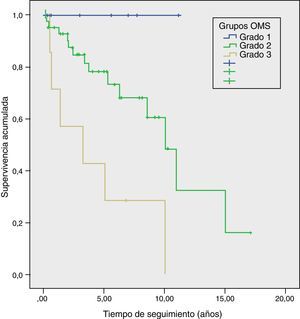
Supervivencia y factores de riesgo de mortalidad a largo plazoLa supervivencia actuarial media fue de 9,6años, siendo la supervivencia actuarial a los 5 y 10años del 73 y del 51%, respectivamente. En el estudio univariante se demostró que la angioinvasión, la invasión perineural, la recidiva durante el seguimiento, el estadio TNM y el grado de la clasificación de la OMS fueron factores de riesgo de mortalidad. En el análisis multivariante se observó que solo el grado de la clasificación de la OMS (HR=3,2; IC95%: 1,02-9,96) y la recidiva tumoral (HR=6,2; IC95%: 1,30-29,30) eran factores de riesgo de mortalidad a largo plazo (tabla 2). Asimismo, se realizó un estudio Kaplan-Meier según los grupos de la OMS, que evidenció una supervivencia a 5años del G1, G2 y G3 del 100, del 73 y del 29%, respectivamente (p=0,002) (fig. 4). Durante el seguimiento, 32 pacientes del escenario A siguen vivos y 13 fallecieron, con una supervivencia actuarial mediana de 131 meses (±10); 7 del escenario B siguen vivos y 5 fallecieron, con una supervivencia actuarial mediana de 102 meses (±41), y 4 del escenario C siguen vivos y 2 fallecieron, con una supervivencia actuarial mediana de 75meses (±0). En el análisis Kaplan-Meier la distribución de pacientes según el escenario clínico no halló diferencias estadísticamente significativas.
Análisis de los factores de riesgo de mortalidad a largo plazo tras la resección quirúrgica por tumor neuroendocrino pancreático no funcionante. Experiencia de 63 casos, Hospital Universitari de Bellvitge, 1993-2012
| Estudio univariantea | Estudio multivariantea | |||
|---|---|---|---|---|
| RR (IC 95%) | p | RR (IC 95%) | p | |
| Edad (> 70 años) | 0,70 | 0,26 | ||
| Sexo (hombre) | 0,67 | 0,42 | ||
| Tamaño (> 4 cm) | 0,34 | 0,23 | ||
| Metástasis hepáticas | 0,21 | 0,66 | ||
| Metástasis a ganglios | 0,19 | 0,92 | ||
| Angioinvasión | 5,53 (1,24-24,59) | 0,024 | 0,88 | |
| Invasión perineural | 4,78 (1,05-21,75) | 0,043 | 0,49 | |
| Grado del tumor OMS | 4,53 (1,83-11,17) | 0,001 | 3,2 (1,02-9,96) | 0,045 |
| Estadio TNM | 1,68 (1,02-2,77) | 0,040 | 0,95 | |
| Recidiva | 8,17 (2,38-28,03) | 0,001 | 6,2 (1,30-29,30) | 0,022 |
IC 95%: intervalo de confianza del 95%; n.s.: no significativo.
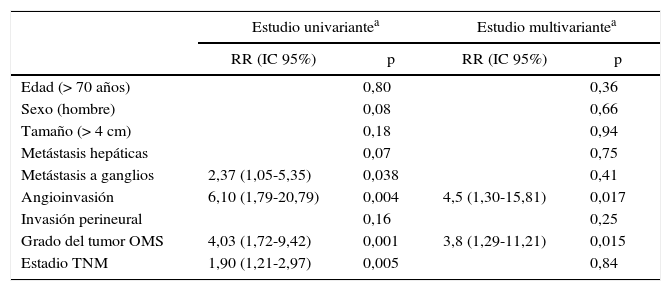
La supervivencia actuarial media libre de enfermedad fue de 8,9 años, y del 55 y el 37% a los 5 y 10 años. En el modelo de Cox univariante se demostró que la angioinvasión, la presencia de adenopatías patológicas, el estadio pTNM y el grado de la clasificación de la OMS fueron factores de riesgo de recidiva. En el análisis multivariante se observó que solo el grado de la clasificación de la OMS (HR=3,8; IC95%: 1,29-11,21) y la angioinvasión (HR=4,5; IC95%: 1,30-15,82) eran factores de riesgo de recidiva (tabla 3). De acuerdo con el escenario clínico, la recidiva se identificó en 14 pacientes del escenario A, falleciendo 11 de ellos; en 9 pacientes del escenario B, 5 de los cuales fallecieron, y un paciente del escenario C, que falleció durante el seguimiento.
Análisis de los factores de riesgo de recidiva a largo plazo tras la resección quirúrgica por tumor neuroendocrino pancreático no funcionante. Experiencia de 63 casos, Hospital Universitari de Bellvitge, 1993-2012
| Estudio univariantea | Estudio multivariantea | |||
|---|---|---|---|---|
| RR (IC 95%) | p | RR (IC 95%) | p | |
| Edad (> 70 años) | 0,80 | 0,36 | ||
| Sexo (hombre) | 0,08 | 0,66 | ||
| Tamaño (> 4 cm) | 0,18 | 0,94 | ||
| Metástasis hepáticas | 0,07 | 0,75 | ||
| Metástasis a ganglios | 2,37 (1,05-5,35) | 0,038 | 0,41 | |
| Angioinvasión | 6,10 (1,79-20,79) | 0,004 | 4,5 (1,30-15,81) | 0,017 |
| Invasión perineural | 0,16 | 0,25 | ||
| Grado del tumor OMS | 4,03 (1,72-9,42) | 0,001 | 3,8 (1,29-11,21) | 0,015 |
| Estadio TNM | 1,90 (1,21-2,97) | 0,005 | 0,84 | |
IC 95%: intervalo de confianza del 95%; n.s.: no significativo.
Los TNEPNF presentan una prevalencia creciente, como lo demuestran las publicaciones recientes del registro nacional americano (National Cancer Intitute's SEER)8,27. Tal y como se comenta, la incidencia de TNE entre 1973-1977 era de 1,7 por millón de habitantes, mientras que entre 2003-2007 pasó a ser de 4,3 por millón de habitantes. Al analizar los tumores menores de 2cm, la incidencia actual se ha duplicado respecto a la de hace 22años27. La mejoría en las pruebas diagnósticas y el aumento en la esperanza de vida han favorecido el aumento en el diagnóstico de estas lesiones, que en su mayoría son asintomáticas. Como es sabido, la dificultad en el manejo de estos pacientes estriba básicamente en la diversidad de formas de presentación, y por tanto en los diferentes tratamientos indicados. Así, el abanico clínico en el momento del diagnóstico va desde pacientes con una lesión infracentimétrica indolente hasta una gran lesión tumoral con infiltración venosa y metástasis hepáticas sincrónicas. Lógicamente, los tratamientos deberán individualizarse dependiendo de la extensión de la lesión. En el estudio actual hemos analizado nuestra experiencia en el tratamiento quirúrgico de los TNEPNF, haciendo hincapié en los factores pronóstico a largo plazo, incluyendo factores anatomopatológicos y clínicos.
Factores anatomopatológicosDurante la última década, los aspectos clinicopatológicos de los TNEP han sido definidos ampliamente. Los consensos recientes de las sociedades europea y americana (ENETS y NANETS), así como de la Organización Mundial de la Salud (OMS, 2010), han redefinido la nomenclatura y los diferentes estadios de clasificación de los TNEP. Hace años, algunos autores defendían la clasificación europea o americana (ENETS-pTNM, AJCC-pTNM)1,28 para el estudio y comparación de series quirúrgicas, al incluir detalles como el tamaño tumoral o la afectación ganglionar. Nuestro estudio demuestra la validez pronóstica de la clasificación de la OMS de 2010, siendo esta una de las variables que influyen en la supervivencia y en la recidiva de los pacientes estudiados. Así, un grado elevado de la clasificación de la OMS de 2010 comporta un mayor riesgo de muerte y de recidiva a largo plazo entre los pacientes intervenidos en nuestro centro, en la línea de otros autores6,10,12,13. Diversos factores anatomopatológicos tumorales, como el índice de proliferación Ki-67, la angioinvasión, la invasión perineural, el número de mitosis, la infiltración peripancreática y la afectación ganglionar han sido definidos como variables que influyen en el pronóstico de los pacientes con TNEPNF7,10-12,18,19,24,28-30. En nuestro estudio hemos incluido diversas variables en relación al tumor resecado, como la angioinvasión y la invasión perineural. Hemos demostrado que la angioinvasión tumoral implica un mayor riesgo de recidiva a largo plazo, en el estudio univariante y multivariante; el estudio univariante de factores de riesgo de muerte demostró que la angioinvasión era un factor de riesgo, a pesar de que el estudio multivariante no lo confirmó. Como vemos, la angioinvasión es uno de los factores que influyen en la mala evolución de los pacientes intervenidos, tal y como lo demostraron previamente otros autores18,29.
Tratamiento quirúrgicoLa resección quirúrgica es el tratamiento de elección en este tipo de tumores y está asociada con una mejoría en la supervivencia6,8-14,16-19,24,30. En lesiones bien diferenciadas (G1-G2), de pequeño tamaño, dependiendo de la localización en la glándula pancreática, se puede plantear la cirugía económica pancreática, que permite minimizar el impacto sobre la función exocrina y endocrina a largo plazo9,14,27. Ahora bien, la agresividad de los TNEPNF G3 aconsejaría la realización de una linfadenectomía regional para completar la cirugía oncológica, al tratarse de un carcinoma neuroendocrino. De hecho, la presencia de adenopatías afectas en el momento de la cirugía ha sido demostrada por algunas series como factor de peor pronóstico7,10,18,24,29,30. En nuestra experiencia, y de acuerdo con otros autores2,8,11, no hemos hallado una relación independiente entre la afectación adenopática y una peor supervivencia. La resección pancreática del TNEPNF obliga, en ocasiones, a la resección de órganos o estructuras vecinas, por su gran volumen o infiltración vascular9,31. En nuestra serie hemos asociado resección de otros órganos en 28 casos, obteniendo una supervivencia similar a los casos sin resección asociada.
Escenarios de tratamientoEn 2001, el grupo del MD Anderson, de Texas, publicó un extenso estudio sobre 163 TNEPNF intervenidos16 que inspiró numerosa literatura al respecto. En él se describen hasta 7 escenarios diferentes para el tratamiento de los TNEPNF. Los escenarios del 1 al 3 se referían a lesiones pancreáticas resecadas, dependiendo de la afectación de los márgenes quirúrgicos. El escenario 4, lesiones pancreáticas no resecadas. Los escenarios del 5 al 7 se referían a lesiones pancreáticas con metástasis hepáticas sincrónicas, ya sea con cirugía o sin cirugía. El paciente remitido al servicio de cirugía para su valoración debe ser estadificado correctamente para planificar su mejor tratamiento. Bajo nuestro punto de vista, el mejor esquema para planificar el tratamiento es dividir los pacientes con TNEPNF en 3 escenarios básicos, ya comentados previamente. A continuación comentaremos los resultados del estudio en base a estos.
Escenario A. Resección pancreática en ausencia de enfermedad a distanciaEl beneficio de la cirugía en TNEPNF sin afectación hepática en la supervivencia del paciente está bien documentada8,9,11,13,16,17. En esta línea, en nuestra experiencia, 32pacientes siguen vivos, con una supervivencia actuarial mediana de 131meses. Ahora bien, el gran volumen alcanzado de algunas lesiones implica una alta incidencia de resecciones vasculares31, o de resecciones de órganos vecinos, tal y como hemos realizado en el 44% de nuestros casos. En 2011, los grupos de Massachusetts11 y Verona19 publicaron sus experiencias con las lesiones pancreáticas resecadas. En dichos artículos se demostró que los TNEPNF resecados tenían un pronóstico distinto dependiendo del tamaño del tumor resecado, hecho que en nuestro estudio no hemos podido reproducir. Dichos artículos plantean una controversia en cuanto al manejo de los TNEPNF de pequeño tamaño. Mientras Haynes et al.11 defienden la resección de todos los TNEPNF a pesar de ser de pequeño tamaño (<2cm) o incidentales, por su posibilidad de malignidad, Bettini et al.19 abogan por el seguimiento en las lesiones <2cm incidentales, ya que únicamente un 6% de su serie tienen una agresividad tumoral que justifique la cirugía pancreática. La elevada morbilidad de la cirugía pancreática, junto con un bajo porcentaje de G3 en los tumores pequeños, fueron los argumentos para el manejo médico. Por último, para apoyar el manejo no quirúrgico, en 2012 el grupo de la Mayo Clínic4 publica una serie de 77 casos seguidos sin cirugía, sin progresión de la enfermedad durante el seguimiento. Recientemente, el tratamiento no quirúrgico de los TNEPNF pequeños ya ha sido recogido en diversas guías clínicas internacionales32. En nuestro centro hemos controlado 29 pacientes con lesiones incidentales menores de 3cm entre 2007-2015, sin evidenciar ningún caso de progresión tumoral ni extensión de la enfermedad33, con un seguimiento medio de 39meses.
Escenario B. Resección pancreática en presencia de metástasis hepáticas sincrónicas resecablesLa presencia de metástasis hepáticas sincrónicas es un hallazgo frecuente en los TNEPNF y un factor de riesgo de mortalidad y de recidiva a largo plazo que ha sido ampliamente demostrado6,8,10,12,16,18,25,28, a pesar de que no hemos podido reproducirlo. Entre finales de los noventa y la primera década del 2000, algunos grupos publicaron experiencias favorables a la resección hepática de metástasis de TNEPNF, defendiendo una mejoría en la supervivencia del paciente y de la calidad de vida. Incluso se evidenciaron supervivencias de entre el 70 y el 82% a los 5años34-37; a pesar de ello, la recidiva a largo plazo es la norma6,36-39. En un interesante trabajo, Elias et al.39 demostraron que las técnicas de imagen actuales infravaloran la presencia de metástasis hepáticas en más del 50% de los pacientes. En 2010, 2 estudios con gran número de pacientes fueron publicados, identificando factores pronóstico8,40. Mayo et al.40 publicaron la experiencia de 8 centros europeos y americanos, sobre 339 TNEP; el análisis multivariable identificó las metástasis sincrónicas, las de tumores no funcionantes y la presentación con enfermedad extrahepática como factores de mal pronóstico. Ese mismo año, Franko et al.8 publicaron una de las series con 2.158 casos analizados retrospectivamente, demostrando, en el subgrupo de pacientes con metástasis hepáticas, que la resección del tumor primario y/o de las metástasis se asociaba a un mejor pronóstico. Ahora bien, hasta el momento pocas experiencias en la literatura comparan pacientes intervenidos y no intervenidos. En 2006, Osborne et al.41 estudiaron 61 pacientes intervenidos frente a 59 embolizados, demostrando una supervivencia mayor entre los pacientes operados. Dicho estudio fue criticado, ya que los 2 grupos de pacientes no eran comparables. Más tarde, en 2011, Mayo et al.42 publicaron un análisis que aportó mayor rigor a la comparación. En él se analizó la experiencia de 9 centros, comparando la resección de las metástasis hepáticas frente al tratamiento intraarterial y realizando un análisis «propensity score» para minimizar los sesgos de selección; demostraron que la supervivencia de los pacientes intervenidos fue superior a la de los pacientes no intervenidos. Finalmente, en un metaanálisis reciente43 se compararon 161 resecados frente a 374 no resecados. Se halló una supervivencia significativamente mayor en los pacientes tratados con la resección de las metástasis hepáticas frente a los tratados con embolización. Así pues, parece claro que la resección hepática en pacientes con lesiones resecables está justificada. Tal y como hemos comentado, en nuestra serie los 12 pacientes sometidos a resección pancreática y hepática han presentado una supervivencia actuarial mediana de 102 meses, hecho que no difiere de la supervivencia de los pacientes resecados sin metástasis hepáticas.
Escenario C. Resección pancreática en presencia de metástasis hepáticas sincrónicas irresecablesEl tipo de resección hepática utilizada dependerá del número de metástasis, del lugar y de la reserva funcional hepática postoperatoria. En pacientes con metástasis hepáticas bilobares las técnicas ablativas o de quimioembolización son alternativas para permitir una resección radical. Recientemente, otras estrategias han sido propuestas en casos de enfermedad diseminada, para permitir la cirugía. En esta línea, el grupo del Hospital Beaujon44 describió un abordaje en 2 tiempos para la resección del tumor primario y de metástasis hepáticas sincrónicas y bilobulares. Este procedimiento permitió la resección completa de la enfermedad sin mortalidad y con aceptable morbilidad (de un 20% en cada procedimiento), y una larga supervivencia en pacientes seleccionados con metástasis hepáticas multilobulares. Sin embargo, en algunos casos los pacientes no podrán ser sometidos a resección hepática por la gran cantidad de afectación hepática, resecando únicamente el tumor primario pancreático. Este escenario ofrece dudas sobre el beneficio de la cirugía pancreática en este contexto, y diversas series previas a la nuestra lo analizan. Así, Nguyen et al.45 y Solorzano et al.16 demostraron una supervivencia superior entre los pacientes resecados (60 y 49% a 5años, respectivamente) frente a los no resecados (30 y 16% a 5años, respectivamente) gracias a esta estrategia. Bettini et al.46 demostraron únicamente una mejor calidad de vida, a pesar de no demostrar diferencias en supervivencia. Bertani et al.47 y Keutgen et al.48 han demostrado, en sendos estudios multivariantes, que la resección del tumor primario en presencia de metástasis hepáticas irresecables se asocia con una mejor supervivencia a largo plazo. En nuestra experiencia, 4 de los 6 pacientes incluidos en este escenario siguen vivos al cierre del estudio, con una supervivencia similar al resto. A nuestro criterio, y de acuerdo con otros autores9,47,48, los pacientes con afectación pancreática y metástasis hepáticas sincrónicas irresecables deben ser estudiados mediante punción percutánea para valorar el grado de diferenciación del tumor. En los casos con tumores bien diferenciados (G1-G2) se resecaría la lesión primaria, mientras que los tumores mal diferenciados (G3) con una evolución rápidamente progresiva no se benefician de la resección.
Por último, en los pacientes menores de 50años con tumor pancreático previamente resecado y afectación hepática irresecable sintomática sin otras posibilidades terapéuticas debería evaluarse el trasplante hepático dentro del abordaje multidisciplinar48-51. Le Treut et al.49 publicaron recientemente un estudio multicéntrico europeo sobre 35 centros. Demostraron que, con una correcta selección de pacientes, se puede alcanzar una supervivencia del 80% y una supervivencia libre de enfermedad del 57% a los 5años. Por último, actualmente las guías clínicas europeas y americanas actuales (ENETS9 y NANETS52) recogen la opción del trasplante en casos muy seleccionados.
En conclusión, el tratamiento de elección del TNEPNF sin enfermedad a distancia es la resección quirúrgica radical. En lesiones de pequeño tamaño bien diferenciadas, dependiendo de su localización en la glándula pancreática, se puede indicar cirugía conservadora. Se debe tener en cuenta que el papel de la cirugía es controvertido en lesiones asintomáticas menores de 2cm. En nuestra experiencia, el seguimiento es una opción válida en lesiones incidentales de pequeño tamaño (<2cm), sobre todo en pacientes añosos. Las metástasis hepáticas sincrónicas resecables en los tumores bien diferenciados deben resecarse junto con el tumor primario, ya sea de forma simultánea o secuencial. Así pues, en nuestra opinión, en dicho escenario la cirugía debe contemplarse como primera opción. La resección del tumor primario pancreático con metástasis hepáticas sincrónicas irresecables debe considerarse en la estrategia terapéutica de los pacientes con TNEPNF bien diferenciados. La indicación quirúrgica en este escenario debe ser exhaustivamente analizada, excluyendo casos con enfermedad hepática generalizada, o en presencia de enfermedad extraabdominal. Por último, según nuestra experiencia, el grado de clasificación de la OMS y la recidiva tumoral son factores de riesgo de mortalidad a largo plazo tras la resección de TNEPNF.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.