La adquisición y jerarquización de la evidencia, así como la posterior formulación de recomendaciones, constituyen la base del desarrollo de las guías de práctica clínica. Sistemas de graduación de la calidad de la evidencia y de la fuerza de las recomendaciones han existido muchos y actualmente se va imponiendo el modelo Grading of Recommendations, Assessment, Development and Evaluation (GRADE). En el sistema GRADE la calidad de la evidencia se clasifica, inicialmente, en alta o baja, según provenga de estudios experimentales u observacionales; posteriormente, según una serie de consideraciones, la evidencia queda en alta, moderada, baja y muy baja. La fuerza de las recomendaciones se apoya no solo en la calidad de la evidencia, sino en una serie de factores como son el balance entre riesgos y beneficios, los valores y preferencias de pacientes y profesionales, y el consumo de recursos o costes.
The acquisition and classification of scientific evidence, and subsequent formulation of recommendations constitute the basis for the development of clinical practice guidelines. There are several systems for the classification of evidence and strength of recommendations; the most commonly used nowadays is the Grading of Recommendations, Assessment, Development and Evaluation system (GRADE). The GRADE system initially classifies the evidence into high or low, coming from experimental or observational studies; subsequently and following a series of considerations, the evidence is classified into high, moderate, low or very low. The strength of recommendations is based not only on the quality of the evidence, but also on a series of factors such as the risk/benefit balance, values and preferences of the patients and professionals, and the use of resources or costs.
La medicina basada en la evidencia (MBE) implica que el profesional integre su conocimiento y juicio médicos con la mejor evidencia científica existente. Determinar cuáles son las mejores evidencias exige unas habilidades en la identificación, análisis crítico y jerarquización de las evidencias disponibles en la literatura. Este primer paso es imprescindible, puesto que cualquier recomendación o grado de recomendación que se proponga respecto a una intervención preventiva o terapéutica o respecto a un procedimiento diagnóstico ha de estar directamente relacionada con la calidad (y otros factores) de la evidencia existente.
El mayor interés de la MBE está en su utilización por grupos de expertos que desarrollan guías de práctica clínica (GPC) para el estudio, diagnóstico, tratamiento o prevención de una enfermedad o problema de salud. Se describen hasta 8 fases en el desarrollo de una guía (tabla 1), pero en este artículo únicamente nos ocuparemos de las fases 3 a 6 (formulación de preguntas, adquisición de evidencia, atribución de calidad y formulación de recomendaciones). La obtención de GPC útiles no es tarea sencilla debido a la heterogeneidad de los individuos que constituyen los grupos o comités de expertos que las realizan, a sus diferentes puntos de vista y métodos, y a la misma variabilidad en la información científica disponible sobre un tema concreto1–3. Hasta hace unos años estos grupos de expertos seguían una metodología informal para alcanzar los acuerdos, pero recientemente se han mejorado los procedimientos de jerarquización de la evidencia y de establecimiento de las recomendaciones pertinentes. Aquí entra en consideración el sistema Grading of Recommendations, Assessment, Development and Evaluation (GRADE).
Elaboración de una guía de práctica clínica: fases
| 1. Delimitación del alcance y de los objetivos |
| 2. Creación del grupo elaborador de la GPC |
| 3. Formulación de las preguntas clínicas (PICO) |
| 4. Búsqueda de la evidencia |
| 5. Evaluación y síntesis de la literatura |
| 6. Formulación de recomendaciones |
| 7. Revisión externa |
| 8. Edición |
GPC: guía de práctica clínica; PICO.
Existe un amplio número de sistemas refinados de categorización de la evidencia científica, entre los que podemos señalar el modelo inglés Oxford Centre for Evidence-Based Medicine (OCEBM), el escocés Scottish Intercollegiate Guidelines Network (SIGN) o el estadounidense del American College of Chest Physicians (ACCP) que utilizó la misma ACCP en sus guías sobre trombosis venosa hasta su séptima revisión4–6. Todos ellos atribuían diferentes niveles de calidad a los estudios sobre un determinado problema, que luego permitían asignar distintos grados de recomendación. Sin embargo, pronto se observaron algunos inconvenientes, como el hecho de que estos sistemas se desarrollaron principalmente por el consenso de opinión de expertos y no fueron validados7. Así, en ocasiones, diferentes sistemas no categorizaban los mismos estudios en los análogos niveles de evidencia. Incluso con un mismo modelo se producían a veces falta de acuerdos. Además, algunos sistemas eran mejores en estimar el nivel de evidencia que en establecer el grado de recomendación, y viceversa. Todo lo anterior hacía que a veces no existiera una buena fiabilidad de las GPC.
En 2004 se comunica la propuesta del grupo de trabajo GRADE, formado por un conjunto internacional y multidisciplinar de metodólogos, expertos en GPC y médicos clínicos, que pretenden obviar los problemas descritos8,9. La bondad del sistema estriba en que es un método riguroso y transparente tanto en la clasificación del nivel de evidencia como en la asignación del grado o fortaleza de la recomendación. En este artículo desarrollaremos estos puntos tal como lo hace el sistema GRADE, pero antes comentaremos los pasos que se deben seguir para la elaboración de las preguntas clínicas.
Formulación de las preguntas clínicas en formato PICO y búsqueda de las respuestasUna vez establecido el alcance de una GPC es necesario definir una serie de preguntas clínicas que se agruparán en apartados de organización, prevención, diagnóstico, tratamiento, pronóstico, etc. Para pasar de una pregunta clínica genérica a una formulada de forma específica de tal modo que facilite la búsqueda bibliográfica y la elaboración de recomendaciones para cada cuestión, se prefiere el método PICO, acrónimo de Pacientes-Intervención-Comparación-resultados/Outcomes. Así:
- a.
Paciente: o población, estadios de enfermedad, grupos de edad, comorbilidad, etc.
- b.
Intervención: tratamiento, prueba diagnóstica, agente etiológico, etc.
- c.
Comparación: posible alternativa a la intervención en estudio como tratamiento habitual o placebo, patrón oro de referencia de una prueba diagnóstica, ausencia de agente etiológico, etc.
- d.
Resultados (outcomes): variables de resultados relevantes en caso de estudios sobre eficacia, pronóstico o etiología, y estimadores de validez en el caso de pruebas diagnósticas (sensibilidad, especificidad, coeficientes de probabilidad, etc.).
Al formular las preguntas clínicas en formato PICO queda definido de forma concreta y sin ambigüedad lo que se pretende averiguar y, además, como a cada tipo de pregunta corresponde un tipo de estudio con el diseño adecuado para su respuesta, el formato ayuda a realizar la búsqueda en la literatura. Durante la confección de las preguntas clínicas hay que definir todas las posibles variables de resultado o desenlace, cuestión aún más relevante cuando se utiliza en la elaboración de las recomendaciones el sistema GRADE, donde se califican las variables según su importancia para clínicos y pacientes y se las pondera en una escala que va del 1 al 9. Únicamente las variables con puntuación del 7 al 9 son consideradas clave para afectar una decisión en el sistema GRADE y es a estas variables clave a las que hay que especificar las preguntas clínicas. Las respuestas a estas preguntas sobre resultados clave serán las que principalmente se utilizarán para graduar las recomendaciones. Las variables con puntuación del 4 al 6 se califican de importantes, pero no clave para la toma de decisiones. Las puntuadas del 1 al 3 se consideran no importantes y no se incluyen en la evaluación, tampoco influirán en las recomendaciones. La selección estricta y acertada de las variables de resultados o desenlaces clave hace que los estudios se seleccionen de igual forma y, así, es posible que los hallazgos que luego se van a considerar para inferir las recomendaciones y, por tanto, la fortaleza de las mismas pueda variar de una GPC a otra10.
Encontrar las respuestas que buscamos a las preguntas PICO requiere, en ocasiones, la colaboración de un documentalista. Podemos necesitar consultar otras GPC anteriores, o revisiones sistemáticas actualizadas, o estudios originales. Localizada la evidencia científica, se debe categorizar según su calidad metodológica (validez interna), la importancia de los resultados y su aplicabilidad.
Finalmente, se gradúa la fuerza de las recomendaciones con arreglo a un sistema determinado. Hasta ahora se ha venido utilizando, entre otros, el sistema escocés SIGN para las preguntas relacionadas con tratamiento o pronóstico, y el inglés Oxford CMBE para las preguntas sobre diagnóstico. En la actualidad se va imponiendo el sistema GRADE que será el que comentemos a continuación. El GRADE Working Group propuso un diferente abordaje basado en sistemas previos y que presume de mejor estructura y mayor transparencia e información8–14. Tiene la ventajas de que a) sopesa la importancia relativa de las variables de resultado o desenlace y elige las que son clave; b) proporciona detalladas descripciones de los criterios de calidad de evidencia respecto a resultados o desenlaces concretos y usa definiciones explícitas y juicios secuenciales durante el proceso de categorización; c) separa la calidad de la evidencia de la fuerza de las recomendaciones; d) además, considera el balance entre beneficios y riesgos, los valores del paciente y el consumo de recursos o costes. También proporciona las tablas de los llamados perfiles de evidencia y sumario de hallazgos, unas tablas singulares e imprescindibles que más adelante comentaremos.
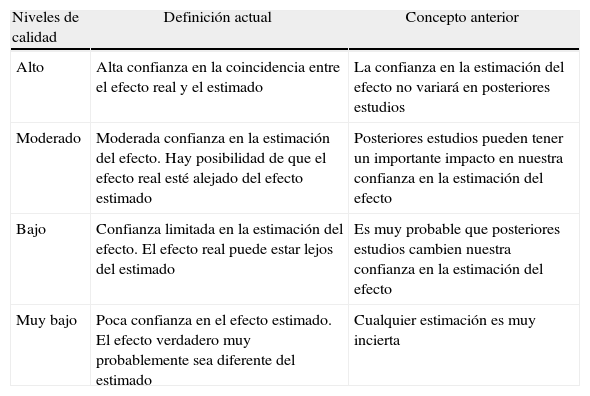
Niveles de evidenciaGRADE define la calidad de la evidencia como el grado de confianza que tenemos en que la estimación de un efecto sea la adecuada para efectuar una recomendación. Para cada uno de los desenlaces o resultados clave se efectúa una evaluación; así, una misma comparación de una intervención terapéutica o preventiva puede recibir diferentes asignaciones de la calidad de la evidencia. En la clasificación del nivel de calidad de la evidencia, el sistema GRADE establece 4 categorías: alta, moderada, baja y muy baja. Lo que representa o significa cada una de las 4 categorías, en su concepción inicial y en la actual, se expone en la tabla 2.
Sistema GRADE: Significado de los 4 niveles de evidencia
| Niveles de calidad | Definición actual | Concepto anterior |
| Alto | Alta confianza en la coincidencia entre el efecto real y el estimado | La confianza en la estimación del efecto no variará en posteriores estudios |
| Moderado | Moderada confianza en la estimación del efecto. Hay posibilidad de que el efecto real esté alejado del efecto estimado | Posteriores estudios pueden tener un importante impacto en nuestra confianza en la estimación del efecto |
| Bajo | Confianza limitada en la estimación del efecto. El efecto real puede estar lejos del estimado | Es muy probable que posteriores estudios cambien nuestra confianza en la estimación del efecto |
| Muy bajo | Poca confianza en el efecto estimado. El efecto verdadero muy probablemente sea diferente del estimado | Cualquier estimación es muy incierta |
En una primera etapa el sistema GRADE considera de calidad alta los estudios experimentales (ensayos clínicos aleatorizados) y de calidad baja los estudios observacionales (casos y controles, cohortes). En un segundo paso, para refinar el nivel de calidad, el sistema establece una serie de ítems que hay que considerar y que pueden hacer bajar o subir el escalón o nivel de la calidad inicialmente asignada.
- a.
Ítems que bajan la calidad:
- 1)
Limitaciones en el diseño y ejecución del estudio (riesgo de sesgo): Así, aleatorización insuficiente o incorrecta, falta de enmascaramiento, pérdidas importantes de seguimiento, análisis sin intención de tratar y ensayos acabados antes de tiempo.
- 2)
Inconsistencia de los resultados (inconsistency): cuando los resultados muestran amplia variabilidad o heterogeneidad no explicada. Particularmente si unos estudios muestran beneficios sustanciales y otros ningún efecto o incluso perjuicio.
- 3)
Incertidumbre acerca de que la evidencia sea directa (indirectness): Siguiendo el método PICO, puede ocurrir con los pacientes estudiados (diferencias en edad, sexo o estadio clínico); o con la intervención, en caso de que ésta sea parecida pero no idéntica; o con la compraración que se realiza; o con los resultados, si se comparan unos a corto plazo y otros a largo plazo, etc.
- 4)
Imprecisión (imprecision): tiene lugar si los intervalos de confianza (IC) son amplios, las muestras pequeñas, o los eventos son pocos.
- 5)
Sesgo de publicación o notificación (publication bias): cuando existe alta probabilidad de estudios no reportados, principalmente por ausencia de efectos, o no se han incluido todas las variables relevantes de resultado.
- 1)
- b.
Ítems que suben la calidad:
- 1)
Fuerte asociación: hallazgos de efectos relativos RR>2, o < 0,5 en estudios observacionales sin factores de confusión.
- 2)
Muy fuerte asociación: hallazgos de efectos relativos RR > 5, o<0,2 basados en estudios sin problemas de sesgo o precisión.
- 3)
Existencia de gradiente dosis-respuesta (dose-response gradient).
- 4)
Evidencia de que todos los posibles factores de confusión o sesgos podrían haber reducido el efecto observado.
- 1)
Las situaciones que pueden determinar un incremento de la confianza en los resultados de estudios observacionales son infrecuentes. En tales casos se debería considerar este aumento únicamente si no hay limitaciones de diseño o ejecución (que podría disminuir la calidad) y, además, existe un efecto muy importante e inmediato o un cambio radical en el pronóstico tras determinada intervención.
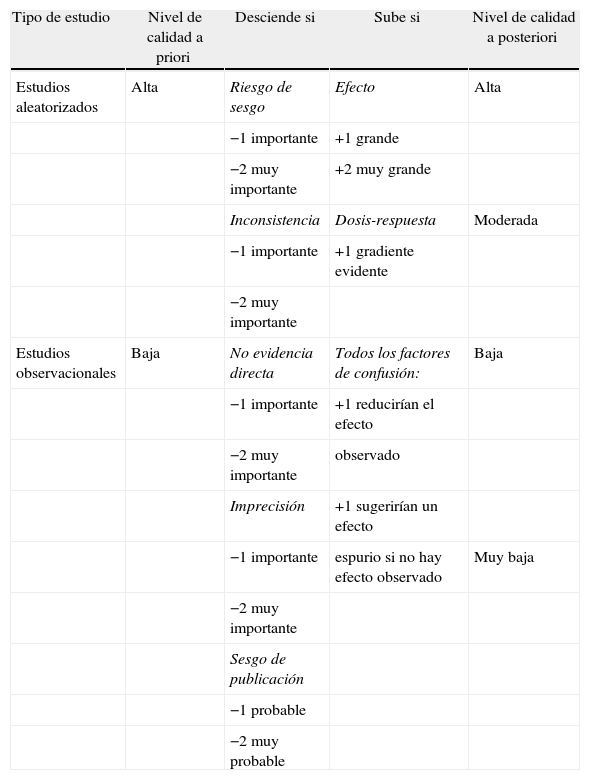
Todos estos ítems determinan, con arreglo a las puntuaciones que se expresan en la tabla 3, un ascenso o un descenso en el nivel de la calidad de la evidencia. Terminado el análisis, los expertos del GRADE resumen toda la evidencia, respecto a las preguntas concretas y las variables de resultado o desenlace previamente escogidas, en una tablas-resumen que denominan perfil de evidencia (evidence profiles [GRADE EP]) y sumario de hallazgos (summary of findings [GRADE SoF]). Las tablas EP y SoF tienen diferentes propósitos y van dirigidas a colectivos distintos15,16.
Clasificación del nivel de evidencia según el sistema GRADE
| Tipo de estudio | Nivel de calidad a priori | Desciende si | Sube si | Nivel de calidad a posteriori |
| Estudios aleatorizados | Alta | Riesgo de sesgo | Efecto | Alta |
| −1 importante | +1 grande | |||
| −2 muy importante | +2 muy grande | |||
| Inconsistencia | Dosis-respuesta | Moderada | ||
| −1 importante | +1 gradiente evidente | |||
| −2 muy importante | ||||
| Estudios observacionales | Baja | No evidencia directa | Todos los factores de confusión: | Baja |
| −1 importante | +1 reducirían el efecto | |||
| −2 muy importante | observado | |||
| Imprecisión | +1 sugerirían un efecto | |||
| −1 importante | espurio si no hay efecto observado | Muy baja | ||
| −2 muy importante | ||||
| Sesgo de publicación | ||||
| −1 probable | ||||
| −2 muy probable |
Las tablas EP son más amplias, presentan los hallazgos relevantes de cada uno de los resultados o desenlaces clave, ofreciéndolos en líneas donde, en la diferentes columnas, se expresan el número de estudios y el número de pacientes, el diseño (aleatorizado u observacional), las comparaciones efectuadas, los estimadores del efecto observado en términos de efecto relativo RR (con su IC 95%) y efecto absoluto, y, además, incluyen un juicio explícito de los factores que ponderan la calidad de los estudios (limitaciones de diseño, inconsistencia, incertidumbre, sesgo de notificación, etc.); finalmente categorizan la calidad de la evidencia para cada uno de los resultados en forma de cruces positivas (+) de 4 a 1, o sea, calidad alta, moderada, baja o muy baja, respectivamente, con el significado que se expresa en la tabla 3. En los casos de tablas que abordan los niveles de evidencia de cuestiones en relación con pruebas diagnósticas, el formato puede ser diferente. Los perfiles de evidencia van dirigidos a un colectivo reducido como revisores y creadores de GPC; también a cualquiera que se cuestione o quiera comprobar la bondad de una valoración.
Las tablas SoF son más escuetas y solo ofrecen los hallazgos relevantes de cada resultado, es decir, como antes señalamos, el número de estudios y el número de pacientes, las comparaciones efectuadas, los estimadores del efecto observado en términos de efecto relativo RR (con su IC 95%) y efecto absoluto; también expresan la calidad asignada. Los sumarios de hallazgos van dirigidos a un colectivo más amplio, principalmente usuarios de GPC y lectores de revisiones sistemáticas. Existe un programa informático o software (GRADEpro) que facilita tanto la creación de tablas EP como tablas SoF14. Para ampliar conocimientos sobre tablas EP y SoF puede consultarse a Guyatt et al.16.
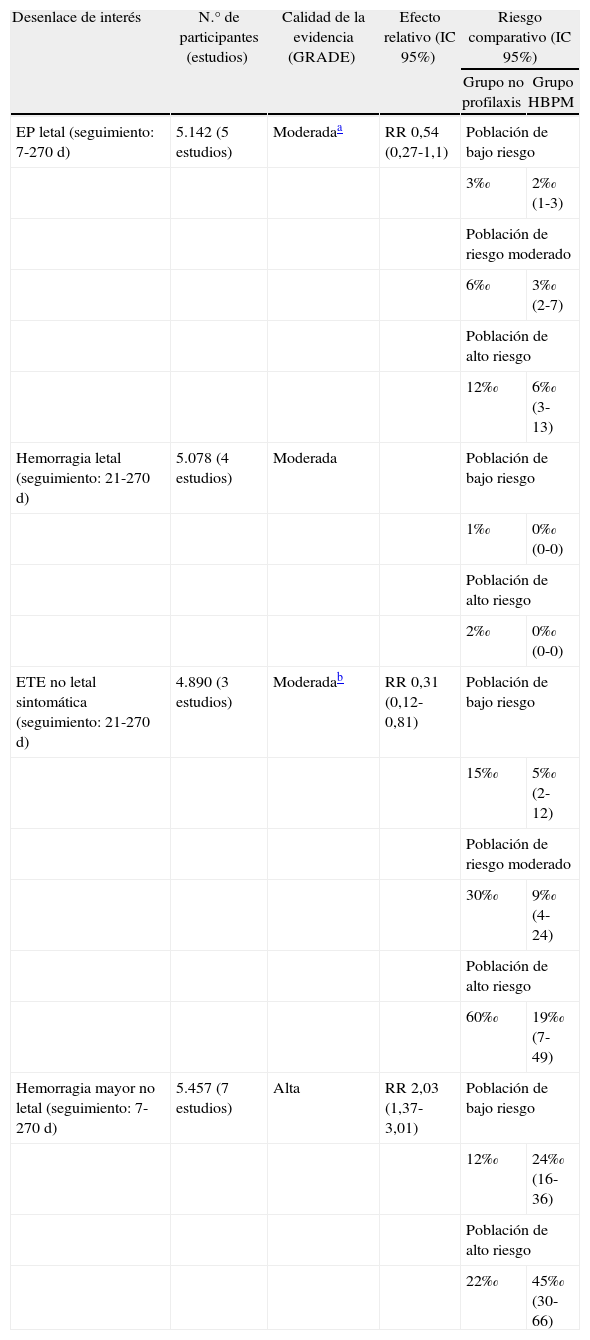
A este respecto, en la guía de la ACCP para Terapia antitrombótica y prevención de trombosis (9.a ed) destacamos una tabla que resume la evidencia para la instauración de profilaxis tromboembólica farmacológica en pacientes quirúrgicos (tabla 4). Observamos una disminución de la calidad de la evidencia en 2 de los desenlaces de interés (embolismo pulmonar fatal y enfermedad tromboembólica venosa sintomática no fatal). En un caso, por la imprecisión asociada a una posible no obtención de efecto, y, en el otro, por limitaciones en el diseño de uno de los estudios. Si comparamos con la 8.a edición de dicha guía, observamos que el nivel de evidencia y el grado de recomendación para profilaxis tromboembólica farmacológica en pacientes de riesgo moderado sometidos a cirugía mayor ha disminuido en la nueva guía17,18.
Efecto de profilaxis con heparina de bajo peso molecular respecto a no profilaxis de enfermedad tromboembólica en pacientes quirúrgicos
| Desenlace de interés | N.° de participantes (estudios) | Calidad de la evidencia (GRADE) | Efecto relativo (IC 95%) | Riesgo comparativo (IC 95%) | |
| Grupo no profilaxis | Grupo HBPM | ||||
| EP letal (seguimiento: 7-270 d) | 5.142 (5 estudios) | Moderadaa | RR 0,54 (0,27-1,1) | Población de bajo riesgo | |
| 3‰ | 2‰ (1-3) | ||||
| Población de riesgo moderado | |||||
| 6‰ | 3‰ (2-7) | ||||
| Población de alto riesgo | |||||
| 12‰ | 6‰ (3-13) | ||||
| Hemorragia letal (seguimiento: 21-270 d) | 5.078 (4 estudios) | Moderada | Población de bajo riesgo | ||
| 1‰ | 0‰ (0-0) | ||||
| Población de alto riesgo | |||||
| 2‰ | 0‰ (0-0) | ||||
| ETE no letal sintomática (seguimiento: 21-270 d) | 4.890 (3 estudios) | Moderadab | RR 0,31 (0,12-0,81) | Población de bajo riesgo | |
| 15‰ | 5‰ (2-12) | ||||
| Población de riesgo moderado | |||||
| 30‰ | 9‰ (4-24) | ||||
| Población de alto riesgo | |||||
| 60‰ | 19‰ (7-49) | ||||
| Hemorragia mayor no letal (seguimiento: 7-270 d) | 5.457 (7 estudios) | Alta | RR 2,03 (1,37-3,01) | Población de bajo riesgo | |
| 12‰ | 24‰ (16-36) | ||||
| Población de alto riesgo | |||||
| 22‰ | 45‰ (30-66) | ||||
EP: embolismo pulmonar; ETE: enfermedad tromboembólica; HBPM: heparina de bajo peso molecular.
Fuente: adaptado de Mismetti et al.17.
El sistema GRADE establece las recomendaciones basándose en una serie de consideraciones8,9,11,12. Así: 1) balance entre riesgos y beneficios: Está basado en el conocimiento de que la mayoría de los clínicos ofrecerán a los pacientes medidas terapéuticas o preventivas siempre que las ventajas de la intervención superen los riesgos y daños colaterales. La certidumbre o incertidumbre con la que el clínico contempla el balance riesgo/beneficio determinará en gran parte la fuerza de la recomendación. 2) Calidad de la evidencia: El segundo factor es la calidad metodológica de los estudios para cada una de las variables de resultados, factor ponderado por los detalles que expusimos y que podían elevar o disminuir el nivel de la evidencia. En general, el grado de la recomendación sigue al nivel de la evidencia, pero no siempre. 3) Han de considerarse también los valores y preferencias de los pacientes. Para ello hay que realizar un juicio de valor y conocer previamente los valores y preferencias de la población de nuestro entorno y de posibles diferencias individuales. 4) Estimación del consumo de recursos o costes.
Todavía faltan estudios apropiados que analicen los valores y preferencias de los pacientes ante situaciones definidas; en cualquier caso, los valores y preferencias fortalecen el grado de la recomendación cuando la concordancia es alta y lo debilitan cuando existe una elevada variabilidad. El análisis de costes suele requerir el concurso de expertos en economía de la salud. En general, se considera que una intervención se puede calificar de muy coste-efectiva si cuesta < una vez la media de la renta per cápita de un país o región por año de vida ajustado por calidad (AVAC) ganado. Incluso hasta 3 veces la media de la renta per cápita por AVAC ganado puede ser tolerable. La OMS ha desarrollado tablas de umbrales al respecto19,20.
Finalmente, de forma simple, las recomendaciones se gradúan de forma binaria en: fuertes (grado 1) o débiles (grado 2), bien a favor, bien en contra. Una recomendación fuerte supone que la inmensa mayoría de los pacientes estarían de acuerdo (o en contra) respecto a la acción recomendada. Los clínicos deberían implementar la acción en la mayor parte de los pacientes y las autoridades sanitarias habrían de adoptar la recomendación como política sanitaria en la mayoría de las situaciones. Una recomendación débil supone que la mayoría de los pacientes aceptarían (o rechazarían) la acción recomendada, pero un número importante de ellos no lo estarían. Los clínicos deberían reconocer que hay diferentes opciones apropiadas para distintos pacientes y, en este caso, habría que ayudar a cada paciente a alcanzar la decisión más consistente con sus valores y preferencias; las autoridades sanitarias deberían debatir la puesta en marcha de la recomendación con los grupos de interés.
En el ejemplo que hemos sugerido anteriormente, observamos que la profilaxis farmacológica del tromboembolismo pulmonar reduce significativamente el riesgo de enfermedad tromboembólica venosa (ETEV) no fatal, no así el embolismo pulmonar (EP) mortal, con un aumento del riesgo de hemorragia mayor no letal (balance entre riesgos y beneficios). Por otro lado, respecto a la calidad de la evidencia, vemos como esta disminuye por la imprecisión observada en los resultados de EP letal así como por limitaciones en el diseño de algún estudio. En definitiva, para pacientes con riesgo tromboembólico moderado se establece una recomendación débil a favor del uso de profilaxis farmacológica18.
Limitaciones, futuro, uso en España del sistema GRADESe deben conocer algunas limitaciones. Así, en primer lugar, el método se ha desarrollado para responder a cuestiones sobre intervenciones alternativas, sobre todo de tratamiento o prevención, no sobre riesgo o pronóstico, y tiene dificultades respecto a pruebas diagnósticas, temas de salud pública o sistemas de salud. Segundo, solo considera los pasos 3 a 6 (tabla 1) de elaboración de una GPC. Y tercero, aunque el sistema hace juicios de una forma altamente sistemática, transparente y reproducible, no elimina por completo los desacuerdos que pueden existir al valorar una evidencia o al decidir cursos alternativos de acción, puesto que siempre hay una impregnación subjetiva en todo juicio.
Para quienes deseen ampliar o profundizar en el método GRADE, como autores de revisiones sistemáticas o de estudios de evaluación de tecnologías sanitarias, panelistas de GPC y metodólogos, existe una amplia y exhaustiva serie de artículos secuenciales al respecto publicada en el Journal of Clinical Epidemiology entre 2011 y 2013, todavía no concluida15,21–32.
En España, algunas revistas científicas de prestigio y factor impacto notable se han hecho eco del fenómeno GRADE. Así, la Revista de Atención Primaria33, Medicina Clínica34, Archivos de Bronconeumología35 y Revista Española de Cardiología13. Por otra parte, se ha comunicado su uso tanto en la evaluación de tecnologías sanitarias36 como en el desarrollo de GPC37–39.
Conflicto de interesesNo existe.