Los carcinomas mixtos adenoneuroendocrinos (MANEC) se caracterizan por la presencia simultánea de un componente glandular exocrino y un componente neuroendocrino. Son tumores poco frecuentes y heterogéneos presentando un perfil morfológico, clínico y pronóstico muy variable.
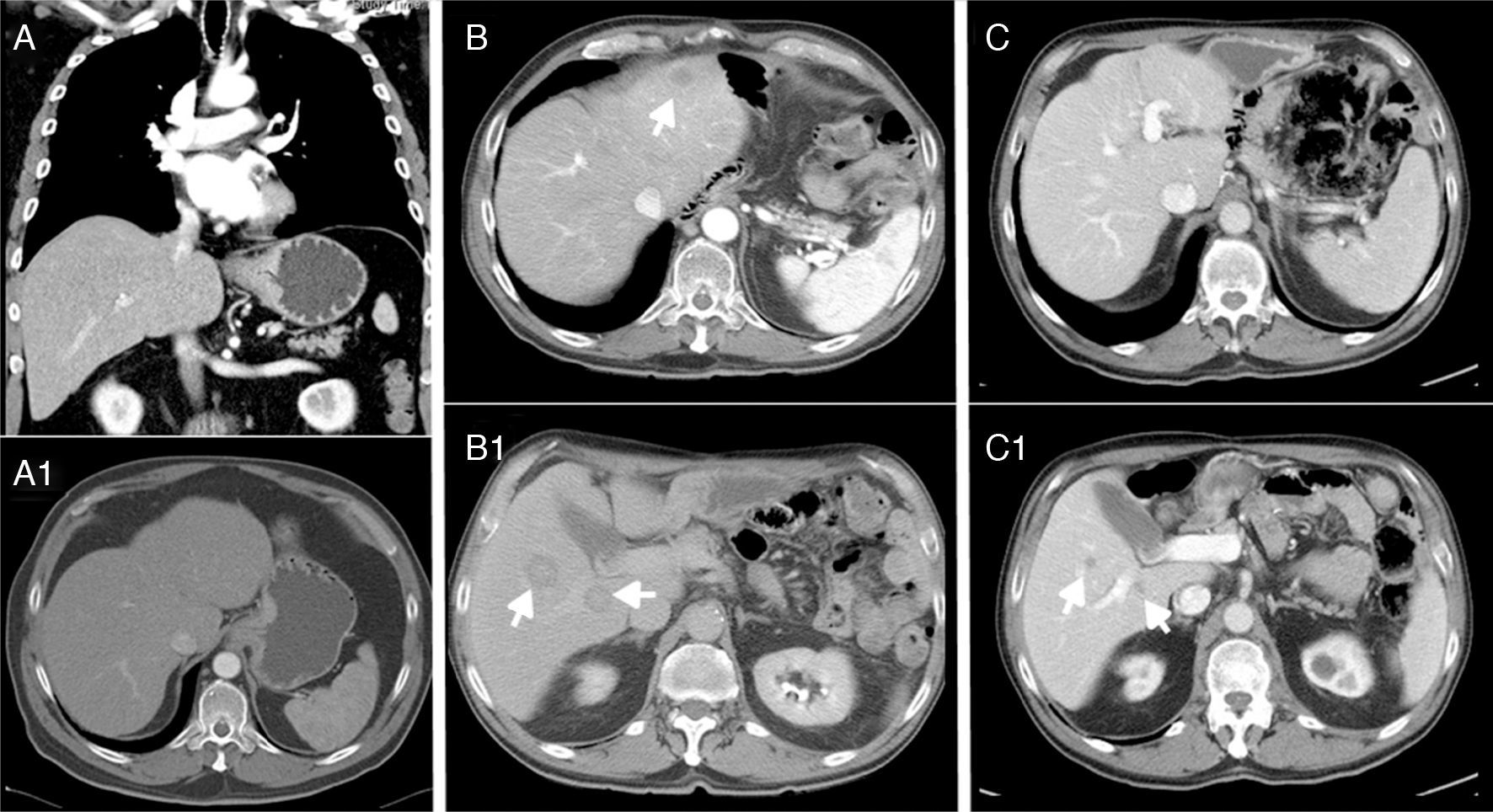
Presentamos el caso de un varón de 69 años, hipertenso controlado, que acude por disfagia progresiva de 4 meses de evolución y pérdida de peso. La endoscopia muestra una masa neoproliferativa en cardias con estenosis y biopsia de adenocarcinoma pobremente diferenciado. La TAC (fig. 1A y 1A1) presenta un engrosamiento mucoso y submucoso de 5cm del cardias (probable T2-T3), adenopatía no concluyente en ligamento gastrohepático, sin evidencia de metástasis a distancia. Los marcadores tumorales eran: CEA: 18,7ng/ml y CA 19-9: 32U/ml.
A-A1) Engrosamiento mucoso y submucoso de 5cm del cardias, adenopatía sospechosa en ligamento gastrohepático, sin evidencia de metástasis a distancia. B-B1) Lesiones hepáticas compatibles con metástasis en los segmentos II, VI y VII a los 14 meses. C-C1) Enfermedad estable sin recaída local y sin crecimiento de las metástasis; actualmente menores de 1cm a los 32 meses.
Durante la cirugía se identificó una tumoración en unión esofagogástrica que infiltraba el hiato y metástasis hepática única periférica en el segmento III, sin evidenciarse otras con la ecografía intraoperatoria. Se decidió realizar metastasectomía hepática dado que la metástasis era única, periférica, y no implicaba mayores riesgos para el paciente. Posteriormente se realizó esofagogastrectomía con anastomosis intramediastínica esofagoyeyunal en Y de Roux como método paliativo.
El examen macroscópico de la pieza quirúrgica mostró afectación circunferencial en la unión esófago-gástrica y bordes libres (margen proximal 4cm).
El estudio patológico mostró un tumor MANEC grado 3 de la OMS 2010 con índice Ki-67>20%. Se aisló un ganglio infiltrado de 28 estudiados. La lesión hepática fue positiva para tumor MANEC con HercepTest™ negativo. El estadio final fue pT3N3M1 (AJCC/UICC TNM 7.ª edición), por ello recibió 6 ciclos de quimioterapia adyuvante con carboplatino y etopósido.
A los 6 meses la TAC y la SPET-TAC fue normal sin evidencia de recaída. Sin embargo, a los 14 meses la TAC (fig. 1B y 1B1) demostró lesiones hepáticas compatibles con metástasis en los segmentos II, VI y VII, motivo por el cual se comenzó nueva línea con carboplatino+5-fluorouracilo de 6 ciclos. El paciente presentó una respuesta muy favorable (criterios RECIST) con disminución del tamaño de las metástasis en porcentaje superior al 50%. La TAC a los 32 meses muestra enfermedad estable sin recaída local y sin crecimiento de las metástasis; actualmente menores de 1cm (fig. 1C y 1C1).
Los MANEC se caracterizan por presentar un componente neuroendocrino marcado por la expresión de sinaptofisina (75-90%), cromogranina (60-70%) y CD56 (50%), y un componente glandular exocrino identificado por su estructura con positividad para citoqueratinas 7 y 20 y el CEA. El componente exocrino generalmente tiene histología de adenocarcinoma, pero también se han descrito casos de células escamosas en tumores de esófago y región anorrectal1,2.
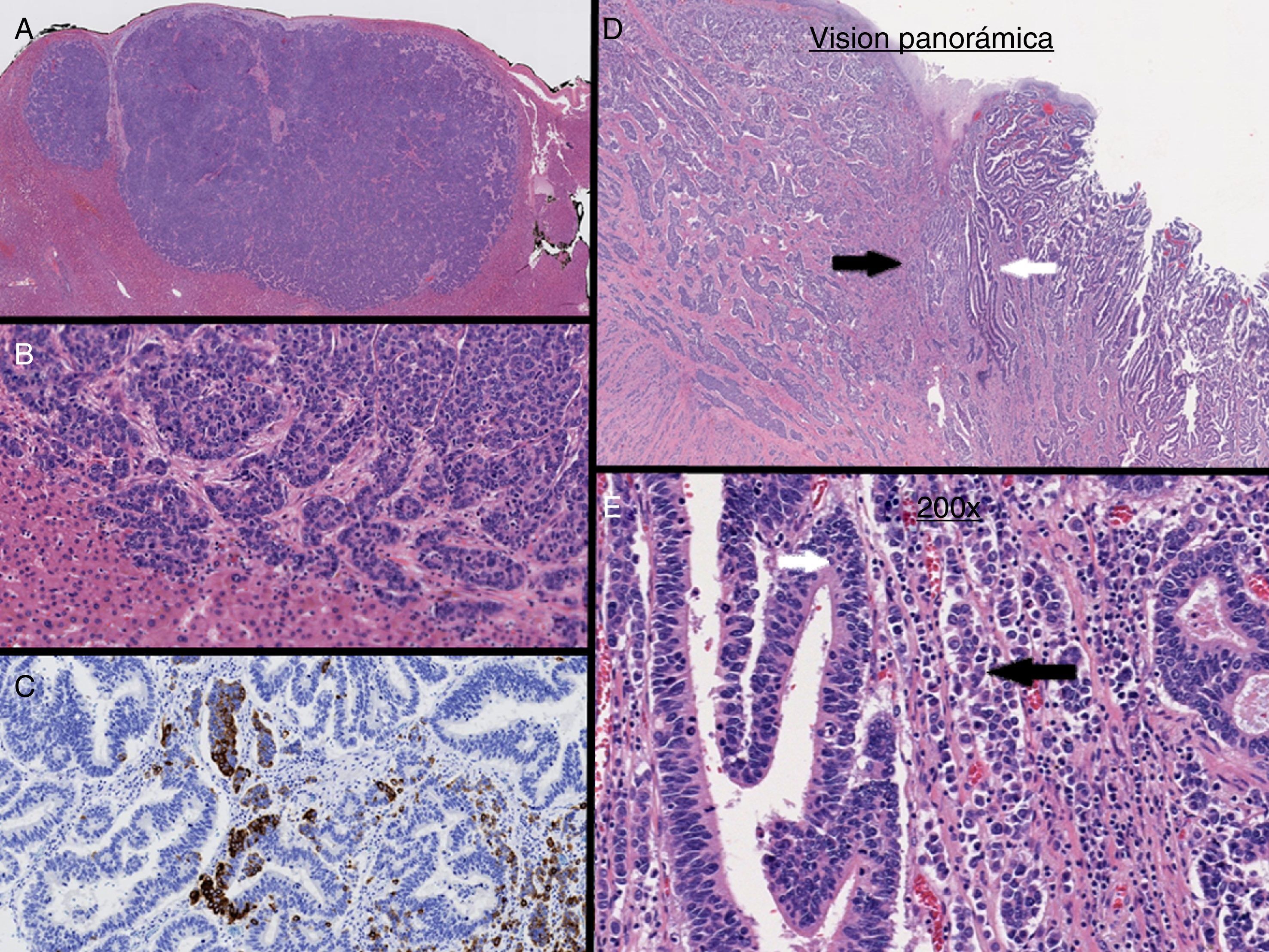
En nuestro caso, la tinción inmunohistoquímica de la lesión hepática mostró positividad para CDX2, sinaptofisina y cromogranina A (fig. 2A-C). Basándose en estos resultados se concluyó que la lesión hepática era una lesión metastásica de MANEC de la unión esofagogástrica (fig. 2D y E) que además presentaba los 2 componentes de forma simultánea al igual que el tumor primario3,4.
A nivel molecular los MANEC pueden surgir de forma independiente a partir de 2 células precursoras diferentes de una manera sincrónica o derivarse de una célula madre multipotencial. Furlan analizó marcadores de microsatélites polimórficos en tumores MANEC y observó una estrecha relación genética entre los 2 componentes histológicos distintos. Este hallazgo sugiere que el mecanismo de la tumorogénesis monoclonal (célula capacidad de diferenciación neuroendocrina y glandular) es el evento genético más frecuente y probable5,6
El pronóstico está relacionado con el tamaño, la invasión y el grado de diferenciación. Los pobremente diferenciados que presentan componentes de adenocarcinoma, como el caso de los MANEC tienen peor pronóstico y dada su rareza, la tasa de supervivencia global a los 5 años es difícil de predecir7,8.
El tratamiento es controvertido, tanto por las particularidades del tumor como por la ausencia de estudios relevantes para dar recomendaciones. La terapia adyuvante es utilizada de forma universal en todos los casos ya que aumenta la supervivencia. A pesar de que se trata de un tumor quimiosensible en el que se aprecia muy buena respuesta inicial, es frecuente la recaída o progresión. Entre los fármacos, la combinación de cisplatino y etopósido es la más empleada en la actualidad.
La cirugía se reserva para enfermedad localizada con intención curativa. En la enfermedad diseminada la cirugía tiene fines paliativos.
Existe poca literatura descrita sobre los MANEC de la unión esofagogástrica. Nuestro paciente presentó biopsia preoperatoria de adenocarcinoma gástrico y en la cirugía se objetivó una metástasis única sincrónica por lo que se decidió cirugía radical y eventual quimioterapia como mejor forma de paliar un supuesto adenocarcinoma gástrico Siewert tipo 3. La alternativa hubiera sido no hacer ningún gesto quirúrgico y colocar una endoprótesis vía endoscópica para tratar la disfagia. Sin embargo, esta última opción no hubiera dado el diagnóstico preciso de tumor MANEC. Además, sorprendentemente, de nuestra revisión se deduce que los casos de tumores MANEC que han registrado mayor supervivencia son los que han recibido terapia radical incluyendo la esofagectomía o gastrectomía con quimioterapia o radioterapia; siendo el papel de esta última controvertido y utilizado en casos de tumores localizados no metastásicos9,10.
El manejo óptimo y protocolizado de estos tumores es desconocido por la baja frecuencia y la escasa experiencia que existe, y limitado a pequeñas series de pacientes.
Cuando se planifica el tratamiento, el componente más agresivo es el que determina la actitud. En general, los tumores con un componente de carcinoma neuroendocrino pobremente diferenciado deben tratarse como carcinomas neuroendocrinos y los tumores compuestos por un adenocarcinoma junto con tumores neuroendocrinos bien diferenciado deben tratarse como adenocarcinomas.
Presentamos un caso único de tumor MANEC de unión esofagogástrica metastásico tratado con cirugía radical (sin dejar enfermedad macro ni microscópica- R0, con linfadenectomía D2 modificada sin incluir el hilio esplénico- nivel 10) dado que se consideró cirugía paliativa y varias líneas de quimioterapia. Del caso se destaca la gran respuesta al esquema carboplatino y 5-fluorouracilo y la posibilidad al resecar el tumor de obtener el diagnóstico definitivo de tumor MANEC con el consiguiente beneficio de la quimioterapia más adecuada y por consiguiente un aumento de la supervivencia.