La hipocalcemia es la complicación que condiciona el postoperatorio de la tiroidectomía. El objetivo de este trabajo es identificar criterios bioquímicos de riesgo de hipocalcemia analizando niveles de paratohormona rápida (PTHir) pre y postiroidectomía y de calcemias postoperatorias.
MétodosSe recoge una serie consecutiva de 310 tiroidectomías totales, obteniendo muestras de PTHr basal y tras 10 minutos postiroidectomía, junto a calcemias séricas cada 12 horas. Se estudian dos grupos, A normocalcémicos, B hipocalcémicos. Se calcula la sensibilidad, especificidad, valor predictivo positivo y negativo en relación con la hipocalcemia utilizando las curvas ROC y sus áreas bajo la curva. Se analiza un grupo control de 48 hemitiroidectomías para comparar los efectos de la cirugía sobre la secreción de PTH.
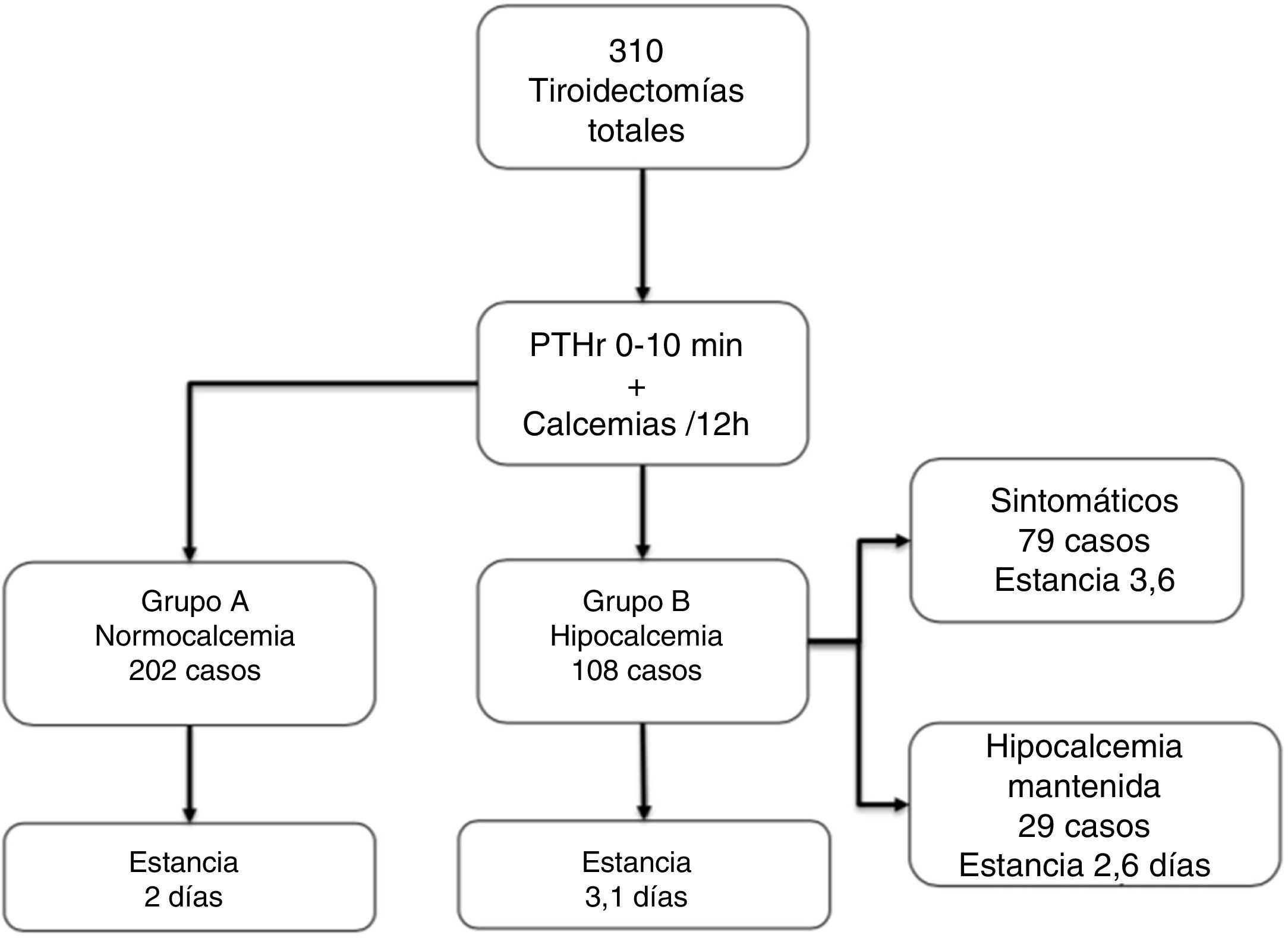
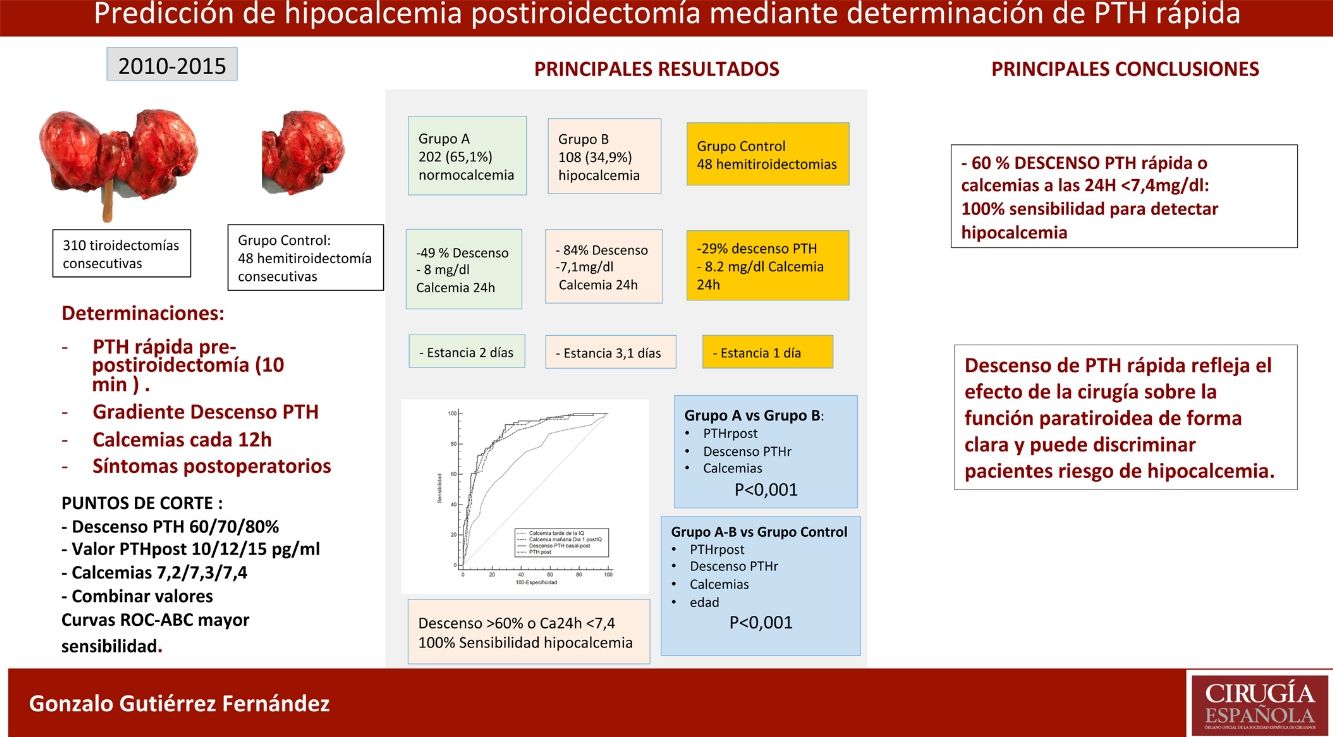
ResultadosDe los 310 pacientes, 202 (65,1%) se mantuvieron normocalcémicos y asintomáticos (grupo A), 108 (34,9%) presentaron hipocalcemia Grupo B, precisando calcio oral (79 sintomáticos). Tras el análisis de varios puntos de corte, combinando un gradiente de descenso de PTHr del 60% o una calcemia menor de 7,4 mg/dL a las 24 horas se consigue una sensibilidad del 100% sin dejar falsos negativos. Comparando con el grupo de control existe una diferencia significativa respecto de las calcemias y la PTHr postoperatorias.
ConclusionesLa tiroidectomía total afecta la función paratiroidea con descenso evidente de PTHr y riesgo de hipocalcemia. La combinación de un descenso del 60% o la calcemia inferior a 7,4 mg/dL a las 24 horas obtiene una sensibilidad del 100% para la predicción de pacientes en riesgo de hipocalcemia.
Hypocalcemia is the most frequent complication after thyroidectomy. The aim of this work is to identify biochemical risk factors of hypocalcemia using quick perioperative (pre and post-thyroidectomy) intact parathyroid hormone (PTHi) and postoperative calcemias.
MethodsIn a consecutive series of 310 total thyroidectomies, samples of quick PTHi at the anaesthetic induction and 10 minutes after surgery, together with serum calcemias every 12 hours were obtained. The sensitivity, specificity, positive and negative predictive value are analyzed and related to hypocalcemia. A control group of hemithyroidectomies is also analyzed to compare the effects of surgery on PTH secretion.
ResultsOf the 310 patients, 202 (65.1%) remained normocalcemic and asymptomatic (group A), 108 (34.9%) presented hypocalcemia (Group B), requiring oral calcium (79 symptomatic). After analysis of several cut-off points, combining a PTHr drop gradient of 60% or calcemia inferior to 7.4 mg/dl at 24 hours, a sensitivity of 100% is achieved without leaving false negatives. Compared to the control group, there is a significant difference with respect to the post-operative calcemias and PTHr, p < 0.001.
ConclusionsTotal thyroidectomy affects parathyroid function with evident decrease in rPTH and risk of hypocalcemia. The combination of PTHr decrease of 60% or less than 7.4 mg/dl calcemia at 24 hours gives a 100% sensitivity for predicting patients at risk of hypocalcemia.
La hipocalcemia postiroidectomía, fundamentalmente por lesión paratiroidea durante la cirugía1, condiciona el postoperatorio y estancia. Encontrar un factor predictor seguro y fiable es fundamental para prevenir y controlar esta complicación. La paratohormona (PTH) se ha utilizado para tal fin, pero debido a la heterogeneidad de los estudios aún no existe un valor de corte de PTH con una sensibilidad del 100% para detectar dicha complicación. La determinación rápida de paratohormona (PTHr) empezó a utilizarse por Irvin en 19912 en cirugía paratiroidea y tiroidea en la década del 20003.
El objetivo del presente trabajo es evaluar la relación entre la determinación de PTH rápida y calcemias postiroidectomía con la hipocalcemia postoperatoria. Validar si las determinaciones bioquímicas disponibles en nuestro medio sirven para predecir qué pacientes pueden estar en riesgo, estableciendo un algoritmo de tratamiento selectivo precoz.
MétodosDiseño general: estudio de seguimiento con recogida de datos prospectiva para evaluar la utilidad diagnóstica de la PTH rápida y las calcemias postiroidectomía (variables predictoras), con el propósito de predecir la hipocalcemia postoperatoria que es considerada la variable resultado. Se incluyeron todas las tiroidectomías totales consecutivas entre los años 2010 a 2015. Criterios de exclusión: insuficiencia renal, enfermedad paratiroidea y tratamiento activo con calcio. Un total de 310 casos se incluyeron finalmente en el estudio. Además, se compararon con un grupo control de 48 hemitiroidectomías para contrastar los mismos parámetros.
La cirugía fue realizada por dos cirujanos de forma similar y estandarizada. Se efectuó linfadenectomía central (uni- o bilateral), según estadio tumoral o indicios de extensión ganglionar.
Determinaciones bioquímicasPara el estudio se analizaron:
- •
Calcemia sérica total preoperatoria (basal).
- •
PTH rápida basal (PTHrpre) en la inducción anestésica.
- •
PTH rápida postiroidectomía (PTHrpost) a los 10 minutos de la extirpación tiroidea.
- •
Calcemia sérica total postoperatoria: la primera entre 5-8 horas postiroidectomía (Ca1); posteriormente cada 12 h (7:00 y 19:00 horas).
- •
La PTH analizada es intacta y su determinación rápida fue realizada mediante inmunoensayo quimioluminiscente específico automatizado (PTH STAT) en un Elipsis (Roche diagnostics dm, Manheim). Obteniendo resultados en menos de una hora.
La calcemia analizada es exclusivamente la sérica total, debido a la imposibilidad de obtener de manera urgente una calcemia corregida o albúmina para su cálculo. Se analizó mediante espectrofotometría automatizada (método-θ-cresolphtaleina) en un Dimension (Siemens Healthcare Diagnostics, DE, USA).
Definición y tratamiento de hipocalcemiaLa hipocalcemia sintomática se definió como la aparición de parestesias y/o tetania. Hipocalcemia bioquímica se definió por valores de calcio sérico inferior a 8 mg/dL e hipocalcemia mantenida si consecutivamente durante las primeras 48 horas no aumenta o disminuye. Se considera hipocalcemia por debajo de 8 mg/dL por ser clínicamente más relevante4 y ser el modelo que adoptan la mayoría de las publicaciones5-7. Los pacientes sintomáticos y/o con hipocalcemia bioquímica mantenida, se trataron con calcio oral (lactogluconato cálcico, 1.500 mg/día) junto con calcitriol 1 μgr/día. Solo los casos con hipocalcemia severa con aparición de tetania, se trataron con calcio intravenoso. Los pacientes permanecieron ingresados hasta que estuvieron asintomáticos y bioquímicamente estables (calcemias en ascenso).
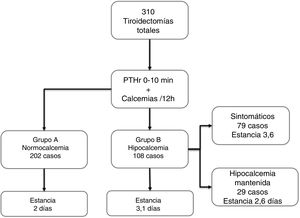
Grupos de pacientesSe analizaron tres grupos de pacientes: Grupo A (n = 202, 65,1%), normocalcémicos, se mantuvieron asintomáticos y con calcemias consecutivas en ascenso, no precisaron tratamiento; Grupo B (n = 108, 34,9%), con hipocalcemia mantenida precisando calcio y calcitriol; Grupo Control, 48 hemitiroidectomías consecutivas en el mismo periodo.
Análisis estadísticoSe calculó la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y negativo (VPN) de diferentes puntos de corte de los valores bioquímicos disponibles: valor absoluto y gradiente de descenso PTHr y calcemias cada 12 h. Se utilizaron las curvas ROC (característica operativa del receptor) para comparar el área bajo la curva de dichos valores como factores predictores de hipocalcemia sintomática, empleando el test de DeLong.
Las variables categóricas se analizaron con χ2. Las cuantitativas con t de Student o U-Mann-Whitney según la normalidad de la variable; y el test de Anova o Kruskal Wallis si se compararon más de dos grupos. Las variables con una distribución normal se expresaron como media ± desviación típica, de lo contrario, como mediana y rango intercuartílico (RI).
La fórmula para calcular el gradiente de descenso es la publicada en otros trabajos8,9 y en la Vía Clínica de Tiroidectomía de la Asociación Española de Cirujanos: (PTHrpre-PTHrpost)/PTHrpre x 100.
El análisis estadístico se llevó a cabo con el paquete estadístico IBM SPSS 25 (IBM Corp. Released 2017. IBM SPSS Statistics for Windows, Version 25.0. Armonk, NY: IBM Corp.) y MedCalc Statistical Software version 19.1 (MedCalc Software bv, Ostend, Belgium; https://www.medcalc.org; 2019).
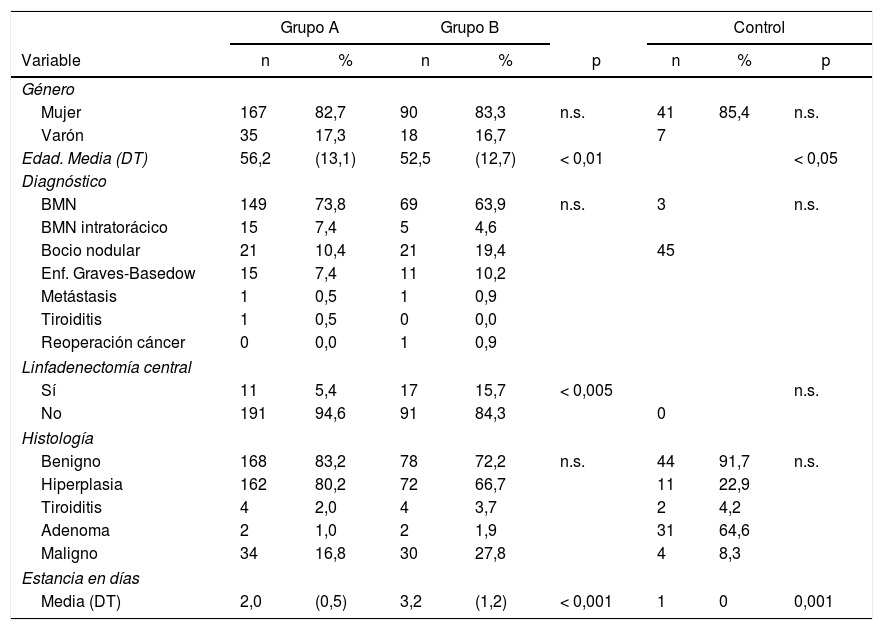
ResultadosSe incluyeron 310 casos, se recogen en la tabla 1, 273 fueron mujeres, (83,2%), la media de edad fue de 54,5 ± 13,1 años. El bocio multinodular fue el diagnóstico más frecuente (n = 239, 77,1%) y enfermedad de Graves en 26 casos. En 28 pacientes (11 en grupo A y 17 en el B) se practicó linfadenectomía central (por indicios de extensión ganglionar). La hiperplasia fue el resultado histológico más habitual (n = 234, 75,5%), y en 64 casos (20,6%) fue patología maligna.
Características demográficas y clínicas de los pacientes del Grupo A y B, así como del grupo control
| Grupo A | Grupo B | Control | ||||||
|---|---|---|---|---|---|---|---|---|
| Variable | n | % | n | % | p | n | % | p |
| Género | ||||||||
| Mujer | 167 | 82,7 | 90 | 83,3 | n.s. | 41 | 85,4 | n.s. |
| Varón | 35 | 17,3 | 18 | 16,7 | 7 | |||
| Edad. Media (DT) | 56,2 | (13,1) | 52,5 | (12,7) | < 0,01 | < 0,05 | ||
| Diagnóstico | ||||||||
| BMN | 149 | 73,8 | 69 | 63,9 | n.s. | 3 | n.s. | |
| BMN intratorácico | 15 | 7,4 | 5 | 4,6 | ||||
| Bocio nodular | 21 | 10,4 | 21 | 19,4 | 45 | |||
| Enf. Graves-Basedow | 15 | 7,4 | 11 | 10,2 | ||||
| Metástasis | 1 | 0,5 | 1 | 0,9 | ||||
| Tiroiditis | 1 | 0,5 | 0 | 0,0 | ||||
| Reoperación cáncer | 0 | 0,0 | 1 | 0,9 | ||||
| Linfadenectomía central | ||||||||
| Sí | 11 | 5,4 | 17 | 15,7 | < 0,005 | n.s. | ||
| No | 191 | 94,6 | 91 | 84,3 | 0 | |||
| Histología | ||||||||
| Benigno | 168 | 83,2 | 78 | 72,2 | n.s. | 44 | 91,7 | n.s. |
| Hiperplasia | 162 | 80,2 | 72 | 66,7 | 11 | 22,9 | ||
| Tiroiditis | 4 | 2,0 | 4 | 3,7 | 2 | 4,2 | ||
| Adenoma | 2 | 1,0 | 2 | 1,9 | 31 | 64,6 | ||
| Maligno | 34 | 16,8 | 30 | 27,8 | 4 | 8,3 | ||
| Estancia en días | ||||||||
| Media (DT) | 2,0 | (0,5) | 3,2 | (1,2) | < 0,001 | 1 | 0 | 0,001 |
DT: desviación típica; n.s.: no significativo; BMN: bocio multinodular.
Los 202 pacientes del Grupo A se mantuvieron asintomáticos; del Grupo B, 108 (34,9%), 79 desarrollaron síntomas en el ingreso (25,4% del total) y 29 casos permanecieron asintomáticos a pesar de la hipocalcemia bioquímica (aunque recibieron tratamiento durante la estancia). Casi todos los pacientes empezaron tratamiento sustitutivo en el segundo día de ingreso (48 ± 12 horas). En la figura 1 se resumen estos grupos y la estancia, que como puede observarse aumenta de forma significativa en el grupo B vs. A (3,1 ± 1,5 vs. 2 ± 0,6, p < 0,001).
En grupo control fueron 48 casos (41 mujeres, 7 hombres) con una edad media de 47,1 ± 13 años, con diagnóstico de nódulo solitario en 45 pacientes, siendo histológicamente 31 adenomas y cuatro cáncer. No hubo complicaciones postoperatorias y el ingreso fue de 24 horas. Como se puede comprobar, existe un descenso significativo tanto de la calcemia basal (9,4 ± 0,2 mg/dL) vs. Ca24 h (8,2 ± 0,4 mg/dL) como de la PTHrpre (83 ± 37 pg/dL) vs. PTHrpost (57 ± 25 pg/dL), p < 0,04. El descenso de PTHr es poco relevante, 29 ± 17%. Se recogen en la tabla 2.
Datos bioquímicos de los Grupos A y B con respecto a la calcemia y PTHr, en diferentes momentos del proceso quirúrgico
| Grupo A | Grupo B | ||||||
|---|---|---|---|---|---|---|---|
| Variable | n | Media (DT)* | IC 95% | n | Media (DT)* | IC 95% | p |
| Calcio basal | 202 | 9,4 [9,2-9,7] | 9,4-9,5 | 108 | 9,4 [9,1-9,6] | 9,3-9,5 | n.s. |
| PTHr pre (pg/mL) | 202 | 82 [64-106] | 83,5-99,9 | 108 | 80 [60-111] | 82,7-99,3 | n.s. |
| PTHr post (pg/mL) | 202 | 41 [24-59] | 38,1-46,9 | 108 | 12 [10-19] | 14,0-17,6 | p < 0,001 |
| Descenso PTHr (%) | 202 | 49 [27-68] | 46,7-54,8 | 108 | 84 [76-88] | 78,0-82,7 | p < 0,001 |
| Calcio 1 (mg/dL) | 202 | 8,1 (0,5) | 8,1-8,2 | 108 | 7,8 (0,6) | 7,7-7,9 | p < 0,001 |
| Calcio 24 h (mg/dL) | 202 | 8,0 (0,5) | 7,8-8,0 | 108 | 7,2 (0,5) | 7,1-7,3 | p < 0,001 |
| Calcio 48 h (mg/dL) | 148 | 8,1 (0,5) | 8,0-8,2 | 105 | 7,1 (0,6) | 7,0-7,2 | p < 0,001 |
| Calcio 72 h (mg/dL) | 8 | 8,4 (0,8) | 7,7-9,1 | 73 | 7,3 (0,6) | 7,2-7,4 | p < 0,001 |
| Calcio 4.° día (mg/dl) | - | 31 | 7,5 (0,6) | 7,3-7,7 | |||
| Calcio 5.° día (mg/dl) | - | 12 | 7,7 (0,8) | 7,2-8,2 | |||
| Calcio 6° día (mg/dl) | - | 6 | 7,9 (0,8) | - | |||
| Calcio 7.° día (mg/dL) | - | 1 | 6,8 | - | |||
DT: desviación típica. RI: rango intercuartílico; n.s.: no significativo.
No hubo diferencias estadísticamente significativas en cuanto a sexo, diagnóstico o histología, pero sí en edad, linfadenectomía y estancia entre los grupos A y B.
En las determinaciones bioquímicas no encontramos diferencias estadísticamente significativas en los valores de PTHrpre (82 vs. 90 pg/mL) y calcemias basales 9,4 vs. 9,4 mg/dL; pero sí las hubo en la PTHrpost (41 vs. 12 pg/mL), descenso de PTHr (49 vs. 83,6%), primera calcemia, Ca1 (8,1 vs. 7,7 mg/dL), calcemia a las 24 h (Ca 24 h) (8 vs. 7,1 mg/dL), calcemia a las 48 h (8,1 vs. 7 mg/dL) y calcemia a las 72 h (8,4 vs. 7,3 mg/dL).
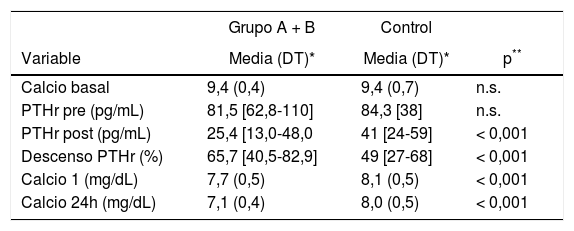
Comparando con el grupo control, se aprecia que tanto el grupo A como el grupo B, las determinaciones de PTHrpost y descenso, así como las calcemias postoperatorias presentaron unas diferencias estadísticamente significativas como también lo fue la edad (47,1 ± 13), tabla 3 .Con el grupo B las diferencias son más llamativas: PTHrpost 12 (10-19) vs. 57,7 (± 25,5), descenso PTHr 83,6 (76-87) vs. 29,7 (± 17,4), Ca 24 h 7,1 (± 0,5) vs. 8,25 (± 0,4), p < 0,001.
Comparación de los Grupos A, B y Control con respecto a la calcemia y PTHr, en diferentes momentos del proceso quirúrgico
| Grupo A + B | Control | ||
|---|---|---|---|
| Variable | Media (DT)* | Media (DT)* | p** |
| Calcio basal | 9,4 (0,4) | 9,4 (0,7) | n.s. |
| PTHr pre (pg/mL) | 81,5 [62,8-110] | 84,3 [38] | n.s. |
| PTHr post (pg/mL) | 25,4 [13,0-48,0 | 41 [24-59] | < 0,001 |
| Descenso PTHr (%) | 65,7 [40,5-82,9] | 49 [27-68] | < 0,001 |
| Calcio 1 (mg/dL) | 7,7 (0,5) | 8,1 (0,5) | < 0,001 |
| Calcio 24h (mg/dL) | 7,1 (0,4) | 8,0 (0,5) | < 0,001 |
DT: desviación típica; n.s.: no significativo.
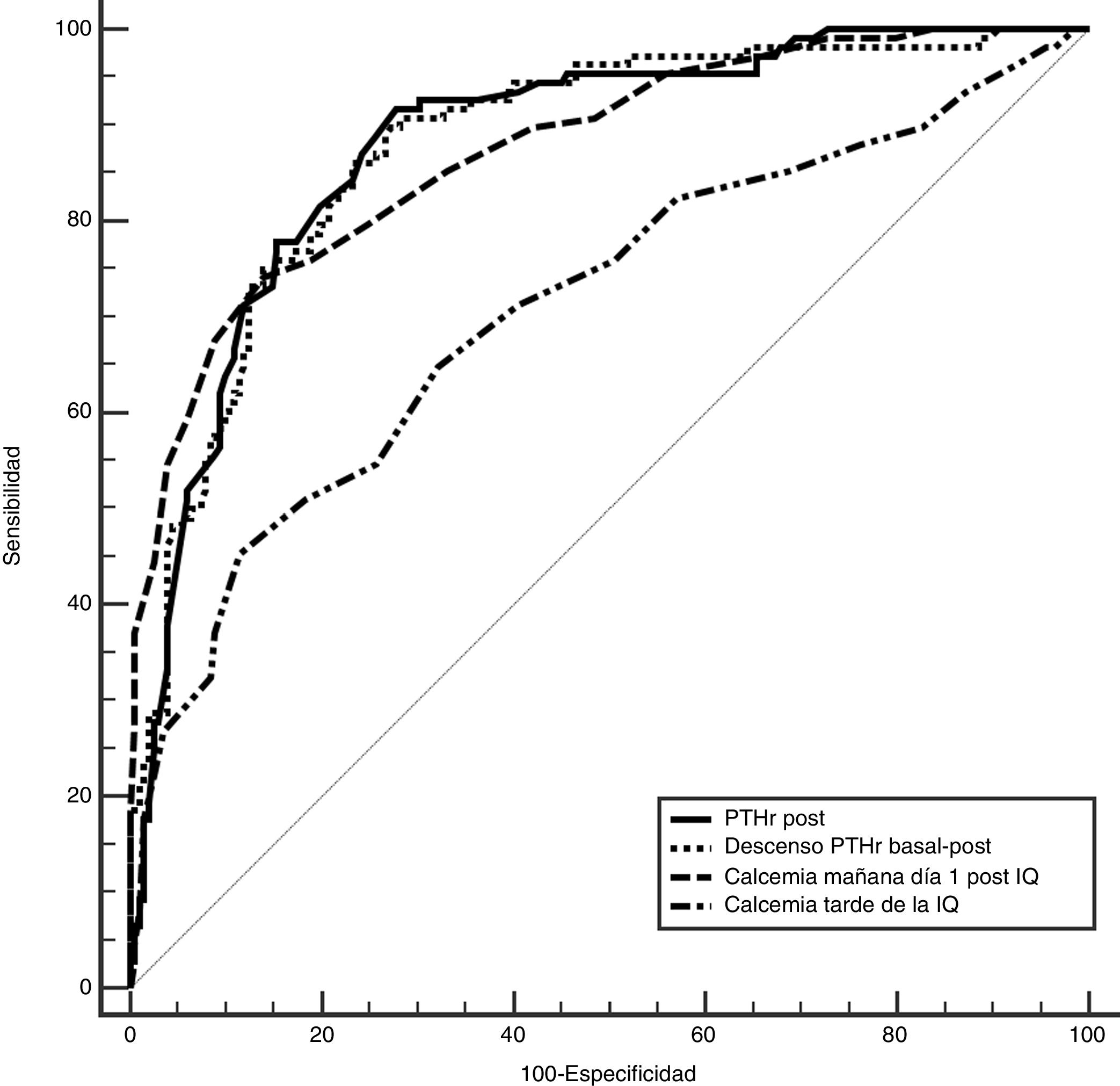
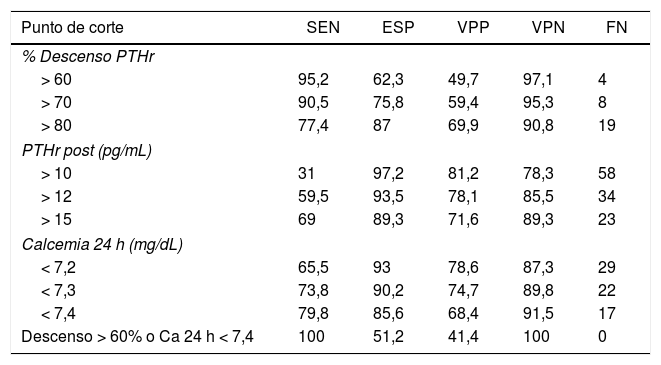
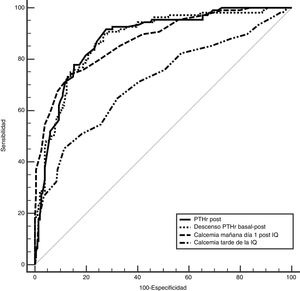
Para determinar cuál de estos parámetros pueden predecir mejor el riesgo de hipocalcemia comparamos el área bajo la curva (ABC), de las siguientes variables (fig. 2): 0,89 (IC 95%: 0,8-0,9) para el descenso PTHr; 0,89 (IC 95%: 0,8-0,9) para la PTHrpost; de 0,7 (IC 95%: 0,6-0,9) para la calcemia de la tarde y de 0,87 (IC 95%: 0,8-0,9) para la calcemia a las 24 h. Para buscar la máxima sensibilidad y el menor número de falsos negativos (FN), se comparan estas variables con mayor ABC y se analizan diferentes puntos de corte arbitrarios basados en la literatura8,10-12 y en las medias bioquímicas obtenidas (tabla 2). Se resume en la tabla 4: descenso de PTHr de 60, 70 y 80%, valor absoluto de PTHrpost de 10, 12, 15 pg/mL, calcemias entre 7,2 a 7,4 mg/dL, así como asociación de descenso de 60% y calcemia inferior a 7,4 mg/dL. Ninguno de estos puntos de corte consigue una sensibilidad del 100% existiendo, además, falsos negativos. Solo al combinar los parámetros con la sensibilidad más alta, descenso mayor del 60% con Ca 24 h inferior a 7,4 mg/dL, se llega a este 100% sin dejar falsos negativos teóricos, pero a costa de 48% de falsos positivos. Es destacable que solo cuatro pacientes sintomáticos presentaron un descenso inferior al 60% con calcemias a las 24 h inferiores a 7,4 mg/dL, es decir, el descenso de PTHr fue más sensible que la calcemia, excepto en estos cuatro pacientes.
Evaluación de diferentes puntos de corte de las variables: porcentaje de descenso de PTHr, PTHr post y calcemia a las 24 horas
| Punto de corte | SEN | ESP | VPP | VPN | FN |
|---|---|---|---|---|---|
| % Descenso PTHr | |||||
| > 60 | 95,2 | 62,3 | 49,7 | 97,1 | 4 |
| > 70 | 90,5 | 75,8 | 59,4 | 95,3 | 8 |
| > 80 | 77,4 | 87 | 69,9 | 90,8 | 19 |
| PTHr post (pg/mL) | |||||
| > 10 | 31 | 97,2 | 81,2 | 78,3 | 58 |
| > 12 | 59,5 | 93,5 | 78,1 | 85,5 | 34 |
| > 15 | 69 | 89,3 | 71,6 | 89,3 | 23 |
| Calcemia 24 h (mg/dL) | |||||
| < 7,2 | 65,5 | 93 | 78,6 | 87,3 | 29 |
| < 7,3 | 73,8 | 90,2 | 74,7 | 89,8 | 22 |
| < 7,4 | 79,8 | 85,6 | 68,4 | 91,5 | 17 |
| Descenso > 60% o Ca 24 h < 7,4 | 100 | 51,2 | 41,4 | 100 | 0 |
SEN: sensibilidad; VPP: valor predictivo positivo; FN: falsos negativos; ESP: especificidad; VPN: valor predictivo negativo.
De los 310 pacientes, los 108 (34,8%) que corresponden al grupo B precisaron tratamiento con calcio (por síntomas o por hipocalcemia mantenida como se ha explicado). De estos, los 29 casos que permanecieron asintomáticos recibieron calcio oral para así romper la tendencia descendente de calcemias, es posible que por ello no desarrollaran clínica. De hecho, hubo 11 casos (3.3%) de hipoparatiroidismo definitivo, todos en este grupo B y de ellos uno del subgrupo asintomático. El tiempo medio de suspensión del tratamiento tras el alta fue de 3,4 meses.
DiscusiónLa tiroidectomía supone un factor de riesgo para la viabilidad de las glándulas paratiroides, aumentando dicho riesgo con cirugías más complejas (linfadenectomía, bocios grandes, etc.)12-14. Por ello pensamos que el parámetro más adecuado para predecir la hipocalcemia postiroidectomía es la determinación de los niveles de PTH, incluyendo este tipo de cirugías que aumentan el riesgo de lesión glandular y, en consecuencia, los niveles de PTH.
Sin embargo, existe una gran variabilidad de parámetros a estudiar (momento, tipo de PTH, manera de obtenerla, definiciones de hipoparatiroidismo, etc.), lo que hace muy difícil establecer un umbral, una cifra o un punto de corte que determine el riesgo de desarrollar hipocalcemia postiroidectomía15-17,aunque también apoyan su utilidad para detectar ese riesgo y/o estratificar pacientes4,18,19. La propia definición de hipocalcemia es también confusa, considerándose en la práctica una cifra inferior a los intervalos normales de laboratorio, habitualmente 8 mg/dL (2 mmol/L)10,20,21. Se justifica por ser «clínicamente» más relevante4.
La Asociación de Cirujanos Endocrinos Australianos, en una revisión de cuatro artículos, establece que la normalidad en la PTH a las cuatro horas predice normocalcemia, aunque cifras bajas de PTH no son sensibles para predecir hipocalcemia4.Por otro lado, Marthur revisando 69 artículos, concluye que la «extrema heterogeneidad» hace difícil adoptar un único valor de PTH como predictor de hipocalcemia. A esto contribuye la amplia disponibilidad de sistemas de determinación de PTH y la propia variabilidad entre ellos22-24. La vía clínica de la AEC recomienda analizar más que un valor absoluto25 el porcentaje del descenso de PTH. Otras revisiones, aun sosteniendo la ausencia de sensibilidad del 100%, establecen que su determinación es el mejor método de estratificar el riesgo18,19. También las hay que desestiman su utilidad; del Rio en una serie de 1006 casos con análisis de PTH a las 24 h26 y Lombardi a las 4 h27 son ejemplos de ello.
Comparativa entre determinaciones de PTHLas determinaciones de PTH y su relación con la hipocalcemia se pueden agrupar según el tipo: estándar9,28-30 o rápida8,12,13,20,31 momento de la extracción: basal, minutos 12,31-33, horas o días postiroidectomía21,29,33-35; valor analizado: gradiente de descenso11,31,36,37 o valor absoluto21,28,32,33; asociación entre diferentes determinaciones de PTH y/o calcemias8,12,38-40. Todos estos datos raramente coinciden. La sensibilidad del 100% no es la norma11,29,31,37,38,41 y, por ello, los falsos negativos son frecuentes e importantes28,42. Sin embargo, no parece que esta circunstancia afecte a la toma de decisiones, alegando una baja posibilidad de presentar síntomas, o que los puntos de corte seleccionen a los pacientes sin riesgo32,43,44.
Las determinaciones rápidas permiten obtener los resultados en la misma sesión quirúrgica con lo que se puede predecir el riesgo precozmente, sin depender de terceras personas posteriormente, con menos molestias para el paciente, en definitiva, optimizando el método42. Lee45 compara la determinación rápida con la estándar en el postoperatorio inmediato sin encontrar diferencias significativas. Aunque este menor tiempo de las muestras con los anticuerpos puede dar cifras más orientativas que reales de PTH, encuentra que un descenso de 75% tiene una sensibilidad y especificidad de 100% y 72% respectivamente, concluyendo que es útil para predecir la función paratiroidea e identificar los pacientes en riesgo31. Di Fabio tiene en su serie 33% de casos con hipocalcemia y 25,9% de sintomáticos, para los primeros un descenso de PTH (basal-10’) de 75,7% tiene la mayor sensibilidad (81,5%) y para los segundos un corte de 79,5% (sensibilidad 76,2%)20.
Roh determina que un descenso de 70% (basal-10’) y un PTHpost > 15 pg/mL puede discriminar qué pacientes están en riesgo.
Con objeto de mejorar sensibilidad y falsos negativos se combinan diferentes parámetros; así Alia emplea el descenso de PTHr de 62,5% y una PTHrpost < 18 pg/mL, para llegar a una sensibilidad de 90% y 17% falsos negativos8. Pisanu combina un valor de PTH de 12 pg/ml con un descenso de 60% a las 6 h para llegar a 100%.
Galy-Bernadoy compara dos kits de PTH con una sola determinación a los 10 minutos postiroidectomía. Obtiene puntos de corte diferentes con cada uno para conseguir una VPP y VPN del 100%. En su serie hay 24% de hipocalcemias asintomáticas y 14-28% de casos en una «zona gris» para monitorización o tratamiento.
En este trabajo analizamos el efecto de la tiroidectomía total sobre la secreción de paratohormona perioperatoria (empleando una medición rápida) y sobre las calcemias séricas totales, en el postoperatorio inmediato y su correlación con hipocalcemia bioquímica y clínica.
Tiroidectomías totales y hemitiroidectomías presentan un descenso de calcemia y PTHr postoperatoria8,20. Para determinar qué variable analítica tiene la mayor sensibilidad en relación con la hipocalcemia, se comparan las ABC. Ninguno de los puntos de corte utilizados consigue 100% de sensibilidad y con falsos negativos. Para intentar mejorar estos resultados, asociamos dos variables como también se refleja en otros artículos8,29,35,38,41 (descenso superior de 60% o calcemias inferiores a 7,4 mg/dL a las 24 h). Con estos criterios, a pesar de aumentar los falsos positivos (tratar innecesariamente), se evitarían los falsos negativos (no tratar precisándolo), lo que es clave como factor predictor. Sin duda, es más seguro tratar innecesariamente algunos casos que dar de alta sin tratamiento cuando es necesario42. Gran parte de la cirugía tiroidea se realiza en hospitales comarcales con menor volumen y menos recursos, teniendo que adecuar los medios y tiempos a sus posibilidades con la menor incomodidad posible a los pacientes42. Dada la variabilidad mencionada, cada centro debería utilizar sus propios medios disponibles, y elaborar su algoritmo de predicción.
Las limitaciones de este estudio son varias: las determinaciones bioquímicas disponibles; los pacientes del grupo B asintomáticos (29 casos) se les administró calcio oral previo alta, aunque probablemente se hubieran mantenido asintomáticos y con calcemias tendentes a la normalización en pocos días. El criterio para ello fue el descenso paulatino de las calcemias46 que impedía un alta segura.
La conclusión de nuestro estudio es que la determinación de PTH rápida refleja claramente el efecto de la cirugía sobre la función paratiroidea postiroidectomía, y puede usarse como factor predictor de hipocalcemia. La combinación del porcentaje de descenso de PTHr (60%) con la calcemia a las 24 horas (< 7,4 mg/dL) consigue una sensibilidad del 100%. Con los puntos de corte seleccionados, podrían identificarse los pacientes sin riesgo, evitando tratamientos generalizados y un alta más temprana con criterios científicos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.