La infección del sitio quirúrgico (SSI) es una de las principales complicaciones quirúrgicas, con una incidencia del 10-20% en cirugía colorrectal. Las terapias basadas en presión negativa (NPWT) han mostrado su eficacia en el tratamiento de heridas crónicas, traumáticas, en las dehiscencias de piel, en el uso de colgajos o injertos. El objetivo principal del estudio es valorar la eficacia de NPWT en la prevención de SSI en cirugía colorrectal. Los objetivos secundarios son valorar la reducción del ingreso hospitalario y analizar los factores de riesgo de SSI.
MétodosEstudio casos y controles prospectivo. Ochenta pacientes intervenidos tras diagnóstico de enfermedad colorrectal, de forma programada o urgente durante el año 2017. Cuarenta pacientes fueron tratados con NPWT preventivo durante una semana. Cuarenta pacientes fueron tratados según protocolo habitual postoperatorio de cuidado de herida quirúrgica.
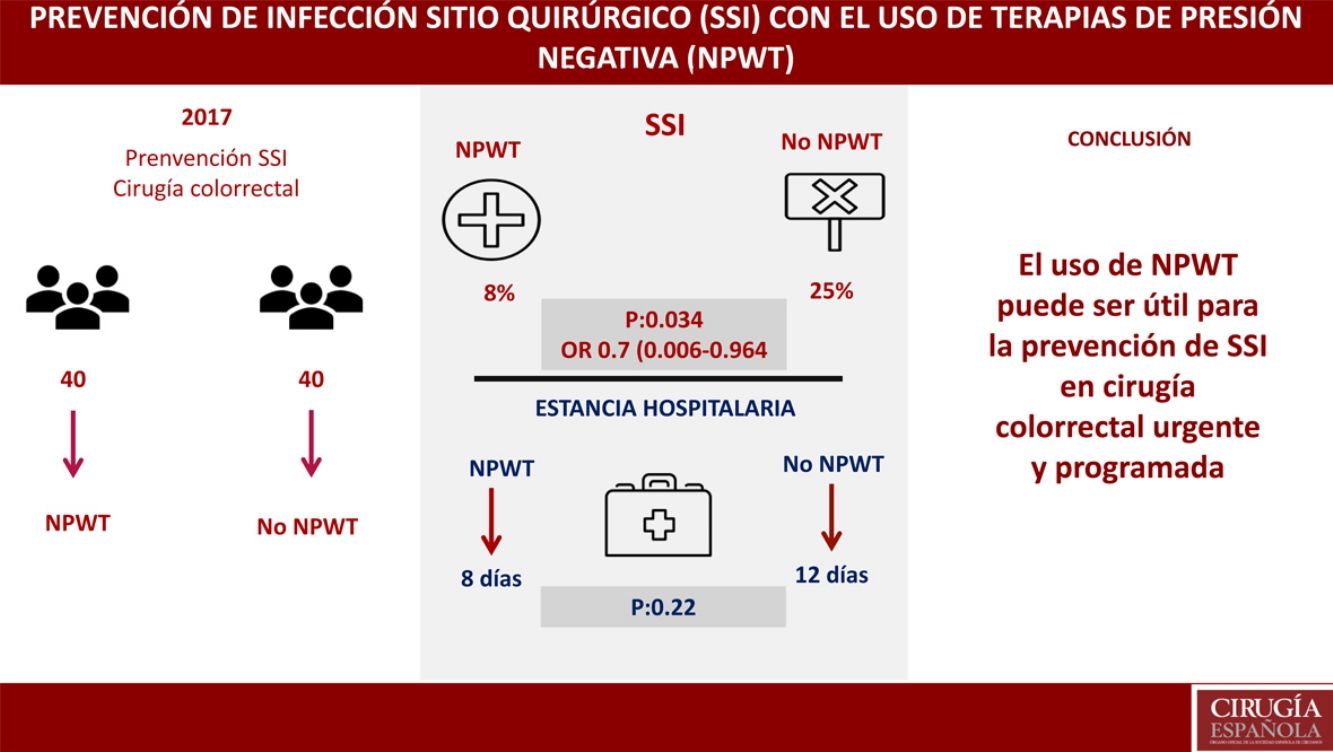
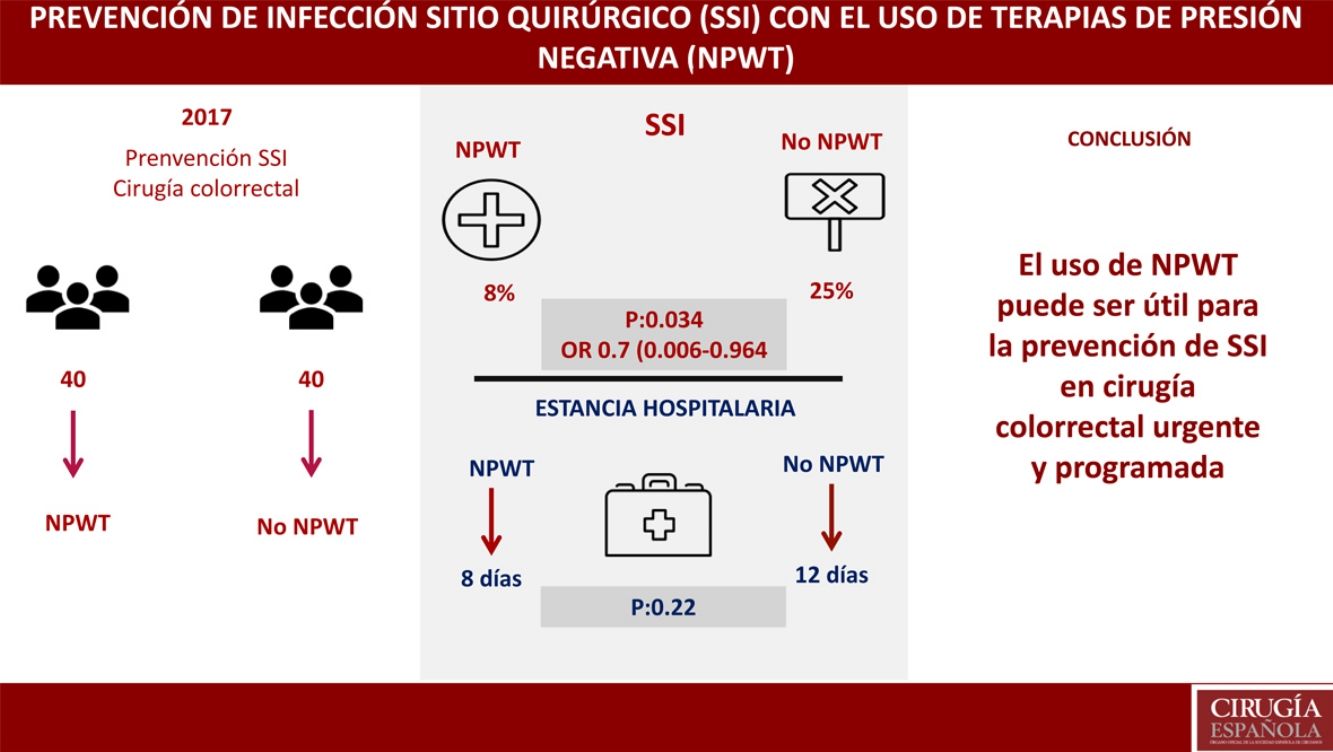
ResultadosNo se encontraron diferencias entre NPWT y grupo control en variables demográficas, comorbilidades, abordaje quirúrgico, indicación urgente o programada, preparación colónica o procedimiento quirúrgico. Se objetivó SSI con el empleo de NPWT en 3 (8%) pacientes (IC del 95%, 0-17,5). SSI en 10 (25%) pacientes (IC del 95%, 12,5-37,5) (p=0,034); OR 0,7 (IC del 95% 0,006-0,964). La estancia hospitalaria en el grupo NPWT fue de 8 días vs. 12 días en el grupo control (p=0,22). En el análisis multivariante se encontró como único factor relacionado con SSI la preparación colónica (p=0,047; OR: 0,8, IC 0,45-0,93).
ConclusionesEl uso de dispositivos NPWT para la cobertura de incisiones cerradas tras cirugía colorrectal puede disminuir la incidencia de SSI.
Surgical site infection (SSI) is one of the most frequent complications in colorectal surgery. It is diagnosed in 10 - 20% of colorectal procedures. Negative Pressure Wound Therapy (NPWT) has shown efficacy in the treatment of chronic and traumatic wounds, wound dehiscence, flaps and grafts. The main objective of this study is to assess NPWT in the prevention of SSI in colorectal surgery. Hospital stay reduction and SSI risk factors are secondary objectives.
MethodsWe present a prospective case-control study including 80 patients after a colorectal diagnosis and surgical procedure (elective and non-elective) in 2017. Forty patients were treated with prevention NPWT for one week. Forty patients were treated according to the standard postoperative surgical wound care protocol.
ResultsNo significant differences were found in demographic variables, comorbidities, surgical approach, elective or non-elective surgery, mechanical bowel preparation and surgical procedure. Three patients has SSI in the NPWT group (8%) (95%CI 0 – 17.5). Ten patients presented SSI in the control group (25%) (95%CI 12.5 – 37.5) (p=0.034); OR 0.7 (95%CI 0.006-0.964). Hospital stay in the NPWT group was 8 days versus 12 days in the non-NPWT group (p=0.22). In the multivariate analysis, mechanical bowel preparation was found to be the only risk factor for SSI (p=0.047; OR: 0.8, CI 0.45-0.93).
ConclusionsNPWT is a useful SSI prevention treatment in colorectal surgery.
La infección del sitio quirúrgico (SSI) es una de las principales complicaciones médicas relacionadas con la cirugía. Aunque es un problema prevenible en la mayor parte de las ocasiones, continúa siendo un problema importante sobre el que debemos focalizar la atención1,2. Este problema provoca una carga importante en los sistemas de salud, que deben hacer frente a los costes derivados de un mayor número de días de ingreso hospitalarios y mayor coste de atención por el paciente3-6.
El CDC Healthcare-Associated Infection (HAI) en su encuesta de prevalencia estimó un total de 157.500 infecciones de herida en 20117. Los datos del NHSN incluyen 16.147 SSI tras 849.659 procedimientos quirúrgicos en todos los grupos reportados en el estudio, para una media de SSI del 1,9% entre 2006 y 20088. Una reducción del 19% de SSI en los 10 procedimientos seleccionados fue reportada entre los años 2008-2013, encontrándose en la cirugía del colon una tasa de SSI del 2%9. En Europa, en el período 2010-2011 se encontró una tasa de infección de herida del 9,5%10.
La tasa de SSI se relaciona directamente con el tipo de cirugía. Las heridas quirúrgicas se clasifican en limpias, limpias contaminadas, contaminadas y sucias, con un riesgo de SSI asociado del 1-5%, el 3-11%, el 10-17% y el 27%, respectivamente11. En cirugía colorrectal programada, la tasa de SSI en algunas series asciende hasta alrededor del 20%12.
Las terapias basadas en presión negativa (NPWT) se introdujeron en 1997 como un posible método para reducir la tasa de SSI13. Clásicamente, las indicaciones para uso de NPWT han sido las heridas crónicas, las heridas traumáticas, las heridas con evolución subaguda, las heridas asociadas a dehiscencias de la piel, las quemaduras, las úlceras (sobre todo de origen vascular y diabético), los colgajos y los injertos14,15. Sin embargo, aún no existe una fuerte evidencia respecto a su uso profiláctico en heridas cerradas de laparotomías.
El objetivo principal de este estudio es intentar evaluar la efectividad clínica de NPWT en la prevención primaria de SSI en cirugía colorrectal. Los objetivos secundarios del estudio son el análisis de la estancia hospitalaria con el empleo de estas medidas y el análisis de los factores de riesgo para la aparición de SSI.
MétodosSe ha realizado un estudio de casos-controles prospectivo, con pacientes intervenidos en el mismo centro hospitalario de tercer nivel durante el año 2017, de cirugía colorrectal, tanto programada como urgente. La intervención quirúrgica se realizó en todos los casos por miembros del equipo de cirugía colorrectal. Los procedimientos analizados en cada caso corresponden a colectomías izquierdas, colectomías derechas, resecciones anteriores, amputaciones abdominoperineales y reconstrucción del tránsito intestinal tras estoma temporal. En el estudio se incluyen tanto cirugías abiertas como cirugías laparoscópicas con incisión accesoria para realización de anastomosis. Los pacientes incluidos en el grupo control corresponden a pacientes intervenidos en el mismo período con los mismos diagnósticos y dentro de los mismos procedimientos aplicados a los que no se aplicó NPWT.
Los criterios de inclusión en el estudio son pacientes intervenidos de cirugía colorrectal en el período descrito, cirugía tanto programada como urgente, realizada por cirujano de la unidad de cirugía colorrectal. No se incluirán en el estudio pacientes intervenidos de cirugía colorrectal fuera de la unidad.
En todos los casos se administró tratamiento antibiótico prequirúrgico como medida profiláctica.
Se realizó un seguimiento de todos los pacientes durante un mes tras la cirugía. Se consideró SSI en los casos en los que se objetivaron alteraciones en la evolución normal de la herida o en la situación clínica del paciente, tales como fiebre, drenaje purulento, eritema extenso o cualquier alteración que requiriese la adopción de medidas terapéuticas, como el drenaje de la herida, la administración de antibióticos o de algún preparado farmacológico que tuviera como objetivo la resolución de SSI.
Los factores de riesgo estudiados fueron la edad, el sexo, el índice de masa corporal (IMC), escala ASA, comorbilidades, la realización de cirugía abierta o laparoscópica, la indicación urgente o programada, la preparación colónica preoperatoria, la presencia de estoma en la cirugía, el tiempo quirúrgico y la localización de la herida.
La estancia hospitalaria fue medida en días de ingreso tras la cirugía.
El estudio estadístico se realizó con SPSS Statistics® v20 (SPSS, Inc., Chicago, IL), el test de la chi al cuadrado y el test Fisher fueron utilizados para análisis variables categóricas. El test de la t de Student fue utilizado para la comparación de medias en variables de distribución normal, mientras que test de Wilcoxon se utilizó para la comparación de medias de distribución no normal. El análisis multivariante fue utilizado en el estudio de los factores de riesgo. La significación estadística fue considerada con p<0,05.
ResultadosEl estudio se compone de 80 pacientes en total. A 40 de ellos, al término de la cirugía en el quirófano, se les aplicó apósito NPWT, el cual se mantuvo durante una semana sin cambio del mismo, excepto en caso de que hubiera cualquier complicación médica que desaconsejara continuar con el uso del apósito. Otros 40 pacientes fueron seleccionados dentro del mismo período, a los que se les realizaron las mismas intervenciones quirúrgicas. El seguimiento de estos pacientes se realizó según cuidados habituales en planta de hospitalización. Cambio de apósito a las 48 h con cuidado y cura de la herida quirúrgica por parte de enfermería.
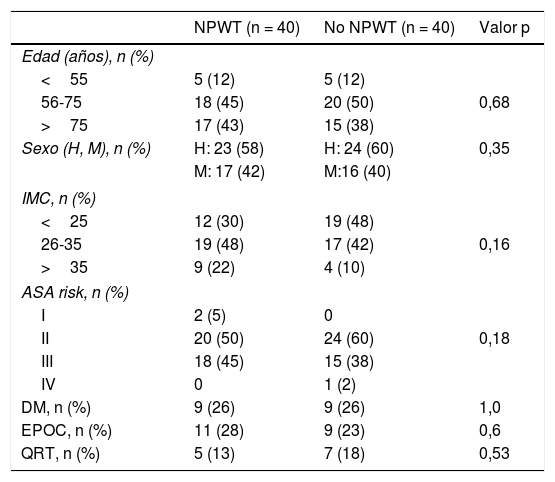
En ambos grupos de estudio encontramos características demográficas parecidas, sin diferencias significativas entre los diferentes factores analizados. Se establecieron 3grupos de edad, siendo en los pacientes tratados con NPWT: <55 años, 5 (12%); en el grupo de edad 56-75 años, 18 (45%), y en el > 75 años, 17 (43%). La distribución por grupos de edad en los pacientes no NPWT: en el grupo <55 años, 5 (12%); en el grupo 56-75 años, 20 (50%), y en el grupo > 75 años, 15 (38%). No se encontraron diferencias entre los 2grupos de tratamiento en la distribución por edad (p=0,68).
Los pacientes tratados con NPWT eran 23 (58%) hombres y 24 (60%) en el grupo no NPWT. En el grupo de tratamiento hubo 17 (42%) mujeres, mientras que en el grupo control 16 (40%) (p=0,35). La distribución según el IMC fue: <25, 12 (30%) sujetos en el grupo NPWT, 19 (48%) en el grupo no NPWT, y IMC 26-35, 19 (48%) pacientes en el grupo NPWT y 17 (42%) en el grupo control. Se encontró un IMC> 35 en 9 (22%) sujetos del grupo NPWT y en 4 (10%) en el control (p=0,164)
La distribución y la presencia de comorbilidades en ambos grupos fue homogénea: no se apreciaron diferencias en los diferentes grados ASA en los 2grupos (p=0,187). En el grupo de tratamiento se encontraron 9 (26%) pacientes con diabetes mellitus, con 9 (26%) en el grupo control (p=1,0). La presencia de enfermedad pulmonar obstructiva crónica en el grupo de tratamiento fue de 11 (28%) pacientes vs. 9 (23%) en el grupo control (p=0,60). A 5 (13%) pacientes del grupo de tratamiento se les aplicó quimiorradioterapia previa a la intervención quirúrgica, mientras que en el grupo control este tratamiento ascendió hasta 7 (18%) pacientes (p=0,53) (tabla 1).
Características demográficas y factores de riesgo por grupos según uso NPWT
| NPWT (n = 40) | No NPWT (n = 40) | Valor p | |
|---|---|---|---|
| Edad (años), n (%) | |||
| <55 | 5 (12) | 5 (12) | |
| 56-75 | 18 (45) | 20 (50) | 0,68 |
| >75 | 17 (43) | 15 (38) | |
| Sexo (H, M), n (%) | H: 23 (58) | H: 24 (60) | 0,35 |
| M: 17 (42) | M:16 (40) | ||
| IMC, n (%) | |||
| <25 | 12 (30) | 19 (48) | |
| 26-35 | 19 (48) | 17 (42) | 0,16 |
| >35 | 9 (22) | 4 (10) | |
| ASA risk, n (%) | |||
| I | 2 (5) | 0 | |
| II | 20 (50) | 24 (60) | 0,18 |
| III | 18 (45) | 15 (38) | |
| IV | 0 | 1 (2) | |
| DM, n (%) | 9 (26) | 9 (26) | 1,0 |
| EPOC, n (%) | 11 (28) | 9 (23) | 0,6 |
| QRT, n (%) | 5 (13) | 7 (18) | 0,53 |
ASA: American Society of Anesthesiology; DM: diabetes mellitus, EPOC: enfermedad pulmonar obstructiva crónica; H: hombre; IMC: índice de masa corporal; M: mujer; NPWT: negative pressure wound therapy; QRT: quimio-radioterapia.
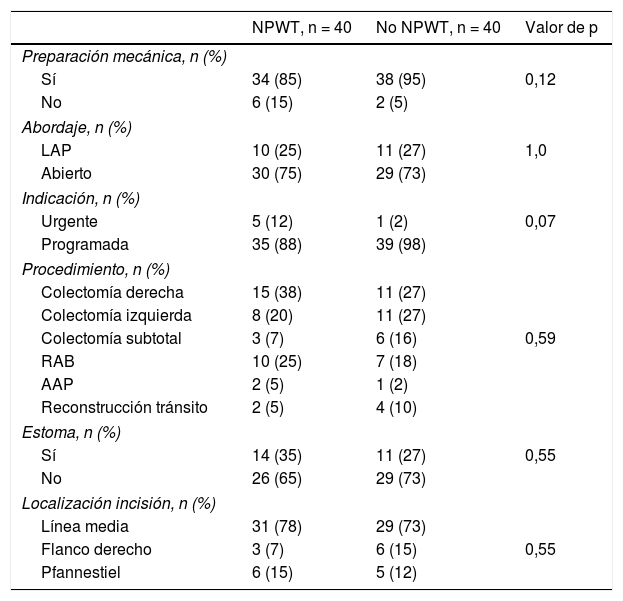
La preparación mecánica colónica previa a la cirugía se llevó a cabo en 34 (85%) pacientes con terapia NPWT y en 38 (95%) de los pacientes no NPWT (p=0,12). En 30 (75%) pacientes con NPWT, el abordaje quirúrgico inicial utilizado fue la cirugía abierta, siendo 29 (73%) en el grupo control (p=1,0). El resto de las cirugías se incluyen en el grupo de abordaje laparoscópico y corresponden a cirugías con incisión accesoria a través de la cual se realiza la anastomosis, necesaria en cada caso. La cirugía realizada fue programada 35 (88%) pacientes del grupo de tratamiento y en 39 (98%) del grupo control (p=0,07). Los procedimientos principales realizados fueron: colectomía derecha, colectomía izquierda, colectomía subtotal, resección anterior baja, amputación abdominoperineal y reconstrucción del tránsito tras estoma temporal previo. No se encontraron diferencias en cuanto al procedimiento realizado en ambos grupos (p=0,59). Las principales incisiones realizadas fueron en su mayoría en línea media, en 31 (78%) pacientes en el grupo de tratamiento, 29 (73%) en el grupo control, siendo la incisión en flanco derecho y la incisión de Pfannestiel el resto de incisiones utilizadas (p=0,55) (tabla 2).
Factores relacionados con la cirugía. Distribución por grupos según utilización de NPWT
| NPWT, n = 40 | No NPWT, n = 40 | Valor de p | |
|---|---|---|---|
| Preparación mecánica, n (%) | |||
| Sí | 34 (85) | 38 (95) | 0,12 |
| No | 6 (15) | 2 (5) | |
| Abordaje, n (%) | |||
| LAP | 10 (25) | 11 (27) | 1,0 |
| Abierto | 30 (75) | 29 (73) | |
| Indicación, n (%) | |||
| Urgente | 5 (12) | 1 (2) | 0,07 |
| Programada | 35 (88) | 39 (98) | |
| Procedimiento, n (%) | |||
| Colectomía derecha | 15 (38) | 11 (27) | |
| Colectomía izquierda | 8 (20) | 11 (27) | |
| Colectomía subtotal | 3 (7) | 6 (16) | 0,59 |
| RAB | 10 (25) | 7 (18) | |
| AAP | 2 (5) | 1 (2) | |
| Reconstrucción tránsito | 2 (5) | 4 (10) | |
| Estoma, n (%) | |||
| Sí | 14 (35) | 11 (27) | 0,55 |
| No | 26 (65) | 29 (73) | |
| Localización incisión, n (%) | |||
| Línea media | 31 (78) | 29 (73) | |
| Flanco derecho | 3 (7) | 6 (15) | 0,55 |
| Pfannestiel | 6 (15) | 5 (12) | |
AAP: amputación abdominoperineal; LAP: laparoscópico; NPWT: negative pressure wound therapy; RAB: resección anterior baja.
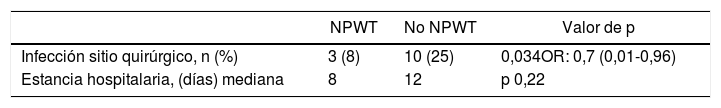
El objetivo primario del estudio fue el análisis de la SSI en el grupo de tratamiento con terapia NPWT en comparación con un grupo control donde se realizó cuidado de la herida quirúrgica sin NPWT. La SSI en el grupo de tratamiento con NPWT se objetivó en 3 (8%) pacientes (IC del 95%, 0-18). La SSI en el grupo control (no NPWT) fue objetivada en 10 (25%) pacientes (IC del 95%, 13-38) (p=0,034). OR 0,7 (IC del 95%, 0,006-0,964). En los casos donde se desarrolló SSI con el uso de NPWT, este dispositivo fue retirado de forma prematura y se realizó drenaje de la herida, tras el cual se inició tratamiento antibiótico (tabla 3).
Un objetivo secundario del estudio fue el análisis de la estancia hospitalaria, encontrándose una mediana de estancia de 8 días en el grupo tratamiento vs. 12 días en el grupo control (p=0,22).
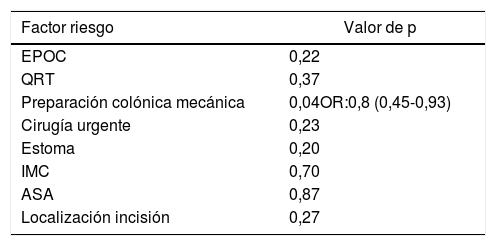
Otro de los objetivos secundarios del estudio fue la estimación de los factores de riesgo de infección de herida quirúrgica de forma global, incluyendo a los 80 pacientes que formaron parte del estudio, independientemente del grupo asignado. En el análisis multivariante se encontró como único factor relacionado con la SSI la preparación colónica (p=0,047; OR: 0,8, IC 0,45-0,93) (tabla 4).
Factores de riesgo de infección del sitio quirúrgico. Análisis multivariante
| Factor riesgo | Valor de p |
|---|---|
| EPOC | 0,22 |
| QRT | 0,37 |
| Preparación colónica mecánica | 0,04OR:0,8 (0,45-0,93) |
| Cirugía urgente | 0,23 |
| Estoma | 0,20 |
| IMC | 0,70 |
| ASA | 0,87 |
| Localización incisión | 0,27 |
ASA: American Society of Anesthesiology; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; QRT: quimio-radioterapia.
La SSI constituye una de las complicaciones más frecuentes tras la cirugía abierta de colon y recto, añadiendo una importante morbilidad16-20, independientemente del seguimiento estricto de las mejores prácticas de antisepsia y antibioterapia profiláctica la tasa de SSI permanece alta en este tipo de intervenciones quirúrgicas, pudiendo alcanzar el 30% según diferentes series16,17. El uso creciente de abordajes laparoscópicos en cirugía colorrectal ha conseguido disminuciones significativas en las tasas de SSI, pero estas ventajas de la laparoscopia no son aplicables a todos los pacientes, dado que algunos de ellos no son candidatos de entrada a este abordaje, y en los que sí lo son, la tasa de conversión a procedimientos abiertos puede alcanzar el 15%21.
Los efectos principales que producen los dispositivos NPWT sobre la herida se basan en la aplicación de una presión negativa de –80mmHg en un ambiente hipóxico22, provocando macrodeformación y aproximación de los tejidos según la movilidad que estos tengan, en la microdeformación con aproximación a nivel celular que favorece la división y proliferación, la eliminación de fluidos, en mayor medida correspondiente al edema del espacio extracelular, y en favorecer un microclima en la herida que dificulte el sobrecrecimiento bacteriano, con probable repercusión en la segunda y tercera fases de curación de la herida23-26.
Aunque hay ciertos estudios que no han objetivado diferencias significativas en la tasa de SSI comparando el uso de NPWT con cuidados estándar de la herida quirúrgica (cobertura con gasa), tanto en procedimientos de cirugía intestinal (gastrointestinal, pancreática y colorrectal) como cirugía vascular27-29, incluyendo una revisión Cochrane previa30, en nuestra serie se ha comprobado como cierta la hipótesis establecida como objetivo principal, objetivando una disminución significativa de la tasa de SSI en el grupo NPWT (8 vs. 25%, p=0,034). Aunque es cierto que este estudio es una serie prospectiva, sin aleatorización ni cegado, se ha comprobado exhaustivamente la ausencia de heterogeneidad entre ambos grupos. La tasa de infección de herida en el grupo no NPWT de nuestra serie es relativamente alta, aunque dentro de rangos descritos en otras series publicadas16-20, y teniendo en cuenta que se incluyeron tanto procedimientos electivos como urgentes, pero teniendo dada la homogeneidad de los grupos en parámetros prequirúrgicos y quirúrgicos, no podemos achacar la diferencia en la tasa de SSI de este grupo con el grupo NPWT a otro factor que no sea el uso de los dispositivos de presión negativa, ya que el manejo posquirúrgico de los pacientes ha seguido el mismo protocolo con esta única diferencia.
Estos datos son concordantes con otros muchos estudios controlados y aleatorizados que incluyen heridas limpias, limpias-contaminadas y contaminadas22,31, así como con el reciente metaanálisis realizado por Strugala y Martin, que incluye 16 estudios (10 de ellos aleatorizados), con un total de 1.863 pacientes (2.202 incisiones), mostrando una disminución global de la tasa de SSI del 13 al 5,2% con el uso de NPWT (RR 0,43 [IC del 95%, 0,32-0,57], p <0,001)32; aunque en este metaanálisis se incluyeron procedimientos traumatológicos, gastrointestinales, colorrectales y cesáreas, no se objetivaron diferencias en la disminución de tasa de SSI con respecto al tipo de cirugía en el análisis multivariante.
En algunos estudios no se han encontrado diferencias significativas en la tasa de SSI con respecto al uso o no de NPWT; estos dispositivos han sido mantenidos poco tiempo tras la cirugía, con duraciones de tratamiento de 48h26, mientras que en nuestro caso hemos abogado por tratamientos de más larga duración (7 días, salvo evidencia de datos de SSI antes de la fecha prevista de retirada), más en la línea de la mayoría de los autores.
Respecto a la estancia hospitalaria postoperatoria, se ha objetiva también una reducción de la misma en el grupo NPWT, aunque no fue posible hallar significación estadística (8 vs. 12 días, p=0,22); sin embargo, esta tendencia se ve también avalada por otros estudios con resultados similares27,33, en los que sí se objetivan diferencias estadísticamente significativas, de hasta –0,47 días (IC del 95%, –0,71 a –0,23; p <0,001), alcanzando diferencias de –5,1 días analizando de forma específica el subgrupo de pacientes con cirugía colorrectal32. En nuestra serie, la ausencia de significación probablemente se deba a que no tenemos implantado un programa de recuperación multimodal intensificada (fast-track), lo que hace que la magnitud de la diferencia sea menos llamativa y se necesite un mayor número de pacientes para alcanzar significación. Dada la ausencia de diferencias significativas en la composición de ambos grupos en los aspectos analizados, es conveniente aclarar que el incremento de la duración en la estancia hospitalaria en el grupo control es consecuencia directa de las complicaciones de la herida quirúrgica. Asimismo, y unido a lo anterior, está ampliamente demostrado que reducciones en la estancia hospitalaria asociadas a disminución en la tasa de SSI conllevan un ahorro significativo de recursos sanitarios y sufrimiento de los pacientes3,22,31-37.
Este estudio tiene algunas limitaciones, como la ausencia de cegado en el estudio, que ha podido introducir sesgos, así como su naturaleza no aleatorizada, aunque creemos que esto ha podido quedar parcialmente subsanado por la comprobación estricta de la ausencia de heterogeneidad prequirúrgica y quirúrgica entre grupos. En cualquier caso, sesgos relacionados con estos factores deberían ser no direccionales. Otro factor limitante es la ausencia de clasificación de la SSI en superficial y profunda, con lo que no se han podido evaluar diferencias en este campo entre ambos grupos. Tampoco ha sido objeto de evaluación de este estudio si la mejora en la tasa de SSI ocurre en todas las heridas o en qué tipo de heridas (limpias, limpias-contaminadas o contaminadas) esta mejora es más significativa; probablemente, el efecto sea mayor en estas últimas, pero esto aún no ha sido comprobado, necesitándose más estudios al respecto.
De acuerdo con las limitaciones previamente descritas, creemos necesario la elaboración de estudios aleatorizados, prospectivos, que redefinan la efectividad en el empleo de este tipo de terapias.
El uso de dispositivos NPWT para la cobertura de incisiones cerradas tras cirugía colorrectal, tanto electiva como urgente, es recomendable, unido a otros factores, como la correcta antisepsia, una técnica quirúrgica cuidadosa y la preparación colónica para la disminución de la SSI; se ha objetivado asimismo disminución de la estancia hospitalaria posquirúrgica asociada al uso de los mismos. Permanece no aclarado si el uso de estos dispositivos es especialmente beneficioso en tipos determinados de heridas (contaminadas). La utilización generalizada de dispositivos NPWT debe sostenerse sobre futuros estudios aleatorizados comparativos.
Conflicto de interesesNinguno de los autores declara conflicto de intereses.