El papel que desempeñan las endoprótesis autoexpandibles en el tratamiento de las dehiscencias tras la esofagectomía transtorácica no está bien definido y resulta controvertido. Nuestro objetivo es mostrar la experiencia en un hospital de tercer nivel con el empleo de estos dispositivos en las dehiscencias tras la esofagectomía de Ivor Lewis.
MétodosEstudio observacional descriptivo de los pacientes que han presentado una dehiscencia de anastomosis tras una esofagectomía transtorácica y, en especial, de aquellos tratados mediante endoprótesis, en el periodo comprendido entre 2011 y 2016 en nuestro centro hospitalario.
ResultadosDiez pacientes (11,8%) presentaron una dehiscencia anastomótica, 8 de los cuales recibieron endoprótesis. Un paciente portador de endoprótesis falleció por causas ajenas a la misma. En un paciente se objetivó migración del dispositivo, manteniéndose una media de permanencia de 47,3 días. La prótesis no fue efectiva en un paciente que tuvo una dehiscencia precoz por isquemia aguda gástrica. Fallecieron los 2 pacientes que no recibieron endoprótesis después de la reintervención.
ConclusionesLas endoprótesis son dispositivos seguros y efectivos que no asocian mortalidad en nuestra serie. Están especialmente indicadas en dehiscencias intermedias o tardías y en pacientes frágiles, pues, junto con el drenaje mediastínico y pleural, evitan reintervenciones gravadas con morbimortalidad. Por tanto, las endoprótesis deben formar parte del arsenal terapéutico habitual para la resolución de la mayoría de las dehiscencias de sutura tras la esofagectomía de Ivor Lewis. La puesta en marcha de estudios prospectivos aleatorizados ayudaría a determinar con mayor precisión el papel que desempeñan estos dispositivos en el tratamiento de las dehiscencias tras una esofagectomía transtorácica.
The role that self-expanding stents play in the treatment of dehiscence after transthoracic esophagectomy is not well defined and controversial. Our aim is to describe the experience in a tertiary care hospital using these devices for treating dehiscence after Ivor Lewis esophagectomy.
MethodsDescriptive observational study of patients who suffered anastomotic dehiscence after a transthoracic esophagectomy, and especially those treated with stents, in the period between 2011-2016 at our hospital.
ResultsTen patients (11.8%) presented anastomotic dehiscence. Eight patients received stents, one of them died due to causes unrelated to the device. Stent migration was observed in one case, and the devices were maintained an average of 47.3 days. The stent was not effective only in one patient who suffered early dehiscence due to acute ischemia of the stomach. The two patients who did not receive stents died after reoperation.
ConclusionsStents are safe and effective devices that did not associate mortality in our series. They are especially indicated in intermediate or late-onset dehiscence and in fragile patients. The use of stents, together with mediastinal and pleural drainage, avoid reoperations with morbidity and mortality. Therefore, stents should be part of the usual therapeutic arsenal for the resolution of most suture dehiscences after Ivor Lewis esophagectomy. Randomized prospective studies would help to more precisely determine the role played by these devices in the treatment of dehiscence after transthoracic esophagectomy.
La dehiscencia de la anastomosis esofagogástrica es la complicación quirúrgica más temida tras la esofagectomía de Ivor Lewis. La salida de saliva, secreción ácida y biliar o alimento al mediastino origina una infección grave y desencadena una reacción inflamatoria sistémica que asocia una elevada mortalidad1.
La reintervención quirúrgica, para drenar la cavidad pleural contaminada y actuar sobre el defecto anastomótico, ha sido la norma del tratamiento durante décadas y sus resultados, dispares. Más recientemente, el empleo de la endoscopia diagnóstica, para determinar la presencia de isquemia en la plastia gástrica así como las dimensiones y localización del defecto, la endoscopia terapéutica —con la colocación de prótesis autoexpandibles— y el drenaje radiológico de colecciones mediastínicas y/o pleurales han modificado el manejo de estos pacientes.
Sin embargo, la utilización de endoprótesis en este contexto clínico no se ha generalizado, tal y como se pudiera esperar, siendo un tema de debate y discusión entre los cirujanos esofagogástricos2,3. Nuestro objetivo es describir los resultados obtenidos en nuestro hospital mediante el uso de endoprótesis metálicas autoexpandibles totalmente recubiertas y drenajes radiológicos en el tratamiento de las dehiscencias esofagogástricas tras el procedimiento de Ivor Lewis.
MétodoDesde enero del 2011 a diciembre del 2016 hemos realizado 85 procedimientos de Ivor Lewis por cáncer de esófago y de la unión esofagogástrica en el Hospital Clínico Universitario Virgen de la Arrixaca. Los detalles de la historia clínica así como las exploraciones complementarias de cada paciente fueron comentados en un comité multidisciplinar constituido por oncólogos médicos y radioterápicos, un anatomopatólogo, un endoscopista, un nutricionista, un médico de medicina nuclear y cirujanos. De los 85 pacientes intervenidos, 74 son hombres y 11 mujeres, con una edad media de 55,7 años (33-86). Todos los pacientes salvo 9 recibieron tratamiento neoadyuvante con quimioterapia y radioterapia (estudio CROSS4) o perioperatorio con quimioterapia (estudio MAGIC5). Los detalles respecto a la técnica quirúrgica así como al manejo perioperatorio han sido detallados en publicaciones previas6.
Las dehiscencias se clasificaron según el momento de aparición en tempranas (1.o a 3.er día postoperatorio), intermedias (4.o a 7.o día postoperatorio) o tardías (a partir del 8.o día)7. Las endoprótesis fueron colocadas bajo sedación por endoscopistas expertos, con presencia de un anestesista en el quirófano o en una sala especializada de la Unidad de Endoscopias. Las longitudes de los dispositivos variaron entre 18 y 24cm y todos fueron metálicos totalmente recubiertos (Hanarostent®-M.I. Tech., Seúl, República de Corea). En 2 casos se procedió a fijar las prótesis con clips metálicos. Recogimos la morbilidad, la mortalidad intrahospitalaria y a 90 días, la estancia hospitalaria, el número de prótesis aplicadas y drenajes radiológicos utilizados, así como el número total de endoscopias practicadas y la causa de la realización de las mismas.
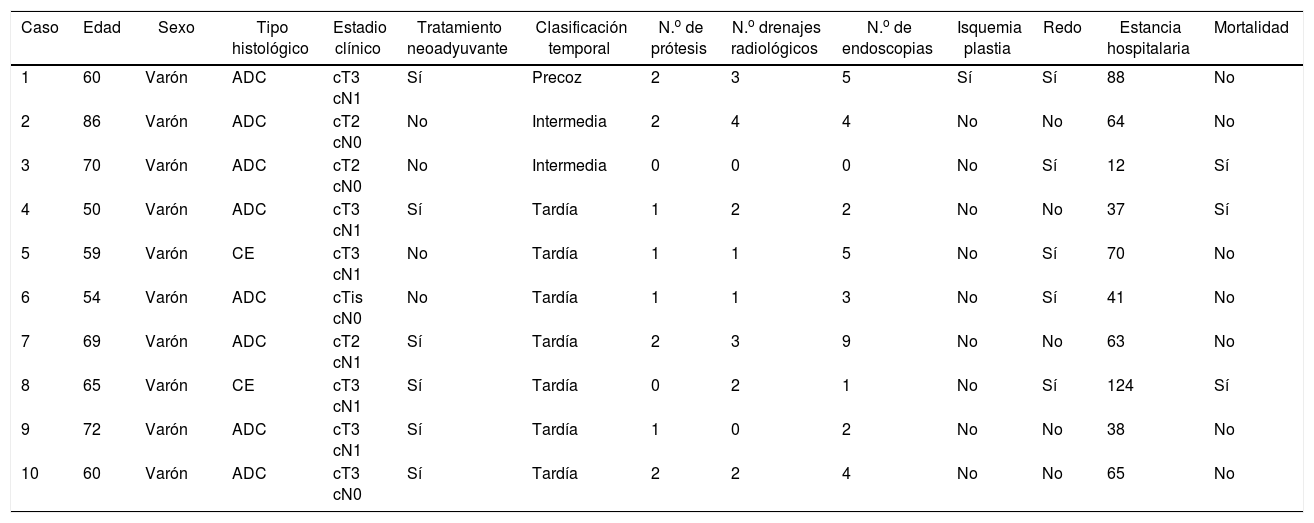
ResultadosLa dehiscencia anastomótica fue diagnosticada en 10 pacientes (11,8%), siendo todos ellos hombres, con una edad media de 64,5 años (50-86). Los datos epidemiológicos y los relacionados con el estadio tumoral de cada paciente se detallan en la tabla 1. Respecto al momento del diagnóstico de la dehiscencia, en 7 pacientes fue tardía, precoz en un paciente e intermedia en los 2 pacientes restantes. Fallecieron 3 pacientes de la serie, 2 de los cuales fueron reintervenidos y no portaron prótesis. De estos últimos, uno presentó un fracaso multiorgánico asociado a una fuga biliar persistente y otro tuvo una neumonía por aspiración.
Datos epidemiológicos, estadio tumoral y datos relacionados con el tratamiento de los pacientes con dehiscencia anastomótica tras la esofagectomía de Ivor Lewis
| Caso | Edad | Sexo | Tipo histológico | Estadio clínico | Tratamiento neoadyuvante | Clasificación temporal | N.o de prótesis | N.o drenajes radiológicos | N.o de endoscopias | Isquemia plastia | Redo | Estancia hospitalaria | Mortalidad |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 60 | Varón | ADC | cT3 cN1 | Sí | Precoz | 2 | 3 | 5 | Sí | Sí | 88 | No |
| 2 | 86 | Varón | ADC | cT2 cN0 | No | Intermedia | 2 | 4 | 4 | No | No | 64 | No |
| 3 | 70 | Varón | ADC | cT2 cN0 | No | Intermedia | 0 | 0 | 0 | No | Sí | 12 | Sí |
| 4 | 50 | Varón | ADC | cT3 cN1 | Sí | Tardía | 1 | 2 | 2 | No | No | 37 | Sí |
| 5 | 59 | Varón | CE | cT3 cN1 | No | Tardía | 1 | 1 | 5 | No | Sí | 70 | No |
| 6 | 54 | Varón | ADC | cTis cN0 | No | Tardía | 1 | 1 | 3 | No | Sí | 41 | No |
| 7 | 69 | Varón | ADC | cT2 cN1 | Sí | Tardía | 2 | 3 | 9 | No | No | 63 | No |
| 8 | 65 | Varón | CE | cT3 cN1 | Sí | Tardía | 0 | 2 | 1 | No | Sí | 124 | Sí |
| 9 | 72 | Varón | ADC | cT3 cN1 | Sí | Tardía | 1 | 0 | 2 | No | No | 38 | No |
| 10 | 60 | Varón | ADC | cT3 cN0 | Sí | Tardía | 2 | 2 | 4 | No | No | 65 | No |
ADC: adenocarcinoma; CE: carcinoma epidermoide.
Ocho pacientes (80%) portaron endoprótesis, siendo necesarios 2 stents en 4 pacientes. Objetivamos migración de la prótesis en un paciente (12,5%), y se llevaron a cabo una media de 4,2 endoscopias por paciente, principalmente para el control de la ubicación así como para descartar posibles problemas relacionados con las endoprótesis, tales como ulceraciones por decúbito o inclusión de la pared esofágica o gástrica en la misma. El tiempo medio de permanencia de las endoprótesis fue de 47,3 días. Se colocaron drenajes radiológicos en 7 pacientes y 3 requirieron reintervención a pesar de portar la endoprótesis; uno para solucionar un quilotórax asociado, otro para desbridamiento pleural y mediastínico y un tercero por fracaso de la endoprótesis, para lavado mediastínico y cierre quirúrgico del defecto. La estancia media de los pacientes tratados con endoprótesis fue de 61,2 días (38-88) y falleció un paciente de los 8 (12,5%).
DiscusiónLa dehiscencia de una anastomosis esofagogástrica intratorácica representa una de las causas más importante de muerte tras una operación de Ivor Lewis8. El diagnóstico precoz, la aplicación de antibióticos, antifúngicos, procinéticos e inhibidores de la bomba de protones, así como la descompresión gástrica, son importantes para disminuir esa tendencia2. En este contexto se impone el drenaje de la cavidad pleural y el mediastino para evitar la repercusión sistémica. Parece lógico pensar que, en ausencia de una necrosis masiva gástrica, el cierre o taponamiento del defecto sea beneficioso en cuanto que evita la continua contaminación.
Tradicionalmente el tratamiento de las dehiscencias tras la esofagectomía de Ivor Lewis exigía una reintervención quirúrgica para la higienización del campo quirúrgico y el control del defecto mediante diversas técnicas en función de los hallazgos. La agresión que representa una nueva toracotomía, especialmente en pacientes frágiles, puede aumentar paradójicamente el riesgo de mortalidad, tal y como ocurrió en 2 pacientes de nuestra serie que fueron operados inicialmente (tabla 1).
Las prótesis metálicas autoexpandibles comenzaron a utilizarse con éxito en patología esofágica para paliar la disfagia maligna en pacientes considerados inoperables o irresecables9,10. El crecimiento de tejido tumoral a través del entramado de la prótesis y la inclusión de la misma en la pared esofágica, con la consecuente perforación que tenía lugar en algunos casos, impusieron la necesidad de recubrir dichas prótesis con algún material que evitara ese problema. El desarrollo tecnológico ocurrido en las últimas décadas nos hace disponer en la actualidad de una variedad considerable de prótesis autoexpandibles, tanto en longitud como en forma y diámetro, metálicas, parcial o totalmente recubiertas, plásticas e incluso biodegradables. Esto ha permitido ampliar las indicaciones para el uso de prótesis en patología esofágica, siendo una de ellas el tratamiento de las fístulas tras la operación de Ivor Lewis.
Las dehiscencias precoces después de una esofagectomía transtorácica generalmente se deben a defectos técnicos o a isquemia aguda de la plastia, por lo que somos partidarios de aplicar tratamiento quirúrgico, ya que en este contexto la prótesis no fue efectiva en el paciente de nuestra serie que la presentó. Estas circunstancias pueden requerir desde una exclusión bipolar hasta el desbridamiento y resutura, con o sin colgajo de refuerzo, o la colocación de un tubo en T. En nuestro caso procedimos al desbridamiento del mediastino, exéresis de una pequeña área isquémica gástrica y la práctica de una nueva esofagogastrostomía. Para el resto de dehiscencias intermedias y tardías, generalmente tipo 2 según la clasificación del Grupo de Consenso de las Complicaciones de la Esofagectomía11, la utilización de endoprótesis ha ayudado a acelerar la recuperación. En este sentido, Hünerbein et al.12 compararon dos grupos de pacientes con dehiscencia anastomótica intratorácica: uno tratado mediante cirugía o tratamiento conservador y otro en el que se utilizaron prótesis plásticas. Los autores demostraron que el empleo de prótesis permitía iniciar antes la ingesta oral, disminuía la estancia hospitalaria y la estancia en una Unidad de Cuidados Intensivos, así como la mortalidad. Nosotros no sabemos qué habría ocurrido si no se hubieran empleado las endoprótesis en nuestros pacientes, y tampoco podemos comparar aún estos resultados con la serie histórica por falta de tamaño muestral, pero no se han presentado complicaciones graves asociadas a los procedimientos endoscópicos13, mostrándose seguros14. El único paciente fallecido portador de endoprótesis en nuestra serie lo fue a causa de una neumonía y a un fracaso renal, habiendo corroborado mediante TC y endoscopia la correcta colocación de la prótesis y la ausencia de colecciones no drenadas.
A pesar de sus ventajas, la vigilancia del paciente portador de endoprótesis ha de ser continua debido a que las prótesis pueden migrar3 o desajustarse las copas, permitiendo el paso de líquido entre las paredes esofágica-gástrica y la endoprótesis, con la consecuente contaminación mediastínica. Algunos autores, como Dent et al.2, consideran que las endoprótesis autoexpandibles no deben formar parte del tratamiento rutinario en este tipo de situaciones pues muestran buenos resultados sin su aplicación, empleando únicamente drenajes radiológicos o reinterviniendo a los pacientes. Estos mismos autores enfatizan las complicaciones derivadas del empleo de endoprótesis, descritas en la literatura y que incluyen algún fallecimiento, para limitar al máximo su utilización. Más recientemente, otros autores15 han descrito el uso con éxito de la terapia aspirativa en el cierre de este tipo de dehiscencias. No obstante, una revisión de la literatura evidencia también complicaciones derivadas de este tratamiento, como las estenosis.
En conclusión, las endoprótesis son dispositivos seguros y efectivos que no asocian mortalidad en nuestra serie. Están especialmente indicadas en dehiscencias intermedias o tardías y en pacientes frágiles, pues, junto con el drenaje mediastínico y pleural, evitan reintervenciones gravadas con morbimortalidad. Por tanto, las endoprótesis deben formar parte del arsenal terapéutico habitual para la resolución de la mayoría de las dehiscencias de sutura tras la esofagectomía de Ivor Lewis. La puesta en marcha de estudios prospectivos aleatorizados ayudaría a determinar con mayor precisión el papel que desempeñan estos dispositivos en el tratamiento de las dehiscencias tras una esofagectomía transtorácica.
Conflicto de interesesLos autores declaramos no tener ningún conflicto de intereses.