La citorreducción con quimioterapia intraperitoneal hipertérmica (HIPEC) se ha postulado como tratamiento de elección en pacientes seleccionados con carcinomatosis peritoneal por cáncer de colon. La presencia simultánea de diseminación peritoneal y hepática ha sido considerada una contraindicación para esta cirugía. El objetivo del presente estudio es analizar la morbimortalidad y supervivencia de los pacientes con carcinomatosis peritoneal por cáncer de colon, intervenidos mediante una citorreducción peritoneal y resección hepática simultánea con HIPEC.
MétodosEntre enero de 2010 y enero de 2015 se intervinieron 61 pacientes, 45 pacientes con carcinomatosis peritoneal (grupo RH−) y 16 con carcinomatosis peritoneal y metástasis hepáticas (grupo RH+).
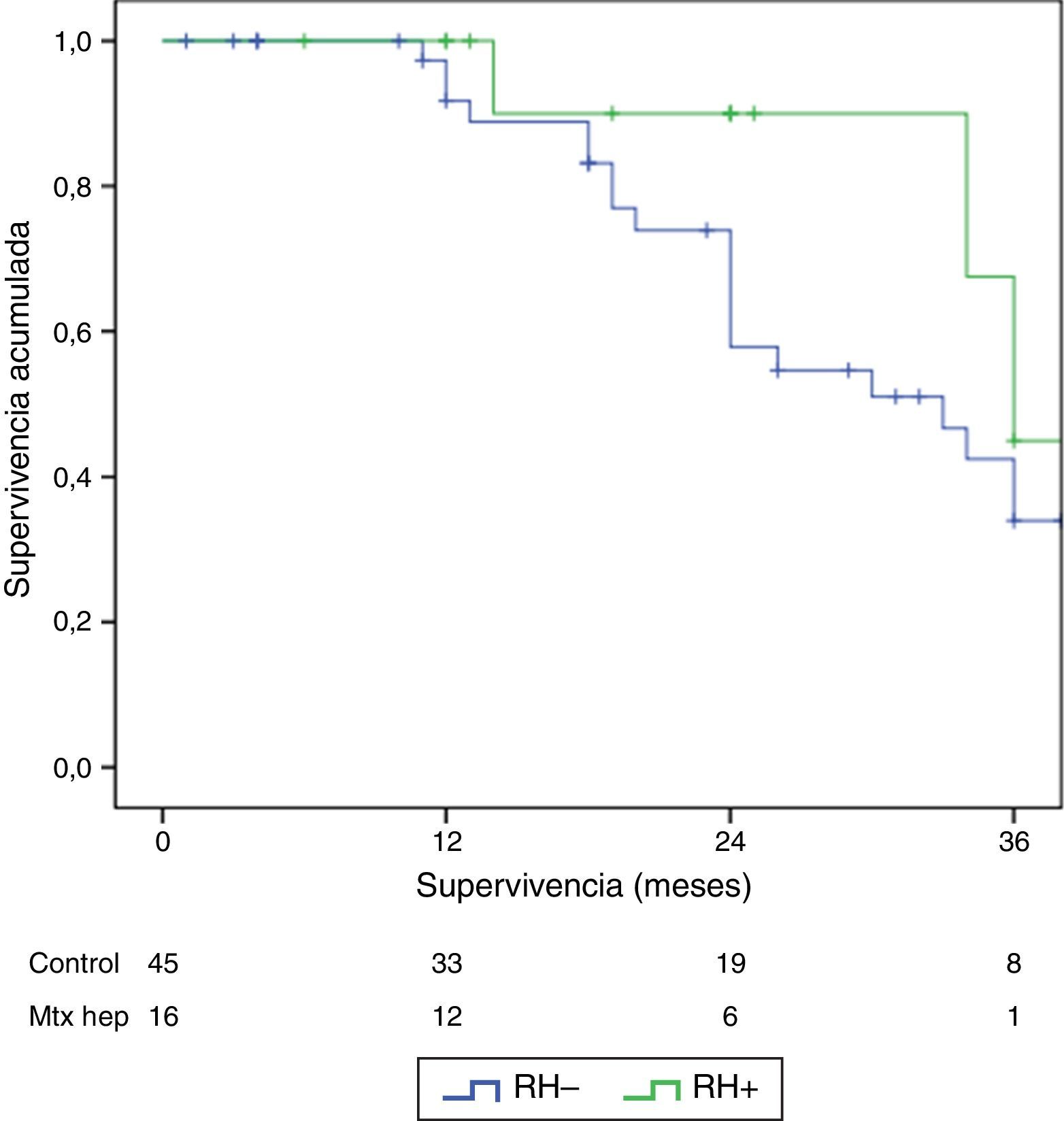
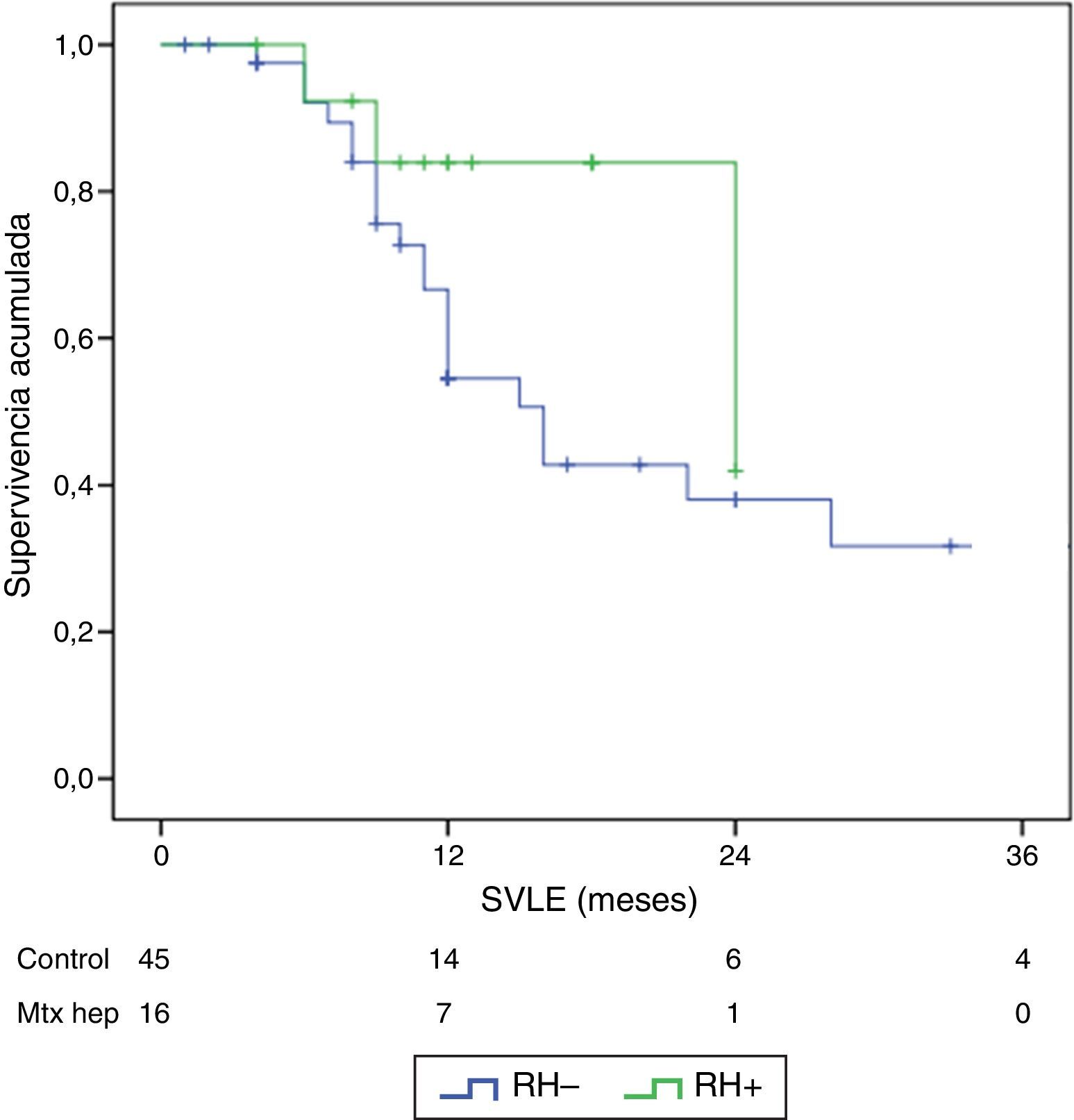
ResultadosNo hubo diferencias significativas entre los 2grupos en los datos demográficos, ASA, duración de la intervención, ni extensión de la enfermedad peritoneal. Las complicaciones postoperatorias Clavien III-V fueron significativamente superiores en el grupo RH+ (56,3 vs. 26,6%; p=0,03). La mortalidad global de la serie fue del 3,2% (2 pacientes en el grupo RH− y ninguno en el grupo RH+). Los pacientes con resección hepática presentaron una estancia hospitalaria significativamente más larga (14,4 vs. 23,1 días; p=0,027). La mediana estimada de supervivencia global fue de 33 meses para RH− y de 36 meses para RH+, y la de supervivencia libre de enfermedad fue de 16 meses para RH− y de 24 para RH+.
ConclusionesLa citorreducción peritoneal con resección hepática simultánea presenta una morbilidad postoperatoria y una estancia hospitalaria significativamente mayores, aunque las cifras son similares a las de otras cirugías abdominales mayores. La aplicación de un tratamiento oncológico y quirúrgico multimodal permite obtener resultados de supervivencia similares en ambos grupos.
Cytoreductive surgery plus intraperitoneal hyperthermic chemotherapy (HIPEC) has recently been established as the treatment of choice for selected patients with peritoneal carcinomatosis of colonic origin. Until recently, the simultaneous presence of peritoneal and hepatic dissemination has been considered a contraindication for surgery. The aim of this paper is to analyze the morbidity, mortality and survival of patients with simultaneous peritoneal and hepatic resection with HIPEC for peritoneal carcinomatosis secondary to colon cancer.
MethodsBetween January 2010 and January 2015, 61 patients were operated on, 16 had simultaneous peritoneal and hepatic dissemination (group RH+), and 45 presented only peritoneal dissemination (group RH−).
ResultsThere were no differences between the groups in terms of demographic data, length of surgery and extension of peritoneal disease. Postoperative grade III-V complications were significantly higher in the RH+ group (56.3 vs. 26.6%; P=.032). For the whole group, mortality rate was 3.2% (two patients in group RH−, and none in group RH+). Patients with liver resection had a longer postoperative stay (14.4 vs. 23.1 days) (P=.027). Median overall survival was 33 months for RH−, and 36 for RH+ group. Median disease-free survival was 16 months for RH−, and 24 months for RH+ group.
ConclusionsSimultaneous peritoneal cytoreduction and hepatic resection resulted in a significantly higher Clavien grade III-V morbidity and a longer hospital stay, although the results are similar to other major abdominal interventions. The application of multimodal oncological and surgical treatment may obtain similar long-term survival results in both groups.
La progresión hepática y peritoneal en el cáncer de colon tiene una incidencia del 50 y 15%, respectivamente y son las 2causas más frecuentes de muerte1,2. El tratamiento oncológico multimodal está consiguiendo importantes avances en el pronóstico de estos pacientes3. El tratamiento quirúrgico de las metástasis hepáticas por cáncer colorrectal ha demostrado una supervivencia a los 5 años del 25-30%, con una mortalidad operatoria en torno al 3%2. Por otra parte, la aplicación de cirugía citorreductora (CCR) con quimioterapia intraperitoneal hipertérmica (HIPEC) en pacientes seleccionados con diseminación peritoneal por cáncer de colon, apéndice y ovario ha mejorado en los últimos años el pronóstico y ha conseguido supervivencias superiores a las alcanzadas hasta ahora con quimioterapia sistémica, como han demostrado 2ensayos aleatorizados y varios estudios multicéntricos3–7. A pesar de estos avances, hasta ahora, el hallazgo intraoperatorio no esperado de diseminación peritoneal en un paciente programado para resección hepática contraindicaba dicha resección y viceversa: el hallazgo de diseminación hepática limitaba igualmente la citorreducción peritoneal. Con la mejora de la evaluación radiológica de la extensión tumoral y los avances en los cuidados perioperatorios y en la técnica quirúrgica, algunos grupos han planteado recientemente el tratamiento quirúrgico simultáneo de la enfermedad hepática y peritoneal en el mismo procedimiento8–12.
Los objetivos del estudio fueron analizar la morbimortalidad de un grupo seleccionado de pacientes con diseminación hepática y peritoneal simultánea, tratados mediante resección peritoneal y hepática e HIPEC en el mismo procedimiento, y evaluar su supervivencia. Los resultados fueron comparados con un grupo control de pacientes con carcinomatosis peritoneal (CP) sin diseminación hepática en los que solo se hizo citorreducción peritoneal con HIPEC.
MétodosEl diseño del estudio consistió en un análisis retrospectivo de una base de datos prospectiva. Entre enero de 2010 y enero de 2015 fueron intervenidos consecutivamente 61 pacientes con CP de origen colorrectal, a los que se realizó CCR con HIPEC. De estos pacientes, 16 presentaron diseminación hepática sincrónica que fue resecada junto a la enfermedad peritoneal más HIPEC en la misma intervención (grupo RH+). Los otros 45 presentaron únicamente CP (grupo RH−) y fueron tratados mediante CCR e HIPEC. La evaluación preoperatoria de los pacientes fue consensuada por los comités multidisciplinarios de Cirugía Oncológica Hepática y Cirugía Peritoneal, formados por cirujanos, oncólogos, radiólogos, patólogos y gastroenterólogos. El estudio fue aprobado por el comité ético local y se ha realizado según las normas de buenas prácticas clínicas, conservando en todo momento la confidencialidad de los datos.
Para la selección de pacientes, se les realizó exploración física, colonoscopia, bioquímica hepática, marcadores tumorales y TAC abdómino-pélvica. La resonancia hepática y la tomografía con emisión de positrones se realizaron de forma selectiva para definir la enfermedad hepática y descartar la enfermedad extraabdominal. Los criterios de resecabilidad fueron: comorbilidad aceptable (ASA I y II), buen estado general (ECOG 0 o 1), un máximo de 3 metástasis hepáticas, ausencia de progresión tumoral durante el tratamiento con quimioterapia sistémica, ausencia de enfermedad extraabdominal y posibilidad de conseguir una resección hepática y peritoneal completa.
Se practicó como técnica quirúrgica una laparotomía media con/sin extensión transversa derecha en función del tipo de resección hepática. Se calculó el índice de CP (ICP) intraoperatoriamente13 y se realizó una ecografía hepática intraoperatoria. La realización de la resección peritoneal y hepática simultánea se basó en la posibilidad de conseguir una resección completa. Se consideró R0 hepática si los bordes eran macroscópicamente negativos. La evaluación del grado de resección tumoral peritoneal se determinó mediante el Completeness of cytorreduction score (CC-Score)14, que considera CC-0: ausencia de enfermedad macroscópica, CC-1: enfermedad peritoneal visible menores de 2,5mm y CC-2: presencia de nódulos peritoneales mayores de 2,5mm. Dado que no se realizaron resecciones hepáticas mayores, no se consideró necesario estimar el porcentaje de volumen hepático residual.
Solo se realizó la HIPEC en los casos de resección tumoral óptima (CC-0 y CC-1). Tras la citorreducción quirúrgica, los pacientes con cáncer de colon recibieron una infusión intravenosa de 5FU (400mg/m2) y ácido folínico (20mg/m2) iv, una hora antes de la quimioterapia hipertérmica. Posteriormente, se infundió 460mg/m2 de oxaliplatino diluidos en 3 l/m2 de glucosa al 1,5% durante 30 min, hasta una temperatura media de 42°C, mediante la técnica abierta de «Coliseum»15. En los pacientes con hipersensibilidad al oxaliplatino se utilizó mitomicina C (12,5mg/m2). En todos los casos se aplicaron las medidas de seguridad sobre manejo de citostáticos y control de posibles vertidos basadas en las recomendaciones de este tipo de procedimientos16,17.
La morbilidad se registró según la clasificación de Clavien-Dindo18. La mortalidad postoperatoria se definió como aquella acontecida durante todo el ingreso hospitalario.
Análisis estadísticoLos datos se presentan como la media±desviación estándar (con un intervalo de confianza del 95%), mediana y rango intercuartílico, o como porcentaje (%). El test de Kolmogorov-Smirnov se utilizó para determinar si las variables seguían una distribución normal. Las variables continuas con distribución normal se compararon mediante muestras independientes de la prueba t de Student; las variables continuas no paramétricas se analizaron mediante la prueba U de Mann-Whitney y las variables categóricas se compararon entre grupos mediante chi cuadrado o la prueba exacta de Fisher. El análisis de supervivencia y supervivencia libre de enfermedad se realizó mediante la aplicación del método de Kaplan-Meier y se utilizó la prueba del log-rank para establecer la existencia de diferencias significativas entre las poblaciones de estudio. El riesgo relativo o hazard ratio fue estimado usando el método de regresión de riesgos proporcionales de Cox para los factores de supervivencia y supervivencia libre de enfermedad. Los cálculos estadísticos se llevaron a cabo con el paquete estadístico SPSS® (v. 24 para Windows®). Los resultados de supervivencia reflejados son actuariales.
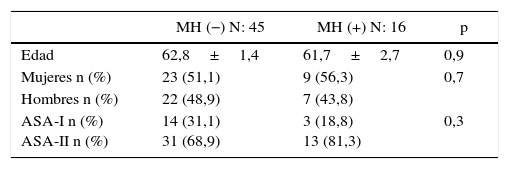
ResultadosRespecto a los datos demográficos, entre enero de 2010 y mayo de 2015, fueron intervenidos de forma consecutiva 61 pacientes con diagnóstico de CP mediante CCR+HIPEC con intención curativa. Se establecieron 2grupos de estudio, grupo RH−: pacientes con CP sin afectación hepática (45 pacientes) y grupo RH+: pacientes con CP y afectación hepática simultánea (16 pacientes; 26,2%). La invasión hepática de los pacientes del grupo RH+ fue diagnosticada preoperatoriamente en todos los casos. No se apreciaron diferencias significativas en los 2grupos en cuanto a la edad, sexo y el ASA (tabla 1).
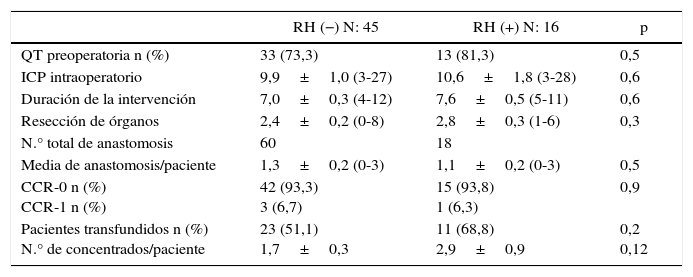
En cuanto a los datos perioperatorios, el 73% de los pacientes del grupo RH− recibieron quimioterapia preoperatoria, frente al 81% del grupo RH+ (p=0,5). El esquema más frecuentemente utilizado fue folfox (52,7%), folfox-bevacizumab (27%), folfiri-bevacizumab (11,3%) y folfox-folfiri-bevacizumab (9%). Todos los pacientes incluidos en el estudio presentaron ausencia de progresión tumoral tras finalizar la quimioterapia. El ICP, el número de órganos extirpados y la duración de la intervención fueron similares entre los 2grupos. Igualmente, el número de anastomosis realizadas no mostró diferencias significativas (1,3 vs. 1,1 anastomosis/paciente). Se consiguió una resección completa (CC-0) en el 93,3% de los pacientes en el grupo RH− y en el 93,8% del grupo RH+. Asimismo, la citorreducción CC-1 (nódulos residuales menores de 2,5mm) también fue similar en los 2grupos (6,7% en el grupo RH− frente al 6,3% en el grupo RH+; p=0,9). La tasa de transfusión perioperatoria fue superior en el grupo RH+, aunque sin diferencias significativas. El índice de transfusión perioperatoria del grupo RH− fue del 51,1% (23 pacientes) con 1,7 concentrados de hematíes trasfundidos por paciente. El 68,8% de los pacientes del grupo RH+ fueron transfundidos (11 pacientes), con una media de 2,9 concentrados por paciente (tabla 2).
Variables perioperatorias
| RH (−) N: 45 | RH (+) N: 16 | p | |
|---|---|---|---|
| QT preoperatoria n (%) | 33 (73,3) | 13 (81,3) | 0,5 |
| ICP intraoperatorio | 9,9±1,0 (3-27) | 10,6±1,8 (3-28) | 0,6 |
| Duración de la intervención | 7,0±0,3 (4-12) | 7,6±0,5 (5-11) | 0,6 |
| Resección de órganos | 2,4±0,2 (0-8) | 2,8±0,3 (1-6) | 0,3 |
| N.° total de anastomosis | 60 | 18 | |
| Media de anastomosis/paciente | 1,3±0,2 (0-3) | 1,1±0,2 (0-3) | 0,5 |
| CCR-0 n (%) CCR-1 n (%) | 42 (93,3) 3 (6,7) | 15 (93,8) 1 (6,3) | 0,9 |
| Pacientes transfundidos n (%) N.° de concentrados/paciente | 23 (51,1) 1,7±0,3 | 11 (68,8) 2,9±0,9 | 0,2 0,12 |
Con relación a las resecciones, la media de lesiones hepáticas extirpadas fue de 1,2 por paciente, con un máximo de 2lesiones. El tamaño medio fue de 2,3cm (rangos: 1-4). La disposición de las lesiones fue intraparenquimatosa en 15 pacientes (93,8%) y subcapsular en un paciente (6,2%). La localización más frecuente fue el segmento VII (33,5%), el segmento IV (22,2%), el segmento III (22,2%), el segmento IV (16,6%) y el segmento V (5,5%). Se realizaron 11 resecciones segmentarias (68,7%), 4 metastasectomías (25%) y una lobectomía izquierda (6,3%). En todos los pacientes se consiguieron márgenes de resección libres. Se realizó adicionalmente una radiofrecuencia hepática diferida 1,5 meses después la cirugía en un paciente con una lesión central de 2cm de diámetro.
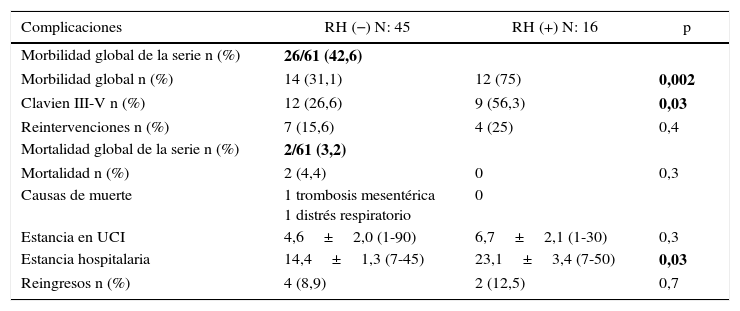
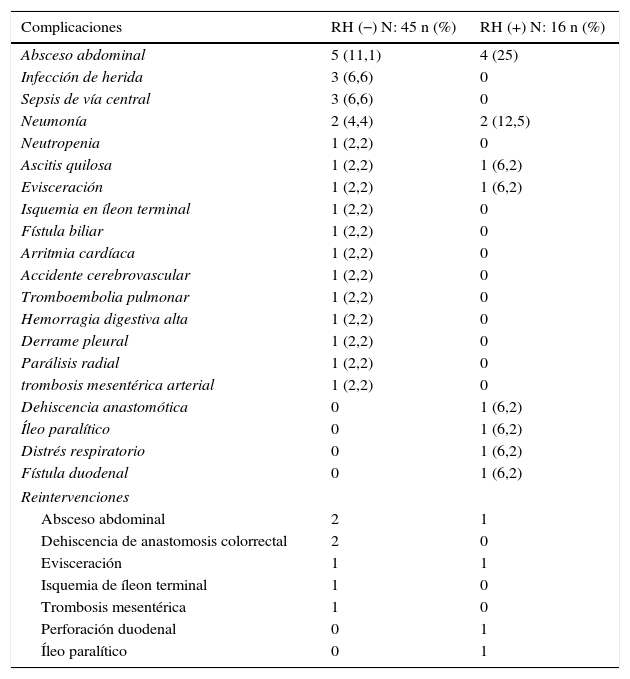
Respecto a la morbimortalidad y a las reintervenciones, cabe decir que la morbilidad global de la serie fue de un 42,6%. Las complicaciones grados III-V de Clavien-Dindo fueron significativamente menores en el grupo sin resección hepática (26,6 vs. 56,3%; p=0,03%). El 50% de todas las complicaciones registradas fueron de naturaleza infecciosa; la única dehiscencia anastomótica registrada en la serie (1,6%) se produjo en el grupo con resección hepática. La mortalidad postoperatoria de la serie fue del 3,2% (2 pacientes en el grupo RH−, ninguno en el grupo RH+). Las causas fueron una trombosis mesentérica arterial masiva con fallo multiorgánico refractario en una paciente y distrés respiratorio asociado a bronconeumonía bilateral nosocomial en otro paciente. En las tablas 3 y 4 se exponen las complicaciones registradas en los 2grupos.
Morbimortalidad
| Complicaciones | RH (−) N: 45 | RH (+) N: 16 | p |
|---|---|---|---|
| Morbilidad global de la serie n (%) | 26/61 (42,6) | ||
| Morbilidad global n (%) | 14 (31,1) | 12 (75) | 0,002 |
| Clavien III-V n (%) | 12 (26,6) | 9 (56,3) | 0,03 |
| Reintervenciones n (%) | 7 (15,6) | 4 (25) | 0,4 |
| Mortalidad global de la serie n (%) | 2/61 (3,2) | ||
| Mortalidad n (%) | 2 (4,4) | 0 | 0,3 |
| Causas de muerte | 1 trombosis mesentérica 1 distrés respiratorio | 0 | |
| Estancia en UCI | 4,6±2,0 (1-90) | 6,7±2,1 (1-30) | 0,3 |
| Estancia hospitalaria | 14,4±1,3 (7-45) | 23,1±3,4 (7-50) | 0,03 |
| Reingresos n (%) | 4 (8,9) | 2 (12,5) | 0,7 |
La negrita hace referencia a la morbilidad y mortalidad globales de la serie.
Complicaciones postoperatorias y reintervenciones
| Complicaciones | RH (−) N: 45 n (%) | RH (+) N: 16 n (%) |
|---|---|---|
| Absceso abdominal | 5 (11,1) | 4 (25) |
| Infección de herida | 3 (6,6) | 0 |
| Sepsis de vía central | 3 (6,6) | 0 |
| Neumonía | 2 (4,4) | 2 (12,5) |
| Neutropenia | 1 (2,2) | 0 |
| Ascitis quilosa | 1 (2,2) | 1 (6,2) |
| Evisceración | 1 (2,2) | 1 (6,2) |
| Isquemia en íleon terminal | 1 (2,2) | 0 |
| Fístula biliar | 1 (2,2) | 0 |
| Arritmia cardíaca | 1 (2,2) | 0 |
| Accidente cerebrovascular | 1 (2,2) | 0 |
| Tromboembolia pulmonar | 1 (2,2) | 0 |
| Hemorragia digestiva alta | 1 (2,2) | 0 |
| Derrame pleural | 1 (2,2) | 0 |
| Parálisis radial | 1 (2,2) | 0 |
| trombosis mesentérica arterial | 1 (2,2) | 0 |
| Dehiscencia anastomótica | 0 | 1 (6,2) |
| Íleo paralítico | 0 | 1 (6,2) |
| Distrés respiratorio | 0 | 1 (6,2) |
| Fístula duodenal | 0 | 1 (6,2) |
| Reintervenciones | ||
| Absceso abdominal | 2 | 1 |
| Dehiscencia de anastomosis colorrectal | 2 | 0 |
| Evisceración | 1 | 1 |
| Isquemia de íleon terminal | 1 | 0 |
| Trombosis mesentérica | 1 | 0 |
| Perforación duodenal | 0 | 1 |
| Íleo paralítico | 0 | 1 |
Un total de 11 pacientes (18%) fueron reintervenidos, 7 en el grupo RH− (15,6%) y 4 en el grupo RH+ (25%; p=0,2). La estancia en cuidados intensivos fue menor en el grupo sin resección hepática, aunque sin diferencias significativas (4,6±2,0 días; rango 1-90), frente a 6,7±2,1 días; rango 1-30; p=0,3). Sin embargo, la estancia hospitalaria fue significativamente menor en el grupo sin resección hepática 14,4±1,3 días (rango 7-45), frente a 23,1±3,4 días (rango 7-50; p=0,027). El grupo con resección hepática presentó una mayor tasa de reingresos (8,9 vs. 12,5%), pero sin diferencias significativas.
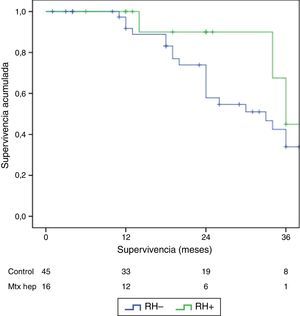
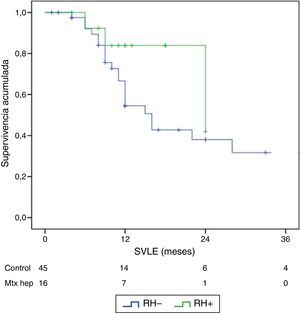
El seguimiento se dio entre 6 y 33 meses. La supervivencia global media fue de 27,4±3,3 meses en el grupo RH− (rango 5-96) y de 23,4±3,8 meses en el RH+ (rango 6-32; p=0,7). La supervivencia libre de enfermedad media fue de 17,6±3,1 meses en el grupo RH− y de 13,4±1,6 meses en el grupo RH+ (p=0,4). La mediana de supervivencia global, estimada mediante el método Kaplan-Meier, fue de 33 meses para el grupo RH− y de 36 para RH+. La mediana de supervivencia libre de enfermedad fue de 16 meses para el grupo RH− y de 24 meses para el grupo RH+. El 31,2% de los pacientes de RH+ presentaron recurrencia hepática, con una media de 11,4 meses desde la intervención. La supervivencia global actuarial a 1, 3 y 5 años fue del 97, 37 y 16%, respectivamente, en el grupo sin resección hepática y del 100, 42 y 22% en el grupo con resección hepática. No existieron diferencias significativas en ningún caso entre los 2grupos (tabla 5, figs. 1 y 2).
Resultados oncológicos
| RH (−) N: 45 | RH (+) N: 16 | p | ||
|---|---|---|---|---|
| SVG media±DE (meses) | 27,4±3,3 | 24,8±4,2 | 0,7 | |
| SVG mediana | 33 | 36 | ||
| SVG actuarial en % | 1 año | 97 | 100 | 0,3 |
| 3 años | 37 | 42 | 0,2 | |
| 5 años | 16 | 22 | 0,6 | |
| SVLE media±DE (meses) | 17,6±3,1 | 13,5±1,5 | 0,7 | |
| SVLE mediana | 12 (8-17,8) | 12 (9,3-18) |
DE: desviación estándar; SVG: supervivencia global; SVLE: supervivencia libre de enfermedad.
La progresión hepática y peritoneal son las dos causas más frecuentes de muerte en los pacientes con cáncer colorrectal12. El 25% de los pacientes presentan metástasis hepáticas en el momento del diagnóstico y un 35-55% las desarrollan después de la resección del tumor primario19. En los últimos años, el tratamiento multimodal con quimioterapia sistémica, CCR e HIPEC, ha modificado el pronóstico de los pacientes con CP por cáncer de colon1,3,5,7,13. A pesar de la ausencia de ensayos de fase III, la cirugía es hoy día el tratamiento de elección de las metástasis hepáticas resecables en el cáncer colorrectal, con una supervivencia a los 5 años en torno al 30-35%2,20–24. La diseminación peritoneal está presente en el 10-15% de los pacientes con cáncer de colon en el momento del diagnóstico y aparece hasta en un 40% de los pacientes después de la resección primaria del tumor. Además, representa la forma de progresión tumoral con peor pronóstico, con una peor tasa de respuesta a la quimioterapia sistémica y una supervivencia un 30% menor que otras formas de metástasis a distancia22,25–27. Los trabajos de Sugarbaker demostraron en los años noventa que la invasión peritoneal podía ser considerada una entidad locorregional durante un tiempo limitado antes de su expansión sistémica y, por tanto, susceptible de un tratamiento específico con CCR+HIPEC en casos seleccionados13. En los últimos años se han publicado un ensayo aleatorizado y numerosos trabajos en los que se demuestra la eficacia de la CCR+HIPEC en pacientes seleccionados con CP por cáncer de colon5,9,28–30. Hasta hace poco tiempo la diseminación peritoneal representaba una contraindicación para la resección de metástasis hepáticas y viceversa: el hallazgo de metástasis hepáticas en pacientes con enfermedad peritoneal limitaba la indicación para aplicar los nuevos criterios de CCR con HIPEC8,25,31. Estudios posteriores observaron que la morbimortalidad y la supervivencia eran similares en los pacientes con metástasis hepáticas o enfermedad peritoneal en los que se conseguía una resección tumoral completa20,21,32. Además, la disminución de la morbimortalidad postoperatoria conseguida en los últimos años ha incrementado la seguridad de estas intervenciones y, como consecuencia, varios grupos han planteado recientemente la posibilidad de realizar una resección hepática y peritoneal simultánea, en pacientes seleccionados en los que es posible conseguir una citorreducción tumoral completa8–11,22,25.
El presente trabajo analiza los resultados preliminares de un grupo de pacientes con resección hepática y peritoneal simultánea por CP secundaria a cáncer de colon en nuestro medio. La selección de los pacientes es un factor clave: de la misma forma que se recomienda no realizar una CCR+HIPEC en pacientes con un índice de CP superior a 18 puntos33 en el cáncer de colon, debido a su elevada morbilidad y escaso beneficio en la supervivencia, existe un acuerdo en limitar la resección simultánea hepática y peritoneal a pacientes con 3 o menos lesiones hepáticas y evitar las resecciones hepáticas mayores9,22. En nuestra serie, el número medio de lesiones hepáticas resecadas fue de 1,2 lesiones/paciente y el ICP medio, de 12,8.
Los avances en los cuidados perioperatorios y en la técnica quirúrgica han reducido la mortalidad postoperatoria, que actualmente se sitúa en el 3-6%8,10,20,21. En nuestro estudio la mortalidad global fue del 3,2%, con una mayor mortalidad en el grupo sin resección hepática (4,4 vs. 0%), pero sin diferencias significativas. La extensión de la enfermedad, medida por el ICP, el número de órganos resecados y la duración de la intervención fue similar en ambos grupos; sin embargo, las complicaciones de grado III-V fueron significativamente mayores en el grupo con resección hepática, con las complicaciones infecciosas como las más frecuentes, lo que pone de manifiesto la mayor complejidad de la resección hepática y peritoneal simultánea. Estos resultados de morbimortalidad son similares a los estándares recomendados en otras intervenciones de cirugía abdominal mayor como la duodenopancreatectomía o la esofaguectomía, lo que plantea su factibilidad en pacientes bien seleccionados y en centros de alto volumen8,10,22,34–37.
Asumimos que el tamaño del grupo con enfermedad peritoneal y hepática es pequeño, lo que constituye la principal limitación del estudio. Sin embargo, pensamos que los datos son relevantes y que el presente trabajo puede considerarse como piloto de un próximo estudio multicéntrico con un mayor volumen de pacientes. Los resultados de seguimiento reflejan la evolución de este subgrupo de pacientes hasta hace poco tiempo considerados irresecables. Se considera que los pacientes intervenidos con diseminación peritoneal y hepática simultánea tienen peor pronóstico que los pacientes operados por diseminación peritoneal única. Sin embargo, su supervivencia media es de 24,8 meses, con una supervivencia libre de enfermedad de 13,5 meses y una supervivencia a los 5 años del 22%. Estos resultados justifican y explican la tendencia reciente a incorporar la citorreducción peritoneal con resección hepática simultánea dentro de un plan terapéutico oncológico multimodal en pacientes bien seleccionados, ya que puede aumentar la supervivencia en este grupo seleccionado de pacientes con enfermedad avanzada, hasta hace poco considerados inoperables.
Las diferencias en la supervivencia de ambos grupos no fueron estadísticamente significativas. Este hecho puede deberse al limitado tamaño muestral del grupo RH+, por lo que es necesario ampliar el estudio con un número mayor de pacientes.
En conclusión, estos resultados muestran que la citorreducción peritoneal e HIPEC con resección hepática simultánea tiene una mayor morbilidad postoperatoria y estancia hospitalaria comparadas con la citorreducción e HIPEC sin resección hepática. Sin embargo, estos resultados son comparables a los publicados en otras cirugías abdominales complejas. La aplicación de este tratamiento multimodal podría aumentar la supervivencia en un grupo seleccionado de pacientes con enfermedad avanzada, que ha sido considerado hasta hace poco tiempo irresecable.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Fueron presentaron datos parciales de este trabajo en la VI Reunión Nacional del Grupo Español de Cirugía Peritoneal, celebrada en Madrid, en noviembre de 2015.