La hemorragia postoperatoria de una anastomosis intestinal o cólica (HPAIC) suele ser una complicación leve, manejada generalmente de forma conservadora. Otras opciones terapéuticas son la cirugía, la endoscopia y la embolización angiográfica. Nuestro objetivo es realizar un análisis descriptivo de las hemorragias anastomóticas postoperatorias en pacientes con anastomosis intestinales o cólicas, el tratamiento realizado y las complicaciones derivadas.
Pacientes y métodosEstudio observacional retrospectivo, que incluye pacientes con HPAIC en el Servicio de Cirugía General y del Aparato Digestivo del Hospital Universitario Vall d’Hebron entre 2007 y 2012. Se han recogido las características de los pacientes, del tratamiento y las complicaciones según la opción terapéutica.
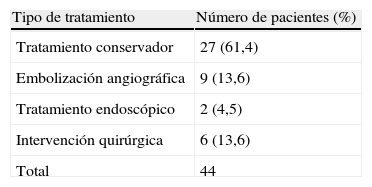
ResultadosHallamos 44 casos de hemorragia anastomótica, siendo varones 25 (56,8%), con una media de edad de 68,2 años (R: 28-92). La caída media de hematocrito fue de 8 puntos (R: 0-17), presentando inestabilidad hemodinámica 13 pacientes (29,5%). Se realizó manejo conservador en 27 pacientes (61,4%), cirugía en 6 (13,6%), manejo endoscópico en 2 (4,5%) y embolización en 9 (20,5%). De los casos embolizados, 4 pacientes presentaron dehiscencia anastomótica (44,5%). La mortalidad fue de 13,6% (6 pacientes). Un total de 4 de las 6 muertes pertenecen al grupo embolizado.
ConclusionesLa mayoría de pacientes con HPAIC responden al tratamiento conservador. Cuando fracasa, existen diferentes opciones terapéuticas que incluyen la embolización angiográfica. En nuestra serie observamos una elevada incidencia de dehiscencia anastomótica postembolización, siendo necesario reevaluar el tipo de embolización así como sus indicaciones y contraindicaciones.
Postoperative small bowel or colic anastomotic bleeding (PSCAB) is often a mild complication and is generally treated by a conservative approach. Other therapeutic options are surgery, endoscopic management and angiographic embolization. Our aim is to review our cases of postoperative anastomotic bleeding in patients with small bowel or colic anastomosis, with special attention to their treatment and complications.
Patients and methodsObservational retrospective study including patients with PSCAB in the department of General and Digestive Surgery in Vall d’Hebron University Hospital, between 2007 and 2012. Demographic and bleeding characteristics as well as therapeutic management were reviewed, including complications derived from the different therapeutic options.
ResultsThere were 44 cases of bleeding after performing small bowel or colic anastomosis, 25 patients were men (56.8%), with a mean age of 68.2 years (R: 28-92). The mean hematocrit decrease was 8 points (R: 0-17), and hemodynamic instability was detected in 13 patients (29.5%). A conservative management was undertaken in 27 patients (61.3%), surgery in 6 (13.6%), endoscopic treatment in 2 (4.5%) and embolization in 9 (20.5%). 4 patients of cases treated with embolization presented anastomotic leak (44.5%). Mortality was 13.6% (6 patients). A total of 4 of 6 deaths were in the group of patients treated with embolization.
ConclusionsMost patients with PSCAB have a good response to conservative management. When there is failure of this approach, there are different therapeutic options, including angiographic embolization. In our series, we have seen a high incidence of post embolization anastomotic leak; further trials will be necessary to provide valuable evidence of the risk of this therapeutic option.
El sangrado digestivo bajo a partir de una anastomosis intestinal o cólica es un problema clínico relativamente frecuente, estimándose el porcentaje de pacientes que presentan este evento entre un 1 y un 5,4% de los tratados con este tipo de intervenciones. Estos pacientes requerirán un diagnóstico sistemático y un algoritmo terapéutico definido1–3.
Este tipo de sangrado no difiere en su presentación de la hemorragia digestiva por otras causas y en ambos casos el manejo suele ser conservador, presentándose la hemorragia severa como un evento infrecuente4. En cualquier caso, cuando el manejo conservador fracasa, será necesario realizar una terapéutica intervencionista.
Las diferentes opciones actuales incluyen la terapia endoscópica, la embolización angiográfica y la reintervención quirúrgica. Sin embargo, estas opciones terapéuticas a día de hoy aún se encuentran en discusión, en cuanto a su tasa de éxito y los riesgos asociados a las mismas3.
El objetivo de este trabajo es realizar una descripción de la frecuencia de la hemorragia postoperatoria en pacientes intervenidos en nuestro servicio, a los cuales se les había realizado una anastomosis intestinal o cólica, el tratamiento realizado y las complicaciones que aparecieron tras el manejo de esta enfermedad mediante radiología intervencionista.
Pacientes y métodosHemos realizado un estudio retrospectivo que incluye a aquellos pacientes que presentaron hemorragia digestiva postoperatoria cuyo punto de origen era la anastomosis intestinal o cólica, durante el período comprendido entre el 1 de enero de 2007 y el 31 de diciembre de 2012, en el Servicio de Cirugía General y del Aparato Digestivo del Hospital Universitario Vall d’Hebron.
Se ha incluido a pacientes intervenidos tanto de forma programada como de forma urgente, por abordaje abierto y laparoscópico. Las anastomosis fueron realizadas de forma manual o mecánica, siendo la elección de la técnica en cada caso según el criterio del cirujano que realizaba la intervención.
El concepto de hemorragia anastomótica postoperatoria ha sido definido como la presencia de signos de sangrado directo (hematoquecia) o indirectos (anemización o repercusión hemodinámica) tras una intervención quirúrgica en la que se realizó este tipo de anastomosis. Cuando nos referimos a pacientes que presentaron inestabilidad hemodinámica, hemos incluido a aquellos con presión sistólica menor de 90mmHg y frecuencia cardíaca de más de 100 latidos por minuto.
Los datos demográficos y los referentes a las características del sangrado y al manejo terapéutico han sido revisados, incluyendo la incidencia de dehiscencia de sutura y mortalidad. Asimismo, se han recogido los datos referentes a las complicaciones derivadas del manejo angiográfico.
El manejo conservador se ha definido como aquel que comprendía la estabilización mediante fluidoterapia y la corrección de coagulopatía, en caso de que existiera, así como la administración de hemoderivados. Las constantes vitales fueron monitorizadas, a fin de identificar una inestabilización del paciente.
En algunos casos se realizó una tomografía computarizada (TC) con contraste intravenoso para confirmar el sangrado activo y excluir otras enfermedades.
La presentación de una isquemia postembolización de la anastomosis ha sido definida como la presentación de sepsis tras la realización de la misma, que se acompañaba de signos clínicos de peritonitis, con la confirmación o no mediante TC con contraste intravenoso o mediante visión directa en cirugía.
Análisis estadísticoLas variables continuas han sido presentadas como medias, rangos y medianas. Las variables categóricas se han presentado como números absolutos y porcentajes.
ResultadosDurante el período estudiado, 2.069 pacientes fueron intervenidos quirúrgicamente mediante la realización de una anastomosis intestinal o cólica. Un total de 44 pacientes (3,17%) presentaron una hemorragia postoperatoria a nivel anastomótico, 25 eran varones (56,8%) y 19 mujeres (43,2%), con una media de edad de 68,2 (28-92) años.
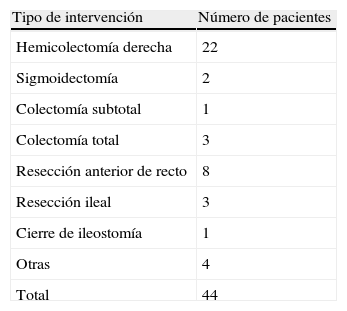
Un total de 34 pacientes (72,7%) fue intervenidos por enfermedad neoplásica, siendo la segunda causa en frecuencia la enfermedad inflamatoria intestinal (5 pacientes, 11,4%), y atribuyéndose el porcentaje restante a otras causas minoritarias. El tipo de cirugía realizada en cada caso se encuentra en la tabla 1, realizándose 20 intervenciones (45,5%) por abordaje abierto y 24 (54,5%) por vía laparoscópica. Un total de 11 anastomosis (25%) fueron realizadas manualmente y 33 (75%) de forma mecánica.
El intervalo medio entre la intervención quirúrgica y el episodio de sangrado fue de 7,6 (0-46) días, con una mediana de 5,5 días. La presentación clínica más frecuente fue la hematoquecia en 42 pacientes (95,5%), mientras que en 2 (4,5%) se observó hipotensión inicial sin otra sintomatología. Trece pacientes (29,5%) experimentaron inestabilidad hemodinámica en el transcurso del episodio. La caída media de hematocrito fue de 8 (0-17) puntos. Un total de 35 pacientes (79,5%) requirieron transfusión de hemoderivados, siendo 3,7 (1-11) la media de concentrados de hematíes transfundidos por paciente.
De los 44 casos revisados, en 16 (36,4%) se realizó una TC abdominal con contraste intravenoso. En los 9 pacientes embolizados, la angiografía confirmó el sangrado activo previamente diagnosticado por TC.
La tabla 2 recoge las diferentes opciones terapéuticas realizadas en nuestro servicio a fin de manejar el sangrado. El tratamiento conservador fue la opción más frecuente, 27 (61,4%), seguido de la embolización angiográfica, que se realizó en 9 pacientes (20,4%). El sangrado cesó en todos los casos dentro de este último grupo.
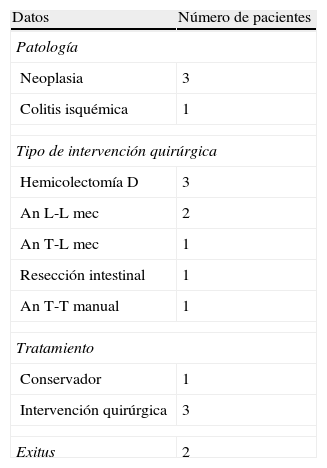
En la presente serie, 7 pacientes experimentaron dehiscencia de anastomosis (20,4%), observándose 4 de ellos tras la realización de embolización angiográfica.
En la tabla 3 quedan recogidos los datos respecto a la dehiscencia de anastomosis tras la realización del procedimiento angiográfico. La mayoría de los casos que presentaron dehiscencia postembolización fueron pacientes a los cuales se les había realizado una hemicolectomía derecha con anastomosis mecánica. La media del intervalo de tiempo transcurrido desde la embolización hasta la aparición de la dehiscencia fue de 3,8 (2-8) días, siendo el manejo quirúrgico la opción terapéutica de elección ante esta situación clínica.
Datos sobre los casos de dehiscencia de sutura postembolización angiográfica
| Datos | Número de pacientes |
| Patología | |
| Neoplasia | 3 |
| Colitis isquémica | 1 |
| Tipo de intervención quirúrgica | |
| Hemicolectomía D | 3 |
| An L-L mec | 2 |
| An T-L mec | 1 |
| Resección intestinal | 1 |
| An T-T manual | 1 |
| Tratamiento | |
| Conservador | 1 |
| Intervención quirúrgica | 3 |
| Exitus | 2 |
An L-L mec: anastomosis latero-lateral mecánica; An T-L mec: anastomosis término-lateral mecánica; An T-T manual: anastomosis término-terminal manual.
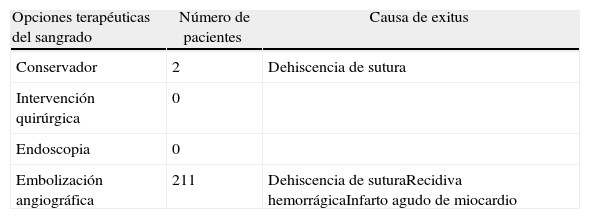
De los 44 pacientes que presentaron sangrado anastomóstico, 6 fueron exitus (13,64%), 4 de ellos tras la realización de embolización angiográfica. Las causas de mortalidad fueron infarto agudo de miocardio en un caso, recidiva del sangrado en otro y dehiscencia de sutura en 2 pacientes (tabla 4). En estos 2 últimos casos, se optó por manejo conservador debido a la edad avanzada y la comorbilidad de ambos pacientes.
Mortalidad tras un episodio de sangrado postoperatorio anastomótico intestinal o cólico
| Opciones terapéuticas del sangrado | Número de pacientes | Causa de exitus |
| Conservador | 2 | Dehiscencia de sutura |
| Intervención quirúrgica | 0 | |
| Endoscopia | 0 | |
| Embolización angiográfica | 211 | Dehiscencia de suturaRecidiva hemorrágicaInfarto agudo de miocardio |
La presencia de una hemorragia a nivel de anastomosis tras resección de intestino delgado o colon suele presentarse en forma de hematoquecia especialmente en las fases iniciales de la recuperación del tránsito intestinal. Generalmente, acostumbra ser una hemorragia autolimitada y sin otra repercusión clínica3. Sin embargo, existe un pequeño porcentaje de pacientes que presenta anemización importante, con inestabilidad hemodinámica y, ocasionalmente, shock y muerte4.
La hemorragia anastomótica postoperatoria en cirugía colorrectal es un tópico poco tratado en la literatura5. Según los datos publicados, se sitúa entre el 1 y el 5,4%1,2,5,6, valores similares a los observados en nuestra serie (3,2%).
Aunque existen publicaciones sobre el aumento de riesgo de esta complicación con relación a ciertos tratamientos o enfermedades previas, así como al lugar o tipo de anastomosis, no todos los estudios avalan estos resultados1,3,5,7,8.
El intervalo medio de sangrado en nuestra serie desde el día de la intervención quirúrgica fue de una semana, dato concordante con los publicados previamente3,9.
En estos pacientes, el manejo inicial debe ser conservador, basado en la recuperación de la volemia y el control estricto de constantes10–12. En nuestro trabajo, el 61,4% de los pacientes fue manejado conservadoramente, cesando el sangrado espontáneamente en todos los casos. Si el manejo conservador fracasa, es necesario sopesar otras opciones terapéuticas7,9,10,13.
Inicialmente, cuando el manejo conservador no funcionaba, se recurría a la reintervención quirúrgica, habiéndose evidenciado un aumento de la mortalidad de casi el doble respecto a aquellos pacientes que no requirieron reintervención. Actualmente, han aparecido otros métodos cuyo propósito es evitar la morbimortalidad asociada a la reintervención12,14. Estos son el manejo endoscópico y la embolización angiográfica, considerados inicialmente menos agresivos que una nueva intervención quirúrgica y habiéndose comprobado con el tiempo que no están exentos de riesgos3,12,14–16. Actualmente, todavía se discute cuál es el método que proporciona mayor tasa de éxito y entraña menos riesgos, considerando como paradigma de las complicaciones la dehiscencia de sutura anastomótica9,17.
Son muchos autores los que defienden como primera opción en el algoritmo de manejo diagnóstico-terapéutico de una hemorragia digestiva baja la realización de una fibrocolonoscopia17,18, existiendo datos que indican que la tasa de éxito será menor que en caso de hemorragia de tracto digestivo superior19. La ventaja de este procedimiento es la localización precisa del punto de origen de la hemorragia mediante visualización directa, excluyendo otras causas de la misma, además de ser un método seguro y efectivo. Sin embargo, se ha señalado como desventaja una visualización pobre en un colon no preparado o con una hemorragia masiva19, así como el riesgo de dehiscencia anastomótica, especialmente si la endoscopia se realiza en los primeros 4 o 5 días postoperatorios, cuando la integridad de la anastomosis aún depende de la sutura9. En cambio, Chardavoyne concluyó en un trabajo publicado en 1991 que, ante una urgencia de este tipo, la colonoscopia era segura incluso en el primer día postoperatorio20. Existen pocos trabajos publicados sobre el manejo del sangrado anastomótico mediante endoscopia, pero los existentes la señalan como primera opción en el caso de anastomosis cólicas, siendo de elección la escleroterapia, la colocación de clips o la electrocoagulación3, no siendo posible, por las limitaciones de esta técnica, su aplicación en el sangrado de anastomosis intestinales. En nuestra serie, contamos solo con 2 casos en los que se utilizó la fibrocolonoscopia como opción terapéutica, colocando clips, con cese del sangrado y buena evolución posterior en ambos casos.
La mayoría de los autores defienden el manejo de la hemorragia digestiva baja mediante angiorradiología como segunda opción terapéutica, cuando el manejo endoscópico está contraindicado o ha fracasado. Sin embargo, no existe consenso, ya que existen otros grupos que utilizan esta técnica como primera opción, dependiendo de la política del hospital y la disponibilidad de medios3,4,14,16,18,19,21.
Aunque la primera embolización transcatéter fue realizada en 1967 por Newton y Adams22, la primera embolización vascular terapéutica por sangrado gastrointestinal fue descrita por Bookstein et al. en 197423. Posteriormente, tanto este grupo como otros autores informaron sobre el riesgo de isquemia cólica tras la realización del procedimiento. Rosenkratz describió en 1982 la aparición de 3 casos de isquemia cólica tras la embolización de 23 casos de sangrado, por lo que este procedimiento dejó de considerarse inocuo24.
Sin embargo, la embolización angiográfica sigue siendo una opción atractiva alternativa al control quirúrgico o endoscópico del sangrado. Esta puede realizarse, en la mayoría de los casos, tras la localización del punto sangrante mediante angiografía, con un control inmediato de la hemorragia en un porcentaje de pacientes del 76 al 100%14,25.
Las publicaciones iniciales situaban el porcentaje de isquemia postembolización en un 13-20%23,26,27, pero actualmente este porcentaje se estima por debajo del 10%27. Esto se podría explicar por un aumento en la experiencia del equipo que realiza el procedimiento y la aparición de la embolización supraselectiva.
La literatura publicada sobre este tema es escasa y no existe ningún estudio que presente datos concluyentes3–5. Existen publicados menos de 20 casos de sangrados anastomóticos que requirieron un manejo intervencionista, sin que exista un consenso sobre el tratamiento de los mismos5. En 17 pacientes de nuestra serie fracasó el manejo conservador, sometiéndose a embolización angiográfica a 9 pacientes. En nuestro servicio, actualmente, no existe un algoritmo diagnóstico-terapéutico definido para los sangrados anastomóticos, por lo que la elección del método utilizado se definió en función del médico responsable y de la disponibilidad de otros especialistas.
De los pacientes embolizados, observamos que casi la mitad presentó dehiscencia de la anastomosis, requiriendo reintervención quirúrgica el 75%, con una mortalidad del 50%. A pesar de que la serie presentada es pequeña, los resultados obtenidos deberían dar pie para la realización de nuevos estudios, de forma ideal prospectivos y multicéntricos, a fin de definir las cifras reales sobre la seguridad de la embolización angiográfica.
Igualmente, y a raíz de los resultados obtenidos, parece prioritaria la realización de una guía clínica del manejo diagnóstico-terapéutico de esta enfermedad en nuestro hospital.
En conclusión, cuando el manejo conservador ha fracasado, la embolización angiográfica parece ser una técnica alternativa a la cirugía cuando aparece un sangrado tras la realización de una anastomosis intestinal o cólica. Sin embargo, en nuestra experiencia, hemos encontrado un alto índice de dehiscencia de sutura tras la realización de este procedimiento, siendo necesario el desarrollo de otros estudios para evaluar la evidencia del riesgo de esta opción terapéutica.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses en ningún caso.
Presentado como comunicación oral en la XVII Reunión Nacional de la Fundación Asociación Española de Coloproctología. Palma de Mallorca, mayo de 2013.