La estadificación clínica preoperatoria es crítica para seleccionar aquellos pacientes cuya enfermedad está localizada y se podrá beneficiar de una cirugía con intención curativa. Idealmente, dicha estadificación debería predecir la invasión tumoral, la afectación linfática y las metástasis a distancia. Con el cTNM podemos seleccionar aquellos pacientes a los que podremos ofrecer una resección endoscópica, una cirugía radical o evitarla en aquellos con metástasis a distancia. Para el diagnóstico inicial de los adenocarcinomas de la unión esofagogástrica se requiere una endoscopia con biopsias. Para la estadificación clínica: TC toracoabdominopélvico, ultrasonografía endoscópica y la PET o la PET-TC. Otras exploraciones de utilidad son: tránsito baritado, resección endoscópica de la mucosa o disección endoscópica de la submucosa (para valoración de estadios iniciales) y la laparoscopia de estadificación. Una vez establecida la resecabilidad del tumor deberá valorarse la operabilidad del mismo en función del estado del paciente.
Preoperative clinical staging is critical to select those patients whose disease is localized and may benefit from surgery with curative intent. Ideally, such staging should predict tumor invasion, lymphatic involvement and distant metastases. With the cTNM, we are able to select patients who could benefit from endoscopic resection, radical surgery or less radical treatment in patients with distant metastasis. The initial diagnosis of adenocarcinomas of the esophagogastric junction requires endoscopy with biopsies. For clinical staging, thoracoabdominal-pelvic CT scan, endoscopic ultrasound and PET or PET/CT are used. Other useful explorations are: barium swallow, endoscopic mucosal resection or endoscopic submucosal dissection (for assessment in initial stages) and staging laparoscopy. Once the resectability of the tumor has been established, the operability of the tumor should be assessed according to the patient's condition.
Para el diagnóstico de los tumores de la unión esofagogástrica (UEG) se requiere una correcta anamnesis, examen físico y una endoscopia con biopsia. La presentación clínica clásica es la disfagia a sólidos progresiva y de corta duración en un varón de mediana edad, a veces con historia de reflujo gastroesofágico y hernia hiatal, y con diagnóstico de esófago de Barrett en algunos de ellos. Al examen físico, suelen ser pacientes robustos que pueden padecer comorbilidades relacionadas con el estilo de vida occidental (p.ej., síndrome metabólico, obesidad), sin pérdida importante de peso en muchos casos1.
La estadificación clínica preoperatoria es crítica para seleccionar aquellos pacientes cuya enfermedad está localizada y se podrá beneficiar de una cirugía con intención curativa. Idealmente, dicha estadificación debería predecir la invasión tumoral, la afectación linfática y las metástasis a distancia. Con el cTNM podemos seleccionar aquellos pacientes a los que podremos ofrecer una resección endoscópica, una cirugía radical o evitarla en aquellos con metástasis a distancia2.
La falta de una clara definición de los tumores de la UEG ha contribuido a la dificultad para clasificar topográficamente estos tumores, y aunque en la mayoría de casos es fácil clasificar los tumores basándose en la endoscopia, el esofagograma, la tomografía computarizada (TC) o la tomografía por emisión de positrones (PET), en ocasiones puede ser complejo en tumores localmente avanzados que obliteran los límites de la UEG. En cualquier caso, todos los tumores de la UEG comparten algunas características morfológicas y tienen similar pronóstico, pero existen diferencias en cuanto a la epidemiología, etiología, distribución y patrón de diseminación linfática, lo que conllevará diferentes estrategias quirúrgicas.
Los tumores Siewert I tienen una epidemiología e histología similar a los adenocarcinomas del esófago distal: predominio de varones, y generalmente historia de reflujo gastroesofágico, predominio de tipo histológico intestinal (de Lauren) y presencia de esófago de Barrett previo. Los tumores Siewert III son similares a los tumores gástricos, con similar proporción del tipo histológico intestinal y difuso, y ausencia de síntomas de reflujo. Se asocian a la presencia de Helicobacter pylori y gastritis atrófica. El predominio de varones no es tan marcado como en el Siewert I3. Los tumores Siewert II no siguen un patrón tan definido.
El propósito de este trabajo es realizar una revisión de la evidencia disponible sobre el empleo y rentabilidad de estas pruebas en el estudio clínico y estadificación de los tumores de la UEG.
Material y métodosRevisión de la literatura restringiendo la búsqueda a los últimos 10 años con el buscador PubMed cruzando los términos «esophagogastric junction» con «cancer», «tumour», «adenocarcinoma», «diagnosis», «staging», «complementary tests», «preoperative explorations», revisión de UpToDate, guías clínicas internacionales como la NCCN y libros de texto como Sleisenger y Cirugía esofagogástrica (Guía clínica de la Asociación Española de Cirujanos).
ResultadosPara el diagnóstico inicial de los adenocarcinomas de la UEG se requiere una endoscopia con biopsias. Tras la confirmación histológica se realizará la estadificación tumoral clínica, crucial para una adecuada estrategia multimodal. Las pruebas complementarias necesarias son: TC toracoabdominopélvico, ultrasonografía endoscópica (USE) y la PET o la PET-TC (ambas integradas). Otras exploraciones complementarias que nos pueden ser de utilidad son: analítica general, tránsito baritado, resección endoscópica de la mucosa (REM) o disección de la submucosa (DES) (para valoración o tratamiento de estadios iniciales) y la laparoscopia o toracoscopia de estadificación1.
La fibrogastroscopia y la biopsia tumoral son las pruebas claves para el diagnóstico de los tumores de la UEG con una sensibilidad del 96%4. El endoscopista debe documentar la localización del tumor respecto a la arcada dentaria y respecto a la UEG, la longitud del tumor, la afectación circunferencial, el grado de obstrucción y la presencia de esófago de Barrett. Generalmente, la endoscopia permite también definir el tipo de tumor de la UEG (Siewert I, II o III), aunque la presencia de una hernia hiatal o los movimientos diafragmáticos durante la respiración lo pueden dificultar5. Algunas técnicas endoscópicas permitirán el estudio más detallado de zonas de displasia o malignidad. La cromoendoscopia convencional usa tinciones (lugol, azul de metileno, ácido acético o índigo carmín) que permiten realzar sutiles cambios en la mucosa para realizar biopsias dirigidas6,7. El mismo objetivo busca la cromoendoscopia electrónica que usa distintos filtros de luz. La imagen de banda estrecha(«narrow band imaging») aumenta la sensibilidad en la detección de displasia en el esófago de Barrett del 85 al 92%8, y el valor predictivo negativo, del 91 al 94%9. La biopsia endoscópica como valoración de la respuesta a la neoadyuvancia ofrece pobres resultados, con una sensibilidad y valor predictivo negativo del 23%, por lo que no se recomienda1.
Tras la confirmación histológica, la TC de tórax, abdomen y pelvis puede ser la técnica de elección para descartar enfermedad metastásica1. La TC informa de metástasis a distancia, infiltración tumoral de órganos vecinos, afectación adenopática, posibles fístulas esofagobronquiales, y aporta también información sobre el estado del parénquima pulmonar y hepático8. La TC ofrece una sensibilidad y especificidad del 52% y 91%, respectivamente, mientras que la PET la ofrece del 71% y 93%, respectivamente8.
La PET y la PET-TC permiten aumentar la sensibilidad en la detección de metástasis a distancia hasta en un 20% más respecto a la TC1, y permiten detectar metástasis tumorales de pequeño tamaño (menores de 1cm). No es útil para determinar la T y limitada para la N, ya que la captación de los ganglios peritumorales y del tumor primario pueden fusionarse en la imagen dificultando su valoración8. En algunos centros se realiza la PET-TC sin contraste intravenoso, lo que puede comprometer el hallazgo de pequeñas metástasis. En tal caso debería realizarse también una TC con contraste intravenoso10. La PET y PET-TC pueden tener también un papel en la reestadificación tras la neoadyuvancia, para definir aquellos tumores que son «respondedores» al tratamiento de inducción quimioterápica11. Se define a los «respondedores» como aquellos que tienen una reducción mayor del 35% en la actividad metabólica, siendo controvertido que esto pueda afectar al pronóstico12-14.
La USE permite el estudio de la profundidad del tumor. Puede distinguir tumores T1 del resto, lo que será crucial para seleccionar los candidatos para tratamiento endoscópico o quirúrgico. Presenta una sensibilidad y especificidad del 81,6% y 99,4%, respectivamente, para los T1; del 81,4% y 96,3% para los T2; del 91,4% y 94,4% para los T3; y del 92,4% y 97,4% para los T415,16. Debe estudiar de forma rutinaria las áreas de drenaje linfático regionales (cN) y no regionales (cM). Esto incluye las áreas peritumoral, paratraqueal, subcarinal, crural, tronco celiaco, vena esplénica, porto-cava y ligamentos gastrohepáticos. Una correcta estadificación deberá documentar el número y localización de los ganglios patológicos, y categorizarlos según los criterios de la AJCC (American Joint Commitee on Cancer): N0 (no hay ganglios sospechosos), N1 (1-2 ganglios patológicos), N2 (3-6 ganglios patológicos), N3 (>6 ganglios patológicos)10. La USE también permite el estudio de metástasis hepáticas cercanas a la curvatura menor. La presencia de ascitis perigástrica es sospechosa de carcinomatosis, en ausencia de otras causas que la justifiquen17. La precisión para la valoración de la T llega al 90%, mientras que para la N está sobre el 80%, y puede aumentar al 92-98% cuando se le añade la punción-aspiración con aguja fina (PAAF) para citología del ganglio5. Se debe reservar la PAAF para la punción de aquellos ganglios que nos cambiarán la actitud terapéutica18. Los tumores estenosantes son una limitación para el estudio ecoendoscópico, dado que el estudio sólo del margen proximal de la estenosis reduce la precisión a menos del 50%. No se debe dilatar el tumor con la finalidad de estadificarlo mejor18. No obstante, los tumores estenosantes que no permiten el estudio ecoendoscópico tienen una elevada probabilidad de ser tumores localmente avanzados. Tumores mayores de 5cm de longitud son predictivos de T3 con una sensibilidad del 89% y especificidad del 92%1. Algunos estudios atribuyen mayor sensibilidad para el estudio de la N a la USE respecto a la TC y la PET19, pero esta prueba no es una buena técnica para evaluar la respuesta a la neoadyuvancia ya que tiende a sobreestadificar la T cuando hay fenómenos inflamatorios, bajando su precisión hasta el 50% en esta situación2. Es incapaz de diferenciar entre tejido tumoral y fibrosis o inflamación, siendo complicado realizar una correcta valoración de las adenopatías tras la neoadyuvancia, debido a las alteraciones que se producen en su apariencia ecográfica1.
Respecto a la laparoscopia de estadificación, su empleo es controvertido y no existe consenso en su uso. La recomendación más amplia se establece en adenocarcinomas de la UEG tipos II y III, T3-4, N+ cuando se planea un tratamiento neoadyuvante, o ante la sospecha de carcinomatosis peritoneal por signos indirectos en otras técnicas diagnósticas2. La laparoscopia diagnóstica o de estadificación debe inspeccionar toda la cavidad peritoneal para descartar metástasis peritoneales o hepáticas. Permite explorar la UEG para evaluar la extensión del tumor, y realizar una citología del lavado peritoneal5. La laparoscopia diagnóstica puede cambiar la actitud terapéutica hasta en un 10-17% de los pacientes. Por otro lado, la ecografía laparoscópica no mejora la estadificación respecto a la laparoscopia sola1.
El tránsito baritado (TEGD) no es una prueba imprescindible ni rutinaria para el diagnóstico ni estadificación de los tumores de la UEG, pero puede ser de utilidad para valorar el tamaño y obstrucción que causa el tumor, y ayuda a localizarlo para poder clasificarlo correctamente como Siewert I, II o III. Tendrá especial relevancia en aquellos tumores estenosantes en que la endoscopia no pueda franquear el tumor2. Puede ser de utilidad también para el estudio de fístulas esofagobronquiales. En estos casos es importante el uso de contraste baritado y no de un agente hidrosoluble hiperosmolar para evitar el riesgo de edema agudo de pulmón y neumonitis8. La REM y la DES son técnicas complementarias a la USE y permiten estudiar en tumores T1 la profundidad de invasión, el grado de diferenciación y la invasión angiolinfática, al resecar el tumor hasta la mucosa (REM) o submucosa (DES). Cuando los márgenes están libres y no se hallan factores de mal pronóstico, la resección puede tener finalidad curativa y ahorrar una cirugía mayor8. La USE no distingue de forma fiable entre Tis y T1. En estos casos es imprescindible realizar una REM o una DES para poder hacer un correcto estudio histológico20.
La resonancia magnética nuclear (RMN) no es una técnica usada rutinariamente en la estadificación de los tumores de la UEG. En general no mejora los resultados de la TC, aunque tras los últimos avances técnicos con la RMN algunos estudios muestran mejorías en la evaluación de la T y la N10. Puede ser de utilidad para el estudio de metástasis hepáticas2.
Además, una vez establecida la resecabilidad del tumor deberá valorarse la operabilidad del mismo basándose en criterios de edad, función ventilatoria, performance status, función cardiovascular, función hepática y estado nutricional21.
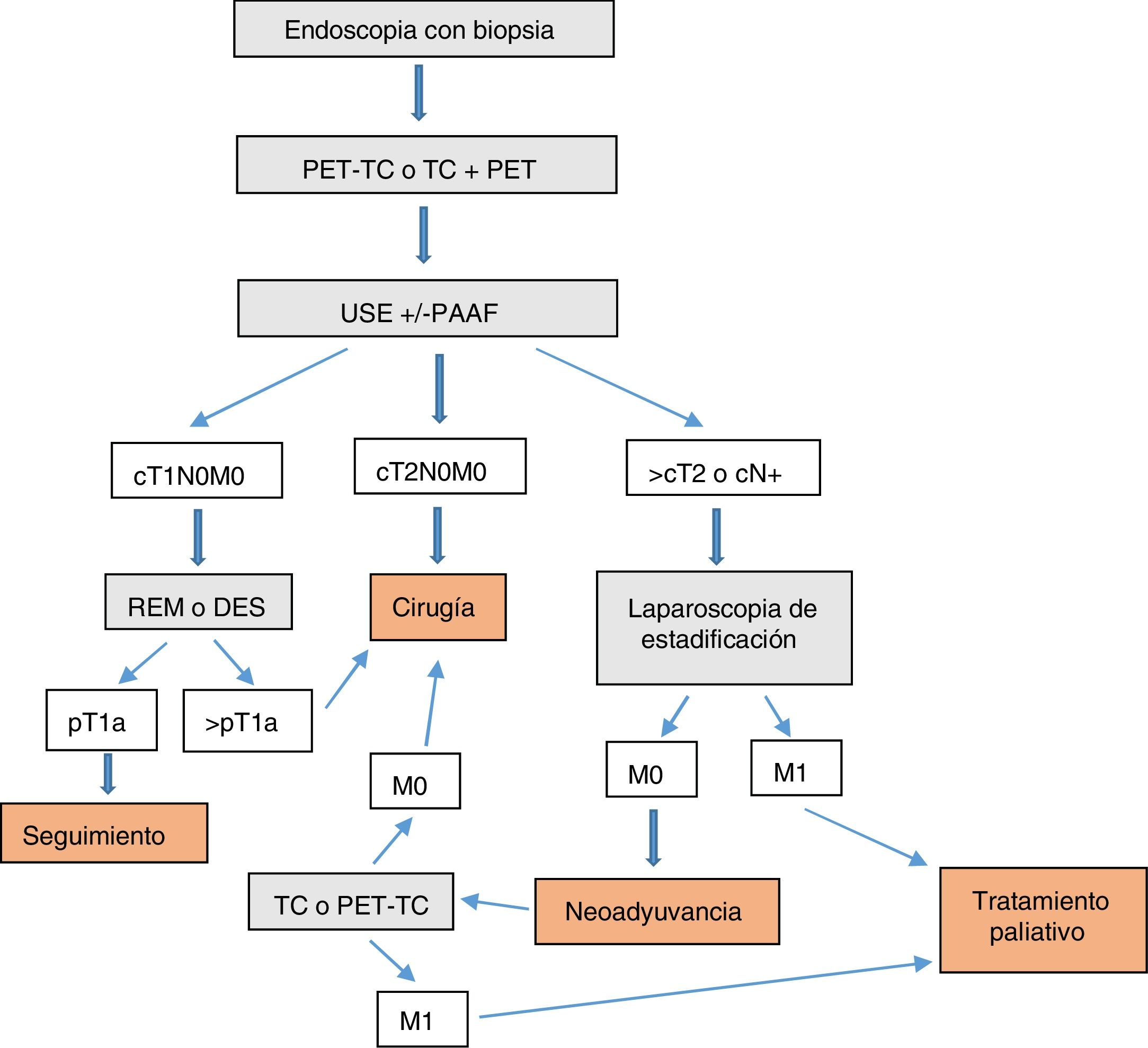
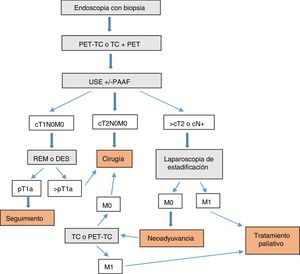
ConclusiónEn nuestra opinión, las exploraciones complementarias que se deberían realizar para diagnosticar y estadificar correctamente los tumores de la UEG son (fig. 1):
- 1.
Endoscopia con biopsia
- 2.
PET-TC o TC+PET (según disponibilidad)
- 3.
USE±PAAF
- 4.
TEGD (opcional)
En tumores T1N0M0, valorar REM o DES como parte del diagnóstico o incluso del tratamiento. En tumores de la UEG tipo Siewert II-III >T2 o N+ valorar laparoscopia de estadificación.
Conflicto de interesesNinguno.
Pere Rebasa y Sandra Montmany.