La presencia de múltiples nódulos pulmonares sintomáticos y uno cardíaco en un niño exigen un diagnóstico y tratamiento urgentes. El diagnóstico de una neoformación cardíaca era difícil hasta hace pocas décadas, y se basaba en un alto índice de sospecha ante signos indirectos, necesitando la angiocardiografía para su confirmación. La ecocardiografía y otros medios de imagen han facilitado la detección de los nódulos cardíacos. Sin embargo, no siempre es fácil acertar con el diagnóstico
Caso clínicoNiño de 12 años con síntomas pulmonares. Diagnosticado de tumor cardíaco con metástasis pulmonares. En nuestro hospital se confirmó la presencia de numerosos nódulos pulmonares. El ecocardiograma detectó un nódulo cardíaco sólido ventricular derecho. La resonancia magnética nuclear confirmó los hallazgos, haciéndose el mismo diagnóstico. La punción-aspiración de un nódulo pulmonar fue diagnóstica: hidatidosis. Fue operado a corazón abierto resecando el quiste cardíaco y tratado con antihelmínticos. Posteriormente se extirparon los quistes pulmonares. Se recuperó el paciente sin complicaciones.
DiscusiónEn este niño, con múltiples nódulos pulmonares y uno cardíaco sólido, se hizo el diagnóstico de tumor cardíaco con metástasis pulmonares; sin embargo, con la historia clínica, los antecedentes y la morfología de los nódulos pulmonares se debió incluir la equinococosis como posible etiología. El cuadro clínico de los quistes hidatídicos cardíacos y de sus complicaciones es muy variable. En estos casos es fundamental la historia clínica y tener un alto índice de sospecha.
ConclusiónEn el diagnóstico diferencial de un nódulo cardíaco sólido, ecodenso, debe incluirse la hidatidosis. El tratamiento de los quistes hidatídicos cardiopulmonares es la cirugía.
The presence of multiple symptomatic pulmonary nodules and one cardiac tumour in a child requires urgent diagnosis and treatment. Until a few decades ago, the diagnosis of a cardiac tumour was difficult and was based on a high index of suspicion from indirect signs, and required angiocardiography for confirmation. Echocardiography and other imaging techniques have also helped in the detection of cardiac neoplasms. However, it is not always easy to make the correct diagnosis.
Clinical caseThe case is presented of a 12 year-old boy with pulmonary symptoms, and diagnosed with a cardiac tumour with lung metastases. The presence of numerous pulmonary nodules was confirmed in our hospital. The echocardiogram detected a solid cardiac nodule in the right ventricle. Magnetic resonance imaging confirmed the findings and the diagnosis. Puncture-aspiration of a lung nodule gave the diagnosis of hydatidosis. He underwent open-heart surgery with cardiac cyst resection and treated with anthelmintics. The lung cysts were then excised, and he recovered uneventfully.
DiscussionThis child had multiple pulmonary nodules and a solid cardiac nodule, and was suspected of having a cardiac tumour with pulmonary metastases. However, given the clinical history, background and morphology of pulmonary nodules, another possible aetiology for consideration is echinococcosis. The clinical picture of cardiac hydatidosis and its complications is highly variable. The clinical history is essential in these cases, as well as having a high index of suspicion.
ConclusionHydatidosis should be included in the differential diagnosis of a solid, echogenic, cardiac nodule. The treatment for cardiopulmonary hydatid cysts is surgical, followed by anthelmintics.
El diagnóstico premortem de una neoformación cardíaca era muy difícil hasta hace pocas décadas1,2. La introducción de la ecocardiografía bidimensional hizo posible su detección1. La resonancia magnética nuclear (RMN) permite definir mejor su morfología y localización; sin embargo, con estos medios de imagen no siempre es fácil hacer un diagnóstico acertado.
Las neoplasias son las enfermedades que con mayor frecuencia provocan la aparición de nódulos simultáneos en el corazón y el pulmón. Los tumores cardíacos primarios en los niños son raros y solo del 8 al 10% son malignos3,4. El mixoma es raro en la infancia1,4 y es el único tumor benigno que produce embolias, es poco frecuente su localización en el ventrículo derecho embolizando a los pulmones5–7. Entre las neoplasias cardíacas primarias malignas, que pueden desarrollarse en el ventrículo derecho y producir metástasis pulmonares, tenemos los rabdomiosarcomas y a los angiosarcomas que son raros en la infancia3,8,9. Los tumores cardíacos malignos secundarios a metástasis de cánceres de otra localización son entre el 20-40% más frecuentes que los cardíacos primarios3,9.
Los quistes hidatídicos pueden implantarse en el corazón2,10,11 y dar imágenes sólidas en la ecografía simulando tumores12–15. Los quistes situados en el ventrículo derecho pueden producir embolismo y diseminación pulmonar13.
El objetivo de este artículo es presentar el caso de un niño en el que se descubrieron múltiples nódulos pulmonares y uno cardíaco sólido, ecodenso, y revisar los errores cometidos en el diagnóstico inicial, así como su tratamiento quirúrgico una vez confirmada la etiología de sus lesiones.
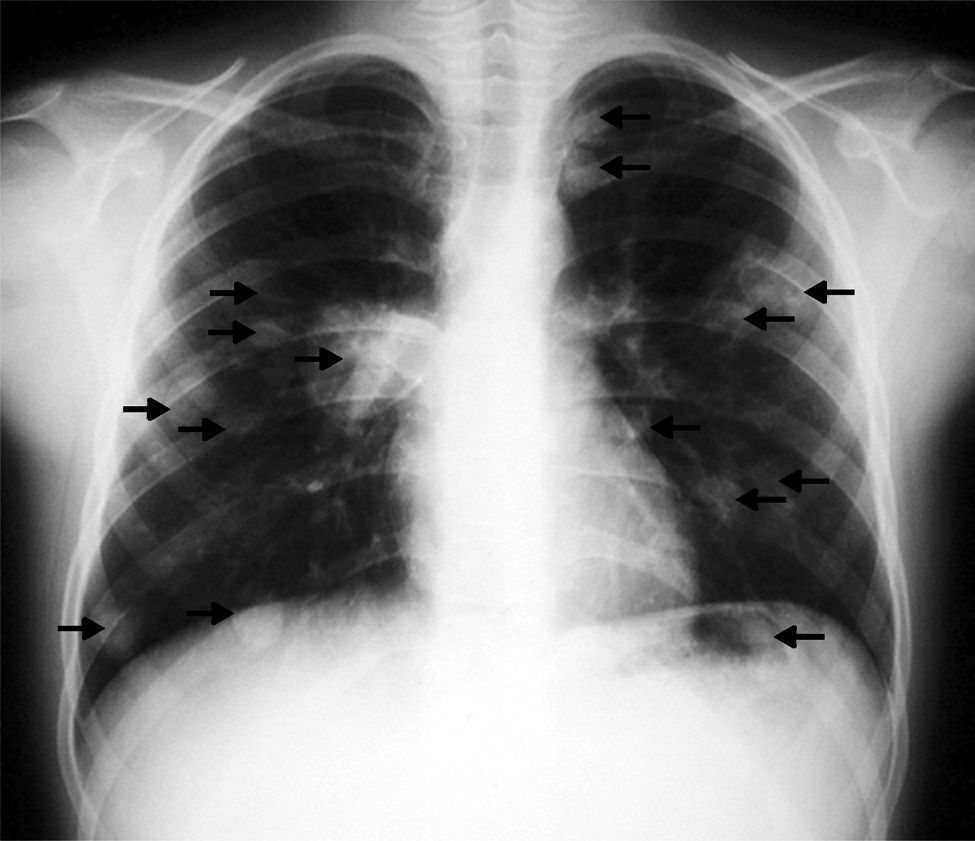
Caso clínicoNiño rumano de 12 años, residente en España desde hacía año y medio. Acudió al servicio de urgencias por presentar: tos con expectoración, a veces hemoptóica, y dolor en el hemitórax izquierdo (atribuido a una caída desde un árbol); en los días previos a la consulta, presentó fiebre. La exploración física fue normal, excepto una temperatura de 39.5°C. En los análisis de laboratorio se descubrió una leucocitosis moderada, los hemocultivos fueron negativos, así como los análisis para detectar tuberculosis o infecciones por hongos. En la radiografía de tórax se apreciaron múltiples nódulos en ambos pulmones. En la tomografía computada (TAC) torácica se encontraron numerosos nódulos de distintos tamaños en los 2 pulmones.
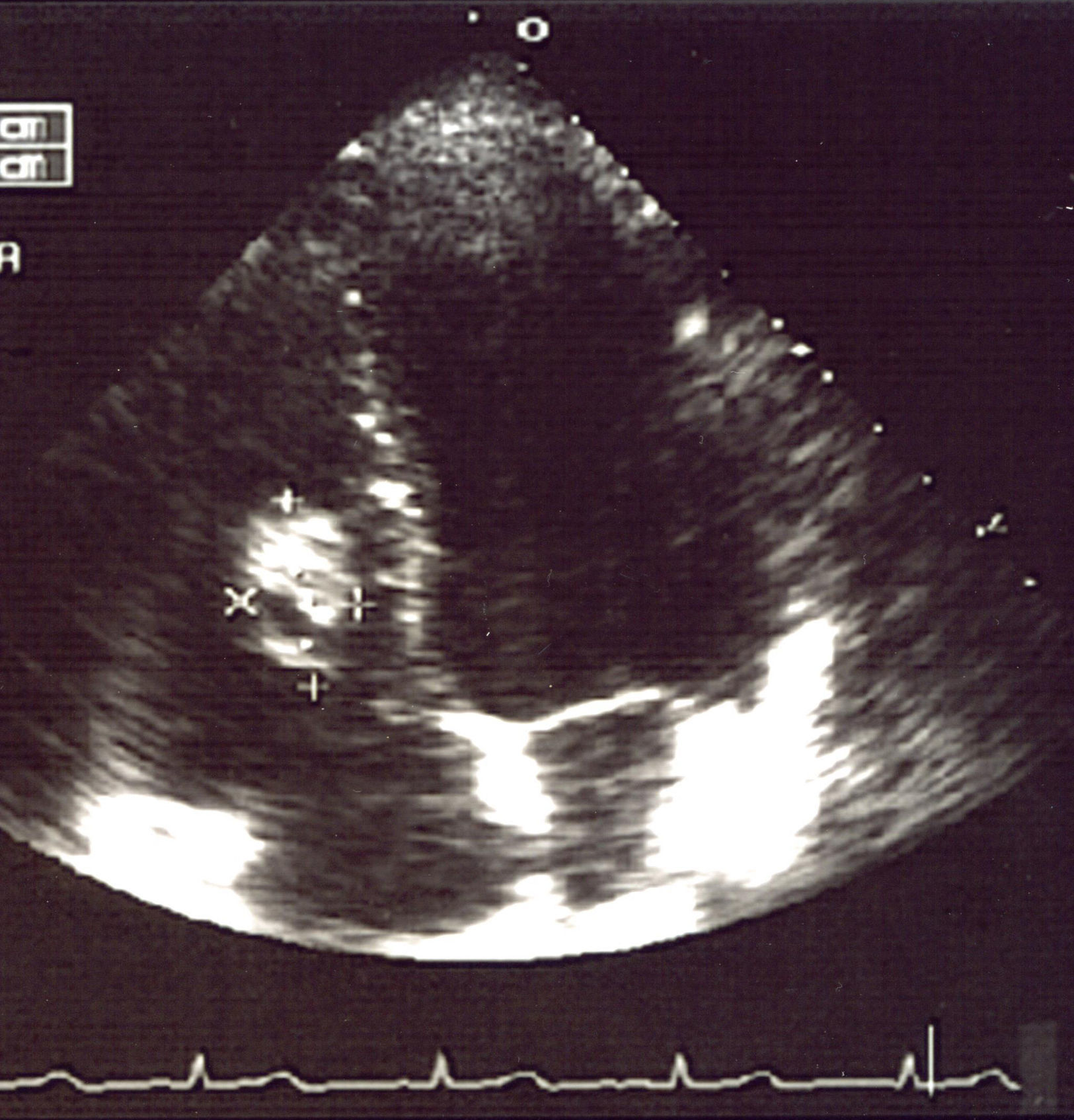
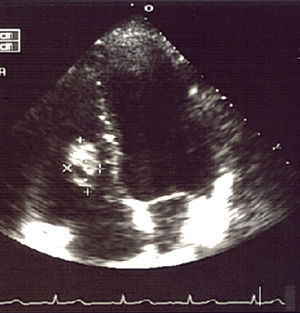
Se hizo una punción con aguja fina de uno de los nódulos, cuyo resultado fue compatible con un proceso inflamatorio inespecífico. En el ecocardiograma se descubrió un nódulo de aproximadamente 3cm en el tabique interventricular derecho.
Ante la aparición de un infiltrado parahiliar derecho se comenzó con tratamiento antibiótico con los diagnósticos de tumor cardíaco con metástasis pulmonares y neumonía asociada. Razón por la cual es remitido al servicio de oncología pediátrica para su estudio y tratamiento.
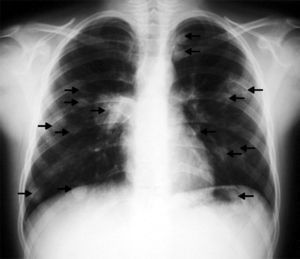
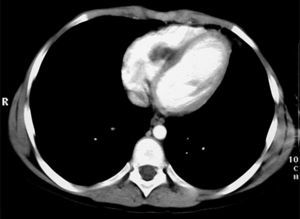
Las pruebas realizadas dieron resultados parecidos a los previos; en la radiografía de tórax (fig. 1) se observaron múltiples imágenes nodulares en ambos pulmones, área con aumento de densidad en la región parahiliar derecha. En el ecocardiograma (fig. 2) se identificó un nódulo de mayor ecogeneidad que el miocardio de 26×18mm situado en el lado derecho del tabique interventricular que afecta al músculo papilar anterior, con lo que se establece el diagnóstico diferencial entre sarcoma, mixoma, linfoma o vegetación endocardítica.
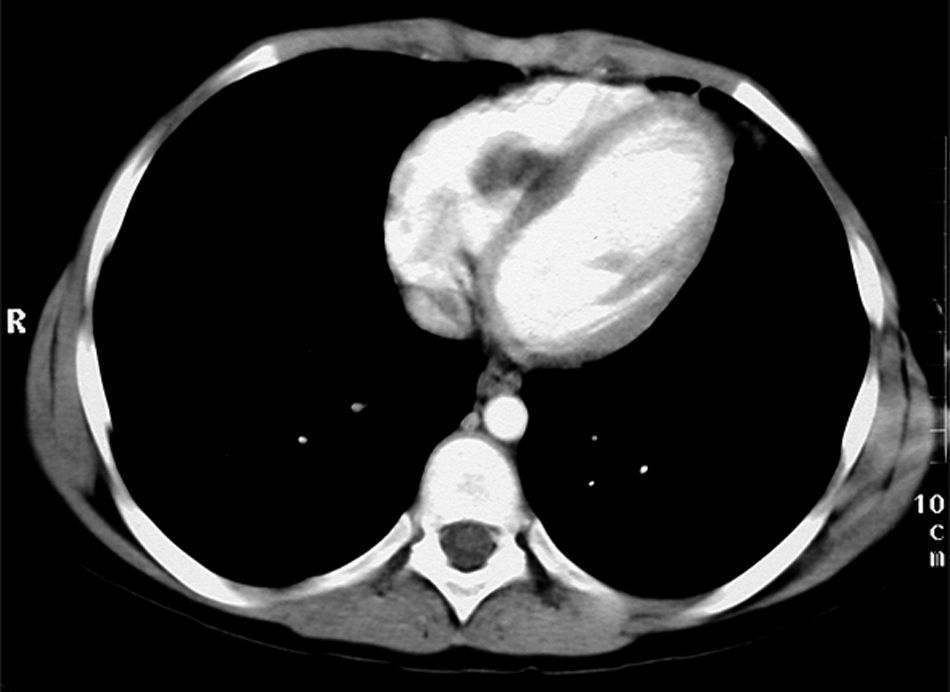
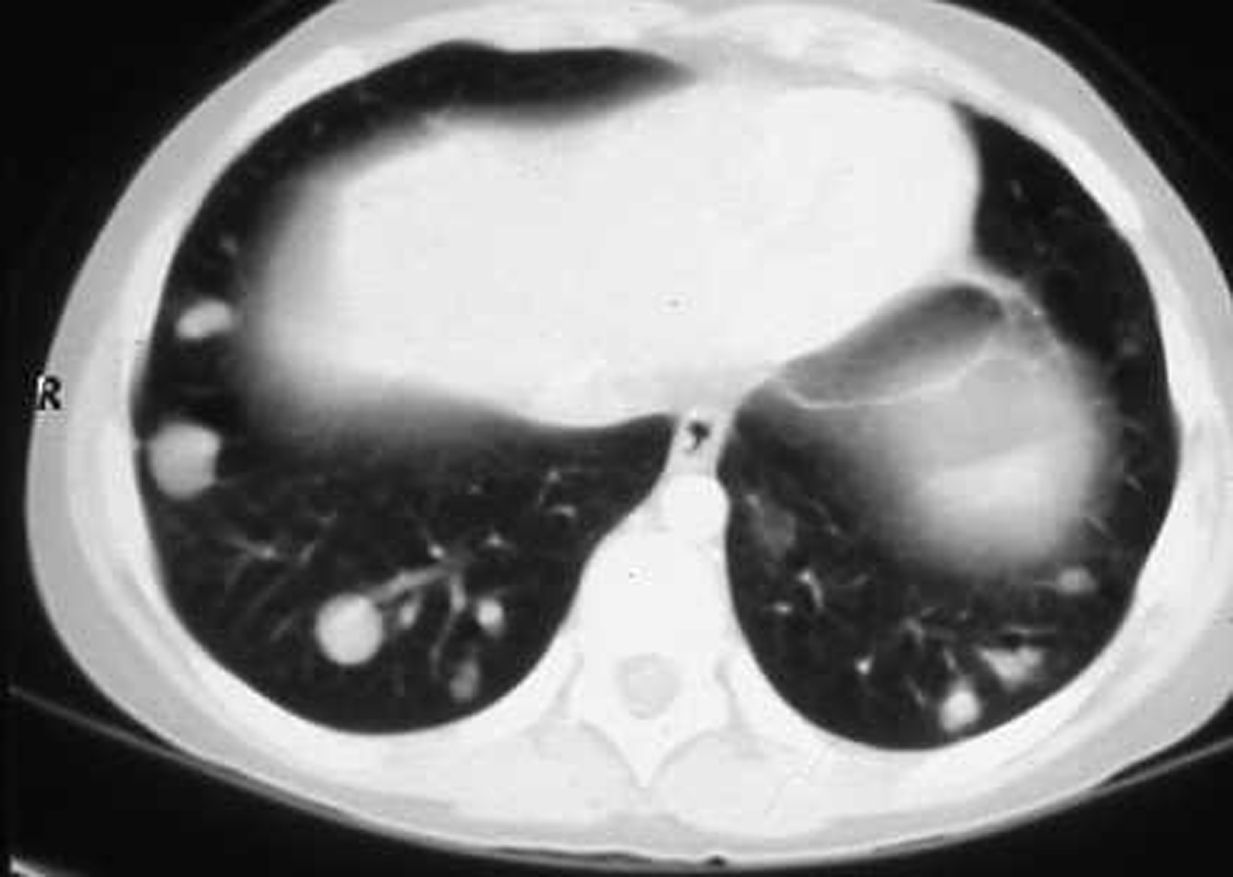
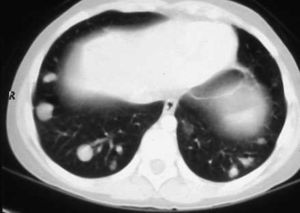
En la RMN cardíaca (fig. 3) se observó en el ventrículo derecho un nódulo de 26mm de diámetro adherido al tabique interventricular. En la RMN torácica (fig. 4); se identifican nódulos pulmonares múltiples de distintos tamaños con predominio en las bases; así como condensación pulmonar en el lóbulo superior derecho, Con el diagnóstico clínico de posible tumor cardíaco con metástasis pulmonares se decidió obtener una biopsia por punción de uno de los nódulos pulmonares. Bajo control tomográfico por TAC se le practicó una punción con aspiración de un nódulo pulmonar izquierdo sin incidencias, y el informe anatomopatológico reveló la presencia de numerosos escólices en los que se reconoce la cabeza con ganchos refringentes y membranas anhistas intensamente PAS positivas; se hizo el diagnóstico de hidatidosis. Una serología fue positiva para equinococosis. Se añadió albendazol al tratamiento antibiótico. Resuelta la infección pulmonar se planteó la resección quirúrgica, en primer lugar del nódulo cardíaco a través de una ventriculotomía derecha, dada su localización inferior y la posible afectación del músculo papilar anterior de la tricúspide.
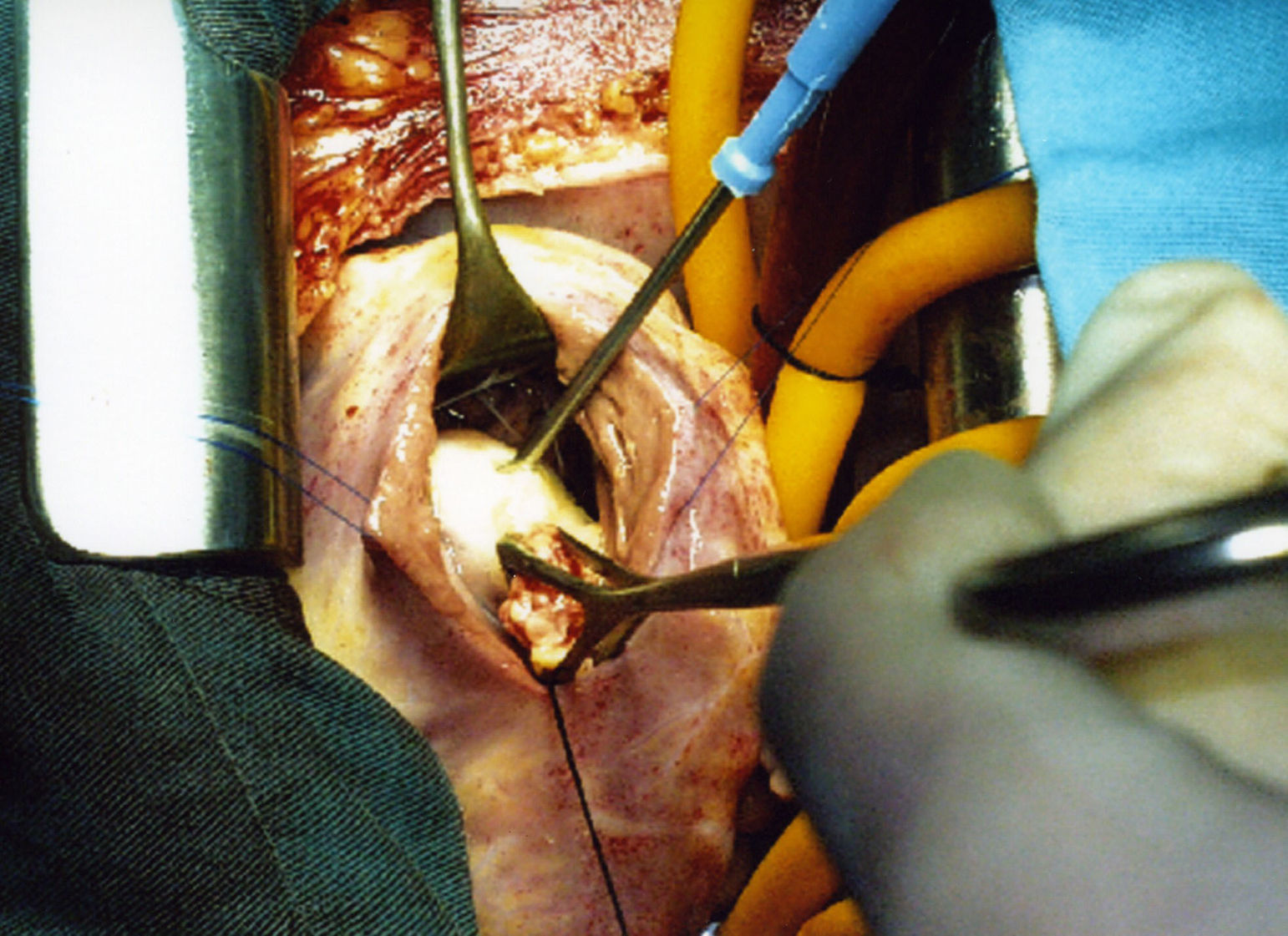
El procedimiento quirúrgico se realizó con anestesia general con bloqueo de los receptores de histamina. Esternotomía media; bajo circulación extracorpórea y cardioplejía hemática, a través de una ventriculotomía transversa derecha, se procedió a una punción-aspiración, con inyección intraquística de suero hipertónico. La resección del quiste tuvo lugar con legrado del septum. Se procedió a la reimplantación de un grupo de cuerdas tendíneas de la valva septal de la tricúspide que se insertaban en el polo superior del quiste y se afectaron con la resección.
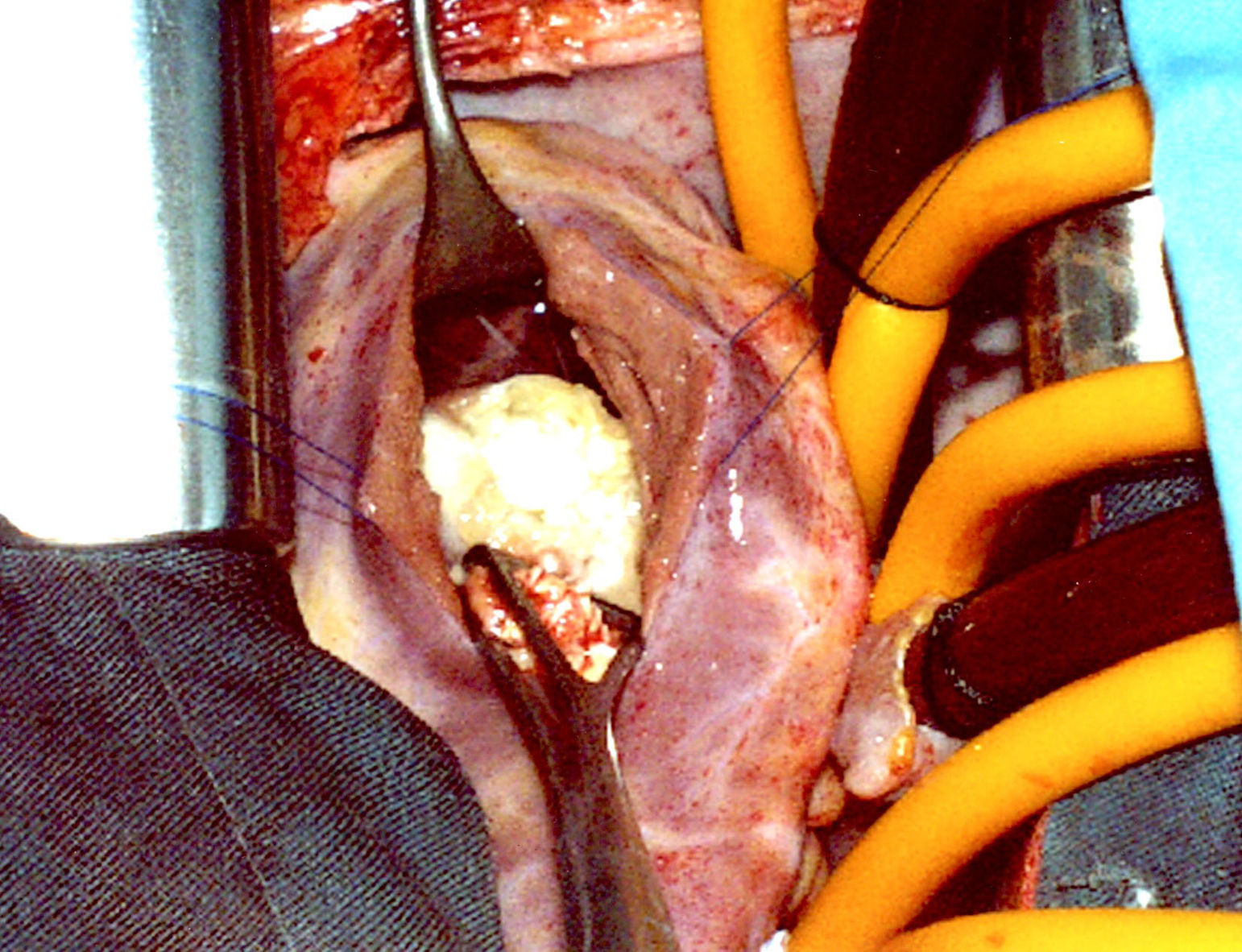
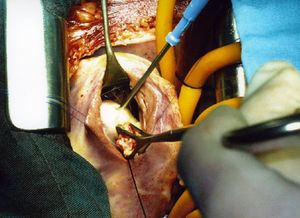
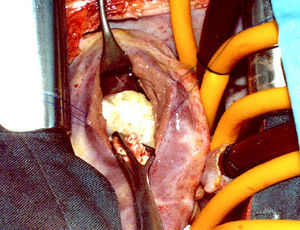
Se encontró una formación ovoidea de 25×15mm en la parte inferior del septum interventricular, limitada por la banda septal de la cresta supraventricular y el fascículo arqueado, situada por debajo del músculo papilar anterior sin afectarlo (fig. 5). Era de color blanco nacarado y de consistencia firme en los 2/3 inferiores, en la parte superior sobresalía un tejido granulomatoso amarillento, blando. Del interior del quiste se extrajeron múltiples vesículas pequeñas, de 5-6mm, de color blanco intenso que contenían líquido claro (fig. 6). El nódulo profundizaba unos 6mm en el tabique del septum interventricular. El diagnóstico final fue de quiste hidatídico fisurado.
La evolución postoperatoria fue excelente por lo que se le dio de alta hospitalaria en buenas condiciones generales, con tratamiento con albendazol.
En la revisión a los 6 meses el estudio ecocardiográfico fue normal, sin insuficiencia tricuspídea y con movilidad normal del tabique interventricular. A los 6 meses de la operación cardíaca se resecaron por toracotomía los quistes pulmonares izquierdos, extirpándose 14, uno roto a la vía aérea en el lóbulo superior, haciéndose una resección atípica a este nivel. Un mes después fue intervenido extirpándose numerosos quistes del pulmón derecho, 2 comunicados a la vía aérea. Ninguno de los quistes pulmonares tenía parásitos vivos.
Las evoluciones postoperatorias fueron buenas. En la revisión al año de las intervenciones pulmonares el paciente continuaba asintomático, en la TAC se apreciaron secuelas cicatriciales pleuropulmonares, un nódulo de 0.6mm en el pulmón izquierdo y otros residuales pequeños en el lóbulo inferior derecho, presentes en los estudios preoperatorios y sin cambios desde entonces.
DiscusiónEn el diagnóstico diferencial de un nódulo cardíaco intracavitario sólido, ecodenso, acompañado de múltiples nódulos pulmonares deben excluirse los tumores que no embolizan y los que no producen metástasis pulmonares. Los tumores cardíacos primarios en la infancia son raros, y solo el 8-10% son malignos3,4. El único tumor cardíaco benigno que produce embolias es el mixoma, que es raro en niños1,4; en una serie de 49 tumores cardíacos se encontraron 33 mixomas, solo 4 en niños con uno en el ventrículo derecho5. El 86% de los mixomas se ubican en la aurícula izquierda, y el 3% en el ventrículo derecho6,7.
El cuadro clínico que presentaba el niño era compatible con embolismo pulmonar; sin embargo, las imágenes pulmonares descartaron este diagnóstico. En este caso la morfología del nódulo cardíaco, su inmovilidad, su localización y su coexistencia con múltiples nódulos pulmonares esféricos sin hipertensión pulmonar excluían el mixoma.
De las neoplasias malignas cardíacas primarias en la infancia solo los rabdomiosarcomas y los angiosarcomas se localizan en las cavidades cardíacas derechas y evolucionan con metástasis o embolias pulmonares. Los rabdomiosarcomas tienden a crecer en el septum en los jóvenes8. Su evolución es rápida, produciendo complicaciones obstructivas, y en el 50% de los casos invasión pericárdica3,8. Los angiosarcomas son los tumores cardíacos malignos primarios más frecuentes en los adultos, siendo raros en los niños, el 80% se localizan en la aurícula derecha produciendo metástasis pulmonares3.
Estos tumores tienen un crecimiento rápido induciendo insuficiencia cardíaca y arritmias, invaden el pericardio produciendo derrames hemáticos y se acompañan de fiebre, anorexia y deterioro general. Su pronóstico es fatal a corto plazo3,9. Nuestro enfermo no tenía síntomas ni signos cardíacos, su estado general era bueno y el tamaño del nódulo cardíaco no había cambiado desde su descubrimiento.
Las neoplasias cardíacas secundarias a metástasis de tumores malignos de otra localización son del 20% al 40% más frecuentes que los tumores cardíacos malignos primarios3,9. En este niño no se habían detectado tumores, desechándose que el nódulo cardíaco y los pulmonares fueran metastásicos. Se descartaron las embolias pulmonares múltiples con un trombo retenido en el ventrículo derecho o una vegetación endocardítica con embolias pulmonares por la falta de sintomatología de disnea, fallo cardíaco derecho o de un cuadro séptico importante.
La historia clínica del hospital de origen mencionaba en los antecedentes: «Tiene contacto directo con ovejas, cabras y perros», averiguándose que los padres eran pastores de ganado ovino y lo fueron también en Rumanía, en donde el niño creció rodeado de ovejas y perros; con estos antecedentes se debería haber pensado en una hidatidosis, sobre todo por las imágenes pulmonares, ya que el nódulo cardíaco no tenía aspecto quístico.
La ecocardiografía es fundamental en el diagnóstico de los quistes hidatídicos cardíacos, siendo pioneros en su estudio autores españoles10,11, pero los quistes intracavitarios pueden tener un aspecto sólido con apariencia de tumor lo que dificulta la certeza del diagnóstico12–14. Oliver et al.11 estudiaron 15 hidatidosis cardíacas encontrando este tipo de imagen en 4 quistes septales, similares al nuestro, 2 fisurizados con diseminación de la equinococosis. En nuestro enfermo la fisuración del quiste pudo contribuir a dar la imagen de nódulo macizo siendo diagnosticado de tumor, como ha pasado en otros casos. En una enferma de la Mayo Clinic14 se hizo el diagnóstico de angiosarcoma cardíaco y el quiste se descubrió en la cirugía. Berincioglu et al.15 publicaron el caso de un niño diagnosticado de tumor ventricular izquierdo por ecocardiografía, TAC, RMN y ecotransesofágico, llegándose al diagnóstico de hidatidosis al hacer una punción-aspiración intraoperatoria. Por todo ello, debe incluirse la equinococosis en el diagnóstico diferencial de un nódulo cardíaco sólido, ecodenso11,12,14,15.
Los quistes hidatídicos, producidos principalmente por Echinococcus granulosus, son una parasitosis frecuente en las regiones con abundancia de ganado ovino. En España, donde fue endémica, ha reaparecido con la inmigración12 y al relajarse el control y la prevención16. Existen numerosas publicaciones sobre equinococosis cardíaca10–12,17, de estos solo del 0.5% al 2% de los quistes anidan en el corazón, siendo la implantación más frecuente la del ventrículo izquierdo, seguida del septum interventricular13,14, y suelen coexistir con quistes en otras localizaciones2.
La hidatidosis cardíaca en niños es rara18, sin embargo los quistes ubicados en el lado derecho del corazón se han asociado con embolismo pulmonar19,20 y la hidatidosis pulmonar secundaria a la fisuración con diseminación del parásito13. Estos quistes terminan produciendo complicaciones graves, e incluso mortales, como anafilaxia, arritmias o embolismo pulmonar masivo2,13,20,21.
El tratamiento de elección en los quistes intracardíacos sigue siendo la resección quirúrgica bajo circulación extracorpórea2,13,21–23. No obstante el grado de dificultad de la cirugía puede ser elevado, en el caso de García Ortiz2 se realizó una cardiomioplastia con diafragma, para cerrar el orificio resultante de la resección del quiste. En la anestesia deben bloquearse los receptores de histamina para evitar la anafilaxia. Durante la operación deben tomarse medidas para evitar la diseminación del parásito. La punción-aspiración del quiste, seguida de la inyección de un líquido escolicida antes de abrirlo, ayuda a prevenir la diseminación de parásitos vivos, el suero salino al 20-30% es eficaz y no daña los tejidos cardíacos13, ya que la utilización de otros líquidos13,18 puede producir daños graves. Lo ideal es hacer una pericistectomía, pero según su localización es prudente dejar parte de la periquística fibrosa para no provocar daños estructurales, en los septales bloqueo auriculoventricular o comunicación interventricular13,23,24. Si el quiste cardíaco se acompaña de otros pulmonares accesibles se pueden extirpar en la misma operación25,26. En nuestro caso, al ser múltiples y dispersos, se prefirió resecarlos en distintas intervenciones. El tratamiento quirúrgico debe complementarse con la administración de albendazol en el postoperatorio.
ConclusionesLa hidatidosis cardíaca es rara y puede manifestarse simulando otras enfermedades, por lo que debe incluirse en el diagnóstico diferencial de los tumores cardíacos.
El tratamiento de los quistes hidatídicos cardíacos es la cirugía a corazón abierto, seguida del tratamiento antihelmíntico correspondiente. En este caso el diagnóstico inicial equivocado complicó el manejo del enfermo. Con una mayor atención a los antecedentes en la historia clínica y un diagnóstico diferencial adecuado, teniendo en cuenta otras enfermedades que fueron frecuentes en nuestro medio, se hubiese hecho un diagnóstico inicial correcto.
La hidatidosis es una parasitosis que produce complicaciones graves, por lo que es necesario un mayor esfuerzo en su prevención.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.