Los tumores del estroma gastrointestinal (GIST) son los sarcomas más comunes del tracto digestivo. Las localizaciones más frecuentes son estómago (60-70%) e intestino delgado (25-30%).
Los síntomas más comunes son hemorragia de tubo digestivo, dolor abdominal, tumor abdominal y obstrucción intestinal. Estos dependen de la localización y del tamaño del tumor. El diagnóstico es histológico. El 95% de los GIST son positivos para CD117.
Casos clínicosEstudio observacional y descriptivo en el que se reportan 5 casos de GIST de yeyuno e íleon, que tuvieron como manifestación clínica principal hemorragia de tubo digestivo de origen oscuro. El periodo de tiempo al diagnóstico varió de 1 a 84 meses. La endoscopia, en todos los pacientes, no fue concluyente y el diagnóstico se hizo por angiotomografía abdominal. El tratamiento incluyó, en todos los casos, resección.
ConclusionesLos GIST pueden tener formas de presentación y síntomas inusuales como la hemorragia de origen oscuro. La tomografía con medio de contraste y la angiografía son herramientas que han demostrado ser útiles para el diagnóstico certero de este tipo de lesiones.
The gastrointestinal stromal tumours (GIST) are the most common soft tissue sarcomas of the digestive tract. They are usually found in the stomach (60-70%) and small intestine (25-30%) and, less commonly, in the oesophagus, mesentery, colon, or rectum.
The symptoms present at diagnosis are, gastrointestinal bleeding, abdominal pain, abdominal mass, or intestinal obstruction. The type of symptomatology will depend on the location and size of the tumour. The definitive diagnosis is histopathological, with 95% of the tumours being positive for CD117.
Clinical casesThis is an observational and descriptive study of 5cases of small intestinal GIST that presented with gastrointestinal bleeding as the main symptom. The period from the initial symptom to the diagnosis varied from 1 to 84 months. The endoscopy was inconclusive in all of the patients, and the diagnosis was made using computed tomography and angiography. Treatment included resection in all patients. The histopathological results are also described.
ConclusionGIST can have multiple clinical pictures and unusual symptoms, such as obscure gastrointestinal bleeding. The use of computed tomography and angiography has shown to be an important tool in the diagnosis with patients with small intestine GISTs.
Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimatosos más comunes del tracto gastrointestinal: representan el 82% del total. Su incidencia anual es de aproximadamente 6.8 pacientes por millón de habitantes, con una ligera prevalencia en hombres. Estos tumores pueden localizarse en cualquier parte del tracto digestivo, desde el esófago hasta el recto. La mayoría se localizan en estómago (60-70%) e intestino delgado (25-30%)1,2.
Los síntomas que producen son inespecíficos y se relacionan con su localización y el tamaño del tumor; el signo más común es la hemorragia de tubo digestivo en el 50% de los casos. Otros síntomas descritos son dolor abdominal, tumor abdominal y obstrucción intestinal3.
Histológicamente se describen 3patrones: células fusiformes (70%), células epitelioides (20%) y patrón mixto4. Característicamente, los GIST tienen un perfil inmunohistoquímico específico. Aproximadamente el 95% de estos son positivos para CD117, aunque se describen otros marcadores presentes en menor porcentaje5.
Los factores pronósticos más importantes son el índice mitótico, el tamaño del tumor y la localización, con mejor pronóstico para aquellos localizados en el estómago3,5.
El objetivo de este trabajo es presentar 5casos de pacientes con diagnóstico de GIST de intestino delgado, cuya presentación clínica fue hemorragia de tubo digestivo de origen oscuro.
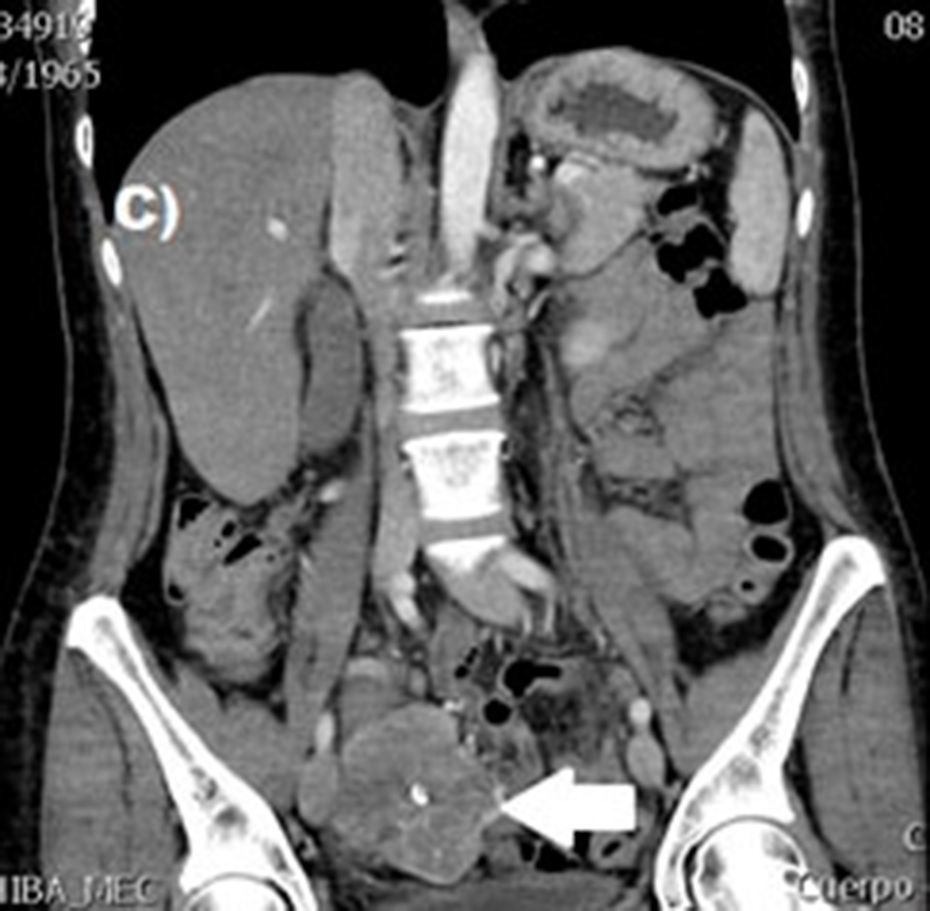
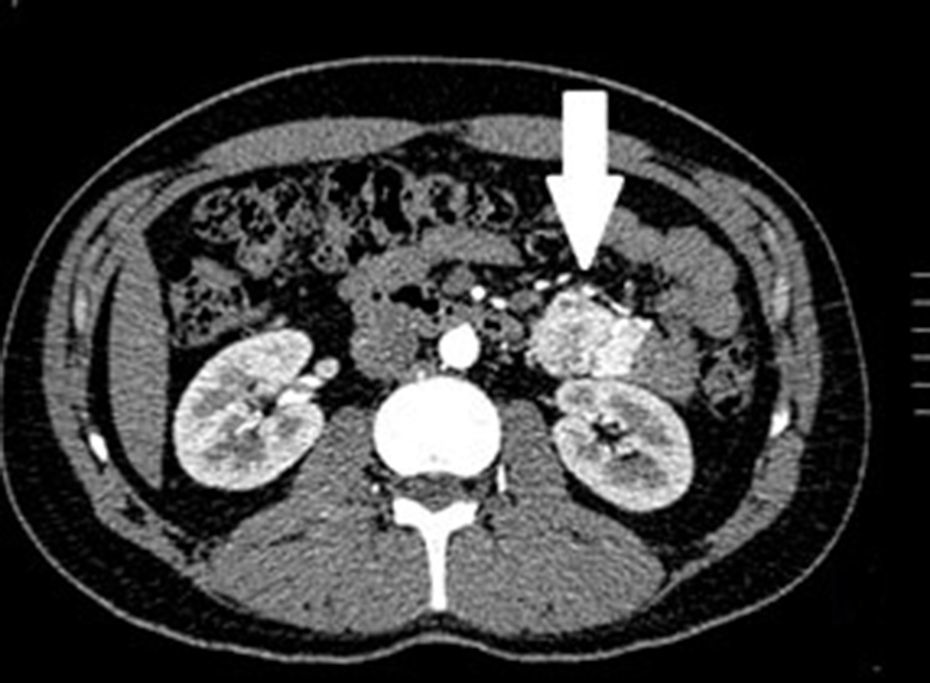
Casos clínicosSe trata de un estudio observacional, descriptivo de serie de casos, en el que se estudió a 5pacientes con diagnóstico de GIST en un periodo de 4años. El promedio de edad fue 53.2 años (rango 36 a 65 años). Tres pacientes fueron hombres y 2 mujeres. Tres de los tumores se localizaron en yeyuno y el resto en íleon (fig. 1). Todos los casos se presentaron con hemorragia de tubo digestivo de origen oscuro. El tiempo al diagnóstico fue variable, con un promedio para el diagnóstico de 43.4 meses (1-84 meses). El 100% de los pacientes fueron estudiados, de manera inicial, con estudios endoscópicos que incluían panendoscopia, colonoscopia o cápsula endoscópica; sin embargo, no pudo determinarse, de manera concluyente, el sitio de hemorragia. El origen de esta fue determinado, en todos los casos, a través de angiotomografía abdominal posterior a los estudios endoscópicos.
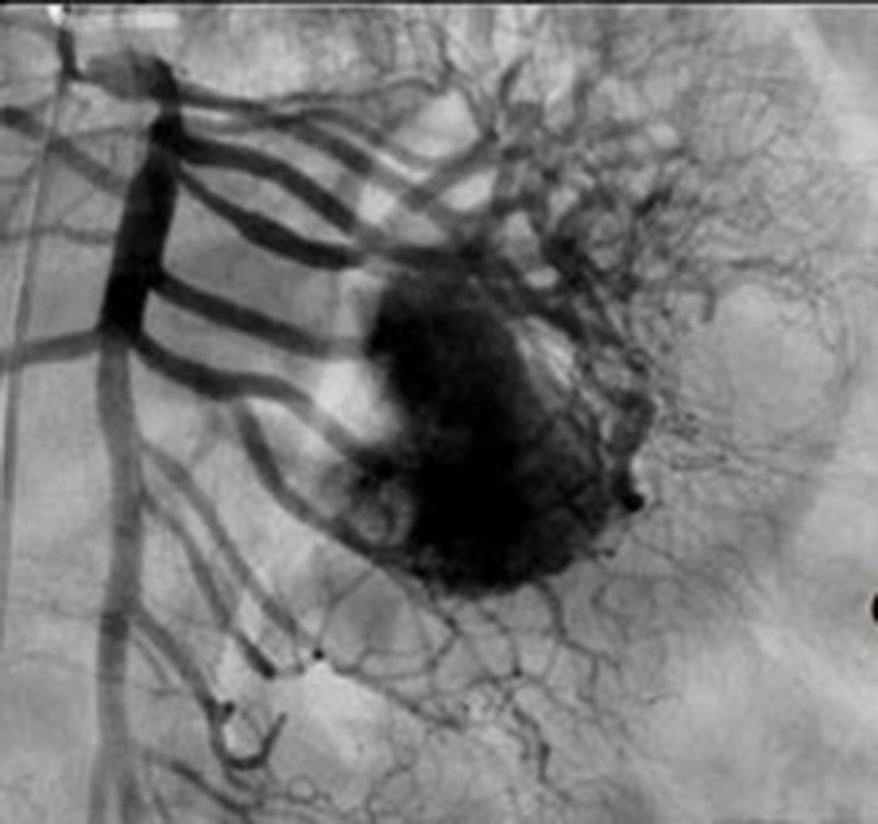
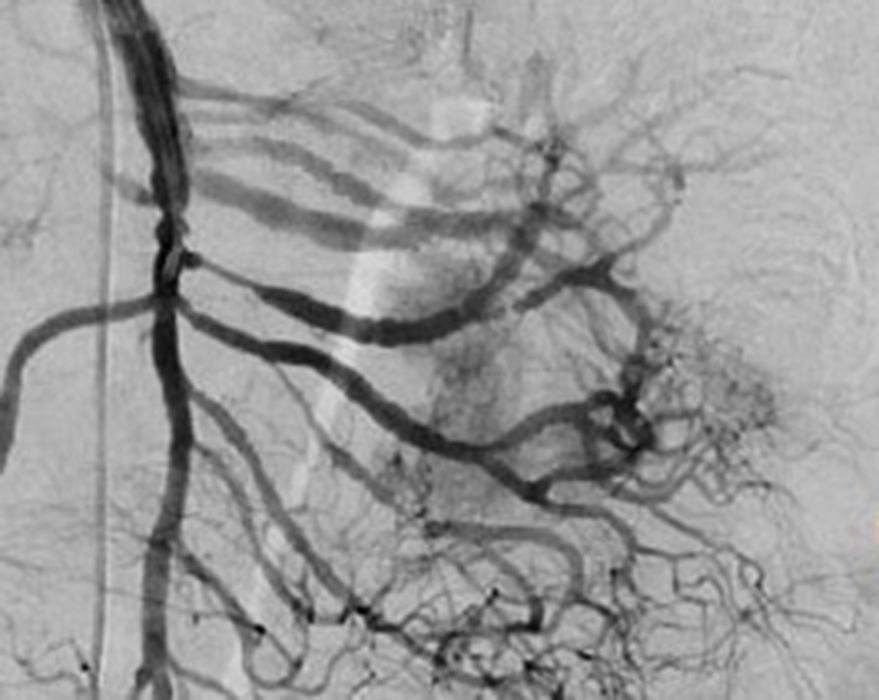
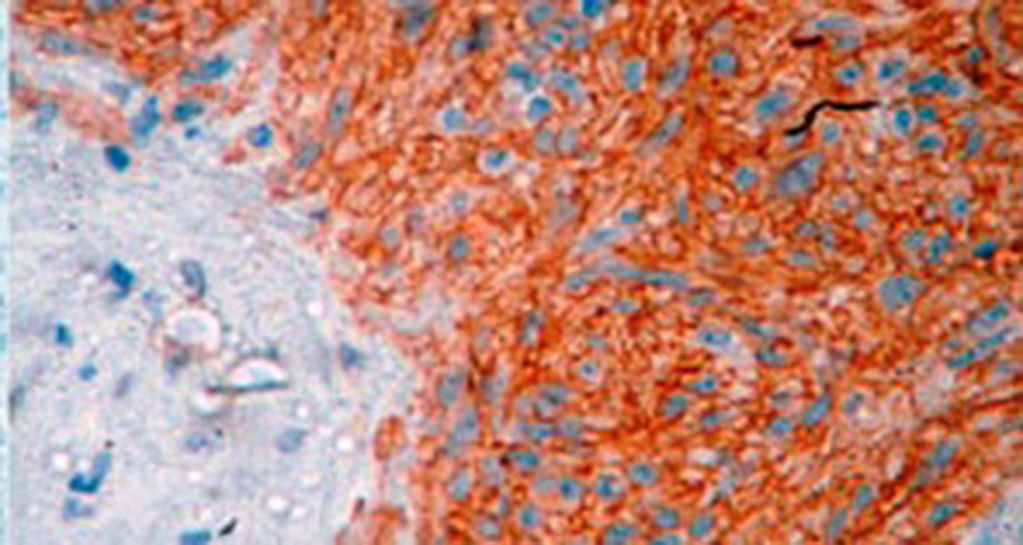
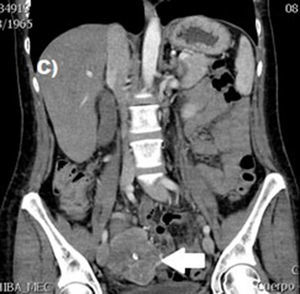
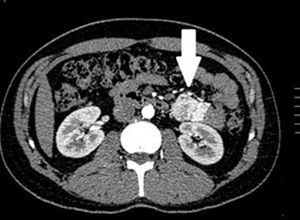
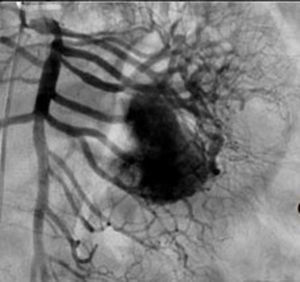
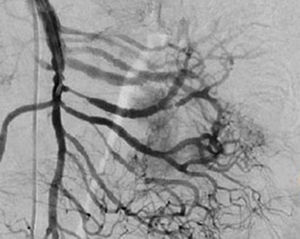
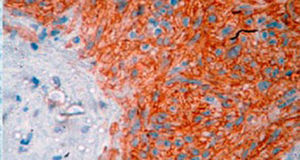
El tratamiento varió de acuerdo con las características individuales del tumor y la localización. En todos los pacientes se realizó resección intestinal. A un paciente (fig. 2), de forma preoperatoria, se le realizó una embolización selectiva para controlar la hemorragia y fue intervenido el día siguiente (figs. 3 y 4). Se realizó procedimiento derivativo (ileostomía) únicamente en un paciente. La evolución fue buena en la totalidad de los pacientes y se mantienen actualmente con manejo quimioterápico. Los datos individuales de los pacientes se resumen, de forma individual, en la tabla 1. El diagnóstico definitivo fue corroborado por estudio histopatológico (fig. 5).
Características clínicas y diagnósticas de pacientes
| Edad | Sexo | Localización | Signos | Tiempo de evolución en meses | Estudios endoscópicos | Método diagnóstico | Tratamiento | Histología | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| 36 | M | Yeyuno | Hematoquecia Hematemesis Melena | 24 | Panendoscopia Colonoscopia | Angio-TC | Embolización selectiva Resección intestinal Anastomosis | 3cm eje mayor Sin mitosis CD117/CD34 + | Buena QT imatinib |
| 60 | F | Yeyuno | Melena | 36 | Panendoscopia Enteroscopia Cápsula endoscópica Colonoscopia | Angio-TC | Resección intestinal Anastomosis | 4cm eje mayor 3 mitosis×50 CSF | Buena QT imatinib |
| 51 | M | Yeyuno | Melena | 72 | Panendoscopia Enteroscopia Colonoscopia | Angio-TC | Resección intestinal Anastomosis | 6.8cm eje mayor 1 mitosis×50 CSF Angiodisplasia CD117/CD34+ | Buena |
| 65 | M | Íleon | Hematoquecia | 84 | Colonoscopia | Angio-TC | Resección intestinal Ileostomía | 4.5cm eje mayor 3 mitosis×50 CSF | Buena |
| 54 | F | Íleon | Hematoquecia | 1 | Panendoscopia Enteroscopia Cápsula endoscópica Colonoscopia | Angio-TC | Resección intestinal Anastomosis | 5cm eje mayor 4 mitosis×50 CSF | Buena QT imatinib |
Angio-TC: angiotomografía; CSF: campos a seco fuerte; QT: quimioterapia.
Se define como hemorragia de tubo digestivo de origen oscuro a aquella que persiste o recurre posteriormente a panendoscopia y colonoscopia negativas, que puede presentarse como sangrado oculto en heces, anemia ferropénica o hemorragia recurrente manifestada con melena o hematoquecia6. La etiología varía dependiendo de la edad del paciente. El diagnóstico de este tipo de hemorragia constituye un reto diagnóstico para el gastroenterólogo y un reto terapéutico para el cirujano6,7.
De las causas de hemorragia de tubo digestivo de origen oscuro, los tumores de intestino delgado constituyen del 5 al 10%. Los leiomiomas y GIST son los tumores más frecuentemente asociados a esta sintomatología6.
La presentación más común de los GIST es la hemorragia de tubo digestivo en forma aguda o crónica, y las manifestaciones son dependientes de la localización del tumor7. Una característica particular que se observó en este estudio fue que el 80% de los pacientes presentaron antecedentes de hemorragia de tubo digestivo alto o bajo protocolizados por al menos un año (con un promedio de 3.6 años y rango de un mes hasta 7 años) antes de identificar el origen de la hemorragia, lo que cumple con criterios para hemorragia de tubo digestivo de origen oscuro.
Manrique y Degrate comentan que, en los casos de hemorragia de tubo digestivo secundarios a GIST identificados posterior a la resección y al estudio patológico y de inmunohistoquímica, estos tumores deben ser considerados como causa del sangrado7,8.
A fin de complementar el estudio de pacientes con hemorragia de origen oscuro, se hace uso de estudios endoscópicos y radiológicos para determinar la localización y tamaño del tumor, además de para descartar complicaciones asociadas, como la enfermedad metastásica.
Los procedimientos endoscópicos tienen gran importancia en el diagnóstico. Existen múltiples opciones con sensibilidad y especificidad diferentes y la selección del tipo de procedimiento dependerá de las manifestaciones clínicas, sospecha diagnóstica o falla diagnóstica de otros estudios. En cuanto a la hemorragia de tubo digestivo de origen oscuro, la Sociedad Americana de Endoscopia Gastrointestinal recomienda un algoritmo diagnóstico específico donde se plantea, de primera instancia, la realización de endoscopia alta o colonoscopia y, en caso de tener resultados negativos, se recomienda la realización de cápsula endoscópica, angiotomografía o enterografía por tomografía9. De los estudios endoscópicos, la cápsula endoscópica tiene como indicación principal la hemorragia de origen oscuro, ya sea oculta en heces o de forma manifiesta (melena, hematoquecia, hematemesis)10. El rango de efectividad diagnóstica total para la cápsula endoscópica varía del 40 al 75%. En cuanto a la hemorragia de tubo digestivo de origen oscuro, esta efectividad va del 55 al 75%11.
Cuando los estudios endoscópicos no demuestran lesión o sitio de hemorragia concluyente, se hace uso de otros estudios diagnósticos. Entre los estudios utilizados se encuentra la tomografía axial computada12. Lupescu et al. reportaron que con la tomografía se puede sospechar el diagnóstico de GIST, aunque con el inconveniente de que, al usar esta herramienta radiográfica, es difícil diferenciar de otros tumores con características semejantes13.
Los hallazgos más frecuentes reportados en la tomografía axial computada en pacientes con GIST de intestino delgado es la presencia de lesiones de bordes bien definidos, que muestran un realce homogéneo, se originan en la pared intestinal, crecen alejándose de la luz intestinal y se proyectan hacia la cavidad abdominal14. La presencia de una lesión hipervascular intramural mayor de 3cm debe hacer sospechar de GIST como primera opción en el diagnóstico diferencial, seguido de tumor carcinoide, tumor glómico o páncreas ectópico15. Es importante subrayar que la lesión hipervascular en intestino delgado por angiotomografía observada en los casos presentados no es la clásica presentación de los GIST; sin embargo, hay reportes en la literatura de la existencia, dentro del tumor, de malformaciones arteriovenosas y angiodisplasias16. Recientemente, Shiozawa et al. reportaron el caso de un paciente con dolor abdominal cuya tomografía mostró un tumor hipervascular cuyo drenaje vascular era a través de una vena yeyunal, en el que el realce en fase arterial y el retorno venoso temprano indicaban malformación arteriovenosa; sin embargo, tras el estudio histopatológico, el diagnóstico definitivo fue de GIST17.
A pesar de que el estudio de elección y el que brinda mayor información para el diagnóstico de hemorragia de tubo digestivo es la endoscopia, en nuestros pacientes, el diagnóstico de sospecha fue realizado a través de angiotomografía abdominal. Esto indica que, en pacientes con hemorragia de tubo digestivo de origen oscuro o con endoscopia normal, la angiotomografía abdominal es un recurso útil para el diagnóstico. La resonancia magnética, específicamente con enteroclisis, ha demostrado también gran utilidad en el diagnóstico de tumores de intestino delgado, con una sensibilidad y especificidad por arriba del 88 y del 93%, respectivamente18, sin embargo, como en nuestra experiencia, su uso no está completamente difundido.
Otra de las herramientas utilizadas como parte del estudio de los pacientes con hemorragia de tubo digestivo de origen oscuro y de GIST es la angiografía, la cual ha demostrado ser una herramienta excelente para el diagnóstico y tratamiento, ya que permite el uso de embolización para el manejo preoperatorio19. Debido a la naturaleza vascular y a la hemorragia asociada de muchas neoplasias del tracto digestivo, el uso de la embolización preoperatoria reduce el tamaño del tumor y, por tanto, la extensión de la resección y la hemorragia intraoperatoria20,21. Esto ha sido demostrado comúnmente en los GIST. En uno de nuestros pacientes se utilizó embolización selectiva para disminuir la vascularidad y el tamaño de la lesión, logrando un manejo intraoperatorio exitoso. Después de la embolización, la lesión fue resecada quirúrgicamente.
El diagnóstico definitivo de los GIST se hace mediante el estudio histopatológico e inmunohistoquímico. En 3de nuestros pacientes se demostró positividad para CD117, marcador que se encuentra en el 95% de los GIST y que permite un diagnóstico casi inequívoco (fig. 5). En algunos casos, la tinción es negativa, por lo que el uso de otros marcadores así como el análisis molecular de mutaciones en ciertos exones del protooncogén que codifica para CD117 permiten el diagnóstico definitivo22,23. En nuestros casos, el patrón de marcadores inmunohistoquímicos utilizados fueron clave para el diagnóstico diferencial. Mientras que los GIST presentan fuerte positividad para CD117 y CD34, el leiomioma y leiomiosarcoma son positivos para actina de músculo liso y desmina, pero negativos para CD34 y CD117. Los shwanomas son fuertemente positivos para proteína S100 aunque en ocasiones son focalmente positivos para CD117, por mencionar algunos24.
El pronóstico depende del tamaño, la actividad mitótica y la localización. En el estudio de Miettinem et al. se reporta una mortalidad global del 39% en GIST de localización en intestino delgado25. Los pacientes de este estudio y de acuerdo con la clasificación para potencial de malignidad de Fletcher, modificada para localización anatómica, 3 fueron catalogados como de bajo riesgo y 2 como de riesgo intermedio. De acuerdo a las guías de la Sociedad Europea de Oncología Médica (ESMO) para el manejo de GIST, la tasa de metástasis o muerte relacionada con tumor en aquellos localizados en estómago, intestino delgado, agrupados de acuerdo con tamaño e índice de mitosis, es de un 4.3% en los tumores con bajo riesgo y de un 24% en los de riesgo intermedio26.
Para los GIST, la resección quirúrgica es el tratamiento de elección. Existen terapias complementarias como el imatinib o sunitib que mejoran el pronóstico y la supervivencia, sobre todo en pacientes con lesiones irresecables o metastásicas27,28.
ConclusionesLos GIST pueden tener distintas formas de presentación y sintomatología. En los casos presentados en este estudio, los pacientes tuvieron una lesión hipervascular demostrada por angiotomografía y hemorragia de tubo digestivo de origen oscuro. La tomografía con medio de contraste y la angiografía son herramientas que han demostrado ser útiles para el diagnóstico certero de este tipo de lesiones, sobre todo en pacientes con estudios endoscópicos negativos. A pesar de que existe una gran variedad de enfermedades que deben ser consideradas dentro de los diagnósticos diferenciales, el análisis de antecedentes, los estudios endoscópicos previos y el cuadro clínico deben orientar para realizar un adecuado abordaje terapéutico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.