Los pacientes menores de 45 años con cáncer gástrico tienen un pronóstico desfavorable. Estudios recientes refieren que la sobrevida a 5 años es mejor en jóvenes posterior a la resección curativa.
ObjetivoDeterminar si los factores pronóstico, como: edad menor de 45 años, anemia, pérdida de peso, grado de diferenciación, subtipo histológico, tumor palpable, profundidad de la invasión y afección ganglionar, reducen la sobrevida en pacientes con adenocarcinoma gástrico avanzado resecable, tratados mediante gastrectomía con linfadenectomía limitada y extendida.
Material y métodosEstudio de cohorte histórica de casos consecutivos de adenocarcinoma gástrico, atendidos y tratados en el Servicio de Sarcomas del Hospital de Oncología de Centro Médico Nacional Siglo XXI, del Instituto Mexicano del Seguro Social, durante el período comprendido entre enero de 2000 y diciembre de 2006.
ResultadosSe evaluó a 588 pacientes; el 19% (n=112) fueron menores de 45 años, el 43% clasificados como Borrmann IV y el 36% como Borrmann III. Tuvieron enfermedad metastásica un 39.3%, localización difusa un 12.5% y menor resecabilidad en 52.7 vs. 61.3% en mayores de 45 años.
Al finalizar el estudio, un 29.5% de los pacientes menores de 45 años estaban vivos; el 26.8% sin recurrencia, con una sobrevida global de 58.6±4.3 meses, comparado con el 18.3% de los pacientes vivos mayores de 45 años, de los cuales el 17.9% estaba sin enfermedad y con una sobrevida global de 35.2±4.3 meses con enfermedad resecable.
ConclusionesLos pacientes menores de 45 años tienen mejor sobrevida después de los 2 años de período libre de enfermedad.
Patients under 45 years with gastric cancer are associated with a poor prognosis. Recent studies report that the 5-year survival is better in younger patients after curative resection.
ObjectiveTo determine if prognostic factors such as age under 45 years old, anaemia, weight loss, tumour differentiation, histological sub-type, depth of invasion, and lymph node involvement, reduce the survival of patients with resectable advanced gastric adenocarcinoma undergoing gastrectomy with limited and extended lymphadenectomy.
Materials and methodsThis study included a cohort of consecutive cases treated in the Sarcomas Department of the Oncology Hospital of the Centro Médico Nacional Siglo XXI, of the Instituto Mexicano del Seguro Social, during the period between January 2000 and December 2006.
ResultsOf the total of 588 patients evaluated, 112 (19%) were under 45 years, 43% classified as Borrmann IV, and 36% as Borrmann III. Metastatic disease was present in 39.3%, localised diffuse in 12.5%; lower resectability 52.7 vs. 61.3% in older than 45 years.
At the end of the study 29.5% of patients under 45 years were alive; no recurrence in 26.8%, with an overall survival of 58.6±4.3 months, compared with 18.3% of patients alive over 45 years, 17.9% disease-free, and with overall survival 35.2±4.3 months resectable disease.
ConclusionsPatients under 45 years have a better survival after a two-year disease-free period.
El cáncer gástrico es la neoplasia gastrointestinal más frecuente en todo el mundo, ocupa el segundo lugar de mortalidad por cáncer a nivel mundial y representa el 3% de los casos de cáncer diagnosticados en México en el 20001–3. La incidencia del cáncer de estómago es más frecuente en el este de Asia, donde el diagnóstico en etapas más tempranas (etapa IA) se identifica hasta en el 30%, se identifica el 70% en etapas avanzadas debido a sus programas de detección4 y el 88% se presenta en la etapa III o IV al momento del diagnóstico5.
La resecabilidad se presenta en un 60-80% y la mortalidad postoperatoria en un rango de 6 a 14%. La tasa de sobrevida a 5 años continúa en un 8-26%, lo que contrasta de forma importante con la sobrevida en Japón, que asciende a un 52% en algunas series6.
Un estudio retrospectivo realizado en nuestro país reportó que el 80.2% de los pacientes con esta neoplasia se diagnosticaron en etapas IIIB y IV, con una sobrevida a 2 años del 13.8%. El promedio de edad de los pacientes correspondió a 58.6 años7,8.
El tratamiento quirúrgico es hasta el momento el único procedimiento que tiene un potencial curativo. En el adenocarcinoma gástrico la presencia o ausencia de metástasis ganglionares distales continúa como el predictor de sobrevida más importante, después de la resección curativa9.
Se ha asociado la edad menor de 40 años con el incremento en la frecuencia de tumores poco diferenciados (55.5%, p=0.02) o con histología de células en anillo de sello (25.9%, p=0.01). Por el contrario, se ha asociado a una frecuencia de 11.3% (p=0.01) y 34.6% (p=0.02), respectivamente, para pacientes mayores de 40 años; lo cual implica peores características clínicas y patológicas que, por lo tanto, se reflejan en un pronóstico desfavorable para la sobrevida de pacientes de mayor edad y tumores con la misma localización anatómica6,10. Sin embargo, estudios recientes contradicen esto: a pesar de las características histológicas adversas en jóvenes, además de la predilección en el sexo femenino, la sobrevida a 5 años es mejor en menores de 50 años (54 vs. 46%, p=0.035), que en mayores de 50 años11.
Otros estudios recientes reflejan que la frecuencia de cáncer gástrico ha aumentado de un 2-8% a un 19% en países orientales en los últimos años y que, a pesar de ser la tasa de resección curativa más baja en pacientes jóvenes (84 vs. 92%, p<0.001), la sobrevida a 5 años en tumores resecados es mejor en los jóvenes (80 vs. 75%, p=0.002)12. La pérdida de peso previa al diagnóstico conlleva una peor tolerancia al tratamiento basado en 5-fluorouracilo, con el incremento en la toxicidad de mucositis y síndrome palmo-plantar, secundarios a déficits nutricionales de glutamina y vitamina B6, respectivamente13–15.
La presencia de una masa palpable al momento del diagnóstico es considerada un signo de irresecabilidad y, por lo tanto, de mal pronóstico para la sobrevida a 5 años (0%-20%), con un promedio de vida en extremo corto (< 4 meses)6,16,17.
Múltiples estudios han demostrado que el compromiso de la serosa es el factor pronóstico negativo de mayor impacto en la sobrevida, puesto que si la neoplasia infiltra la serosa, el impacto de la disección ganglionar en la sobrevida se reduce porque la cirugía no puede controlar la diseminación peritoneal transcelómica, principal causa de recurrencia y muerte de pacientes posgastrectomía por cáncer18. Se ha reportado una sobrevida del 62.7% para tumores que invaden la muscular propia, de 42.2% con infiltración de la subserosa y de 30.1% con afección de la serosa (p≤0.0001)19.
Además, se ha señalado que el pronóstico de pacientes que presentan invasión de la serosa es más favorable cuando no existe metástasis ganglionar (N0) y que la tasa de sobrevida quinquenal decae progresivamente cuando existe el compromiso linfático (67.9 vs. 32.8%, p<0.01)20.
De esta manera, en la actualidad se considera que la profundidad de invasión tumoral y la afectación ganglionar son 2 de los factores pronóstico independientes más importantes en el carcinoma gástrico21.
Al comparar el tipo de cirugía, gastrectomía total o parcial, para cáncer gástrico distal encontramos resultados similares en cuanto a morbilidad, mortalidad general y sobrevida global; por lo tanto, es preferible un abordaje quirúrgico conservador, siempre que este permita una resección completa del tumor22.
ObjetivoIdentificar los principales factores pronóstico de sobrevida de pacientes con carcinoma gástrico avanzado resecable, tratados mediante gastrectomía con linfadenectomía limitada y extendida, en el Servicio de Sarcomas del Hospital de Oncología de Centro Médico Nacional Siglo XXI, del Instituto Mexicano del Seguro Social.
Material y métodosEstudio de cohorte histórica, identificada al momento del diagnóstico e integrada a partir del día de la cirugía. Se revisaron retrospectivamente los expedientes clínicos de la población derecho habiente de los pacientes atendidos y tratados en el Servicio de Sarcomas del Hospital de Oncología, de Centro Médico Nacional Siglo XXI, del Instituto Mexicano del Seguro Social, en el período comprendido entre el primero de enero del 2000 y el 31 de diciembre del 2006. Con un período de seguimiento de 6 años.
Se incluyó a pacientes con una edad en un rango de 16 años hasta los 72 años, a los que se les hubiera realizado una endoscopia en la unidad con toma de biopsia (muestra que fue revisada por el Servicio de Patología de nuestro hospital) y que tuvieran el diagnóstico histológico de adenocarcinoma gástrico, estadio clínico avanzado. Estos pacientes recibieron tratamiento quirúrgico con intención curativa. Se consideró la disección limitada como disección D1, que incluye los relevos ganglionares del 1 al 6; la disección extendida como disección D2, que comprende los relevos ganglionares del 1 al 11 más la disección de la serosa de la trascavidad de los epiplones desde el mesocolón transverso.
De acuerdo con la localización anatómica del tumor, se realizó gastrectomía subtotal si se extirparon los 2/3 distales del estómago (antro y cuerpo) y gastrectomía total si se realizó la resección completa del estómago.
En el Servicio de Radiología e Imagen del hospital se les practicó tomografía axial computada contrastada de abdomen y pelvis para valorar la resecabilidad. Se les determinó la cifra de hemoglobina por medio de una biometría hemática.
Para el estudio se consideró aquella disminución de peso corporal involuntaria, relacionada con el padecimiento actual, no atribuible a otra causa. Se refirió a masa palpable a la tumoración abdominal que corresponda al tumor gástrico en estudio.
La etapificación se realizó de acuerdo con la clasificación del TNM del AJCC (American Joint Committe on Cancer, por sus siglas en inglés), 7.a edición 2009. El estado funcional del paciente se determinó de acuerdo con la clasificación del Eastern Cooperative Oncology Group (ECOG, por sus siglas en inglés) y se tomó a partir de la información del expediente clínico.
También se hizo de acuerdo a la clasificación de Lauren, que divide en 2 subtipos (intestinal y difuso) el cáncer gástrico, cada uno con características histopatológicas, clínicas y epidemiológicas propias.
En cuanto a las variables basadas en la morfología celular, se obtuvo la información de acuerdo con lo documentado en el reporte de histopatología de la pieza quirúrgica (papilar, coloide, medular y con células en anillo de sello), así como en cuanto al grado de diferenciación, que va del G1 a G4.
El tamaño del tumor y la metástasis se obtuvieron por medio del reporte del Servicio de Patología.
El análisis estadístico se registró en una base de datos y, posteriormente, en SPSS versión 13.0 para Windows. Se realizó estadística descriptiva con registro de media, desviación estándar y tabla de frecuencias. Se utilizó la t de Student para grupos independientes para diferencias de medias. Para el análisis de factores asociados a complicaciones se usó la chi cuadrada y para cuantificación de factores de riesgo, se utilizó la razón de momios. En cuanto a la supervivencia, se analizó a través del método de Kaplan-Meier. Para comparar las curvas de supervivencia se utilizó el test de long rank (Mantel-Cox) o el test de Breslow. Se consideró significación estadística una p<0.05 con intervalo de confianza de 95%.
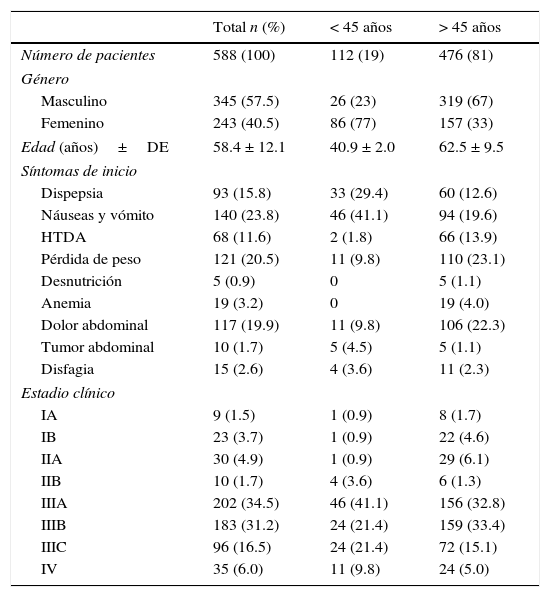
ResultadosSe evaluó a 588 pacientes, de los cuales el 19% (n=112) fueron menores de 45 años y el 81% (n=476) fueron mayores de 45 años. Las características demográficas y clínicas se encuentran en la tabla 1. En ella se puede observar que predomina el sexo femenino (77%) en el grupo de menores de 45 años y que en el grupo de los mayores de 45 años predominan los hombres (67%). Los síntomas más comunes fueron: náuseas y vómito en el grupo de menores del 45 años (41.1%), seguidos de dispepsia (29%); por el contrario, la pérdida de peso (23.1%) y el dolor abdominal (22.3%) fueron los síntomas más comunes en los mayores de 45 años.
Características clínicas y demográficas de 588 pacientes con adenocarcinoma gástrico tratados con cirugía
| Total n (%) | < 45 años | > 45 años | |
|---|---|---|---|
| Número de pacientes | 588 (100) | 112 (19) | 476 (81) |
| Género | |||
| Masculino | 345 (57.5) | 26 (23) | 319 (67) |
| Femenino | 243 (40.5) | 86 (77) | 157 (33) |
| Edad (años)±DE | 58.4 ± 12.1 | 40.9 ± 2.0 | 62.5 ± 9.5 |
| Síntomas de inicio | |||
| Dispepsia | 93 (15.8) | 33 (29.4) | 60 (12.6) |
| Náuseas y vómito | 140 (23.8) | 46 (41.1) | 94 (19.6) |
| HTDA | 68 (11.6) | 2 (1.8) | 66 (13.9) |
| Pérdida de peso | 121 (20.5) | 11 (9.8) | 110 (23.1) |
| Desnutrición | 5 (0.9) | 0 | 5 (1.1) |
| Anemia | 19 (3.2) | 0 | 19 (4.0) |
| Dolor abdominal | 117 (19.9) | 11 (9.8) | 106 (22.3) |
| Tumor abdominal | 10 (1.7) | 5 (4.5) | 5 (1.1) |
| Disfagia | 15 (2.6) | 4 (3.6) | 11 (2.3) |
| Estadio clínico | |||
| IA | 9 (1.5) | 1 (0.9) | 8 (1.7) |
| IB | 23 (3.7) | 1 (0.9) | 22 (4.6) |
| IIA | 30 (4.9) | 1 (0.9) | 29 (6.1) |
| IIB | 10 (1.7) | 4 (3.6) | 6 (1.3) |
| IIIA | 202 (34.5) | 46 (41.1) | 156 (32.8) |
| IIIB | 183 (31.2) | 24 (21.4) | 159 (33.4) |
| IIIC | 96 (16.5) | 24 (21.4) | 72 (15.1) |
| IV | 35 (6.0) | 11 (9.8) | 24 (5.0) |
DE: desviación estándar; HTDA: hemorragia del tubo digestivo alto.
La etapa clínica que predominó en el grupo de los menores de 45 años fue la IIIA (41.1%) y en los mayores de 45 años fue la IIIB (33.4%).
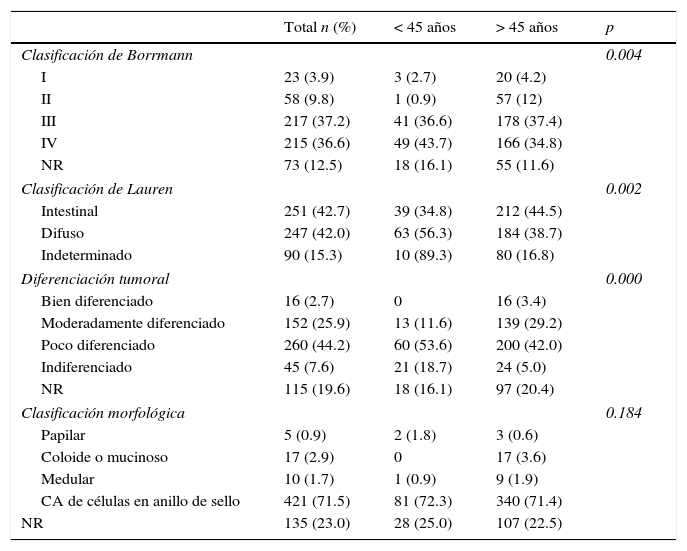
Las características de presentación del tumor se muestran en la tabla 2, donde en los menores de 45 años predominó el Borrmann III (36.6%), mientras que en los mayores de 45 años predominó el Borrmann III (37.4%, en cuanto a la clasificación de Lauren en los menores de 45 años predomina el tipo difuso, al contrario que el tipo intestinal, que predomina en los mayores de 45 años). En ambos grupos, en cuanto a la diferenciación tumoral, predomina el poco diferenciado. La histología que prevalece es el carcinoma de células en anillo de sello.
Características macroscópicas y microscópicas del tumor
| Total n (%) | < 45 años | > 45 años | p | |
|---|---|---|---|---|
| Clasificación de Borrmann | 0.004 | |||
| I | 23 (3.9) | 3 (2.7) | 20 (4.2) | |
| II | 58 (9.8) | 1 (0.9) | 57 (12) | |
| III | 217 (37.2) | 41 (36.6) | 178 (37.4) | |
| IV | 215 (36.6) | 49 (43.7) | 166 (34.8) | |
| NR | 73 (12.5) | 18 (16.1) | 55 (11.6) | |
| Clasificación de Lauren | 0.002 | |||
| Intestinal | 251 (42.7) | 39 (34.8) | 212 (44.5) | |
| Difuso | 247 (42.0) | 63 (56.3) | 184 (38.7) | |
| Indeterminado | 90 (15.3) | 10 (89.3) | 80 (16.8) | |
| Diferenciación tumoral | 0.000 | |||
| Bien diferenciado | 16 (2.7) | 0 | 16 (3.4) | |
| Moderadamente diferenciado | 152 (25.9) | 13 (11.6) | 139 (29.2) | |
| Poco diferenciado | 260 (44.2) | 60 (53.6) | 200 (42.0) | |
| Indiferenciado | 45 (7.6) | 21 (18.7) | 24 (5.0) | |
| NR | 115 (19.6) | 18 (16.1) | 97 (20.4) | |
| Clasificación morfológica | 0.184 | |||
| Papilar | 5 (0.9) | 2 (1.8) | 3 (0.6) | |
| Coloide o mucinoso | 17 (2.9) | 0 | 17 (3.6) | |
| Medular | 10 (1.7) | 1 (0.9) | 9 (1.9) | |
| CA de células en anillo de sello | 421 (71.5) | 81 (72.3) | 340 (71.4) | |
| NR | 135 (23.0) | 28 (25.0) | 107 (22.5) | |
NR: no representativo; CA: cáncer.
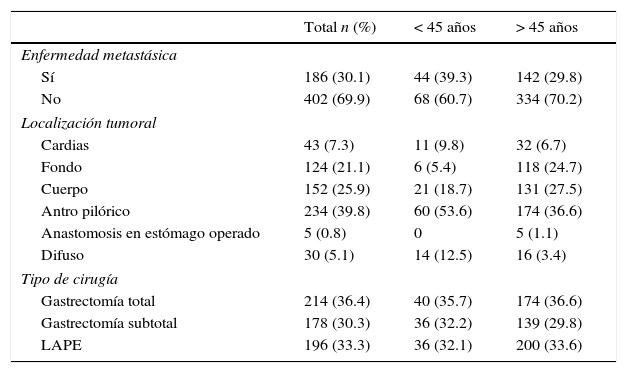
Los hallazgos y resultados quirúrgicos se muestran en la tabla 3, donde se encontró un porcentaje más elevado de enfermedad metastásica (39.3 vs. 29.8%), así como de localización difusa (12.5 vs. 3.4%), pero menor de enfermedad resecable (52.7 vs. 61.3%) en pacientes menores de 45 años al compararlos con el grupo de mayor edad.
Resultados de la cirugía
| Total n (%) | < 45 años | > 45 años | |
|---|---|---|---|
| Enfermedad metastásica | |||
| Sí | 186 (30.1) | 44 (39.3) | 142 (29.8) |
| No | 402 (69.9) | 68 (60.7) | 334 (70.2) |
| Localización tumoral | |||
| Cardias | 43 (7.3) | 11 (9.8) | 32 (6.7) |
| Fondo | 124 (21.1) | 6 (5.4) | 118 (24.7) |
| Cuerpo | 152 (25.9) | 21 (18.7) | 131 (27.5) |
| Antro pilórico | 234 (39.8) | 60 (53.6) | 174 (36.6) |
| Anastomosis en estómago operado | 5 (0.8) | 0 | 5 (1.1) |
| Difuso | 30 (5.1) | 14 (12.5) | 16 (3.4) |
| Tipo de cirugía | |||
| Gastrectomía total | 214 (36.4) | 40 (35.7) | 174 (36.6) |
| Gastrectomía subtotal | 178 (30.3) | 36 (32.2) | 139 (29.8) |
| LAPE | 196 (33.3) | 36 (32.1) | 200 (33.6) |
LAPE: laparoscopia.
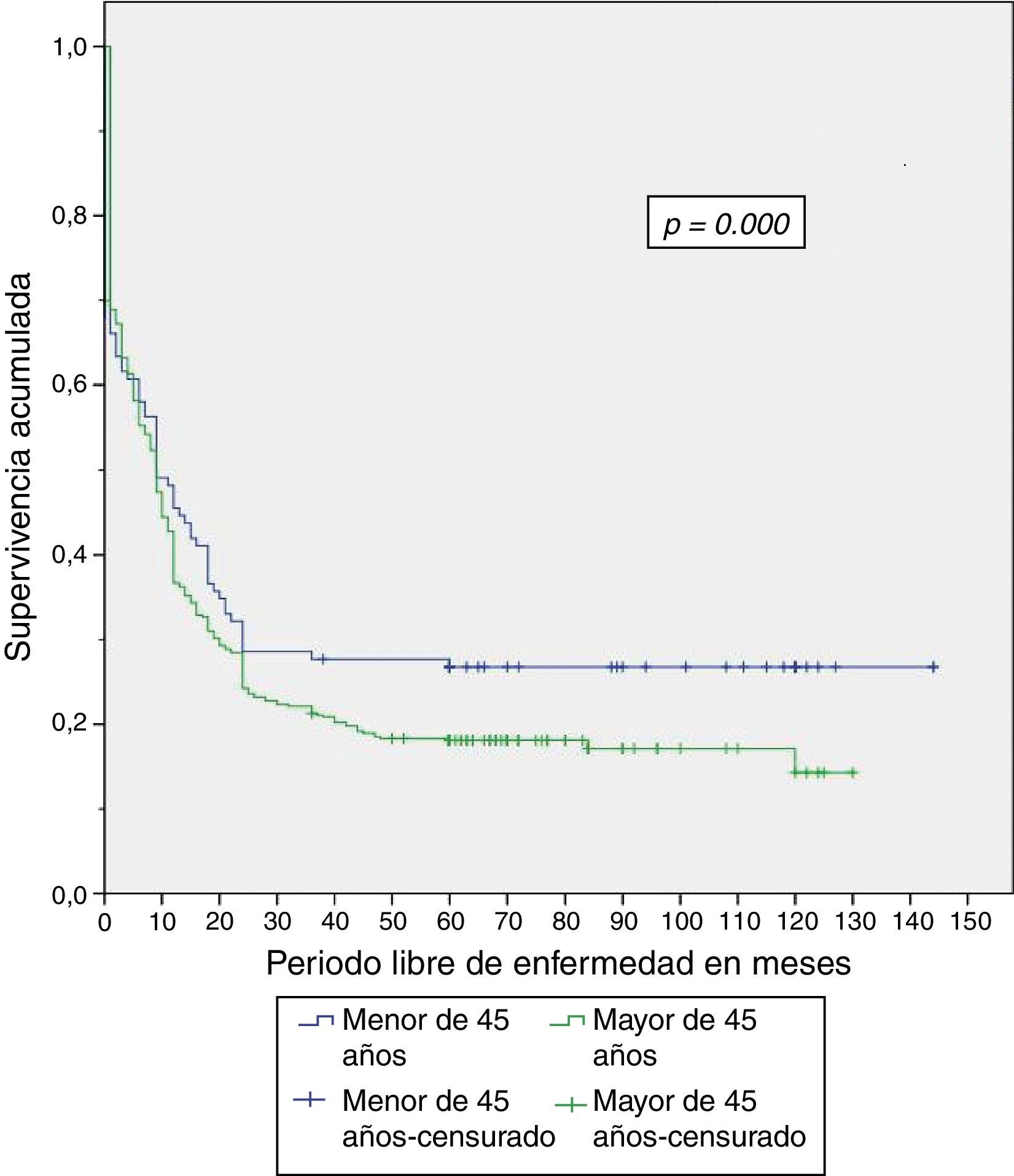
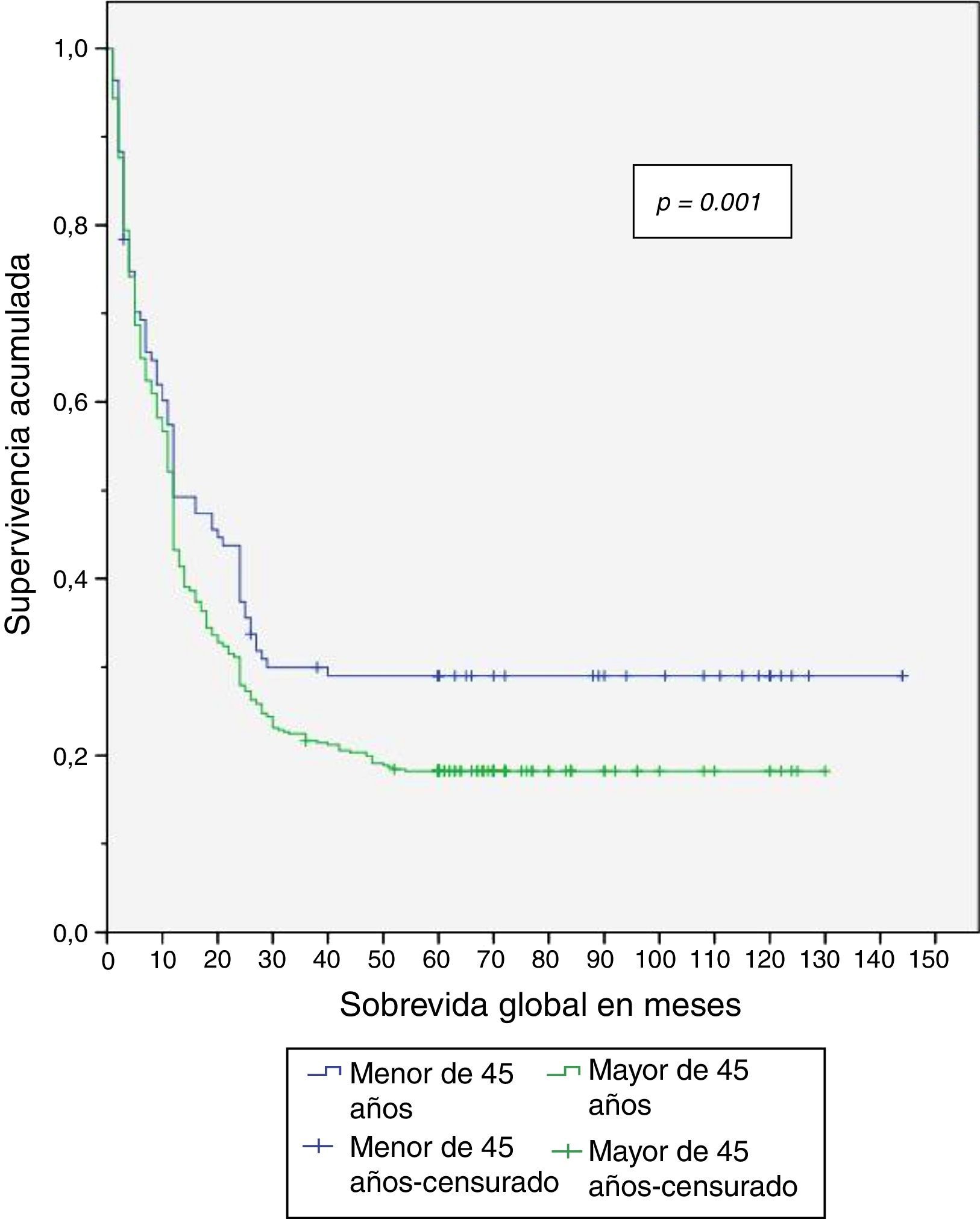
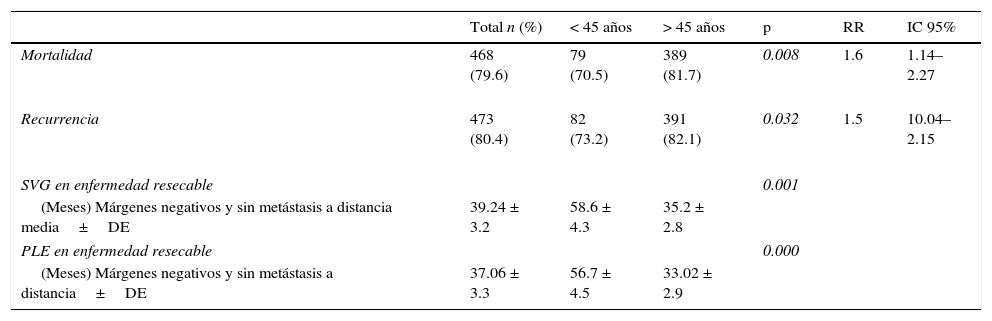
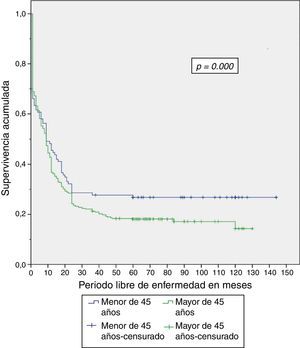
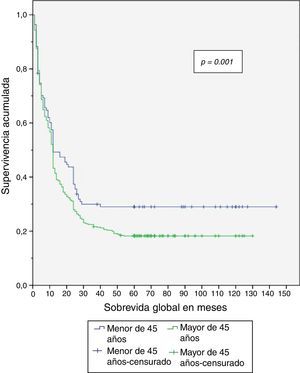
Al finalizar el análisis del estudio, el 29.5% de los pacientes menores de 45 años estaban vivos, de los cuales el 26.8% estaban sin recurrencia de la enfermedad (tabla 4). Se expone el período libre de enfermedad y la sobrevida global en enfermedad resecable en las figuras 1 y 2. El 50% de los pacientes murieron a los 12 meses en ambos grupos. La diferencia de la sobrevida global se presenta a partir de los 24 meses, y corresponde a menos del 30% de los pacientes; la sobrevida global a 5 años fue del 28% en el grupo de menores de 45 años y del 18% en mayores de 45 años.
Mortalidad y sobrevida
| Total n (%) | < 45 años | > 45 años | p | RR | IC 95% | |
|---|---|---|---|---|---|---|
| Mortalidad | 468 (79.6) | 79 (70.5) | 389 (81.7) | 0.008 | 1.6 | 1.14–2.27 |
| Recurrencia | 473 (80.4) | 82 (73.2) | 391 (82.1) | 0.032 | 1.5 | 10.04–2.15 |
| SVG en enfermedad resecable | 0.001 | |||||
| (Meses) Márgenes negativos y sin metástasis a distancia media±DE | 39.24 ± 3.2 | 58.6 ± 4.3 | 35.2 ± 2.8 | |||
| PLE en enfermedad resecable | 0.000 | |||||
| (Meses) Márgenes negativos y sin metástasis a distancia±DE | 37.06 ± 3.3 | 56.7 ± 4.5 | 33.02 ± 2.9 | |||
SVG: sobrevida global; PLE: período libre de la enfermedad; DE: desviación estándar.
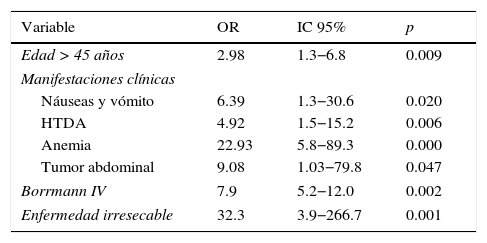
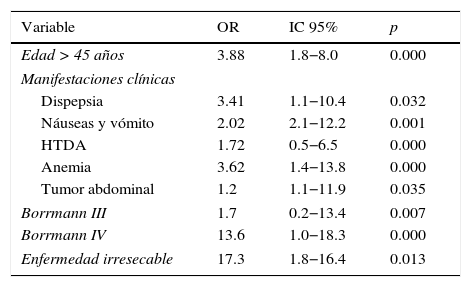
La regresión logística múltiple se presenta en la tabla 5 al comparar los 2 grupos de estudio. Los factores pronóstico adversos de sobrevida fueron: edad mayor de 45 años (OR 2.98), náuseas y vómito (OR 6.39), hemorragia de tubo digestivo alto (OR 4.92), anemia (OR 22.93), tumor abdominal (OR 9.08), Borrmann (OR 7.9) y enfermedad irresecable (OR 32.3). Los factores pronóstico adversos para recurrencia respecto a la edad mayor de 45 años (OR 3.88) fueron dispepsia (OR 3.41), anemia (OR 3.62), tumor abdominal (OR 1.2), Borrmann IV (OR 13.6) y enfermedad irresecable (OR 17.3) (tabla 6).
Factores pronóstico adversos de sobrevida
| Variable | OR | IC 95% | p |
|---|---|---|---|
| Edad > 45 años | 2.98 | 1.3−6.8 | 0.009 |
| Manifestaciones clínicas | |||
| Náuseas y vómito | 6.39 | 1.3−30.6 | 0.020 |
| HTDA | 4.92 | 1.5−15.2 | 0.006 |
| Anemia | 22.93 | 5.8−89.3 | 0.000 |
| Tumor abdominal | 9.08 | 1.03−79.8 | 0.047 |
| Borrmann IV | 7.9 | 5.2−12.0 | 0.002 |
| Enfermedad irresecable | 32.3 | 3.9−266.7 | 0.001 |
HTDA: hemorragia del tubo digestivo alto.
Factores pronóstico adversos para recurrencia
| Variable | OR | IC 95% | p |
|---|---|---|---|
| Edad > 45 años | 3.88 | 1.8−8.0 | 0.000 |
| Manifestaciones clínicas | |||
| Dispepsia | 3.41 | 1.1−10.4 | 0.032 |
| Náuseas y vómito | 2.02 | 2.1−12.2 | 0.001 |
| HTDA | 1.72 | 0.5−6.5 | 0.000 |
| Anemia | 3.62 | 1.4−13.8 | 0.000 |
| Tumor abdominal | 1.2 | 1.1−11.9 | 0.035 |
| Borrmann III | 1.7 | 0.2−13.4 | 0.007 |
| Borrmann IV | 13.6 | 1.0−18.3 | 0.000 |
| Enfermedad irresecable | 17.3 | 1.8−16.4 | 0.013 |
HTDA: hemorragia del tubo digestivo alto.
El cáncer gástrico en México según el Reporte histopatológico de neoplasias concentra el 3% de los casos de cáncer diagnosticados en el país, con 3 casos registrados por 100,000 habitantes1–4.
A pesar de que los porcentajes de resecabilidad se han incrementado (60-80%) y la mortalidad postoperatoria es de un 6-14%, las tasas de sobrevida a 5 años continúan en un 8-26% en algunas series5–7. De tal manera que, a pesar de que algunos pacientes con cáncer gástrico son reportados como resecables y libres de enfermedad ganglionar en el estudio histopatológico definitivo, lo cual implicaría un mejor pronóstico, finalmente mueren por enfermedad maligna recurrente8–10.
Se ha asociado la edad menor de 40 años con el incremento en la frecuencia de tumores poco diferenciados, con histología de células en anillo de sello y tumores difusos10. Sin embargo, los estudios recientes contradicen lo anterior y refieren que a pesar de las características histológicas adversas en jóvenes, además de la predilección en sexo femenino, la sobrevida a 5 años es mejor en menores de 50 años (54 vs. 46%, p=0.035)11.
En el estudio se integraron 2 grupos divididos en menores de 45 años, que correspondía al 19% (n=112) de los casos, y mayores de 45 años 81% (n=476).
Se ha reportado que el cáncer gástrico afecta en un 4% más a la población masculina en todos los grupos de edad12–15. En este estudio encontramos que hubo mayor número de casos en hombres (55.5 vs. 40.5%) que en mujeres, y que el predominio de casos de género masculino se conservó en el grupo de pacientes mayores de 45 años (67%). Sin embargo, se dio una inversión de dicha tendencia en el grupo de pacientes menores de 45 años, con predominio del género femenino (77%).
El tiempo de evolución promedio de la enfermedad fue de 8.1 meses (DE: 4.6) no significativa en ambos grupos (p=0.829).
Al comparar ambos grupos, hay diferencia en cuanto a los síntomas iniciales. Para los menores de 45 años, el principal son las náuseas (41.1%) seguido de dispepsia (29.4%). En el grupo de pacientes de mayor edad fue más común la pérdida de peso (23.1%) seguida del dolor abdominal (22.3%), sin una diferencia estadística significativa.
Los síntomas de alarma al momento del diagnóstico son factores pronóstico mayores independientes negativos asociados a sobrevida a 5 años. Los más relevantes son: disfagia 7%, masa palpable 11%, anemia 12% y vómito 14% (p=0.001)16,17. Al realizar el análisis de regresión logística, encontramos en nuestro estudio que los síntomas con pronóstico adverso para recurrencia y sobrevida fueron principalmente: anemia (OR=22.93), tumor abdominal palpable (OR 9.08), náuseas y vómito (OR 6.39) y hemorragia de tubo digestivo alto (OR 4.92) (tabla 6).
En cuanto al estado funcional, en nuestro análisis fueron 32.3% los pacientes clasificados como ECOG 2 y 6.5% como ECOG 3 tratados quirúrgicamente. Se les asocia a una sobrevida media de 27.02 y 5.48 meses, respectivamente, con resultados similares en ambos grupos de edad (tabla 1). Cunningham identificó que los pacientes con ECOG 2 y 3 tienen peor sobrevida (HR 1.712, p>0.0001) comparados con pacientes con estado funcional 0 y 1 (HR 1.0)18–21.
Respecto a las características del tumor, se encontró una diferencia en cuanto a la clasificación endoscópica para ambos grupos de edad, ya que en menores de 45 años se presentaron más casos de tumores clasificados como Borrmann IV (43%), seguidos de Borrmann III (36%), mientras que en mayores de 45 años de observó a la inversa: una mayor frecuencia de tumores Borrmann III (37%), seguida de Borrmann IV (34%) (p=0.004). La sobrevida media fue de 59 meses en Borrmann III y de 13 meses en Borrmann IV.
Se ha reportado una sobrevida de 62.7% para tumores que invaden la muscular propia (pT2), de 42.2% con infiltración de la subserosa (pT3) y de 30.1% con afección de la serosa (pT4) (p≤0.0001)22–25. La profundidad de la invasión en el reporte patológico no tuvo diferencia estadística y principalmente se presentaron profundidades pT4 (31.1%) y pT4b (34.4%), con similares porcentajes en ambos grupos.
El cáncer gástrico es clasificado como temprano, limitado a la mucosa y submucosa, que en Estados Unidos representa del 6 al 8%, y en países como Japón, gracias a sus métodos de escrutinio, representa del 30 al 50%26–29. En México sabemos que la sobrevida es pobre; en el año 2000 se reportó que casi el 80% de los pacientes se diagnosticaban en estadios avanzados III o IV, con tasas de resecabilidad del 33% y con una sobrevida a 5 años <15%30–33.
En nuestro análisis, clasificados como tempranos fueron un 5.2% (EC IA y IB) con diferencia en ambos grupos de edad; fueron un 1.8 y un 6.3% para menores y mayores de 45 años respectivamente (p=0.002). El 88.2% de nuestros pacientes se encontraron en estadios III y IV de la enfermedad, porcentaje similar en ambos grupos. Con una media de sobrevida de 110 meses para EC IA, 44.3 meses para EC IIB, 20.8 meses IIIA, 11.1 meses en IIIB y de 3.41 meses en EC IIIC.
El sitio anatómico más común del tumor fue el antro pilórico para ambos grupos (39.8%). Llama la atención que en el grupo de pacientes menores de 45 años el porcentaje de localización tumoral difusa fue del 12.5 vs. 3.4% en pacientes de mayor edad. Sin embargo, el tipo de resección quirúrgica fue similar en ambos grupos, con gastrectomía total en el 36.4% de los pacientes, sin significado estadístico.
Durante la exploración quirúrgica se encontró enfermedad metastásica en el 30.1% de los casos, con un porcentaje más elevado en el grupo de pacientes menores de 45 años al compararse con el grupo de mayor edad (39.3 vs. 29.8%, respectivamente) (p=0.05) (RR: 0.09).
De igual manera, hubo un predominio mayor de casos de resección tumoral con márgenes quirúrgicos negativos en pacientes mayores de 45 años, con el mismo patrón observado al clasificar la enfermedad como resecable o no resecable; es decir, que, al considerar a los pacientes con márgenes quirúrgicos negativos y sin enfermedad metastásica, se encontró también mayor número de casos en los pacientes de mayor edad (61.3%) al compararse con el grupo de pacientes menores de 45 años (52.7%); sin embargo, estadísticamente esto no fue significativo (p=0.96).
Entonces, aun cuando se presentó menor porcentaje de enfermedad resecable en el grupo de menores de 45 años, se encontró que tanto el período libre de enfermedad como la sobrevida global fueron significativamente mayores en dicho grupo al compararse con el grupo de mayores de 45 años, con un período libre de la enfermedad de 56 vs. 33 meses y sobrevida global de 58 vs. 35 meses, respectivamente.
ConclusiónLos pacientes jóvenes menores de 45 años a los que se les realizó resección completa de la enfermedad tienen mejor sobrevida después de alcanzar los dos años de período libre de enfermedad, a pesar de tener factores de mal pronóstico, como presentación avanzada de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.